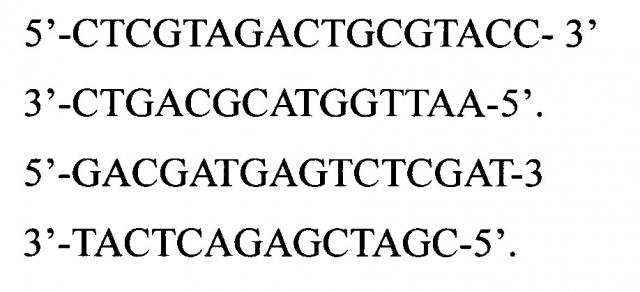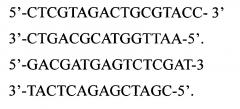Набор синтетических олигонуклеотидов для проведения метилчувствительной амплификации днк
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, молекулярной генетики и молекулярной биологии. Используется для синтеза, детектирования и последующего секвенирования ДНК с метилированными CpG-динуклеотидами. Создают набор синтетических олигонуклеотидов, включающий последовательности нуклеотидов:
для специфического маркирования и амплификации метилированных участков ДНК. 1 ил., 1 пр.
Реферат
Изобретение относится к области биотехнологии, молекулярной генетики и молекулярной биологии. Может использоваться для выявления метилирования ДНК растений и животных.
Для исследований в области молекулярной биологии и генетике регулирования экспрессии генов часто оценивают уровень метилирования, в том числе по CpG-динуклеотидами. Оценка общего метилирования, а также исследование метилирования специфичных участков ДНК, является важным компонентом молекулярно-генетических исследований регуляции работы генов, мутагенеза, влияния факторов среды на геномы растений, человека и животных. Исследование метилирования участков ДНК, кодирующих определенные признаки, является ключевым моментом в исследовании механизмов наследственности и канцерогенеза.
Известно, что наиболее часто для исследования метилирования используют бисульфитное секвенирование [Frommer М., McDonald L.E., Millar D.S. et al. (1992) A genomic sequencing protocol that yields a positive display of 5-methylcytosine residues in individual DNA strands // Proc. Natl. Acad. Sci. USA. 89 (5): 1827-1831]. Бисульфитное секвенирование рассматривается как ведущая технология обнаружения метилирования ДНК, поскольку она обеспечивает качественный и эффективный подход к идентификации 5-метилцитозина. Метод основан на реакции аминирования цитозина и 5-метилцитозина бисульфитом, которая протекает для них по-разному. Цитозины в одноцепочечной ДНК будут преобразованы в остатки урацила и распознаны как тимин при последующеей амплификации и секвенировании, тогда как 5-метилцитозин невосприимчив к этой конверсии и остается в виде цитозинов. В последующем проводится полимеразная цепная реакция необходимая для определения метилирования в интересующих локусах с использованием специфических олигонуклеотидов. Преимущество данного анализа заключается в том, что возможно исследовать частичное метилирования одного и того же участка ДНК по одной из цепей. Неудобством данного метода является необходимость секвенирования фрагментов до и после бисульфитной реакции для выявления модификации цитозина, кроме того данный метод подходит для анализа конкретных участков ДНК, тогда как для оценки общего метилирования генома необходимо проводить дорогостоящее полногеномное секвенирование.
Известно использование метил-специфичной полимеразной цепной реакции [Herman J.G., Graff J.R., et al. (1996) Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands // Proc. Natl. Acad. Sci. USA. 93 (18): 9821-9826]. Данный метод может быстро оценить статус метилирования практически любой группы сайтов с 5-метилцитозином. Этот анализ основан на первоначальной модификации ДНК бисульфитом натрия, с последующей амплификацией с помощью олигонуклеотидов, специфичных для метилированной и неметилированной ДНК. Метод требует небольших количеств ДНК, чувствителен к 0,1% метилированных аллелей одного локуса и может быть проведен на ДНК, экстрагированной из образцов зафиксированных образцов. К недостаткам метода, как и в предыдущем случае, можно отнести необходимость использования известной последовательности ДНК.
Из известных решений наиболее близким является использование метил-чувствительного полиморфизма амплифицированых фрагментов [Cervera МТ., Ruiz-Garcia, L., Martinez-Zapater J. (2002) Analysis of DNA methylation in Arabidopsis thaliana based on methylation-sensitive AFLP markers // Mol. Gen. Genomics. 268:543]. Данный метод пригоден для выявления участков метилирования ДНК и последующего секвенирования. Для проведения анализа используют олигонуклеотидные адаптеры, специфичные к сайтам рестрикции эндонуклеаз EcoRI, HpaII и MspI и праймеры того же состава, со следующими последовательностями:
Основным недостатком данного метода является возможное снижение специфичности, а также возможного образования неспецифичных продуктов реакции, при использовании олигонуклеотидов для преамплификации, комплементарных последовательности адаптеров, не имеющих нуклеотидов на 3' конце комплементарных сайту рестрикции целиком.
Задачей данного изобретения является подбор универсальных олигонуклеотидов, применимых для создания адаптеров и амплификации метилированных участков ДНК для последующего клонирования или мультиплексного высокопроизводительного секвенирования.
Поставленная задача решается набором синтетических олигонуклеотидов для детектирования метилированных участков ДНК.
Для детектирования метилирования ДНК предложены олигонуклеотиды для подготовки адаптеров, содержащие специфичные последовательности к сайтам рестрикции эндонуклеаз BisI, KroI, и EcoRI:
А также олигонуклеотиды для амплификации фрагментов ДНК, несущих метилированные сайты узнавания данных эндонуклеаз:
Используя данный набор олигонуклеотидов возможно проводить реакцию лигирования адаптеров в местах рестрикции эндонуклеаз BisI (C(5mC)↓NGC), KroI (G↓C(5mC)GGC) с метилированных цитозином и увеличивать копийность участков ДНК с данными сайтами с помощью полимеразной цепной реакции. Полученные участки ДНК подходят гибридизации, секвенирования, ПЦР в реальном времени и другим анализам. Заявляемый набор синтетических олигонуклеотидов для детектирования метилирования проверяют на различных видах растений или животных.
Ход работы с применением набора синтетических олигонуклеотидов для проведения метилчувствительной амплификации ДНК состоит из следующих шагов.
1) Растительный или животный материал перед проведением ПЦР с помощью заявляемого набора проводится через процедуру пробоподготовки, например, с использованием набора Diamond DNA kit (ООО «АБТ», Россия) в соответствии с инструкцией производителя; в ходе этой процедуры из материала выделяется ДНК, которую в свою очередь используют для ПЦР.
2) Раствор олигонуклеотидов EcoAd1 (100 мкМ) и EcoAd2 (100 мкМ), растворы олигонуклеотидов BisAd1 (1 мМ), BisAd2 (1 мМ), а также KroAd1 (1 мМ), KroAd2 (1 мМ) попарно смешиваются в соотношении 1:1 и нагреваются в течение 3 минут при 95°C и оставляются для остывания при комнатной температуре на 5 минут для получения трех типов адаптеров.
3) Готовится смесь для проведения реакции рестрикции/лигирования следующего состава: 1,1 мкл 10х SE буфер W, 100-500 нг геномной ДНК, 5 ед. EcoRI эндонуклеазы (СибЭнзим, Россия), 1 ед. BisI/KroI эндонуклеазы (СибЭнзим, Россия), 1 мМ БСА, 1 мкл BisI/KroI-адаптера, 1 мкл EcoRI адаптера, 5-10 ед. Т4-Лигазы, АТФ 1 мМ, вода до 11 мкл. Реакция проводится в амплификаторе по следующей программе: 37°C - 3 ч.; 14°C - 12-16 ч. 4). Амплификация проводится с олигонуклеотидами pBis 5' TCACGGATGCGCCTANGC 3', pKro 5' CGCATCCGTGACCCGGC 3', рЕсо 5' ACGCGCACAGCGATAATTC 3'. Для ПЦР использ. 10 мкл реакционной смеси, содержащей 0,5 ДНК с лигированными адаптерами, 1 мкл 10х ПЦР буфера, 25 мМ MgCl2, 0,4 мкл 5 мМ смеси dNTPs, 1 мкл каждого 10 мМ олигонуклеотида и 0,5 ед. Taq-полимеразы (СибЭнзим, Россия). ПЦР проводится на амплификаторе, по следующему протоколу: 94,0°C - 5 мин [94,0°C - 30 сек, 64,0°C - 30 сек, 72°C - 1 мин]×6 (Touchdown 1°C); [94,0°C - 30 сек, 58,0°C - 30 сек, 72°C - 1 мин]×25; 72,0°C - 10 мин. Продукты амплификации выделяются изопропанолом, магнитными частицами, спин-колонками или прочим методом очистки продуктов ПЦР. Длина полученных продуктов амплификации проверяются с использованием электрофореза (фиг. 1). В результате образуются продукты различной длины пригодные для последующего клонирования/секвенирования или мультиплексного высокопроизводительного секвенирования с анализом гомологий последовательностей в международных системах базах данных нуклеотидных последовательностей.
Набор синтетических олигонуклеотидов для проведения метилчувствительной амплификации ДНК, включающий олигонуклеотиды, для получения ДНК адаптеров со свободными концевыми нуклеотидами, специфичными к сайтам рестрикции эндонуклеаз EcoRI, KroI и BisI и праймеры для полимеразной цепной реакции, отличающиеся тем, что используют олигонуклеотиды в следующей последовательности:
EcoAd1 5' TATTGACGCGCACAGCGAT 3',
EcoAd2 5' AATTATCGCTGTGCGCGTCAATA 3',
BisAd1 5' GGTCACGGATGCGCATT 3',
BisAd2 5' NAATGCGCATCCGTGACC 3',
KroAd1 5' CCGGGTCACGGATGCGCCTA 3',
KroAd2 5' TAGGCGCATCCGTGAC 3'.
pBis 5' GTCACGGATGCGCCTANGC 3',
pKro 5' CGCATCCGTGACCCGGC 3',
pEco 5' ACGCGCACAGCGATAATTC 3'.