Вакцины на основе нуклеопротеина вируса гриппа
Иллюстрации
Показать всеПредставленные изобретения относятся, в частности, к гибридному белку, содержащему вариант нуклеопротеидного антигена из штамма вируса гриппа типа А, содержащий точечные мутации Е339А и R416A, слитый с вариантом домена олигомеризации С4bр курицы, в частности IMX313T и IMX313P. Изобретения также относятся к нуклеиновой кислоте, которая кодирует гибридный белок; вектору, содержащему указанную нуклеиновую кислоту; иммуногенной композиции, которая может использоваться в качестве вакцины или для иммунотерапии с целью профилактики заболеваний гриппом, которая содержит представленный гибридный белок. Изобретения позволяют улучшить иммуногенность NP антигена вируса гриппа А и могут быть использованы в медицинской промышленности. 6 н. и 8 з.п. ф-лы 20 ил., 3 табл., 11 пр.
Реферат
Предшествующий уровень техники
Существует потребность в улучшенных вакцинах. Современные стратегии вакцинации против гриппа нацелены на формирование устойчивых гуморальных ответов (образования антител) против гемагглютининов. Ввиду высокой степени антигенного дрейфа между циркулирующими штаммами вируса гриппа в течение одного года, вакцинные штаммы следует заменять специально для каждого сезона гриппа. Хотя годовая (или сезонная) вакцинация против гриппа является успешной в разной степени для различных возрастных категорий, необходима, безусловно, более эффективная защита, особенно для молодых и пожилых людей. Кроме того, существует большой постоянный риск того, что будут развиваться реассортантные вирусы, которые приобрели самые различные гены гемагглютининов (ГА) в результате процесса, известного как «антигенный сдвиг». Это создало бы чрезвычайную ситуацию в здравоохранении, поскольку в настоящее время вакцины гриппа основаны в основном на гемагглютининовом антигене.
Вирус гриппа является оболочечным, одноцепочечным вирусом с отрицательной смысловой РНК из семейства вирусов Orthomyxoviridae, который разделяется на 3 основных типа: А, В и С. Вирусы гриппа А заражают самых различных животных, включая людей, птиц, свиней, лошадей, летучих мышей и многих других, хотя тропизм любого конкретного вируса гриппа, как правило, в высшей степени приспособлен к определенному хозяину. Вирусы гриппа В заражают меньшее количество видов, а именно, человека и тюленей, но также являются основной причиной ежегодных эпидемий гриппа. Большинство гриппозных инфекций человека вызваны вирусом гриппа А или В; вирусы гриппа С, которые заражают людей и свиней, реже бывают причиной серьезных инфекций или эпидемий у людей (Lamb, 2001).
Современные вакцины на основе инактивированного вируса гриппа вызывают образование антител, защищающих от близкородственных штаммов вируса. Вакцины, разрешенные к применению в настоящее время, вызывают, главным образом, образование штамм-специфических нейтрализующих антител против гемагглютинина (ГА), главной антигенной детерминанты на поверхности вируса, которые обладают высокой иммуногенностью и могут предотвратить заболевание, вызванное заражением соответствующим штаммом вируса. Тем не менее, ГА обладает существенной антигенной изменчивостью, что исключает его использование в виде однокомпонентной вакцины, предназначенной для обеспечения широкой защиты. По этой причине большой интерес представляют альтернативные стратегии вакцинации, которые формируют защитные ответы, направленные против менее изменчивых мишеней.
Естественное заражение вирусом гриппа А вызывает как гуморальный, так и клеточный иммунитет. Длительный клеточный иммунитет направлен преимущественно против консервативных внутренних вирусных белков, таких как нуклеопротеин (NP, от англ. nucleoprotein). Нуклеопротеиновый антиген (NP антиген) является иммуногенным для организма человека, перенесшего естественные инфекции, но образовавшиеся при этом цитотоксические Т-лимфоциты имеют короткий период существования (McMichael, 1983а, McMichael, 1983b).
Клеточный иммунитет против NP является важным, поскольку он направлен против различных вариантов эпитопов NP, а ДНК-вакцины, для которых мишенью служит NP, вызывают перекрестный иммунитет у животных (Schotsaert, 2012).
Нуклеопротеиновый антиген (NP антиген) уже давно признан в качестве высоко консервативного антигена: даже самые дивергентные штаммы вируса гриппа А обладают 90% идентичностью кодируемых в них белков NP (Gorman, Xu, 1991). Антигенные изменения NP редки и встречаются лишь в незначительной степени (, 2010).
Применение нуклеопротеина в качестве антигена в вакцинах
Применение нуклеопротеина вируса гриппа в качестве антигена было описан в 1980-х годах (Wraith, 1987). Клеточные иммунные ответы у мышей против NP способны вызывать иммунитет, и в частности давать перекрестный иммунитет против дивергентных штаммов вируса типа А. Было показано, что иммунизация мышей NP, выделенным из вируса H3N2, может обеспечить прочную защиту (75%) при летальном заражении гетерологичным вирусом (H1N1), но не предотвращает инфекцию.
ДНК-вакцины, использующие ген NP, известны двадцать лет: их применяли в первых экспериментах «по доказательству правильности концепции» самой ДНК-вакцинации (Ulmer, 1993).
Экспрессия NP с помощью вирусного вектора была впервые продемонстрирована в 1980 (Yewdell, 1985), а иммунизация с помощью этого вектора была сопряжена с улучшенным образованием цитотоксических Т-лимфоцитов против разнообразных штаммов вируса гриппа типа А, но не типа В, по сравнению с ДНК-вакцинами.
Так, было показано, что иммунизация мышей с помощью вектора MVA, экспрессирующего нуклеопротеин PR8, защищает их от заражения низкой дозой гетеросубтипических вирусов гриппа (Altstein, 2006). Совсем недавно вирусный вектор, кодирующий белок NP, слитый с белком М1, был применен для иммунизации людей (Lillie, Berthoud, 2012; Antrobus, 2012). Эти исследования показали, в частности, что клеточные иммунные ответы на NP могут быть существенно увеличены у пожилых людей (Antrobus, 2012), когда гуморальный ответ снижается в связи со «старением» иммунной системы.
Секреция нуклеопротеина
Ряд исследований показал, что белок NP локализуется преимущественно в ядре, снижая иммуногенность таких ДНК-вакцин (, 2010).
Улучшенные клеточные иммунные ответы против NP могут быть получены путем стимуляции секреции NP, например, при помощи слияния сигнального пептида tPA с геном NP (Luo, 2008), с помощью ДНК-содержащих композиций (Greenland, 2007; Sullivan, 2010) и с помощью применения электропорации (Laddy, 2008) для улучшения доставки ДНК.
Мономерные нуклеопротеины гриппа
Предпочтительное применение мономерных антигенов в слиянии с доменами олигомеризации C4bp было описано в заявке на патент WO 2005/014654. Однако опасность мономерных антигенов заключается в их сниженной иммуногенности. Это было продемонстрировано Bachmann с коллегами на гликопротеине G вируса везикулярного стоматита (Bachmann, 1993) и Fiers с коллегами (Fiers, 2001) для антигена нейраминидазы, или NA, вируса гриппа. Следует ожидать, что уменьшение или разрушение структур более высокого порядка у нуклеопротеинов вируса гриппа будет снижать их иммуногенность.
Ряд мутаций, как было показано, преобразует нуклеопротеин вируса гриппа, который в естественном состоянии является олигомером, в мономерную форму (Ye, 2006). То, что мономерные варианты NP, описанные в этой статье 2006 года, действительно являются мономерными, подтверждается в более поздних работах (Tarus, 2012а; Ye, 2012). Две описанные в этих работах точечные мутации, которые делают мономерным нуклеопротеин вируса гриппа типа А, являются консервативными в нуклеопротеинах штаммов вируса гриппа типов В и С (Фигура 3 в Nakada, 1984). Поэтому те же самые точечные мутации могут быть введены в нуклеопротеины штаммов вируса гриппа типов В и С для того, чтобы сделать мономерными эти нуклеопротеины вируса гриппа. Однако никаких исследований иммуногенности мономерных нуклеопротеинов не проводилось.
Основной технической проблемой при получении вакцины против гриппа с NP антигеном является достижение сильных и прочных клеточных иммунных ответов. «Клеточный иммунный ответ» представляет собой иммунный ответ, который не вовлекает в участие антитела, а вызывает активацию антиген-специфических Т-лимфоцитов, и в частности цитотоксических Т-лимфоцитов, а также высвобождение различных цитокинов в ответ на антиген. Клетки CD4 или хелперные Т-клетки обеспечивают защиту против различных патогенов путем секреции цитокинов, которые активируют иммунный ответ. Цитотоксические Т-клетки (CD8) вызывают гибель патогенов путем апоптоза без использования цитокинов.
Хотя остаются споры о том, CD4 или CD8 ответы против NP являются более важными для защиты (Epstein, 2000), есть мнение, что клеточные, а не гуморальные ответы на нуклеопротеин являются ключом к защите, которую этот антиген может вызывать (Thomas, 2006). Вакцины, которые обеспечивают защиту, вызывая сильный цитотоксический Т-клеточный ответ, могут быть полезными, когда Т-клеточные эпитопы получены из высоко консервативного белка NP (Epstein, 2000; Roy, 2007). Клеточные иммунные ответы, опосредованные Т-лимфоцитами, функционируют, главным образом, путем распознавания инфицированных вирусом гриппа клеток, при помощи ингибирования репликации вируса и посредством ускорения клиренса вируса.
Специфические Т-клетки, участвующие в обеспечении иммунитета, включают как CD4+, так и CD8+ Т-клетки, и часто выполняют свои функции под действием секретируемых цитокинов и цитолитической активности, соответственно. В частности, CD8+ цитотоксические Т-лимфоциты (ЦТЛ) специфичные к NP вируса гриппа могут играть важную роль в гетеросубтипическом защитном иммунитете против летального заражения мышей вирусом гриппа (Gschoesser, 2002), обеспечивая клиренс вируса гриппа с поверхностей слизистой оболочки верхних дыхательных путей (Mbawuike, 2007) и способствуя выживанию и восстановлению после заражения (Epstein, 2000). Оптимальная вакцина на основе NP позволит улучшить как CD4, так и CD8 клеточные ответы.
Данная заявка на патент обеспечивает способы улучшения клеточного иммунного ответа на нуклеопротеины вируса гриппа.
Краткое описание изобретения
Настоящее изобретение относится к способу повышения иммуногенности и, в частности, клеточной иммуногенности NP антигенов из вирусов гриппа путем слияния, по меньшей мере, одного варианта NP антигена из штаммов вируса гриппа типа А, В или С с вариантом домена олигомеризации C4bp курицы в качестве белка-носителя.
Настоящее изобретение относится, в частности, к гибридному белку, содержащему, по меньшей мере, один мономерный вариант NP антигена из штамма вируса гриппа типа А, В или С, и белок-носитель IMX313, имеющий последовательность, показанную в SEQ ID NO: 1, например, такую, как описанная в заявке на патент WO 2007/062819.
Настоящее изобретение, в частности, относится к гибридному белку, включающему мономерный вариант NP антигена из штамма вируса гриппа типа А, содержащий точечные мутации Е339А и R416A, как показано в SEQ ID NO: 2, и вариант белка-носителя IMX313, содержащий С-концевую замену, по меньшей мере, одним положительно заряженным пептидом, имеющим последовательность ZXBBBBZ где (i) Ζ обозначает любую аминокислоту или отсутствует, (ii) X представляет собой любую аминокислоту и (iii) В является аргинином (R) или лизином (K), как показано в SEQ ID NO: 3, например, как описано в заявке на патент РСТ/ЕР 2013/076289, поданной 11 декабря 2013 года. Предпочтительный вариант белка-носителя IMX313 не вызывает образование антител, которые перекрестно реагируют с протамином.
Настоящее изобретение, в частности, относится к гибридному белку, включающему мономерный вариант NP антигена и модифицированный белок-носитель IMX313T или IMX313P, показанный соответственно в SEQ ID NO: 4 и SEQ ID NO: 5.
Настоящее изобретение также относится к иммуногенной композиции, содержащей последовательность ДНК в плазмиде или вирусном векторе, дополнительно содержащей сигнальный пептид, например, tPA, показанный в SEQ ID NO: 6.
Настоящее изобретение также относится к рекомбинантной ДНК, кодирующей указанные гибридные белки.
Настоящее изобретение также относится к иммуногенной композиции, содержащей последовательность ДНК, кодируемую плазмидой или вирусным вектором, или к гибридному белку, дополнительно содержащему вакцинные адъюванты или лиганды на основе нуклеиновых кислот для внутриклеточных ТПР, как описано в заявке на патент РСТ/ЕР 2013/076289, поданной 11 декабря 2013 года.
Настоящее изобретение также относится к плазмидной ДНК, вирусному вектору, гибридному белку или иммуногенной композиции для использования в качестве вакцины или для иммунотерапии в качестве способа профилактики или лечения гриппа.
Подробное описание изобретения
Перед подробным описанием настоящего изобретения следует понять, что данное изобретение не ограничивается, в частности, приведенными примерами способов и может, безусловно, варьироваться. В частности, настоящее изобретение относится к гибридным белкам, содержащим, по меньшей мере, один нуклеопротеиновый антиген вируса гриппа, и не ограничивается конкретным нуклеопротеином вируса гриппа.
Все публикации, патенты и патентные заявки, цитируемые здесь, независимо от того являются ли они supra или infra, включены в данное описание путем ссылки. Тем не менее, упомянутые в настоящем изобретении публикации цитируются с целью описания и раскрытия протоколов, реагентов и векторов, которые приведены в публикациях и могут быть использованы в связи с настоящим изобретением.
Кроме того, для осуществления настоящего изобретения используются, если не указано иное, обычная очистка белков и методы молекулярной биологии из данной области техники. Такие методы хорошо известны специалистам в данной области техники и полностью описаны в литературе. В нижеследующей формуле изобретения и в последовательном описании изобретения, если контекст не требует иного для того, чтобы выразить язык или необходимый смысл, слова «вмещать», «содержать», «заключать в себе» или «включать» или их варианты, такие как «содержит», «содержащий», «включающий», «включенный», «включает», «включающий» используются в включающем смысле, т.е. для определения присутствия заявленных признаков, что не исключает наличия или добавления дополнительных признаков в различные формы осуществления изобретения.
Следующие ниже термины определены для лучшего понимания изобретения.
Вирусы гриппа бывают трех типов А, В и С. Эта классификация была первоначально серологической: антисыворотки против нуклеопротеина вируса гриппа типа А перекрестно реагируют с нуклеопротеинами других вирусов гриппа типа А, но не реагируют с нуклеопротеинами вирусов гриппа типа В или типа С. Вирусы гриппа типа А классифицируются на подтипы на основе серологических перекрестных реакций их гликопротеинов гемагглютинина (Н) и нейраминидазы (N).
Под термином «нуклеопротеины вируса гриппа» подразумеваются нуклеопротеины вирусов гриппа всех трех типов (А, В и С).
Термин «белок-носитель», как правило, обозначает белок, с которым конъюгированы или слиты антигены, за счет чего они становятся более иммуногенными. В настоящем изобретении этот термин специально используется в значении «белок, несущий антиген». Функцией этого белка является повышение иммуногенности указанного антигена, с которым он конъюгирован или слит.
Термин «вариант нуклеопротеина» обозначает все белки с последовательностью, имеющей идентичность, по меньшей мере, 90% с версиями дикого типа нуклеопротеина вируса гриппа из штаммов вируса гриппа типа А, В и С.
Термин «вариант домена олигомеризации курицы» обозначает вариант домена C4bp с последовательностью SEQ ID NO: 1, описанный в заявках на патент WO 2007/062819 и РСТ/ЕР 2013/076289, поданных 11 декабря 2013 года, обе ссылки включены в настоящее изобретение путем ссылки; в частности, фрагмент, состоящий, по меньшей мере, из 48 смежных аминокислот и/или обладающий, по меньшей мере, 70% идентичностью с аминокислотной последовательностью SEQ ID NO: 1, описанный заявке на патент WO 2007/062819.
«Вариант белка-носителя IMX313» описан в заявке на патент РСТ/ЕР 2013/076289, поданной 11 декабря 2013 года.
Протамин состоит из группы гетерогенных пептидов со средней молекулярной массой 4500 дальтон, полученных из рыбы. Приблизительно 67% аминокислотного состава протамина составляет аргинин. Протамин уже давно используется для получения инсулина (нейтральный протамин Хагедорна), или для нейтрализации гепарина.
Термин «гибридный белок» обозначает рекомбинантный белок, не существующий в природе, содержащий два домена из различных источников, которые были подвергнуты слиянию. Точнее, в данном изобретении, гибридный белок включает нуклеопротеиновый антиген вируса гриппа, слитый с вариантом домена-носителя из домена олигомеризации C4bp курицы, в частности, «IMX313T» или «IMX313P». Процесс слияния обладает тем преимуществом, что образует гомогенный продукт.«Конъюгация» может быть более формально описана с генетической точки зрения таким образом: ДНК, кодирующую про-иммуногенный белок-носитель, сращивают с ДНК, кодирующей антиген. Антиген может быть слит с N- или С-концом белка-носителя.
Изобретение относится к иммуногенной композиции, содержащей, по меньшей мере, один вариант нуклеопротеинового антигена вируса гриппа и вариант домена олигомеризации C4bp, и вызывающей повышенный клеточный иммунный ответ против нуклеопротеинового антигена вируса гриппа.
В соответствии с настоящим изобретением, нуклеопротеин, слитый с вариантом белка-носителя домена олигомеризации C4bp курицы, в частности IMX313T или IMX313P, может представлять собой нуклеопротеин вирусов гриппа любого типа (А, В или С).
Антиген нуклеопротеина может быть слит с N- или С-концом белка-носителя, в частности IMX313T или IMX313P.
Согласно изобретению, по меньшей мере, один нуклеопротеин слит с одним белком-носителем, в частности IMX313T или IMX313P; тем не менее, с одним и тем же белком-носителем могут быть слиты два или более, одинаковых или различных, нуклеопротеина.
В соответствии с предпочтительным аспектом настоящего изобретения, антиген нуклеопротеина слитый с вариантом домена олигомеризации C4bp курицы, в частности IMX313T или IMX313P, представляет собой мономерный антиген. Использовать мономерные антигены, как описано в патентной заявке WO 2005/014654, действительно выгодно при условии, что мономеризация не уменьшает их иммуногенность. Кроме того, NP образует тример в кристаллах (Ye, 2006) и другие олигомеры in vivo (Arranz, 2012; Moeller, 2012). Слияние тримерного или олигомерных белков в гептамерный белок, такой как IMX313T или IMX313P, ведет к риску возникновения стерических конфликтов. С другой стороны, мономерные формы естественных олигомерных белков имеют уменьшенную иммуногенность (Fiers, 2001).
Для получения мономерного антигена нуклеопротеина специалистам в данной области техники известны различные точечные мутации, которые могут быть введены в белковую последовательность NP антигена для того, чтобы вызвать его мономеризацию. В частности, NP антиген имеет, по меньшей мере, одну из двух следующих точечных мутаций: Е339А и R416A.
В одной форме осуществления изобретения NP антиген представляет собой NP антиген из штамма вируса гриппа типа А.
В предпочтительной форме осуществления настоящего изобретения NP антиген содержит обе точечные мутации Е339А и R416A, и, следовательно, является мономерным.
В другой форме осуществления настоящего изобретения NP антиген имеет полипептидную последовательность, показанную в SEQ ID NO: 2.
Увеличение клеточных иммунных ответов на антигены, экспрессированные из ДНК-вакцин, было ранее получено путем слияния гена антигена с геном, кодирующим IMX313 (Spencer, 2012). Предпочтительно, если варианты этого домена имеют С-концевую замену, по меньшей мере, из одного положительно заряженного пептида, обладающего последовательностью ZXBBBBZ, где (i) Z обозначает любую аминокислоту или отсутствует, (ii) X представляет собой любую аминокислоту и (iii) В является аргинином (R) или лизином (K), как показано в SEQ ID NO: 3, которая позволяет улучшить иммунный ответ на антиген, слитый с данным антигеном, например, как описано в патентной заявке РСТ/ЕР 2013/076289, поданной 11-е декабря 2013 года. Предпочтительный вариант белка-носителя IMX313 не вызывает образования антител, которые перекрестно реагируют с протамином.
Конкретные улучшенные варианты, которые называются IMX313T и IMX313P, недавно описаны в заявке на патент РСТ/ЕР 2013/076289, поданной 11 декабря 2013 года. Их пептидные последовательности являются следующими:
В другой форме осуществления изобретения гибридный белок включает в себя NP антиген, который содержит сигнальный пептид. Некоторые исследования показали, что белок NP локализуется, прежде всего, в ядре, что потенциально могло бы уменьшить иммуногенность таких ДНК-вакцин. Таким образом, обеспечение возможности секреции NP антигена путем добавления сигнального пептида является целесообразным. В частности, этот сигнальный пептид представляет собой тканевый активатор плазминогена (tPA), секреторный сигнальный пептид, как описано в (Luo, 2008).
В конкретной форме осуществления настоящего изобретения NP антиген является мономерным и содержит сигнальный пептид.
В другой форме осуществления настоящего изобретения NP антиген включает обе мутации Е339А и R416A, а также сигнальный пептид tPA. Как показано в примерах, гибридный белок, содержащий IMX313T и мономерный NP антиген, включающий сигнальный пептид, вызывает у мышей при введении в форме ДНК-вакцины Th1-ответ (IgG2a) более сильный, чем Th2-ответа (Фиг. 13). По общему мнению иммунологов, Th1-ответы предпочтительнее Th2-ответов. Однако способы улучшения преимущественно Th1-ответов на антиген без использования вспомогательных средств, разработанных для этой цели, в данной области не известны. В приведенных ниже примерах показано, что слияние IMX313T или IMX313P с нуклеопротеиновыми антигенами вируса гриппа предпочтительно улучшает Th1-ответы.
Изобретение также относится к гибридному белку, включающему любой белок-носитель, который содержит биспиральный домен и, по меньшей мере, один нуклеопротеиновый (NP) антиген вируса гриппа. При этом данный нуклеопротеиновый антиген является мономерным.
Настоящее изобретение также относится к нуклеиновой кислоте, кодирующей гибридный белок, такой как описано выше, и, в частности:
- кодирующей гибридный белок, содержащий NP антиген и IMX313T или IMX313P;
- кодирующей гибридный белок, содержащий мономерный NP антиген и IMX313T или IMX313P;
- кодирующей гибридный белок, включающий NP антиген, который содержит сигнальный пептид и IMX313T или IMX313P;
- кодирующей гибридный белок, включающий мономерный NP антиген, который содержит сигнальный пептид и IMX313T или IMX313P.
В предпочтительных формах осуществления изобретения нуклеиновая кислота кодирует гибридный белок, содержащий мономерный NP антиген из вируса гриппа А. В предпочтительных формах осуществления изобретения нуклеиновая кислота кодирует гибридный белок, который не образует антитела, перекрестно реагирующие с протамином. В частности, эти нуклеиновые кислоты представляют собой последовательности, как показано в SEQ ID NO: 6 и SEQ ID NO: 7.
Настоящее изобретение также относится к вектору, содержащему нуклеиновую кислоту, представленную выше, и генетические элементы, такие как промоторы и энхансеры, для того, чтобы обеспечить экспрессию ДНК кассеты в клетках-хозяевах.
Настоящее изобретение также относится к иммуногенной композиции, содержащей:
- гибридный белок, или нуклеиновую кислоту, или вектор, упомянутые выше, и
- лиганды на основе нуклеиновых кислот для внутриклеточных ТПР и/или каких-либо других адъювантов.
Толл-подобные рецепторы (ТПР)
Клетки врожденной иммунной системы обнаруживают патогены через ограниченный набор рецепторов, кодируемых генами зародышевой линии. Эти рецепторы врожденного иммунитета распознают ряд экспрессируемых патогенами консервативных молекулярных структур, называемых патоген-ассоциированными молекулярными паттернами (ПАМП).
Эти производимые патогенами молекулы представляют собой сложные молекулы, которые высоко специфичны для набора патогенов. Толл-подобные рецепторы (ТПР) представляют собой набор рецепторов, распознающих иммунные паттерны, которые способны привести в состояние готовности иммунную систему немедленно после заражения патогеном. Они играют важную роль в качестве ключевых компонентов между врожденным и приобретенным иммунитетом и могут распознавать многие болезнетворные микроорганизмы, в диапазоне от вирусов до паразитов. Первый охарактеризованный ТПР, названный «толл», отвечает, как было показано, за противогрибковые ответы у взрослых мух дрозофил (Drosophila) и на сегодняшний день определены 10 его эквивалентов у человека, участвующих в распознавании патогена. ТПР могут быть классифицированы на различные группы в зависимости от их локализации и типа ПАМП, которые они распознают. ТПР 1, 2, 4, 5 и 6 экспрессируются, главным образом, на поверхности клетки, где они в основном распознают бактериальные продукты, тогда как ТПР 3, 7, 8 и 9 локализованы в внутриклеточных компартментах и распознают в основном вирусные продукты и нуклеиновые кислоты.
Внутриклеточные толл-подобные рецепторы
Кроме того, для совершенствования способов иммунизации также имеет большое значение ограничение передачи сигналов через ТПР рецепторы. Толл-подобные рецепторы (ТПР) представляют собой класс белков, которые играют ключевую роль в иммунной системе. После того, как микробы нарушили физические барьеры организмов, их распознают ТПР. Распознаваемые признаки микробов включают двухцепочечную РНК вирусов, неметилированные сайты CpG-островков бактерий и вирусов и некоторых РНК и ДНК молекулы.
Существует значительный интерес к таким нуклеиновым кислотам, поскольку они являются лигандами для класса толл-подобных рецепторов (далее ТПР) и, в частности для ТПР3, ТПР7, ТПР8, ТПР9 и ТПР13 (Blasius, 2010 и ссылки внутри статьи). Иногда они классифицируются как «внутриклеточные толл-подобные рецепторы», но, по меньшей мере, ТПРЗ также присутствует на некоторых поверхностях клеток. ТПР3 экспрессируется на множестве эпителиальных клеток, включая эпителиальные клетки дыхательных путей, матки, роговицы, влагалища, шейки матки, желчных протоков и кишечника, и при этом такие клетки экспрессируют ТПР3 на своей клеточной поверхности (Akira, 2006).
Важность ограничения сигналов через эти рецепторы, и в частности рецептор ТПР3, зависит от дозы. Таким образом, прочное связывание лигандов на основе нуклеиновой кислоты с антигеном важно для того, чтобы предотвратить их связывание с ТПР в отсутствие антигена. Поэтому прочно связанные внутриклеточные лиганды ТПР намного предпочтительнее композиций, в которых связывание является менее прочным. Вследствие этого специалисты в данной области заняты поиском антигенных композиций, способных эффективно связывать ТПР лиганды таким образом, чтобы они не отделялись от антигена прежде, чем антиген поступит в клетки, где он вызовет иммунный ответ, с целью уменьшения потенциальных побочных эффектов, опосредованных связыванием лигандов с ТПР рецепторами в других местах.
В настоящей заявке на патент и, в частности, в примерах, были использованы следующие внутриклеточные лиганды ТПР:
- для ТПР3: полиинозин-полицитидиловая кислота poly (I:C), представляющая собой дуплекс полинуклеотида полиинозиновой кислоты гибридизованный с полицитидиловой кислотой, аналог двухцепочечной РНК. Длина ее цепи составляла двадцать нуклеотидов для каждой нити.
- для ТПР7: олигонуклеотид, называемый ssRNA40, с последовательностью 5' GsCsCsCsGsUsCsUsGsUsUsGsUsGsUsGsAsCsUsC 3', где символ «s» представляет собой фосфотиоатную связь (SEQ ID NO: 8);
- для ТПР9: олигонуклеотид, называемый ODN1826 с последовательностью: 5' tccatgacgttcctgacgtt 3' (SEQ ID NO: 9).
В конкретном аспекте настоящего изобретения иммуногенная композиция включает:
- гибридный белок, или нуклеиновую кислоту, или вектор, представленные выше, и
- полиинозин-полицитидиловую кислоту poly (I:C).
Изобретение также относится к гибридному белку, такому, как описано выше, для применения в качестве вакцины с целью профилактики и лечения заболеваний гриппом. Эта вакцина против гриппа может применяться для нескольких направлений использования:
- профилактики сезонного гриппа;
- профилактики в ситуации пандемии;
- «универсальной» профилактики, т.е. иммунизации вакцинами против всех типов вируса гриппа;
- иммунотерапии всех видов гриппа.
Способы профилактики или лечения гриппа могут быть выполнены с помощью специфических вакцин в соответствии с настоящим изобретением, в организме человека или животных. Специалистам в данной области известно, как адаптировать композиции вакцин для каждого конкретного применения и конкретных пациентов.
Изобретение также относится к нуклеиновой кислоте, например, как описано выше, для применения в качестве ДНК-вакцины с целью профилактики заболеваний гриппом.
Изобретение также относится к вектору, например, как описано выше, для применения в качестве вирусной вакцины с целью профилактики заболеваний гриппом.
Изобретение также относится к иммуногенной композиции, как описано выше, для применения в качестве вакцины с целью предупреждения заболевания гриппом.
Изобретение также относится к способу повышения клеточного иммунного ответа на нуклеопротеиновый антиген вируса гриппа, включающему слияние этого антигена с белком-носителем IMX313T или IMX313P, имеющим последовательность, показанную в SEQ ID NO: 4 и SEQ ID NO: 5.
В другой форме осуществления изобретения гибридный белок, или нуклеиновая кислота, или вектор, или иммуногенная композиция, такие как описано выше, применяются в иммунотерапии заболеваний гриппом.
Краткое описание графических материалов
Фигура 1. Карта исходной плазмиды pcDNA3-NP. Эта плазмида и производные от нее плазмиды, сконструированные, как описано в примерах, были использованы для ДНК-вакцинации.
Фигура 2. Сравнение суммарных Т-клеток, секретирующих IFN-γ в ответ на иммунизацию плазмидами, кодирующими NP или NP, слитый с IMX313.
Фигура 3. Сравнение CD8 и CD4 Т-клеток, секретирующих IFN-γ в ответ на иммунизацию плазмидой, кодирующей NP или плазмидой, кодирующей NP, слитый CIMX313.
Фигура 4. Сравнение иммунных ответов в виде образования антител IgG против рекомбинантного NP, вызванных ДНК плазмидами, кодирующими либо NP, либо NP, слитый с IMX313.
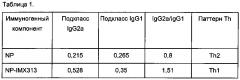
Фигура 5. Сравнение иммунных ответов в виде образования антител подкласса IgG против рекомбинантного NP, вызванных ДНК плазмидами, кодирующими либо NP, либо NP, слитый с IMX313.
Фигура 6. Сравнение суммарных Т-клеточных ответов на плазмиды, кодирующие NP, мономерный NP (NPm), мономерный NP слитый с IMX313 (NPm-IMX313) и мономерный NP слитый с IMX313T (NPm-IMX313T).
Фигура 7. Сравнение иммунных ответов в виде образования CD8+ и CD4+ Т-клеток на плазмиды, кодирующие NP, мономерный NP (NPm), мономерный NP слитый с IMX313 (NPm-IMX313) и мономерный NP слитый с IMX313T (NPm-IMX313T).
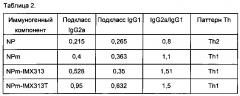
Фигура 8. Сравнение иммунных ответов в виде образования антител IgG, измеренных методом иммуносорбентного ферментного анализа (ELISA, от англ. enzyme-linked immunosorbent assay) с использованием рекомбинантного NP, на плазмиды, кодирующие NP, мономерный NP (NPm), мономерный NP слитый с IMX313 (NPm-IMX313) и мономерный NP слитый с IMX313T (NPm-IMX313T).
Фигура 9. Сравнение иммунных ответов в виде образования антител подкласса IgG, измеренных с использованием рекомбинантного NP, на плазмиды, кодирующие NP, мономерный NP (NPm), мономерный NP слитый с IMX313 (NPm-IMX313) и мономерный NP слитый с IMX313T (NPm-IMX313T).
Фигура 10. Влияние секреции, вызванной сигнальным пептидом tPA, на различные гибридные белки NP. Количество суммарных Т-клеток измеряли по секреции IFN-γ методом метод иммуноферментных пятен (ELISpot, от англ. enzyme-linked immunospot) по сравнению с NP, секретируемым NP (tPA-NP), секретируемым мономерным NP (tPA-NPm), секретируемым NP, слитым с IMX313 (tPA-NP-IMX313), секретируемым мономерным NP, слитым с IMX313 (tPA-NPm-IMX313) и секретируемым мономерным NP, слитым с IMX313T (tPA-NPm-IMX313T).
Фигура 11. Влияние секреции, вызванной сигнальным пептидом tPA, на CD8+ и CD4+ ответы против различных гибридных белков NP, измеренные по секреции IFN-γ, методом ELISpot сравнению с NP, секретируемым NP (tPA-NP), секретируемым мономерным NP (tPA-NPm), секретируемым NP, слитым с IMX313 (tPA-NP-IMX313), секретируемым мономерным NP, слитым с IMX313 (tPA-NPm-IMX313) и секретируемым мономерным NP, слитым с IMX313T (tPA-NPm-IMX313T).
Фигура 12. Влияние секреции, вызванной сигнальным пептидом tPA, на образование IgG против различных гибридных белков NP, измеренное по секреции IFN-γ, методом ELISpot по сравнению с NP, секретируемым NP (tPA-NP), секретируемым мономерным NP (tPA-NPm), секретируемым NP, слитым с IMX313 (tPA-NP-IMX313), секретируемым мономерным NP, слитым с IMX313 (tPA-NPm-IMX313) и секретируемым мономерным NP, слитым с IMX313T (tPA-NPm-IMX313T).
Фигура 13. Влияние секреции, вызванной сигнальным пептидом tPA, на образование антител подкласса IgG против различных гибридных белков NP, измеренное по секреции IFN-γ, методом ELISpot по сравнению с NP, секретируемым NP (tPA-NP), секретируемым мономерным NP (tPA-NPm), секретируемым NP, слитым с IMX313 (tPA-NP-IMX313), секретируемым мономерным NP, слитым с IMX313 (tPA-NPm-IMX313) и секретируемым мономерным NP, слитым с IMX313T (tPA-NPm-IMX313T).
Фигура 14. Слияние нуклеопротеина с IMX313T увеличивает иммуногенность NP в такой же степени, как форма выпуска NP в адъюванте типа масло-в-воде AddaVax (Invivogen); при этом применение AddaVax совместно с гибридным белком NPM-IMX313T дает синергический эффект.
Фигура 15. Анализ результатов, представленных на Фигуре 14 после отделения CD4 и CD8 клеток. Синергетический эффект AddaVax с белком NPm-IMX313T виден как в CD4 ответах, так и в CD8 ответах.
Фигура 16. Образование IgG против нуклеопротеина. Слияние нуклеопротеина с IMX313T в отсутствие адъюванта AddaVax не показывало значительных изменений в титрах IgG по сравнению с NP. Но в присутствии AddaVax гибридный белок является значительно более иммуногенным, чем нуклеопротеин.
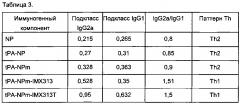
Фигура 17. Сравнение иммунных ответов в виде образования антител подкласса IgG, измеренное с использованием рекомбинантного NP, после иммунизации NP или NPm-IMX313T, совместно с AddaVax или без AddaVax. Как видно из Таблицы 4, NP совместно с AddaVax или без AddaVax вызывал Th1-ответ. Однако гибридный белок NPm-IMX313T, совместно с AddaVax или без AddaVax, дополнительно поляризовал иммунный ответ в виде образования IgG в сторону Th1-ответа.
Фигура 18. Анализ методом ДСН-ПААГ-электрофореза рекомбинантных белков, применяемых для иммунизации. Полоса 1: маркеры молекулярной массы (New England Biolabs); полоса 2: рекомбинантный NP (Imgenex); полоса 3: очищенный NP; полоса 4: очищенный NPm-IMX313T.
Фигура 19. Анализ методом ДСН-ПААГ-электрофореза рекомбинантных белков NPm-IMX313P. Полоса 1: очищенный NP; полоса 2: очищенный NPm-IMX313T; полоса 3: очищенный NPm-IMX313P; полоса 4: маркеры молекулярной массы (New England Biolabs).
Фигура 20. Образование IgG против протамина или IMX313P после иммунизации мышей белком IMX313P. Оно показывает, что, хотя мыши производят IgG антитела на IMX313P (и некоторые из них перекрестно реагируют с IMX313), никаких антител, не вступающих в перекрестную реакцию с протамином, найдено не было.
ПРИМЕРЫ
Для ДНК-вакцинации исходную плазмиду pcDNA3-NP, показанную на Фигуре 1, модифицировали так, как описано в приведенных ниже примерах. Плазмиды pIMX494 и pIMX497 описаны в заявке на патент РСТ/ЕР 2013/076289, поданной 11 декабря 2013 года.
Пример 1. Введение IMX313 в плазмиды, кодирующие нуклеопротеин Последовательность, кодирующую IMX313 амплифицировали из плазмиды pIMX494 с использованием олигонуклеотидных праймеров IMX1289 (5' caatgcagaggagtacgacaatggatccaagaagcaaggtgatgctgatg 3' - SEQ ID NO: 10) и IMX1290 (5' GTAGAAACAAGGGTATTTTTCTTtattactccttgctcagtccttgc 3' - SEQ ID NO: 11) и встраивали в плазмиду pcDNA3-NP, как описано Geiser.
Пример 2. Вставка сигнального пептида tPA
Сигнальный пептид tPA амплифицировали из вектора pSG2-85A (Spencer, 2012) с использованием олигонуклеотидов IMX1305 (5' cactgagtgacatcaaaatcatgGATGCAATGAAGAGAGGGC 3' - SEQ ID NO: 12) и IMX1306 (5' cgtaagaccgtttggtgccttggctagctcttctgaatcgggcatggatttcc 3' - SEQ ID NO: 13) и встраивали в рамку считывания с N-концом последовательности, кодирующей NP в ряде плазмид, как описано Geiser.
Пример 3. Создание двух точечных мутаций в NP для того, чтобы сделать его мономерным
Олигонуклеотидные праймеры IMX1287 (5' ccattctgccgcatttgCagatctaagag 3' -SEQ ID NO: 14) и IMX1288 (5' CAAAAGGGAGATTTGCCTGTACTGAGAAC 3' - SEQ ID NO: 15) использовали для амплификации внутреннего фрагмента гена NP, и полученный в результате этого продукт ПЦР встраивали в плазмиды, кодирующие NP, как описано Geiser. Поскольку оба олигонуклеотида не полностью соответствовали гену NP, вставка продукта ПЦР создавала две точечных мутации. Праймер IMX1287 создавал мутацию Е339А (замена GAA на GCA), тогда как праймер IMX1288 создавал мутацию R416A в гене NP (замена AGA на GCA).
Пример 4. Вставка IMX313T
Последовательность, кодирующую IMX313T, амплифицировали из плазмиды pIMX497 с использованием олигонуклеотидных праймеров IMX1289 (SEQ ID NO: 10) и IMX051 (5' GTAGAAACAAGGGTATTTTTCTTtattaggagcgacggcgacgc 3' - SEQ ID No: 16) и встраивали в различные плазмиды, являющиеся производными плазмиды pcDNA3-NP, как описано Geiser.
Пример 5. ДНК иммунизация нуклеиновыми кислотами согласно настоящему изобретению
5.1. Протокол
Группы из пяти самок мышей линии BALB/C иммунизировали внутримышечно дважды с интервалом в 14 дней различными ДНК-плазмидами, используя 20 мкг каждой плазмиды на инъекцию. Иммунные ответы измеряли на 28 день, определяя влияние различных модификаций: +/- IMX313 или IMX313T; +/- сигнальный пептид tPA; +/- мономеризующие мутации.
Антиген-специфические Т-клеточные