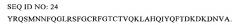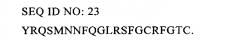Антитело к адреномедуллину (adm) или фрагмент анти-adm антитела, или анти-adm he-ig каркас для применения в терапии
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к антителу к адреномедуллину или его антигенсвязывающему фрагменту. Указанное антитело или его антигенсвязывающий фрагмент специфически связывается с N-концевой областью (ак-1-21) зрелого человеческого ADM, имеющей последовательность YRQSMNNFQGLRSFGCRFGTC, представленную в виде SEQ ID NO:23, и обладает аффинностью связывания с ADM, составляющей по меньшей мере 10-7 М. Также предложена фармацевтическая комбинация, предназначенная для применения в качестве лекарственного средства для стабилизации кровообращения и содержащая эффективное количество указанного антитела или его антигенсвязывающего фрагмента и сосудосуживающее средство, например катехоламин. Предложена фармацевтическая комбинация, предназначенная для применения в качестве лекарственного средства для регулирования жидкостного баланса и содержащая эффективное количество указанного антитела или его антигенсвязывающего фрагмента и жидкость для внутривенного введения. Предложена фармацевтическая комбинация, предназначенная для применения в качестве лекарственного средства для лечения сепсиса и содержащая эффективное количество указанного антитела или его антигенсвязывающего фрагмента и антитело к TNF-альфа. Предложена фармацевтическая комбинация, предназначенная для применения в качестве лекарственного средства для лечения сепсиса и содержащая эффективное количество указанного антитела или его антигенсвязывающего фрагмента и антибиотики. Также предложена фармацевтическая композиция для регулирования жидкостного баланса пациента, содержащая эффективное количество указанного антитела или его антигенсвязывающего фрагмента и фармацевтически приемлемый наполнитель. 6 н. и 8 з.п. ф-лы, 24 ил., 12 табл., 11 пр.
Реферат
Область техники, к которой относится изобретение
Объектом настоящего изобретения является антитело к адреномедуллину или фрагмент антитела к адреномедуллину, или анти-ADM не-Ig каркас, где указанное антитело или фрагмент, или каркас представляет собой не обладающее нейтрализующей активностью антитело (не нейтрализующее антитело).
Объектом настоящего изобретения является антитело к адреномедуллину или фрагмент антитела к адреномедуллину, или анти-ADM не-Ig каркас, где указанное антитело или указанный фрагмент, или указанный каркас представляет собой
- стабилизирующее ADM антитело или стабилизирующий ADM фрагмент антитела, или стабилизирующий ADM не-Ig каркас, которое/который удлиняет время полужизни (т.е. время полуудержания t½) адреномедуллина в сыворотке, крови, плазме по меньшей мере на 10%, предпочтительно по меньшей мере на 50%, более предпочтительно на >50%, наиболее предпочтительно на 100%, и/или
- указанное стабилизирующее ADM антитело или указанный стабилизирующий ADM фрагмент антитела, или указанный стабилизирующий ADM не-Ig каркас блокирует биологическую активность ADM менее чем на 80%, предпочтительно менее чем на 50%.
Указанное выше положение относится к блокированию биологической активности ADM не более чем на 80% или не более чем на 50% соответственно, его следует понимать в смысле ограниченного блокирования биологической активности ADM или снижения биологической активности ADM соответствующим связывающим ADM агентом, представляющим собой стабилизирующее ADM антитело или фрагмент антитела, или не-Ig каркас. Подразумевается, что это означает, что биологическая активность ADM сохраняется. Например, в случае блокирования биологической активности ADM не более чем на 80%, подразумевается, что сохраняется примерно 20% остаточной биологической активности ADM, в случае блокирования биологической активности ADM не более чем 50%, подразумевается, что сохраняется примерно 50% остаточной биологической активности ADM.
Объектом настоящего изобретения является антитело к адреномедуллину или фрагмент антитела к адреномедуллину, или анти-ADM не-Ig каркас, где указанное антитело или указанный фрагмент, или указанный каркас связывается с N-концевой областью (ак 1-21) человеческого адреномедуллина.
В предпочтительном варианте осуществления настоящего изобретения объектом изобретения является антитело к адреномедуллину или фрагмент антитела к адреномедуллину, или анти-ADM не-Ig каркас, где указанное антитело или указанный фрагмент, или указанный каркас связывается с N-концом (ак 1) человеческого адреномедуллина.
Предпосылки создания изобретения
Пептид адреномедуллин (ADM) впервые был описан в 1993 г. (Kitamura К. и др., «Adrenomedullin: A Novel Hypotensive Peptide Isolated From Human Pheochromocytoma», Biochemical and Biophysical Research Communications, т. 192, 1993, cc. 553-560) в качестве нового обладающего гипотензивным действием пептида, состоящего из 52 аминокислот, который был выделен из человеческой феохромоцитомы; SEQ ID NO: 21. В этом же году были описаны также кДНК, кодирующая состоящий из 185 аминокислот пептид-предшественник, и полная аминокислотная последовательность указанного пептида-предшественника. Пептид-предшественник, который содержит, в том числе состоящую из 21 аминокислоты сигнальную последовательность на N-конце, обозначают также как «препроадреномедуллин» (пре-проADM). В настоящем описании все специально указанные аминокислотные положения соответствуют пре-проADM, который содержит 185 аминокислот. Пептид адреномедуллин (ADM) представляет собой пептид, который содержит 52 аминокислоты (SEQ ID NO: 21) и который содержит аминокислоты 95-146 пре-проADM, из которого он образуется в результате протеолитического расщепления. К настоящему времени более подробно охарактеризованы лишь несколько фрагментов из пептидных фрагментов, образовавшихся при расщеплении пре-проADM, в частности физиологически активные пептиды адреномедуллин (ADM) и «РАМР», пептид, содержащий 20 аминокислот (22-41), которые расположены после состоящего из 21 аминокислоты сигнального пептида в пре-проADM. Открытие и характеризация ADM в 1993 г. стимулировали интенсивные исследования, результаты которых обобщены в различных обзорных статьях, в контексте настоящего описания ссылка дана прежде всего, на статьи, представленные в выпуске «Peptides», посвященном, в частности, ADM («Adrenomedullin: from a pheochromocytoma to the eyes», под ред. Takahashi К., Peptides, т. 22, 2001, с. 1691, и Eto Т., «А review of the biological properties and clinical implications of adrenomedullin and proadrenomedullin N-terminal 20 peptide (PAMP), hypotensive and vasodilating peptides», Peptides, т. 22, 2001, cc. 1693-1711). В качестве дополнительного обзора можно упомянуть публикацию Hinson и др., «Adrenomedullin, а Multifunctional Regulatory Peptide», Endocrine Reviews, т. 21(2), 2000, cc. 138-167. В проведенных к настоящему времени научных исследованиях установлено, среди прочего, что ADM можно рассматривать в качестве многофункционального регуляторного пептида. Он высвобождается в кровоток в неактивной форме, удлиненной глицином (Kitamura К. и др., «The intermediate form of glycine-extended adrenomedullin is the major circulating molecular form in human plasma», Biochem. Biophys. Res. Commun., т. 244(2), 1998, сс. 551-555, только реферат). Обнаружен также связывающий белок (Pio R. и др., «Complement Factor Н is a Serum-binding Protein for adrenomedullin, and the Resulting Complex Modulates the Bioactivities of Both Partners», The Journal of Biological Chemistry, т. 276(15), 2001, сс. 12292-12300), который является специфическим в отношении ADM и вероятно также модулирует действие ADM. В проведенных к настоящему времени исследованиях в качестве наиболее важных физиологических действий ADM, а также РАМР, рассматривались их воздействия на кровяное давление.
Таким образом, ADM является эффективным вазодилататором, и возможно, что гипотензивное действие связано с конкретными пептидными сегментами в С-концевой области ADM. Установлено также, что указанный выше дополнительный физиологически активный пептид РАМР, образованный из пре-проADM, также обладает гипотензивной активностью, даже, если он, вероятно, имеет механизм действия, отличный от механизма ADM (см. помимо указанных выше обзорных статей Eto Т., «А review of the biological properties and clinical implications of adrenomedullin and proadrenomedullin N-terminal 20 peptide (PAMP), hypotensive and vasodilating peptides», Peptides, т. 22, 2001, cc. 1693-1711; и Hinson и др., «Adrenomedullin, a Multifunctional Regulatory Peptide», Endocrine Reviews, т. 21(2), 2000, сс. 138-167; см. также Kuwasako К. и др., «Purification and characterization of РАМР-12 (PAMP-20) in porcine adrenal medulla as a major endogenous biologically active peptide», FEBS Lett, т. 414(1), 1997, cc. 105-110, только реферат; и Kuwasaki К. и др., «Increased plasma proadrenomedullin N-terminal 20 peptide in patients with essential hypertension», Ann. Clin. Biochem., т. 36 (Pt. 5), 1999, сс. 622-628, только реферат; или Tsuruda Т. и др., «Secretion of proadrenomedullin N-terminal 20 peptide from cultured neonatal rat cardiac cells», Life Sci., т. 69(2), 2001, cc. 239-245, только реферат; и EP-A20622458). Кроме того, установлено, что концентрации ADM, которые удалось измерить в кровотоке и других биологических жидкостях, при ряде патологических состояний существенно превышают концентрации, обнаруженные у здоровых контрольных индивидуумов. Так, уровень ADM у пациентов с застойной сердечной недостаточностью, инфарктом миокарда, заболеваниями почек, гипертензивными нарушениями, сахарным диабетом, острой фазой шока и сепсисом и септическим шоком существенно повышается, хотя и в различной степени. Концентрации РАМР также повышаются при некоторых указанных патологических состояниях, но его уровни в плазме ниже по сравнению с ADM (Eto Т., «А review of the biological properties and clinical implications of adrenomedullin и proadrenomedullin N-terminal 20 peptide (PAMP), hypotensive and vasodilating peptides», Peptides, т. 22, 2001, сс. 1693-1711; на с. 1702). Кроме того, известно, что необычно высокие концентрации ADM можно обнаружить при сепсисе, а наиболее высокие концентрации выявлены при септическом шоке (см. Eto Т., «А review of the biological properties and clinical implications of adrenomedullin и proadrenomedullin N-terminal 20 peptide (PAMP), hypotensive and vasodilating peptides», Peptides, т. 22, 2001, cc. 1693-1711; и Hirata и др., «Increased Circulating Adrenomedullin, a Novel Vasodilatory Peptide, in Sepsis», Journal of Clinical Endocrinology and Metabolism, т. 81(4), 1996, cc. 1449-1453, Ehlenz К. и др., «High levels of circulating adrenomedullin in severe illness: Correlation with C-reactive protein and evidence against the adrenal medulla as site of origin», Exp Clin Endocrinol Diabetes, т. 105, 1997, cc. 156-162, Tomoda Y. и др., «Regulation of adrenomedullin secretion from cultured cells», Peptides, т. 22, 2001, cc. 1783-1794; Ueda S. и др., «Increased Plasma Levels of Adrenomedullin in Patients with Systemic Inflammatory Response Syndrome», Am. J. Respir. Crit. Care Med., т. 160, 1999, cc. 132-136 и Wang P., «Adrenomedullin and cardiovascular responses in sepsis», Peptides, т. 22, 2001, cc. 1835-1840).
Кроме того, в данной области известен метод идентификации иммунореактивности адреномедуллина в биологических жидкостях для диагностических целей, в частности, для диагностики сепсиса, диагностики сердечных нарушений и диагностики рака. Согласно изобретению срединный пептидный фрагмент (мид-региональный) проадреномедуллина, который содержит аминокислоты (45-92) полного препроадреномедуллина, оценивают количественно, в частности, с помощью иммуноанализа, для осуществления которого используют по меньшей мере одно меченое антитело, которое специфически распознает срединный проADM (WO 2004/090546).
В WO-A1 2004/097423 описано применение антитела к адреномедуллину для диагностики, прогнозирования и лечения сердечнососудистых нарушений. В данной области описано также лечение заболеваний путем блокирования ADM-рецептора (например, в WO-A1 2006/027147, РСТ/ЕР 2005/012844), при этом указанные заболевания могут представлять собой сепсис, септический шок, сердечнососудистые заболевания, инфекции, дерматологические заболевания эндокринные заболевания, метаболические заболевания, желудочно-кишечные заболевания, рак, воспаления, гематологические заболевания, респираторные заболевания, заболевания скелетно-мышечной системы, неврологические заболевания, урологические заболевания.
Известно, что на ранней фазе сепсиса ADM улучшает сердечную функцию и поставку крови в печень, селезенку, почку и тонкий кишечник. ADM-нейтрализующие антитела нейтрализуют указанные выше действия на ранней фазе сепсиса (Wang P., «Adrenomedullin and cardiovascular responses in sepsis», Peptides, т. 22, 2001, сс. 1835-1840).
На более поздней фазе сепсиса, гиподинамической фазе сепсиса, ADM представляет собой фактор риска, в значительной степени ассоциированный с гибелью пациентов при септическом шоке (Schiitz и др., «Circulating Precursor levels of endothelin-1 and adrenomedullin, two endothelium-derived, counteracting substances, in sepsis», Endothelium, 14, 2007, cc. 345-351). Методы диагностики и лечения пациентов на критической стадии болезни, например, на очень поздних фазах сепсиса, и применение эндотелина и агонистов эндотелина, обладающих сосудосуживающей активностью, для приготовления лекарственных средств, предназначенных для лечения пациентов на критической стадии болезни, описано в WO-A1 2007/062676. Кроме того, в WO-A1 2007/062676 описано применение вместо эндотелина и/или агонистов эндотелина или в сочетании с ними антагонистов адреномедуллина, т.е. молекул, которые предупреждают или ослабляют сосудосуживающее действие адреномедуллина, например, путем блокирования соответствующих ему рецепторов, или субстанций, которые предупреждают связывание адреномедуллина с его рецептором (например, специфические связывающие агенты, такие как антитела, которые связываются с адреномедуллином и блокируют сайты связывания его рецептора; «иммунологическая нейтрализация»). Указанное применение или комбинированное применение, включающее последовательное или предварительно разделенное применение, описано в определенных случаях как желательное, например, для повышения успеха терапии, или для избегания нежелательного физиологического стресса или побочных действий. Таким образом, известно, что нейтрализующие ADM антитела можно использовать для лечения сепсиса на поздней стадии сепсиса.
В данной области описано применение ADM в сочетании с ADM-связывающим белком-1 для лечения сепсиса и септического шока. Считается, что лечение страдающих сепсисом животных с помощью ADM и ADM-связывающего белка-1 препятствует переходу в более позднюю фазу сепсиса. Следует отметить, что в живом организме ADM-связывающий белок (фактор комплемента H) присутствует в кровотоке указанного организма в высоких концентрациях (Pio и др., «Identification, characterization, and physiological actions of factor H as an Adrenomedullin binding Protein present in Human Plasma» Microscopy Res. and Technique, 55, 2002, cc. 23-27 и Martinez и др., «Mapping of the Adrenomedullin - Binding domains in Human Complement factor H; Hypertens Res, т. 26, дополнение, 2003, cc. 56-59).
Согласно настоящему изобретению ADM-связывающий белок-1 можно обозначать также как белок-1, связывающий ADM (фактор комплемента H).
Таким образом, введение ADM может оказывать благоприятное действие на ранней стадии болезни, такой, например, как сепсис, но может оказывать вредное воздействие на более поздней стадии сепсиса. В случае введения антител к ADM может иметь место противоположное действие. Кроме того, при применении ADM или антител к ADM решающее значение может иметь дозирование.
В случае других болезней блокирование ADM может оказывать благоприятное действие до определенной степени. Однако полная нейтрализация ADM может также оказывать вредное воздействие, так как определенное количество ADM может требоваться для осуществления некоторых физиологических функций. Во многих публикациях подчеркивается, что введение ADM может быть полезным при некоторых болезнях. В противоположность этому, в других публикациях указывается, что при некоторых обстоятельствах введение ADM может быть опасно для жизни. Известные из существующего уровня техники проблемы можно преодолевать с помощью антител к ADM или фрагментов антител к ADM, или анти-ADM не-Ig каркасов, предлагаемых в настоящем изобретении.
Описание изобретения
Объектом изобретения является антитело к адреномедуллину или фрагмент антитела к ADM, связывающийся с адреномедуллином, или анти-ADM не-Ig каркас, связывающийся с адреномедуллином, предназначенные для применения в качестве лекарственного средства, при этом указанное антитело или указанный фрагмент, или указанный каркас представляет собой не обладающее/не обладающий нейтрализующей активностью антитело или фрагмент, или каркас (не нейтрализующее/не нейтрализующий антитело или фрагмент, или каркас).
Согласно изобретению «антитела» или «фрагменты антител», или «не-Ig каркасы», предлагаемые в изобретении, обладают способностью связываться с ADM и, таким образом, направлены против ADM, поэтому их можно обозначать как «анти-ADM антитела», «анти-ADM фрагменты антител» или «анти-ADM не-Ig каркасы».
В другом варианте осуществления изобретения антитела к ADM, фрагменты антител к ADM или анти-ADM не-Ig каркасы, представленные в настоящем описании, могут связываться с находящимся в кровотоке (циркулирующим) ADM, и, таким образом, направлены против циркулирующего ADM.
В конкретном варианте осуществления изобретения антитело к ADM, фрагмент антитела к ADM или анти-ADM не-Ig каркас представляют собой не нейтрализующее/не нейтрализующий антитело, фрагмент или не-Ig каркас. Нейтрализующее антитело к ADM, фрагмент антитела к ADM или анти-ADM не-Ig каркас может блокировать биологическую активность ADM примерно на 100%, по меньшей мере более чем на 90%, предпочтительно по меньшей мере более чем на 95%.
В противоположность этому не нейтрализующее/не нейтрализующий антитело к ADM, фрагмент антитела к ADM или анти-ADM не-Ig каркас блокирует биологическую активность ADM менее чем на 100%, предпочтительно менее чем на 95%, предпочтительно менее чем на 90%, более предпочтительно менее чем на 80% и еще более предпочтительно менее чем на 50% (относительно основного уровня). Это означает, что остаточная биологическая активность ADM, связанного с не нейтрализующим антителом к ADM, фрагментом антитела к ADM или анти-ADM не-Ig каркасом, должна сохраняться на уровне, превышающем 0%, предпочтительно превышающем 5%, предпочтительно превышающем 10%, более предпочтительно превышающем 20%, более предпочтительно превышающем 50%. Это означает, что блокирование биологической активности ADM составляет не более 80% или не более 50% соответственно, и поэтому должно рассматриваться как ограниченное блокирование биологической активности ADM соответствующим связывающим ADM агентом, таким как антитело к ADM, фрагмент антитела к ADM или анти-ADM не-Ig каркас.
Следует иметь в виду, что указанное ограниченное блокирование биологической активности ADM имеет место даже при избыточной концентрации антитела, фрагмента антитела или не-Ig каркаса, то есть избытка антитела, фрагмента или каркаса относительно ADM. Указанное ограниченное блокирование является свойством, присущим самому связывающему ADM агенту. Это означает, что указанное антитело, указанный фрагмент или каркас обеспечивает максимальное ингибирование, составляющее 80% или 50% соответственно. В приведенном в качестве примера варианте осуществления изобретения указанное антитело к ADM, указанный фрагмент антитела к ADM или указанный анти-ADM не-Ig каркас может блокировать биологическую активность ADM по меньшей мере на 5%. Это означает по смыслу, что сохраняется примерно 95% остаточной биологической активности ADM.
Объектом настоящего изобретения является антитело к адреномедуллину или фрагмент антитела к адреномедуллину, предназначенное/предназначенный для применения при лечении хронического или острого заболевания, где указанное антитело или указанный фрагмент представляет собой
- стабилизирующее ADM антитело или стабилизирующий ADM фрагмент антитела к адреномедуллину, которое/который удлиняет время полуудержания t½ адреномедуллина в сыворотке, крови, плазме по меньшей мере на 10%, предпочтительно по меньшей мере на 50%, более предпочтительно на >50%, наиболее предпочтительно на 100%, и/или
- где указанное антитело или указанный фрагмент антитела к адреномедуллину блокирует биологическую активность ADM менее чем на 80%, предпочтительно менее чем на 50%.
Объектом настоящего изобретения является антитело к адреномедуллину или фрагмент антитела к адреномедуллину, предназначенное/предназначенный для применения при лечении хронического или острого заболевания, где указанное антитело или указанный фрагмент связывается с N-концевой областью (ак 1-21) человеческого адреномедуллина.
Предпочтительным вариантом осуществления настоящего изобретения является антитело к адреномедуллину или фрагмент антитела к адреномедуллину, предназначенное/предназначенный для применения при лечении хронического или острого заболевания, где указанное антитело или указанный фрагмент связывается с N-концом человеческого адреномедуллина.
В этом контексте молекула(ы), представляющая(ие) собой антитело или фрагмент антитела, или не-Ig каркас, которые «не обладают нейтрализующей анти-ADM активностью», для простоты обозначенные в совокупности в настоящем описании как «не нейтрализующее»/«не нейтрализующий» антитело к ADM, фрагмент антитела или не-Ig каркас, которое/который, например, блокирует биологическую активность ADM менее чем на 80%, определяют как
- молекулу или молекулы, связывающуюся(иеся) с ADM, которая(ые) при добавлении в культуру линии эукариотических клеток, экспрессирующих функциональный человеческий рекомбинантный ADM-рецептор, состоящий из CRLR (рецептор, подобный рецептору кальцитонина) и RAMP3 (модифицирующий активность рецептора белок 3), снижает(ют) количество цАМФ, продуцируемого клеточной линией под действием параллельно добавляемого пептида человеческого синтетического ADM, где указанный добавляемый человеческий синтетический ADM вносят в количестве, которое в отсутствии анализируемого не нейтрализующего антитела приводит к стимуляции синтеза цАМФ, составляющей половину от максимальной, где снижение уровня цАМФ указанной(ыми) молекулой(ами), связывающейся(имися) с ADM, достигает уровня, не превышающего 80%, даже в том случае, когда анализируемую(ые) не нейтрализующую(ие) молекулу(ы), связывающуюся(иеся) с ADM, добавляют в количестве, превышающем в 10 раз количество, необходимое для достижения максимального снижения синтеза цАМФ, которое можно получать с помощью анализируемого не нейтрализующего антитела.
Указанное определение применимо и к другим диапазонам: 95%, 90%, 50% и т.д.
Биологическую активность определяют как действие, которое оказывает субстанция на живой организм или ткань или орган или функциональную единицу in vivo или in vitro (например, в анализе) после взаимодействия с ними. В случае определения биологической активности ADM это может быть воздействие ADM в функциональном анализе цАМФ в присутствии человеческого рекомбинантного рецептора адреномедуллина. Таким образом, согласно настоящему изобретению биологическую активность определяют с помощью функционального анализа цАМФ в присутствии рецептора адреномедуллина. Для определения биологической активности ADM с помощью указанного анализа можно осуществлять следующие стадии:
- Получают кривую дозовой зависимости для ADM с использованием функционального анализа цАМФ в присутствии человеческого рекомбинантного рецептора адреномедуллина.
- Можно рассчитывать концентрацию ADM, вызывающую стимуляцию цАМФ, составляющую половину от максимальной.
- При постоянных концентрациях ADM, вызывающих стимуляцию цАМФ, составляющую половину от максимальной, получают кривые дозовой зависимости (применяя конечную концентрацию вплоть до 100 мкг/мл) при применении стабилизирующего ADM антитела или стабилизирующего адреномедуллин фрагмента антитела или стабилизирующего адреномедуллин не-Ig каркаса соответственно.
В этом анализе биологической активности ADM максимальное ингибирование, составляющее 50%, означает, что указанное антитело к ADM или указанный фрагмент антитела к адреномедуллину, или указанный антиадреномодуллиновый не-Ig каркас соответственно блокирует до 50% биологической активности относительно основных уровней. В этом анализе биологической активности ADM максимальное ингибирование, составляющее 80%, означает, что указанное антитело к ADM или указанный фрагмент антитела к адреномедуллину, или указанный антиадреномодуллиновый не-Ig каркас соответственно блокирует до 80% биологической активности. Это подразумевает, что блокирование биологической активности ADM достигает не более 80%. Это означает, что сохраняется примерно 20% остаточной биологической активности ADM.
Однако в настоящем описании и в приведенном выше контексте выражение «блокирует биологическую активность ADM» касательно указанных в настоящем описании антител к ADM, фрагментов антител к ADM и анти-ADM не-Ig каркасов следует понимать только как снижение биологической активности ADM, предпочтительно снижение биологической активности циркулирующего ADM с 100% с сохранением минимум 20% остаточной биологической активности ADM, предпочтительно снижение биологической активности ADM с 100% с сохранением 50% остаточной биологический биологической активности ADM; но в любом случае должен сохраняться такой уровень биологической активности ADM, который можно определять с помощью подробно описанного выше анализа.
Биологическую активность ADM можно определять с помощью функционального анализа цАМФ в присутствии человеческого рекомбинантного рецептора адреномедуллина (биоанализ адреномедуллина), который описан в примере 2.
Антитело к адреномедуллину (ADM) представляет собой антитело, которое специфически связывается с ADM, фрагмент антитела к адреномедуллину представляет собой фрагмент антитела к ADM, при этом указанный фрагмент специфически связывается с ADM. Анти-ADM не-Ig каркас представляет собой не-Ig каркас, который специфически связывается с ADM. Специфическое связывание с ADM допускает связывание также и с другими антигенами. Это означает, что указанная специфичность не должна исключать того, что антитело может давать перекрестную реакцию с другими полипептидами, отличными от тех, к которым оно выработалось. Указанное относится также к специфичности фрагмента антитела к ADM или анти-ADM не-Ig каркаса, предлагаемого в изобретении.
При создании изобретения неожиданного было установлено, что не нейтрализующие антитела к ADM или не нейтрализующие фрагменты антител к ADM, или не нейтрализующие анти-ADM не-Ig каркасы обладают выраженным терапевтическим преимуществом по сравнению с обладающими нейтрализующим действием субстанциями.
Согласно одному из конкретных вариантов осуществления изобретения предпочтительным является применение антитела к ADM или фрагмента антитела к адреномедуллину, или анти-ADM не-Ig каркаса, предлагаемого в настоящем изобретении, если указанное антитело к адреномедуллину или указанный фрагмент антитела к адреномедуллину, или анти-ADM не-Ig каркас представляет собой стабилизирующее ADM антитело или стабилизирующий адреномедуллин фрагмент антитела, или стабилизирующий адреномедуллин не-Ig каркас, которое/который удлиняет время полужизни (t½, т.е. время полуудержания) адреномедуллина в сыворотке, крови, плазме по меньшей мере на 10%, предпочтительно по меньшей мере на 50%, более предпочтительно на >50%, наиболее предпочтительно на >100%.
Время полужизни (время полуудержания) ADM можно определять в человеческой плазме в отсутствии или в присутствии стабилизирующего ADM антитела или стабилизирующего адреномедуллин фрагмента антитела, или стабилизирующего адреномедуллин не-Ig каркаса соответственно, используя иммуноанализ для количественной оценки ADM.
Можно осуществлять следующие стадии:
- ADM можно разводить в человеческой цитратной плазме в отсутствии или в присутствии стабилизирующего ADM антитела или стабилизирующего адреномедуллин фрагмента антитела, или стабилизирующего адреномедуллин не-Ig каркаса соответственно и можно инкубировать при 24°C.
- В выбранные моменты времени (например, в течение периода времени, составляющего 24 ч) отбирают аликвоты и расщепление ADM в указанных аликвотах можно прекращать путем замораживания при -20°C.
- Количество ADM можно определять непосредственно с помощью иммуноанализа hADM, если на выбранный анализ не влияет стабилизирующее антитело. Альтернативно этому, аликвоты можно обрабатывать денатурирующими агентами (типа HCl) и после очистки образца (например, центрифугированием) значение pH можно нейтрализовать и определять количество ADM с помощью иммуноанализа ADM. Альтернативно этому, для количественной оценки ADM можно применять технологии, не основанные на использовании иммуноанализа (например, ОФ-ЖХВР).
- Время полужизни ADM рассчитывают для ADM, инкубированного в отсутствии и присутствии стабилизирующего ADM антитела или стабилизирующего адреномедуллин фрагмента антитела, или стабилизирующего адреномедуллин не-Ig каркаса соответственно.
- Удлинение времени полужизни рассчитывают для стабилизированного ADM в сравнении с ADM, который инкубировали в отсутствии стабилизирующего ADM антитела или стабилизирующего адреномедуллин фрагмента антитела, или стабилизирующего адреномедуллин не-Ig каркаса соответственно.
Двукратное увеличение времени полужизни ADM представляет собой удлинение времени полужизни на 100%.
Время полужизни (время полуудержания) определяют как период, во время которого концентрация конкретного химического соединения или лекарственного средства снижается наполовину по сравнению с исходной концентрацией, определенной в общей воде организма или крови.
Анализ, который можно применять для определения времени полужизни (времени полуудержания) адреномедуллина в сыворотке, крови, плазме, описан в примере 3.
Антитело, предлагаемое в настоящем изобретении, представляет собой белок, включающий один или несколько специфически связывающихся с антигеном полипептидов, которые кодируются в основном генами иммуноглобулинов. Известные гены иммуноглобулинов включают гены константных областей каппа, лямбда, альфа (IgA), гамма (IgG1, IgG2, IgG3, IgG4), дельта (IgD), эпсилон (IgE) и мю (IgM), а также множество генов вариабельных областей иммуноглобулина. Полноразмерные легкие цепи иммуноглобулинов, как правило, имеют молекулярную массу примерно 25 кДа или длину 214 аминокислот. Полноразмерные тяжелые цепи иммуноглобулинов, как правило, имеют молекулярную массу примерно 50 кДа или длину 446 аминокислот. Легкие цепи кодируются геном вариабельной области на NH2-конце (длиной примерно 110 аминокислот) и геном константной области каппа или лямбда на СООН-конце. Аналогично этому, тяжелые цепи кодируются геном вариабельной области (длиной примерно 116 аминокислот) и одним из указанных генов константной области.
Основной структурной единицей антитела, как правило, является тетрамер, который состоит из двух идентичных пар цепей иммуноглобулина, каждая пара включает одну легкую и одну тяжелую цепь. В каждой паре вариабельные области легкой и тяжелой цепи связываются с антигеном, а константные области опосредуют эффекторные функции. Иммуноглобулины могут также находиться в виде широкого разнообразия других форм, включая, например, Fv, Fab и F(ab')2, а также в виде бифункциональных гибридных антител и одноцепочечных антител (см., например, Lanzavecchia и др., Eur. J. Immunol. 17, 1987, с. 105; Huston и др., Proc. Natl. Acad. Sci. U.S.A., 85, 1988, cc. 5879-5883; Bird и др., Science 242, 1988, cc. 423-426; Hood и др., Immunology, Benjamin, N.Y., 2-ое изд., 1984; Hunkapiller и Hood, Nature 323, 1986, cc. 15-16). Вариабельная область легкой или тяжелой цепи иммуноглобулина включает каркасную область, прерывающуюся тремя гипервариабельными участками, которые называют также определяющими комплементарность участками (CDR) (см., Sequences of Proteins of Immunological Interest, E. Kabat и др., изд-во U.S. Department of Health and Human Services, 1983). Как указано выше, за связывание с эпитопом антигена ответственны прежде всего CDR. Иммунный комплекс представляет собой антитело, такое как моноклональное антитело, химерное антитело, гуманизированное антитело или человеческое антитело, или функциональный фрагмент антитела, специфически связанное/связанный с антигеном.
Химерные антитела представляют собой антитела, гены легких и тяжелых цепей которых созданы, как правило, с помощью генной инженерии, из генов вариабельных и константных областей иммуноглобулинов, которые принадлежат различным видам. Например, вариабельные сегменты генов из мышиного моноклонального антитела можно соединять с человеческими константными сегментами, такими как каппа и гамма 1 или гамма 3. Так, в качестве одного из примеров, терапевтическое химерное антитело представляет собой гибридный белок, состоящий из вариабельного или антигенсвязывающего домена из мышиного антитела и константного или эффекторного домена из человеческого антитела, хотя можно применять и другие виды млекопитающих, или вариабельную область можно получать с помощью методик молекулярной биологии. Методы создания химерных антител хорошо известны в данной области (см., например, U.S. №5807715). «Гуманизированный» иммуноглобулин представляет собой иммуноглобулин, включающий человеческую каркасную область и один или несколько CDR из нечеловеческого (например, мышиного, крысиного или синтетического) иммуноглобулина. Нечеловеческий иммуноглобулин, являющийся источником CDR, называют «донором», а человеческий иммуноглобулин, являющийся источником каркасной области, называют «акцептором». В одном из вариантов осуществления изобретения в гуманизированном иммуноглобулине все CDR получают из иммуноглобулина-донора. Присутствие константных областей не является обязательным, но если они имеются, то они должны быть практически идентичны константным областям человеческих иммуноглобулинов, т.е. идентичны по меньшей мере примерно на 85-90%, например, примерно на 95% или более. Таким образом, все части гуманизированного иммуноглобулина, возможно за исключением CDR, практически идентичны соответствующим частям встречающихся в естественных условиях последовательностей человеческого иммуноглобулина. «Гуманизированное антитело» представляет собой антитело, содержащее гуманизированную легкую цепь и гуманизированную тяжелую цепь иммуноглобулина. Гуманизированное антитело связывается с тем же антигеном, что и антитело-донор, которое является источником CDR. Акцепторный каркасный участок гуманизированного иммуноглобулина или антитела может иметь ограниченное количество замен аминокислот, полученных из донорского каркасного участка. Гуманизированные или другие моноклональные антитела могут иметь дополнительные консервативные аминокислотные замены, которые практически не влияют на связывание антигена или другие функции иммуноглобулина. Примерами консервативных замен являются такие замены, как gly, ala; val, ile, leu; asp, glu; asn, gin; ser, thr; lys, arg; и phe, tyr. Гуманизированные иммуноглобулины можно конструировать с помощью технологий генной инженерии (см., например, U.S. №5585089). Человеческое антитело представляет собой антитело, в котором гены легких и тяжелых цепей имеют человеческое происхождение. Человеческие антитела можно создавать с помощью методов, известных в данной области. Человеческие антитела могут продуцироваться иммортализованной человеческой В-клеток, секретирующей представляющее интерес антитело. Иммортализацию можно осуществлять, например, путем заражения EBV или путем слияния человеческой B-клетки с клеткой миеломы или гибридомы с получением клетки триомы. Человеческие антитела можно получать также с помощью методов фагового дисплея (см., например, Dower и др., публикация РСТ WO 91/17271; McCafferty и др., публикация РСТ WO 92/001047; и Winter, публикация РСТ WO 92/20791) или отбирать из человеческой комбинаторной библиотеки моноклональных антител (см. веб сайт Morphosys). Человеческие антитела можно получать также, используя трансгенных животных, которые несут гены человеческого иммуноглобулина (см., например, Lonberg и др., публикация РСТ WO 93/12227; и Kucherlapati, публикация РСТ WO 91/10741).
Таким образом, антитело к ADM может иметь форматы, известные в данной области. Примерами являются человеческие антитела, моноклональные антитела, гуманизированные антитела, химерные антитела, антитела с трансплантированными CDR. В предпочтительном варианте осуществления изобретения антитела, предлагаемые в настоящем изобретении, представляют собой полученные методами рекомбинации антитела, такие как IgG, как правило, полноразмерный иммуноглобулин, или фрагменты антител, содержащие по меньшей мере F-(фрагмент) вариабельного домена тяжелой и/или легкой цепи, например, химические сшитые антитела (антигенсвязывающий фрагмент), включая (но, не ограничиваясь только ими) Fab-фрагменты, в том числе Fab минител (минибоди), антитело в виде одноцепочечного Fab, антитело в виде одновалентного Fab с эпитопными метками, например Fab-V5Sx2; двухвалентный Fab (миниантитело), димеризованный с помощью СН3-домена; двухвалентный Fab или мультивалентный Fab, например, полученный путем мультимеризации с помощью гетерологичного домена, например, путем димеризации dHLX-доменов, например, Fab-dHLX-FSx2; F(ab')2-фрагменты, scFv-фрагменты, мультимеризованные мультивалентные и/или мультиспецифические scFv-фрагменты, двухвалентные и/или биспецифические димерные антитела (диабоди), BITE® (биспецифические, привлекающие Т-клетки антитела, т.е. антитела, связывающиеся одновременно с антигеном клетки-мишени и Т-клеточным антигеном), трехфункциональные антитела, поливалентные антитела, например, из класса, отличного G; однодоменные антитела, например, нанотела (нанободи), выведенные из представителей верблюдовых или рыб иммуноглобулины, и многие другие форматы.
Помимо антител к ADM, в данной области хорошо известны другие биополимерные каркасы, которые образуют комплекс с молекулой-мишенью, и они нашли применение для создания биополимеров, обладающих высокой специфичностью в отношении мишеней. Их примерами являются аптамеры, шпигельмеры, антикалины и конотоксины. Иллюстрации форматов представлены на фиг. 1а, 1б и 1в.
В предпочтительном варианте осуществления изобретения формат антитела к ADM выбирают из группы, включающей Fv-фрагмент, scFv-фрагмент, Fab-фрагмент, scFab-фрагмент, F(ab)2-фрагмент и слитый белок scFv-Fc. В другом предпочтительном варианте осуществления изобретения формат антитела выбирают из группы, включающей scFab-фрагмент, Fab-фрагмент, scFv-фрагмент и их оптимизированные с позиций биодоступности конъюгаты, такие как ПЭГилированные фрагменты. Одним из наиболее предпочтительных форматов является формат scFab.
He-Ig каркасы могут представлять собой белковые каркасы и их можно применять в качестве миметиков антител, поскольку они обладают способностью связываться с лигандами или антигенами. He-Ig каркасы можно выбирать из группы, включающей не-Ig каркасы на основе тетранектина (например, описанные в US 2010/0028995), фибронектиновые каркасы (например, описанные в EP 1266025); каркасы на основе липокалина (например, описанные в WO 2011/154420); убикитиновые каркасы (например, описанные в WO 2011/073214), трансферриновые каркасы (например, описанные в US 2004/0023334), каркасы на основе белка A (например, описанные в EP 2231860), каркасы на основе анкириновых повторов каркасы (например, описанные в WO 2010/060748), каркасы на основе микропротеинов (предпочтительно микропротеинов, образующие «цистиновый узел») (например, описанные в EP 2314308), каркасы на о