Производные ингенола, применяемые для лечения рака
Иллюстрации
Показать всеИзобретение относится к фармацевтической композиции для лечения рака, причем она содержит одно из соединений формулы I, где А представляет собой СН3- или СН2=СН-, и В представляет собой -СН=СН-, [-CH2-]х или [CH2-]у, где х является целым числом от 1 до 10, где у является целым числом от 1 до 10, при условии, что: если А представляет собой СН3-, В представляет собой [-CH2-]Х; если А представляет собой СН2=СН-, В представляет собой [-CH2-]у, в эффективном количестве и один или более фармацевтически приемлемых наполнителей. 3 н. и 8 з.п. ф-лы, 9 ил., 4 пр.
(I)
Реферат
Область техники
Настоящее изобретение относится, в общем, к новым производным ингенола, применяемым в лечении рака. В других аспектах настоящее изобретение относится к фармацевтической композиции, лекарственному средству, применению, способу лечения рака и лекарственной форме.
Уровень техники
Рак является общим наименованием, данным группе, включающей более чем 100 болезней, которые характеризуются, в общем, неупорядоченным ростом клеток, которые вторгаются в ткани и органы и которые могут распространиться в другие области тела, что называется метастазирование.
Различные типы рака соответствуют различным типам клеток организма. Например, существуют несколько типов рака кожи, поскольку кожа включает более одного типа клеток. Если рак начинается в эпителиальных тканях, таких как кожа или слизистые оболочки, он называется карцинома. Если он начинается в соединительных тканях, таких как кости, мышцы, или хрящи, его называют саркома. Другие характеристики, которые отличают один тип рака от других, включают скорость размножения клеток и их способность вторгаться в ткани и органы, расположенные рядом или на отдалении от очага.
Трудность эффективного лечения рака состоит в установлении различий между злокачественными и нормальными клетками в организме. Оба типа происходят из одного источника и очень похожи, и поэтому практически не распознаются иммунной системой как угроза. В настоящее время рак можно лечить с помощью хирургии, химиотерапии, лучевой и иммунотерапии (терапия моноклональными антителами). Выбор метода лечения зависит от расположения, степени злокачественности опухоли и стадии заболевания, а также общего состояния здоровья пациента. Полное удаление опухоли без повреждения остального организма является основной целью лечения. Иногда это может быть достигнуто путем операции, но склонность заболевания к внедрению в соседние ткани или распространению в отдаленные места (метастазы) часто ограничивает его эффективность. Эффективность химиотерапии, в большинстве случаев, ограничивается ее токсичностью для других тканей (клеток) организма, то же относится к лучевой терапии, которая также может повреждать нормальные ткани. В иммунотерапии канцерогенные клетки вырабатывают механизмы избегания иммунного ответа, явление, известное как устойчивость к лечению.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Цифры, описанные ниже, относятся к значениям IC50, полученного при обработке колоний опухолевых клеток человека соединениями в соответствии с данным изобретением.
ФИГ. 1 – колонии клеток HB4А, MDA-MB-231, MDA-MB-468, BT20, HT587T, MCF7 и MCF7/AZ, относящиеся к раку молочной железы.
ФИГ. 2 - колонии клеток SW480, SW620, CO115, HCT15, HT29, SK-CO-10, DLD1, LOVO, DIFI и Caco2, относящиеся к раку ободочной и прямой кишки.
ФИГ. 3 – колонии клеток JHU28, JHU13, JHU12, N13, SCC25, SCC4, SCC14 и FADU, относящиеся к раку шеи и головы.
ФИГ. 4 - колонии клеток H292 и A549, относящиеся к раку легких; колонии клеток GRM, COLO858, COLO679, A375, WN1617, WN9, WMM852, WN793 и SKMEL37, относящиеся к меланоме; колония клеток A431m, относящаяся к плоскоклеточному раку; и колонии клеток DAOY и ONS76, относящиеся к гранулобластоме;
ФИГ. 5 - колонии клеток PC-3 LNCaP и PNT2, относящиеся к раку предстательной железы; колонии клеток T24, 5637, HT1376 и MCR, относящиеся к раку мочевого пузыря; колония клеток JEG3, относящаяся к хориокарциноме; колонии клеток SIHA, CASKI, C33 и HELA, относящиеся к раку шейки матки.
ФИГ. 6 - колонии клеток KYSE30, KYSE70, KYSE279 и KYSE410, относящиеся к раку пищевода; колонии клеток MiaPaCa-2, PANC1, PSN-1 и BXPC-3, относящиеся к раку поджелудочной железы.
ФИГ. 7 - колонии клеток U87-MG, U373, U251, GAMG, SW1088, SW1783, NHA, SNB19, RES186, RES259, KNS42, UW479 и SF188, относящиеся к глиоме.
ФИГ. 8 - колония клеток Jurkat, или лейкоза, и колонии клеток PA-1 и SW626, относящиеся к раку яичников.
ФИГ. 9 - некоторые колонии раковых клеток, по сравнению с величиной, полученной с соединением темозоломида (обозначен как TMZ), препарата, используемого для лечения рака мозга.
Подробное описание изобретения
Поиск новых способов лечения рака представляет собой постоянно развивающийся процесс, и в этой динамике разрабатываются новые активные вещества, применяемые в лечении рака, в сочетании с низкой токсичностью.
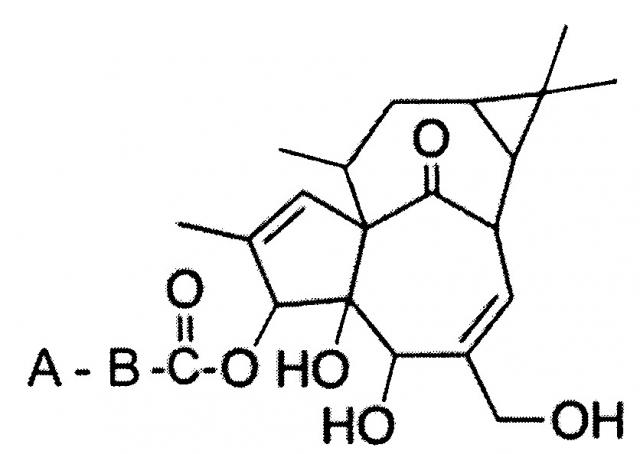
В первом аспекте, настоящее изобретение относится к соединениям, полученным из ингенола, формулы I
Формула I
где
А представляет собой фенил, СН3- или СН2=СН-,
и В представляет собой -СН=СН-, [-CH2-]х или [CH2-]у,
где х является целым числом от 1 до 10, предпочтительно, от 2 до 6, и у является целым числом от 1 до 10, предпочтительно от 8 до 10,
при условии, что:
если А представляет собой фенил, В представляет собой -СН=СН-;
если А представляет собой СН3-, В представляет собой [-CH2-]Х;
если А представляет собой СН2=СН-, В представляет собой [-CH2-]у
для лечения рака.
В частности, и без исключения других вариантов, производные ингенола в соответствии с данным изобретением подходят для лечения рака молочной железы, рака прямой и ободочной кишки, рака головы и шеи, рака головного мозга (например, глиомы и гранулобластомы), рака предстательной железы, рака мочевого пузыря, хориокарциномы, рака шейки матки, лейкоза, рака кожи (например, плоскоклеточного рака и меланомы), рака пищевода, рака поджелудочной железы и рака яичников.
Конкретные примеры производных ингенола, подходящих в соответствии с данным изобретением, в не ограничивающем смысле, включают:
3-циннамилингенол
3-гексаноилингенол
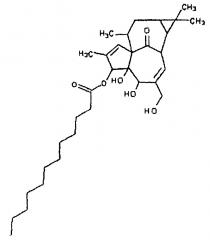
3-додеканоилингенол
3-додека-11-еноилингенол
Продукты, полученные в соответствии с данным изобретением, особенно те, которые показаны выше, отличаются тем, что обладают низким потенциалом к образованию токсичных продуктов разложения после метаболизма.
Формула I включает изомеры структур, изображенных здесь, а также их фармацевтически активные производные, например, соли, пролекарства, метаболиты, кристаллы, гидраты и сольваты.
Фармацевтически активными производными являются те, которые обычно демонстрируют поведение, совпадающее с поведением свободной основной молекулы.
Фармацевтически приемлемые соли соединений формулы I включены в фармацевтически активные производные. Конкретный противоион, который является частью любой соли соединения в соответствии с данным изобретением, как правило, не является критическим, при условии, что соль в целом является фармакологически приемлемой, и при условии, что противоион не придает нежелательных свойств соли в целом.
Не исключая другие варианты, кислотно-аддитивные соли могут быть указаны в качестве фармацевтически приемлемых солей, таких как неорганические соли, например, хлористоводородной, бромистоводородной, серной, азотной и фосфорной кислоты, или органические соли, например, уксусной, пропионовой, гексановой, гептановой, гликолевой, пировиноградной, молочной, малоновой, ятарной, яблочной, малеиновой, фумаровой, винной, лимонной, бензойной, коричной, метансульфоновой, п-хлорбензолсульфоновой, 2-нафталинсульфоновой, п-толуолсульфоновой, камфорсульфоновой, триметилуксусной, трет-бутилуксусной, лаурилсерной, глюконовой, глутаровой, гидроксинафтойной, салициловой, стеариновой, муконовой, миндальной и 2-гидроксиэтансульфоновой кислот.
Не исключая другие варианты, основно-аддитивные соли могут быть указаны в качестве фармацевтически приемлемых солей, такие как соли аммония, соли щелочных металлов, таких как натрий, калий, литий, кальций или магний, соли с органическими основаниями, такие как соли первичных, вторичных или третичных аминов (например, изопропиламин, триметиламин, диэтиламин, триизопропиламин, три-н-пропиламин, этаноламин, 2-диметиламиноэтанолы, трометамин, дициклогексиламин, N-метил-D-глюкамин и соли с аминокислотами, такими как аргинин, лизин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, этилендиамин, глюкозамин, теобромин, пурин, морфолин, и т.д. В некоторых возможных вариантах, азотсодержащие основные группы могут быть кватернизованы агентами алкилгалогенидного типа, такими как хлориды, бромиды и иодиды метила, этила, пропила или бутила; длинноцепочечные галогениды, такие как хлориды, бромиды и йодиды децила, лаурила, миристила и стеарила.
Производные ингенола в соответствии с данным изобретением могут быть получены различными методами, известными специалисту в данной области техники, синтетическими или полусинтетическими способами, например, из растительного сырья (такого как активная фракция, получаемая при хроматографическом разделении бутанольного экстракта из латекса Euphorbia tirucalli L., описанный в заявке на международный патент WO2007000618) или из любого другого подходящего сырья, например, свободного основания ингенола, терпенов и т.д.
В другом аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим одно или несколько соединений формулы I и один или более фармацевтически приемлемых наполнителей. Термин «фармацевтически приемлемые наполнители» относятся к инертным веществам, применяемым в фармацевтических композициях в качестве разбавителей, носителей или добавок, которые сами по себе не обладают лекарственной активностью. Следующие публикации могут быть приведены в качестве источников информации об этих наполнителях: "Remington: The Science and Practice of Pharmacy", 20th Edition or later, Lippincott, Williams and Wilkins Publishing House; "Pharmaceutical Dosage Forms and Drug Delivery Systems (1999) H.C. Ansel et al., 7th ed., Lippincott, Williams and Wilkins Publishing House; "Handbook of Pharmaceutical Excipients" (2000) A. H. Kibbe et al, 3th edition, American Pharmaceutical Association Publishing House.
Производные ингенола в соответствии с данным изобретением и композиции, содержащие их, могут быть введены человеку или животному (не человеку) любым подходящим способом, например перорально, парентерально, внутривенно, внутриартериально, внутрибрюшинно, трансдермально, подъязычно, ректально, внутримышечно, трансбуккально, интраназально, липосомально, ингаляциями, вагинально, подкожно, внутрь жировой ткани, внутриглазно, внутрисуставно или интратекально, с применением катетера или стента, и т.д.
Не существует конкретных ограничений в лекарственных формах, содержащих производные ингенола в соответствии с данным изобретением. Например, для твердого перорального введения могут быть использованы таблетки, пастилки, капсулы, гранулы, пилюли и тому подобное. Для жидкого перорального введения применяют растворы, дисперсии, суспензии, эмульсии, масла и т.д. Другие подходящие лекарственные формы включают липосомы и наночастицы, или любую другую форму, известную специалисту в данной области. Лекарственная форма может быть с немедленным, длительным или контролируемым высвобождением.
Термин «липосом» означает маленькие везикулы, состоящие из одного или более концентрических фосфолипидных бислоев, которые спонтанно размещают себя в водной среде. Они могут применяться в качестве медицинских систем с контролируемым выделением. Липосомы могут защищать активные вещества от химического, физического и ферментного разложения, способны повышать концентрацию лекарственного средства в целевом месте, могут применяться в качестве не токсичных наполнителей для солюбилизации гидрофобных лекарственных средств и могут продлевать срок действия везикулы и лекарственного средства в кровотоке, оказывая положительное действие на характеристики фармакокинетики и токсичности активного вещества.
Термин «наночастицы» означают ультрамелкие частицы, обычно от 1 до 100 нанометров в диаметре, которые могут инкапсулировать или защищать активные вещества или лекарственные средства, и потенциально представляют предпочтительные свойства при применении в системе с контролируемым выделением лекарственного средства. Наночастицы могут защищать активное вещество от химического, физического или ферментного разложения, способны повышать концентрацию лекарственного средства в целевом месте, могут применяться в качестве не токсичных наполнителей для солюбилизации гидрофобных лекарственных средств и могут продлевать срок действия везикулы и лекарственного средства в кровотоке, оказывая положительное действие на характеристики фармакокинетики и токсичности активного вещества.
В конкретном аспекте, композиция в соответствии с данным изобретением содержит, помимо одного или более производных ингенола формулы I, по крайней мере, одно дополнительное активное вещество, отличное от него, например, выбранное из противоопухолевого агента, антиретровирусного агента, антибиотика, противоопухолевого агента, противокашлевого агента, неврологического агента, противодиабетического агента, антигипертензивного агента, ингибиторов протонного насоса, и т.д.
Выражение «активное вещество» означает биологически активное вещество.
В другом аспекте настоящее изобретение относится к лекарственному средству, содержащему одно или более производных ингенола формулы I.
В другом аспекте настоящее изобретение относится к применению одного или более производных ингенола формулы I в приготовлении продукта, применяемого для лечения рака. В еще одном конкретном аспекте, данное изобретение относится к способу лечения рака, отличающемуся тем, что одно или более производных ингенола формулы I вводят пациенту, как таковое или в виде композиции.
В еще одном конкретном аспекте, настоящее изобретение относится к использованию одного или более производных ингенола формулы I для лечения рака.
В еще одном конкретном аспекте, данное изобретение относится к лекарственной форме для лечения рака отличающейся тем, что она содержит от 0,01 до 5000 мг одного или более производных ингенола формулы I по пункту 1. Подходящая доза для лечения, в соответствии с данным изобретением, может вводиться один или несколько раз в течение периода времени.
Примеры
Ниже приведены конкретные примеры вариантов осуществления изобретения, относящихся к некоторым производным ингенола, без какого-либо ограничения данного изобретения только этими примерами.
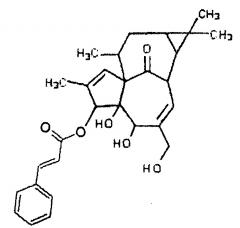
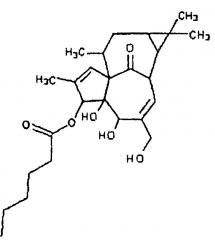
В представленных ниже примерах применяют следующие производные ингенола формулы I, показанные ниже, обозначенные здесь как ингенол A, ингенол В и ингенол С, для простоты. Необходимо отметить, что имеются указания на стерео пространственную конформацию для каждого соединения.
ИНГЕНОЛ А
ИНГЕНОЛ В
ИНГЕНОЛ С
Пример 1
Различные колонии клеток рака тестируют in vitro – тест описан ниже - чтобы определить 50% ингибирующую концентрацию (IC50), которая представляет собой концентрацию, необходимую для ингибирования 50% активности клетки, в мкм (микромолях).
Подготовка клеток, используемых в тестах
Тестируемые раковые клетки выращивают в среде DEMEM (модифицированной по Дульбекко среде Игла) или среде RPMI (Roswell Park Memorial Institute) 1640, обе которые поставляются американской компанией Life Technologies, с добавлением 10% фетальной бычьей сыворотки (Life Technologies) и 1% пенициллина/стрептомицина (Life Technologies) в культуральных флаконах 25 или 75 см2 из полиэтилена, или в культуральных планшетах, со средней плотностью 1×106 при 37°С, 5% CO2 и 90% влажности, до достижения конфлюэнтности. После конфлюэнтности, клетки трипсинизируют (0,05% раствор трипсина/0,53 мМ ЭДТК – продукт TripLE Express, Life Technologies), высевают и выдерживают в условиях, описанных выше, для следующих испытаний.
Определение IC50
Анализ жизнеспособности клеток в водном растворе используют для этого определения, с использованием продукта "Cell Titer 96 Aqueous One Solution Cell Proliferation Assay" от американской компании Promega, описанного производителем в качестве колориметрического способа для определения количества жизнеспособных клеток в исследованиях пролиферации или цитотоксичности. CellTiter 96 содержит соединение тетразолия, [(3-(4,5-диметил-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2Н-тетразолий, внутреннюю соль; MTS] и реагент электронной связи (этосульфат феназина; PES). PES имеет улучшенную химическую стабильность, что позволяет сочетать его с MTS с получением раствора со стабильным цветом. Поглощение, измеренное для различных тестируемых и контрольных образцов, позволяет определить, одинаковое ли количество живых клеток в каждом образце. Для этого анализа, 3-5×103 клеток высевают в 96-луночные планшеты, в трех экземплярах, и туда добавляют разведения соединений в соответствии с данным изобретением (0; 2,5; 5; 7,5; 10 и 20 мкМ - разведены в ДМСО - диметилсульфоксиде). Разведение соединений проводят таким образом, чтобы клетки подвергались только 1% ДМСО/лунку. Оптическую плотность измеряют с помощью планшетного ридера ELISA (оборудование Flash Varioskan от американской компании Thermo Scientific) при 490 нм через 72 часов лечения. Данные собирают и нормализуют по отношению к средней выживаемости образцов, обработанных только ДМСО (считаются 100% жизнеспособностью). Эксперименты проводят в экспериментальных и биологических трех экземплярах.
Результаты значений оптической плотности преобразуют в процент жизнеспособности клеток, где клетки в присутствии носителя (ДМСО) используют в качестве контроля, соответствующего 100% выживаемости. Анализ нелинейной регрессии с использованием программы GraphPad Prism (от американской компании GraphPad Software) проводят на основании результатов жизнеспособности, что дает уравнение, используемое для расчета концентрации вещества, требуемой для получения 50% снижения жизнеспособности клеток (IC50).
Как можно видеть на ФИГ. 1-8, производные ингенола в соответствии с данным изобретением обладают противоопухолевой активностью, продемонстрированной в in vitro тестах IC50 (50% максимальной ингибирующей концентрации) для большого диапазона колоний раковых клеток.
Как можно видеть на ФИГ. 9, продукты из тестов, проведенных с производными ингенола в соответствии с данным изобретением, по сравнению с темозоломидом, противоопухолевым продуктом, используемым в клинической онкологии для лечения рака головного мозга, являются более мощными и эффективными.
Пример 2
Способ получения ингенола из активной фракции, полученной хроматографическим разделением латексного бутанольного экстракта из Euphorbia tirucalli L. (далее ингенольный пул), описанного в заявке на международный патент WO 2007000618.
Реакцию гидролиза проводят с 18 г ингенольного пула, элюированного в 300 мл метанола и 6 мл метоксида натрия. Реакцию отслеживают ВЭЖХ каждые 30 минут при 214 и 290 нм в колонке YMC Pro C18, 4,6×50 мм, 3 мкм, с градиентом А-В 5-70% за 7 минут, при 1,5 мл/мин. Растворители: растворитель А – 0,1% ТФК в воде, растворитель В – 0,08% ТФК в ацетонитриле.
Реакционную смесь нейтрализуют 1 мл ледяной уксусной кислоты. Последующую очистку проводят в 75% растворе этилацетата в гептане, применяемом в флэш-колонке, содержащей 300 г двуокиси кремния. Колонку уравновешивают тем же растворителем. Ингенол элюируют в 100 г этилацетата. Элюирование отслеживают с помощью УФ определителя при 290 нм. Объединенные фракции выпаривают.
Пример 3
Получение промежуточного соединения ингенол-5,20-ацетонида для защиты гидроксильных групп 5 и 20
Реакцию проводят для получения ацетонида ингенола в 7,34 г гидролизованного ингенола из примера 2 (1,00 эквив.; 21,1 ммоль), элюированного в 250 мл ацетона (34,1 объемн. эквив.) с 76,0 мг (1S)-(+)-10-камфорсульфоновой кислоте (С2107; 0,0104 масс. эквив.; 99%). Реакцию отслеживают ВЭЖХ каждые 15 минут при 214 и 290 нм в колонке YMC Pro C18, 4,6×50 мм, 3 мкм, с градиентом А-В 5-70% за 7 минут, при 1,5 мл/мин. Растворители: растворитель А – 0,1% ТФК в воде, растворитель В – 0,08% ТФК в ацетонитриле. Через 1,5 часа реакции определяют 78% ацетонида 5,20-ингенола и 9,8% ингенола. Реакцию нейтрализуют 140 мкл триэтиламина (47,9 мЭкв.; 1,01 ммоль). Очистку ацетонида 5,20-ингенола проводят выпариванием при 35°С/30'/10 Торр, затем кристаллизуют из толуола.
Пример 4
Эстерификацию 5,20 ацетонида из примера 3 проводят через снятие защиты с полученного промежуточного соединения, с получением 3-додеканоата ингенола (ингенол С).
Ингенолы А и В, указанные выше, как известно специалисту в данной области техники, могут быть получены по методике, такой же как описана в этом примере, с применением, вместо додекановой кислоты, коричного ангидрида или кислоты (для ингенола А) и капроновой кислоты или ангидрида (для ингенола В).
Эстерификация
3,60 г ацетонида 5,20-ингенола (1,00 эквив.; 9,27 ммоль), полученного в примере 3, элюируют в 80 мл ацетонитрила (22,2 объемн. эквив.) с 4,17 г додекановой кислоты (1,50 эквив.; 13,9 ммоль), и 4,53 г карбоната цезия (1,50 эквив.; 13,9 ммоль).
Реакцию отслеживают ВЭЖХ каждые 15 минут при 214 и 290 нм на колонке YMC Pro C18, 4,6×50 мм, 3 мкм, с градиентом А-В 5-70% за 7 минут, при 1,5 мл/мин. Растворители: растворитель А – 0,1% ТФК в воде, растворитель В – 0,08% ТФК в ацетонитриле.
Полученное промежуточное соединение, 5,20-изопропилиденингенол-3-додеканоат, затем экстрагируют и очищают.
Проводят экстрагирование продукта этой стадии синтеза в дихлорметане и воде. Органическую фазу сушат с сульфатом магния и выпаривают при 35°С/30'/10 Торр. Затем очищают солюбилизацией в 5% этилацетате в гептане, с последующим помещением в флэш-колонку, содержащую 80 г двуокиси кремния. Колонку уравновешивают тем же растворителем. Затем колонку промывают 5% этилацетатом в гептане. Промежуточное соединение, 5,20-изопропилиденингенол-3-додеканоат элюируют в 10% этилацетате в гептане. Элюирование отслеживают ВЭЖХ с УФ определителем при 290 нм. Объединенные фракции выпаривают при 35°С/30'/10 Торр.
Снятие защиты
Для снятия защиты с промежуточного соединения 4,90 г 5,20-изопропилиденингенол-3-додеканоата (1,00 эквив., 8,29 ммоль; 96%) элюируют в 80 мл метаноле (19,9 объемн. эквив.) с 4,60 мл 1N хлористоводородной кислоты (1 М; 0,555 эквив.; 4,60 ммоль). Затем проводят экстрагирование толуолом и водой. Органическую фазу сушат с сульфатом магния и выпаривают при 35°С/30'/10 Торр.
3-Додеканоат ингенола получают с чистотой практически 97%.
Специалист в данной области техники легко оценит, с помощью изложенных здесь идей, преимущества настоящего изобретения, и будет знать, как предложить модификации и эквивалентные альтернативы вариантам, которые не описаны, не выходя за объем данного изобретения, определенный в формуле изобретения.
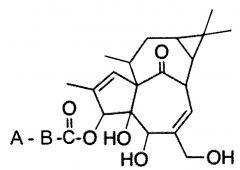
1. Фармацевтическая композиция для лечения рака, отличающаяся тем, что она содержит одно из соединений формулы I
Формула I
где
А представляет собой СН3- или СН2=СН-, и В представляет собой -СН=СН-, [-CH2-]х или [CH2-]у,
где х является целым числом от 1 до 10,
где у является целым числом от 1 до 10,
при условии, что:
если А представляет собой СН3-, В представляет собой [-CH2-]Х;
если А представляет собой СН2=СН-, В представляет собой [-CH2-]у,
в эффективном количестве и один или более фармацевтически приемлемых наполнителей.
2. Фармацевтическая композиция по п. 1, отличающаяся тем, что раком является рак молочной железы, рак толстой и ободочной кишки, рак головы и шеи, рак мозга, рак предстательной железы, хориокарцинома, рак шейки матки, лейкемия, рак кожи, рак легких, рак пищевода, рак поджелудочной железы, рак мочевого пузыря или рак яичников.
3. Фармацевтическая композиция по п. 1, отличающаяся тем, что значение х варьируется от 2 до 6 и значение у варьируется от 8 до 10.
4. Фармацевтическая композиция по п. 1, отличающаяся тем, что соединения формулы (I) являются одним или более из 3-гексаноилингенола, 3-додеканоилингенола или 3-додека-11-еноилингенола.
5. Фармацевтическая композиция по п. 1, отличающаяся тем, что соединения формулы (1) являются изомерами, метаболитами, кристаллами, гидратами, сольватами или фармацевтически приемлемыми солями соединения формулы I.
6. Фармацевтическая композиция по п. 1, отличающаяся тем, что соединения формулы (1) включают одну из следующих структур:
или
7. Фармацевтическая композиция по п. 1, отличающаяся тем, что она содержит по крайней мере один дополнительный активный компонент, отличный от соединения формулы I.
8. Фармацевтическая композиция по п. 7, отличающаяся тем, что указанный по крайней мере один дополнительный активный ингредиент выбирают из противоопухолевого агента, антиретровирусного агента, антибиотика, противокашлевого агента, неврологически активного агента, антидиабетического агента, гипотензивного агента и ингибиторов протонного насоса.
9. Фармацевтическая композиция по п. 1, представленная в виде дозированной лекарственной формы, содержащая от 0,01 до 5000 мг одного или более соединений формулы I.
10. Способ лечения рака, отличающийся тем, что он включает введение пациенту, нуждающемуся в таком лечении, композиции по любому из п. 1-9.
11. Применение фармацевтической композиции по любому из п. 1–9 для лечения рака.