Циклические ортоэфиры в качестве топливной присадки
Иллюстрации
Показать всеИзобретение относится к жидким углеводородам, содержащим обезвоживающий ингибитор обледенения, выбранный из формулы I, солей или смесей этого, где: R1 выбран из незамещенной, разветвленной или линейной С1-С6-алкильной или простой эфирной группы; R2 выбран независимо из незамещенного, линейного или разветвленного С1-С7-алкила; Y выбран независимо и представляет собой незамещенный алкил; y представляет собой целое число от 1 до 3. Жидкий углеводород представляет собой авиационное топливо, бензин, дизельное топливо или топочный мазут. Изобретение также относится к способу ингибирования образования кристаллов льда в жидком углеводороде и применению соединения III, где: R1 выбран из незамещенной, разветвленной или линейной С1-С6-алкильной или простой эфирной группы; R2 выбран из незамещенного, линейного или разветвленного С1-С7-алкила; R5 и R7 представляют собой водород; R6 и R8 представляют собой метил, и где R6 и R8 могут находиться в цис- или транс-положении относительно друг друга; в качестве обезвоживающего ингибитора обледенения. 3 н. и 16 з.п. ф-лы, 8 ил., 5 табл.
Реферат
Область техники, к которой относится изобретение
Данное изобретение относится к жидким углеводородам, таким как углеводородные топлива, гидравлические жидкости, смазочные масла или растворители, содержащим обезвоживающие ингибиторы обледенения в виде циклических ортоэфиров. Углеводородные топлива включают в себя авиационные топлива. Предлагаются также способы ингибирования образования ледяных кристаллов и соединения, замедляющие образование льда.
Уровень техники
В данном контексте растворимость воды относится к максимальному количеству воды, которое может растворяться в любом данном количестве углеводородов при определенной температуре и влажности воздуха; эта величина сильно зависит от химического состава самого топлива [1, 2].
Растворенная вода часто является обычным компонентом жидких углеводородов и испаряется при сгорании углеводородных топлив. Однако свободная вода может замерзать и блокировать линии подачи топлива или другие питающие линии. Вода может также поддерживать микробный рост и вносить свой вклад в коррозию. Поэтому существует необходимость удаления воды или снижения степени образования ледяных кристаллов в жидких углеводородах.
Существует потребность в идентификации кинетически быстродействующих, липофильных поглотителей воды, которые при гидролизе могут образовывать гидрофильные ингибиторы обледенения.
Авиационные турбинные топлива в большинстве случаев являются прямогонными дистиллятами сырой нефти, и их состав включает в себя 99-99,5 об. % углеводородов, при этом остальная часть в виде гетероорганических компонентов содержит элементы S, О и N. Реактивное топливо представляет собой смесь большого количества различных углеводородов; большинство их можно разделить на три широких класса: парафины (или алканы), нафтены (или циклоалканы), и ароматические соединения (или алкилбензолы) [1, 3, 4]. Соотношения между тремя указанными классами варьируются в зависимости от источника сырой нефти, из которого получают топливо, и процесса нефтепереработки. Содержание ароматики ограничено 25% об./об. [5]. Возникновение электростатического притяжения между водой и π-ароматическими системами обусловливает повышенную растворимость воды в алкилбензолах по сравнению и с парафинами и с нафтенами [4].
Для защиты реактивного топлива от загрязнения водой в авиационной промышленности используют как техническое оборудование, так и процедуры контроля качества [1]. Однако даже если реактивное топливо поступает в топливный бак без воды, это не предотвращает ее образования.
Действительно, присутствующая в топливе растворенная вода будет осаждаться из раствора в виде микрокапель при понижении температуры топлива в течение суточных циклов или в ходе работы по мере набора высоты воздушным судном [6, 7]. Растворимость воды в топливе уменьшается приблизительно на 2 ч/млн (об.) в расчете на 1°C. Например, изменение температуры от 20 до -10°C приводит к образованию приблизительно 29 ч/млн (об.) растворенной воды, выделяющейся в свободном состоянии, что в 100 тоннах топлива составляет до 3,62 литра свободной воды.
Второй источник свободной воды в топливных баках возникает вследствие конденсации атмосферной влаги. По мере расходования топлива воздух втягивается в топливные баки через вентиляционную систему; влага воздуха конденсируется при контакте с холодным топливом и поверхностями бака в конце длительного полета [8]. Свободная вода может вызывать недостаточную подачу топлива к двигателям, поддерживать рост микробов, способствовать коррозии и, кроме того, замораживаться в воздушном судне с риском закупоривания фильтров. В промышленности разработано оборудование и процедуры для смягчения указанных проблем, но задачи, требующие решения, остаются [1, 3].
В авиационной промышленности используют большое разнообразие присадок для противодействия проявлению отрицательного влияния свободной воды. С целью предотвращения роста микробов добавляют биоциды, для защиты от коррозии стальных баков и трубопроводов, не имеющих покрытия, и улучшения смазочных свойств топлив используют ингибиторы коррозии, а для замедления образования льда добавляют ингибиторы обледенения топливной системы (FSII).
Так как монометиловый эфир этиленгликоля (EGME) был запрещен из-за его токсичности для людей и окружающей среды, единственным ингибитором FSII, одобренным в настоящее время для топлив Jet A, Jet A-I и топлив для военных целей, является монометиловый эфир диэтиленгликоля (di-EGME) [1, 5]. Ингибиторы FSII представляют собой гидрофильные вещества, растворяющиеся в любой образующейся свободной воде, нарушающие систему водородных связей, ответственных за молекулярное упорядочение, и понижающие таким образом температуру замерзания жидкости путем предотвращения кристаллизации [3]. Концентрация di-EGME должна находиться в диапазоне 0,10-0,15% об./об. [1, 5]. Автор Trohalaki и др. обнаружили, что при указанных концентрациях вода (0,007 об. %) в реактивном топливе замерзает ниже -36°C [9]. Было также показано, что di-EGME является эффективным сдерживающим средством для роста микробов [1].
В авиационной промышленности обнаружилось несколько проблем, связанных с взаимодействием между ингибитором FSII и «влажным» топливом, которое в действительности может отрицательно сказываться на защите топлива.
- В дополнение к гидрофильности, ингибитор di-EGME является также гигроскопичным - это дополнительное свойство является причиной захвата атмосферной воды при осуществлении операций составления смесей, что оказывает влияние на ее растворимость в топливе.
- Ингибитор di-EGME характеризуется очень высоким соотношением распределения вода-топливо: он предпочтительно растворяется в воде. Это приводит к образованию более плотных водных слоев, отделяющихся под действием силы тяжести, с концентрацией di-EGME до 40-50 масс. %. Если его не восполнять, реактивное топливо по существу "лишается" защиты от обледенения.
- Наличие di-EGME в воде, содержащейся в топливе, изменяет межфазные свойства, и может ухудшать эксплуатационные характеристики фильтров и мониторов. В частности, может снижаться эффективность разделения в системе фильтр/коагуляторы [8].
Кроме того, ингибиторы FSII токсичны при концентрациях, необходимых для эффективного предотвращения обледенения. «Водяные подушки», сливаемые из баков хранения, отстойников топливной системы и фильтров, неизбежно содержат di-EGME в более высокой концентрации, создавая проблемы при обращении с указанными отходами и их уничтожении [10]. Ингибиторы FSII оказывают лишь слегка раздражающее действие, однако они быстро впитываются кожей. Пары могут вызывать раздражение глаз и дыхательной системы. Долгосрочные последствия включают в себя повреждение центральной нервной системы, крови, кожи, глаз и почек [11]. Ингибитор di-EGME способен подвергаться биологическому разложению в системе очистки сточных вод; однако концентрации, обнаруженные в водяных подушках, могут оказаться высокими и достаточными для нарушения микробиологического процесса. Высокое потребление кислорода, необходимое при разложении, приводит к меньшей доступности кислорода в окружающей среде для живущих в воде организмов [12].
Жидкие углеводороды, такие как авиационные топлива, сопряжены с рядом проблем при подборе водопоглощающих соединений, подлежащих использованию в качестве обезвоживающих ингибиторов обледенения.
Авиационное турбинное топливо представляет собой смесь тысяч органических соединений; поэтому крайне важно, чтобы выбранный поглотитель реагировал исключительно с водой, которая, как известно, является слабым нуклеофилом. Авторы данного изобретения идентифицировали продукты присоединения спирта к альдегидам и кетонам (например, ацетали, полуацетали, кетали, полукетали и ортоэфир) как потенциально обладающие соответствующими уровнями селективности и стабильности для целей изобретения.
Важный фактор заключается в том, чтобы данное соединение было горючим, поскольку и поглотитель, и побочные продукты должны легко сгорать и не оставлять никакого остатка.
Так как молекула воды относительно невелика (молекулярная масса MM = 18 г/моль), для обезвоживания реактивного топлива, при условии, что стехиометрия реакции 1:1, требуется относительно большое число реагирующих молей поглотителя. В указанном выше примере 3,62 л свободной воды требуют примерно 200 моль поглотителя. Поэтому важно обеспечивать, чтобы MM предполагаемого поглотителя была как можно ниже, или чтобы поглотитель обладал множественными реакционными центрами (более высокая стехиометрия реакции).
Селективный поглотитель, способный переключаться (т.е. включение/выключение), может храниться без разложения (выключение), но при этом активироваться (включение) при смешивании с топливом. Это наилучшим образом достигается путем выбора процесса, катализируемого слабой кислотой, особенно с учетом того факта, что многие жидкие углеводороды, такие как реактивное топливо Jet А-1 и некоторые гидравлические жидкости, имеют слабокислую реакцию.
Для оптимальной защиты топлива продукты взаимодействия одного моля поглотителя с водой в идеальном варианте будут давать один эквивалент FSII. Несмотря на то, что, в принципе, можно синтезировать ациклический поглотитель, который при гидролизе образует до трех эквивалентов FSII, это отрицательно отразится на атомной эффективности. Затем авторам требуется функциональная группа, которая может быть включена в циклическую систему, образующую после гидролиза ациклический спирт, при условии сохранения атомной эффективности.
В идеальном варианте поглотитель воды должен быть достаточно гидрофобным, чтобы в ней растворяться, и таким образом защищать реактивное топливо; в то же время, продукт его реакции с водой должен быть достаточно гидрофильным для того, чтобы предпочтительно распределиться в оставшейся воде и действовать как эффективный FSII.
Применение для FSII ацеталей и кеталей, полученных из маннозы сахара, исследовано автором Mushrush с сотр. (патент США 5705087). Оказывается, упомянутые соединения являются устойчивыми (до 2 лет в реактивном топливе) и эффективными в качестве ингибиторов обледенения, и что важно, безвредны, как было найдено, по отношению к окружающей среде, и относительно нетоксичны в необходимой концентрации [10, 13]. Кроме того, в топливах использовали кетали (патент США 2878109).
В отличие от ингибитора обледенения, поглотитель воды должен претерпевать химическую реакцию при очень низких рабочих температурах (T), с которыми обычно имеют дело в воздушном судне. Такие низкие температуры могут резко уменьшать кинетическую энергию распределяющихся молекул до такой величины, что химическая реакция замедляется или практически останавливается. Поэтому необходимо обеспечивать, чтобы энергетический барьер реакции (Ea) был низким. Это обеспечивает быстрое протекание реакции даже при низких температурах, что соответствует высокой константе (κ) скорости. Соотношение между температурой, энергией активации и скоростью реакции выражается уравнением Аррениуса (I) [14].
При проверке констант скоростей в диапазоне, соответствующем реакции возможных поглотителей (т.е. ацеталей, кеталей и ортоэфиров) с водой, авторы изобретения обнаружили отчетливые корреляции между структурой и барьером реакции (Ea) (фиг. 1). Скорости гидратации ацеталей возрастают в тысячу раз при замене одного водородного атома при функциональном атоме углерода на алкильную группу (1→2 фиг. 1). Увеличение скорости реакции в десять тысяч раз сопровождает переход к родственному кеталю (2→3 фиг. 1), и более чем в десять раз при переходе к родственному ортоэфиру (3→4 фиг. 1). Это важное увеличение относительной скорости легко объяснимо при помощи стерического фактора разуплотнения, поскольку в течение реакции гидролиза промежуточный тетраэдрический продукт стягивается в соответствующую треугольную модификацию, или тем, что рост скорости находится в соответствии со стабильностью соответствующих промежуточных диалкоксикарбениевых продуктов (см. ниже - схема 2) [15].
Наиболее высокая скорость в ряду продуктов присоединения спирта к карбонильным соединениям достигается в случае ортоэфира 4 (фиг. 1), который легко гидролизуется вследствие наличия трех атомов кислорода с неподеленными парами электронов, которые могут увеличивать основность уходящей группы - ROH (см. ниже - схема 2).
В заключение следует отметить, что, оказывается, ортоэфиры являются наиболее перспективными кандидатами для присадки двойного назначения, удовлетворяющей критериям, указанным выше. Следующая стадия заключалась в проверке возможности использования катализируемого кислотой гидролиза низкомолекулярного ортоэфира для дегидратации реактивного топлива. Фигура 2 представляет комплексную природу реактивного топлива.
Авторы изобретения обнаружили, что циклические ортоэфиры обеспечивают возможность поглощения воды в жидких углеводородах с использованием низких концентраций кислоты, обычно обнаруживаемых в топливах. Это означает, что к жидкому углеводороду не нужно добавлять кислые катализаторы, что снижает коррозию, например, в топливных баках и топливных трубах. Циклические ортоэфиры создают возможность для образования водорастворимых продуктов реакции, таких, как спирты и сложные эфиры, которые действуют в качестве антифризов в направлении снижения температуры замерзания оставшейся в жидком углеводороде воды. Они также могут обладать противомикробной активностью. Кроме того, продуктам реакции можно придавать заданные свойства для распределения в различных фазах топлива. Структура циклического ортоэфира допускает в отношении себя изменения с целью увеличения скорости взаимодействия с водой в углеводородах, что дополнительно снижает количество кислоты, требуемой для наличия в жидком углеводороде, и делает данное соединение пригодным для использования в углеводородах без значительных концентраций присутствующей кислоты. Особенно предпочтительной является способность поглощать воду с одновременным образованием продуктов, обладающих свойствами ингибировать обледенение.
Раскрытие изобретения
Изобретение относится к жидкому углеводороду, содержащему обезвоживающий ингибитор обледенения, выбранный из формулы I и формулы II, солей или смесей этого:
где:
R1 и R3 избираемы независимо и выбраны из замещенной или незамещенной, разветвленной или линейной C1-C6-алкильной или эфирной группы;
R2 и R4 избираемы независимо и выбраны из замещенного или незамещенного, линейного или разветвленного C1-C7-алкила;
Y выбран независимо и представляет собой замещенный или незамещенный алкил;
y представляет собой целое число от 1 до 3;
z представляет собой целое число, по меньшей мере, равное 2, такое, как например, от 2 до 6, обычно равное 2.
Считается, что соединения по данному изобретению существуют в растворе в виде катионов, таких как 1,3-диоксолан-2-илиевые катионы. Это показано на фигуре 8, а также обсуждается в работе Santry и др., J. Am. Chem. Soc., (1998) 110, 2909-2914.
Соответственно, такие катионы могут образовываться при использовании солей данных соединений, таких как 1,3-диоксолан-2-илиевые соли. Поэтому данное изобретение включает в свой объем и такие соли.
Жидкий углеводород может представлять собой углеводородное топливо, углеводородное смазочное масло, гидравлическую жидкость или углеводородный растворитель. Наличие воды в гидравлических жидкостях или смазках, таких как масла или буровые смазочные масла, может являться основной проблемой в условиях холодного климата, когда лед может блокировать питающие трубы, снижать эффективность смазочного масла или гидравлической жидкости, либо вызвать коррозию. Смазочные масла и гидравлические жидкости могут быть изготовлены, например, из минеральных масел, либо из растительных или животных жиров или масел.
Углеводородные растворители (т.е. углеводороды, используемые в качестве растворителей) включают в себя циклические соединения, такие как бензол, ксилол, циклогексан, циклогептан, циклооктан и циклопентан; алканы с длинной цепью, такие как гептан, декан, гексан, октадекан и тридекан; более сложные смеси молекул, такие как скипидар. Часто желательно иметь возможность высушивать углеводородный растворитель для удаления воды. Циклические ортоэфиры по данному изобретению можно использовать для такой цели.
Углеводородные топлива включают в себя авиационные топлива, такие как керосин на основе продукта Jet А-1 или AVTUR (Стандарт Министерства Обороны 91-91), Jet A или топлива для военных целей, бензин или легкое горючее, дизельное топливо или топочные мазуты. Между тем, как проблема образования кристаллов льда в реактивных топливах является особенно сложной вследствие передвижения воздушного судна в холодных верхних слоях атмосферы, образование кристаллов льда также может представлять собой проблему в условиях более холодного климата и в других топливах.
Жидкие углеводороды могут быть получены на основе минерального или неочищенного масла. Их также можно получать из животных или растительных источников, включая растительные масла или животные жиры. Можно также использовать смеси неочищенного масла и масел биологического происхождения.
Обезвоживающий ингибитор обледенения в форме циклических ортоэфиров может находиться в углеводородной фазе, водной фазе или в обеих фазах смеси углеводорода и воды, т.к. вода может растворяться в жидком углеводороде или отделяться в виде фазы, отличной от углеводорода.
R1 и R3 могут быть выбраны из CH3-, CH3CH2-, CH3O(CH2)a-, где a - целое число от 1 до 5, и полиалкиленгликоля, содержащего от 1 до 6 атомов углерода.
Выбор R1 позволяет изменять продукт реакции в форме спирта. Если R1 представляет собой этил СН3СН2-, образуется этанол. Это является предпочтительным, т.к. этанол является компонентом многих видов топлива, поэтому будет легко сгорать. Он также является биоцидом и обладает свойствами антифриза. Более того, токсичность этанола хорошо охарактеризована. Метанол (исходя из метального остатка) менее предпочтителен из-за потенциальной токсичности или летучести. Однако в некоторых обстоятельствах он может иметь предпочтение вследствие своих биоцидных свойств или свойств растворителя.
Как правило, а равно 1, 2, 3 или 4.
В качестве R1 или R3 можно использовать алкилен или полиалкиленгликоли, такие как метиленгликоль, этиленгликоль, полиметилен или полиэтиленгликоли. И в этом случае, токсичность полиэтиленгликолей (PEG) хорошо изучена. Можно использовать моно-, ди- или триэтиленгликоль.
R2 и R4 могут быть независимо выбраны из -CH3, -CH2CH3, -CH2CH2CH3, -CH2CH(СН3)2 и -CH2C(СН3)3.
Изменение R2 и R4 может влиять на растворимость продукта реакции в воде или углеводороде. Обычно R2 и R4 представляют собой C1, C2 или C3-алкил. Однако также отмечается, что использование CH2CH(CH3)2 и особенно -CH2C(CH3)3, как обнаружено, увеличивает реакционную способность циклических эфиров при взаимодействии с водой. Это обсуждается в работе Santry и др. (J. Am. Chem. Soc., (1998) 110, 2909-2914), в которой рассматривалось влияние боковых алкильных групп на реакционную способность циклических соединений. Особенно эффективен был радикал неопентил -CH2C(CH3)3. Можно также заместить один или несколько остальных водородных атомов дополнительными метальными группами с целью дополнительной модификации реакционной способности циклического ортоэфира.
R3 и R4 могут быть выбраны независимо и могут являться метилом или этилом.
Y представляет собой связующее звено между двумя атомами кислорода. Он может быть выбран независимо, и может являться, например, -CH2- или СН(CH3)-. Значение y может быть целым числом от 1 до 3. Таким образом, два атома кислорода могут быть связаны, например, с помощью -CH2-, -CH2CH2-, или -CH2CH2CH2-, y обычно равен 2.
Значение z может быть целым числом от 2 до 6, обычно 2 или 3.
Обезвоживающий ингибитор обледенения может иметь формулы III или IV.
где R5 и R7 представляют собой водород; R6 и R8 представляют собой метил, при этом R6 и R8 могут находиться в цис- или транс-положении по отношению друг к другу. В качестве альтернативы все R5-R8 могут представлять собой метил.
Предполагается, что введение метальных групп в положение R6 и R8 повысит реакционную способность циклического ортоэфира в отношении воды, снижая таким образом необходимость присутствия кислого катализатора в жидком углеводороде.
Если жидкий углеводород представляет собой реактивное топливо, R1 может быть CH3CH2-, R2 может быть + C1-C3-алкилом и Y может быть -CH2-, ау может быть равен 2.
В случае, если в жидком углеводороде, как правило, находится недостаточное количество кислоты, к жидкому углеводороду можно добавлять кислоту, такую как метансульфоновая кислота или другая кислота.
Термин «жидкий углеводород» предназначен для обозначения того, что углеводород является жидкостью при температурах выше -50°C, -40°C, -30°C, -20°C или выше -10°C и до 50°C, 100°C, 120°C, 160°C, 180°C, 200°C 250°C или 300°C в зависимости от природы жидкого углеводорода. Реактивное топливо, например, обычно замерзает около -36°C, а закипает примерно при 160°C.Бензол кипит приблизительно при 80°C при нормальном атмосферном давлении.
Как правило, жидкий углеводород содержит от 0,01 до 3%; от 0,1 до 2% или от 0,5 до 1% об. обезвоживающего ингибитора (ингибиторов) обледенения.
Как правило, обезвоживающий ингибитор обледенения может иметь формулу I или III.
В данном изобретении также предлагаются способы ингибирования образования кристаллов льда в жидком углеводороде с использованием циклических ортоэфиров формул I-IV, описанных выше.
Жидкий углеводород, заместители R1-R8, Y, y и z могут быть такими, как описано выше.
Также предлагаются соединения формул III и IV.
Ниже изобретение описано с помощью примера только со ссылкой на следующие фигуры.
На фиг. 1 показано сравнение относительных констант скорости (в скобках) для гидратации ацеталей 1-2, кеталя 3 и ортоэфира 4.
На фиг. 2 приведена типичная хроматограмма ГХ анализа реактивного топлива, отображающая сложную смесь компонентов топлива Jet A-1.
Фиг. 3. Типичный спектр ЯМР продукта ТМОА в буферном растворе ACOM/AcONa с солью ТМС.
Фиг. 4. Графическое изображение кинетических данных для реакции TMOA с буфером D.
Фиг. 5. Калибровочная кривая соотношения воды и относительного пика (ОПП) этанола, полученная методом ГХ.
Фиг. 6. Kobs относительно [H+] для TMOA.
Фиг. 7. Распределение топливо/вода и его последствия для катализируемого кислотами гидролиза. Поглотитель воды представлен в виде сферы.
Фиг. 8. Образование 1,3-диоксолан-2-илиевых катионов в воде.
Ацетали, кетали, ортоэфиры и циклические ортоэфиры широко известны в данной области техники, как например, по работе Santry 1998 Supra, и могут быть получены из ряда промышленно доступных источников, таких как Sigma Aldrich.
Осуществление изобретения
Экспериментальная часть
Экспериментальная ГХ
Анализы выполняли с использованием газового хроматографа Agilent 5890, снабженного пламенно-ионизационным детектором. Использованная ГХ-колонка была изготовлена из плавленого кварца, HP-5MS, 30 м на 0,25 мм, при этом скорость потока гелия составляла 1,5 мл/мин. Температуры детектора и инжектора устанавливали на 250°C. Температура печи во время анализа составляла 80°C в течение 4 мин, а затем повышалась со скоростью 20°C/мин до 240°C и поддерживалась на этом уровне в течение 2 мин.
Топливо Jet А-1, полученное фирмой Air BP (номер партии BIS/HAL/12/035K), сушили с помощью выдерживания его над молекулярным ситом , по меньшей мере, в течение 24 часов. Стандартные образцы с различными концентрациями воды получали путем добавления отмеренных объемов дистиллированной воды с помощью микролитровых шприцов SGE к 20 мл безводного топлива Jet А-1, соблюдая особую осторожность при введении воды в середину растворителя. Каждый стандартный образец приготовляли непосредственно перед использованием и обрабатывали ультразвуком в течение 5 минут для обеспечения равномерного распределения воды.
Реакционный раствор приготовляли для обеспечения возможности простого одностадийного добавления всех необходимых химических веществ. Указанный раствор получали смешением 10 мл триэтилортоформиата (реагент), 1 мл 3-метилпентана (внутренний стандарт) и 7,1 мкл метансульфоновой кислоты (катализатор) в виале для ГХ, полученной от фирмы Supelco (Беллефонт, США). Вследствие загрязнения атмосферной влагой необходимо было приготавливать свежий раствор реагентов каждый день.
Для проведения анализа к 1 мл пробы Jet А-1, помещенному в ГХ виалу для пробы емкостью 2 мл, добавляли 100 мкл реакционного раствора. Во избежание потерь воды на кончике пипетки Gilson, применяемой для отбора пробы, вышеуказанную смесь использовали для ополаскивания кончика пипетки. Все химические вещества, использованные в данном эксперименте, приобретены у фирмы Sigma Aldrich, кроме кислоты, которую перегоняли над безводным MgSO4 и выдерживали над молекулярным ситом . Все виалы для проб мыли ацетоном и сушили при 200°C в течение 2 часов.
Экспериментальный ЯМР [25]
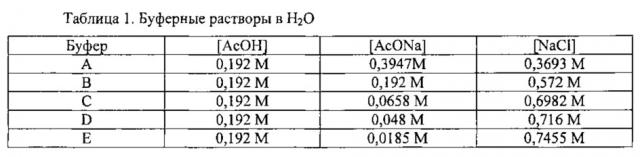
Приготовляли пять буферов с постоянной концентрацией уксусной кислоты (AcOH) и различными концентрациями H+ путем варьирования количества добавляемого ацетата натрия (AcONa) (таблица 1). Так как концентрация ионов в растворе оказывает влияние на константу скорости гидролиза, добавляли хлорид натрия для поддержания постоянного значения ионной силы во всех 5 буферах [26].
Пробы реакционной смеси подготавливали непосредственно в 5 миллиметровой ЯМР пробирке путем добавления 15 мкл ТМОА в 500 мкл ацетона-D6. Для инициирования реакции добавляли 100 мкл буфера уксусная кислота/ацетат натрия. Все химические вещества, самой высокой степени чистоты, приобретали у фирмы Sigma Aldrich. Ацетон-В6 и ТМОА сушили перед каждым экспериментом путем перегонки над молекулярным ситом в атмосфере азота. Хлорид натрия и ацетат натрия сушили при нагревании их при T=100°C в течение 4 часов в вакууме.
Для отслеживания изменения концентрации ТМОА во времени использовали ЯМР-спектрометр 300 МГц, регистрируя девять последовательных 1H ЯМР-спектров каждые 10 мин (действительное время задержки = 10,38 мин). Для маскировки сигнала Н20 использовали метод подавления предварительного насыщения сигнала растворителя. Использовали внешний эталон путем помещения в ЯМР-пробирку запаянной капиллярной трубки с натриевой солью 3-(триметилсилил)-1-пропансульфокислоты, растворенной в D20 (концентрация = 0,1966 M).
1H ЯМР спектр ТМОА состоит из двух синглетов, резонирующих при 3,15 и 1,33 м.д., приписываемых остаткам -OCH3 и -CH3, соответственно (интегрирование 3:1 - фиг. 7). Относительную площадь пика (ОПП) (ОПП - пропорциональна концентрации) определяли путем сравнения сигнала резонанса -CH3 с сигналом резонанса внешнего стандарта. Смотрите фиг. 3.
В качестве примера результаты для буфера D (pH=4,15) приведены в таблице 2 и представлены на фигуре 4.
Экспериментальная компьютерная оценка
Для расчета log Kow использовали две программы: KOWWIN™ и LogP (AB/LogP v2.0) из набора программ EPI и ACD/I-Lab, соответственно [21, 22]. Обе программы оценивают логарифмический коэффициент распределения октанол-вода с использованием метода на основе вклада атом/фрагмент. Величины, приведенные в таблице 2, представляют собой средние значения для двух результатов.
Для оценки токсикологии в отношении млекопитающих и окружающей среды использовали ряд программ с надежно отработанными вычислительными методами. Растворимость соединения в воде и проницаемость кожи (kp) для него определяли с помощью его значений Kow с использованием программ WSKOWWIN™ и DERMWTN, соответственно. С помощью программы MPBPWIN™ оценивали давление паров указанных химических веществ по их температурам кипения [21].
Среднюю смертельную концентрацию (LC50) для Pimephales Promelas рассчитывали с помощью программы ACD/I-Lab [22].
Программу KOCWIN™ применяли для прогнозирования нормированного по углероду коэффициента сорбции и осаждения (Коп) в почве с использованием двух различных моделей: метода молекулярной связности Sabljic с уточненными поправочными коэффициентами и традиционного метода на основе log Kow. Приведены средние значения [21].
Программа BIOWIN™ является основой для оценки аэробной и анаэробной биоразлагаемости органических веществ с использованием 7 различных моделей. Авторы рассмотрели только период времени полного биоразложения, достигаемый в случае, когда материал полностью использован микроорганизмами, а также прогнозирование легкости биоразлагаемости [21].
Результаты и обсуждение
Удаление свободной воды из реактивного топлива: проверка концепции
Вследствие сложности состава топлива Jet А-I в ГХ хроматограмме существует относительно узкое окно "видимости" для наблюдения аналитических маркеров до начала элюирования компонентов Jet А-I (<2 мин в условиях, описанных в экспериментальной части) (фиг. 2). Поэтому был необходим тщательный выбор методологии с целью демонстрирования возможности использования ортоэфиров в качестве обезвоживающих агентов для реактивного топлива, прежде чем работа могла бы быть предпринята.
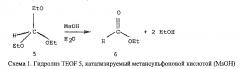
Chen и др. разработали применимый аналитический подход для измерения содержания воды в ряде гидрофобных растворителей, таких, как декан, приемлемый заменитель топлива Jet A-I [16]. Метод основывается на косвенном определении воды посредством измерения методом ГХ содержания этанола (EtOH), летучего побочного продукта, выделяющегося при протекании катализируемой кислотой стехиометрической реакции воды с ортоэфиром 5 (схема 1).
Метод ГХ адаптировали для измерения содержания воды в реактивном топливе (см. экспериментальную часть). Важно отметить, - и как подтверждено ГХ-МС - продукты гидролиза 5, т.е. этанол, этилформиат 6, наряду с внутренним стандартом (3-метипентаном) элюируются быстрее компонентов реактивного топлива (фиг. 2). Время удерживания этанола и 3-метилпентана (внутренний стандарт) составляло 1,69 и 1,8 мин., соответственно.
Для каждого водного стандарта площадь относительного пика (ОПП) этанола рассчитывали путем деления площади пика этанола на площадь пика внутреннего стандарта. Для коррекции атмосферной и остаточной воды, присутствующей в растворе реагента, ОПП раствора реагента вычитали из ОПП этанола. Построили калибровочную кривую, и она представлена на фигуре 5.
Как можно видеть, существует очень хорошая линейная корреляция (R=0,9995%) между ОПП этанола и концентрацией воды в топливе Jet А-I в изученном интервале концентраций (100-1250 ч/млн об./об.).
В заключение необходимо отметить, что линейность указанного соотношения ясно показывает эффективность использования триэтилортоформиата 5 в качестве обезвоживающего агента для топлива Jet А-I. Важно, что описанный здесь метод ГХ можно использовать для определения концентраций воды в реактивном топливе с превышением точности промышленного стандарта - а именно, метода Карла Фишера [16].
Как обсуждалось во введении, реактивное топливо является слабокислым, и действительно, партия топлива Jet A-I, использованная для указанных анализов, как сообщается, характеризовалась числом 0,01 мг КОН/г по стандарту ASTM D3242 [17]. С целью проверки способности 5 обезвоживать реактивное топливо в отсутствие добавленной кислоты, описываемый в настоящем документе ГХ метод повторяли без метансульфоновой кислоты. В отсутствие добавленного кислого катализатора - при наличии только собственной кислотности реактивного топлива для катализирования процесса - было найдено, что реакция протекает на 60-75% по истечении двух дней в сравнении со 100%-ной полнотой за 30 мин при использовании метансульфоновой кислоты. Так как сильнокислый катализатор нежелателен внутри топливного бака воздушного судна, должен быть найден кинетически более быстрый процесс посредством изменения либо (а) условий реакции, т.е. природы кислого катализатора, либо (б) молекулярной структуры ортоэфира.
Природа кислого катализатора и ее связь со скоростью гидролиза
Хотя в катализируемом кислотами гидролизе ортоэфиров существует еще много неясного, подлежащего выявлению, в общем случае принимают, что данный процесс можно разделить на две стадии; а именно: образование водопоглощающего диалкоксикарбениум-иона 11 из ортоэфира 7, и последующая гидратация и распад продукта 11 с образованием эфира 13 (схема 2). Полагают, что первоначальное протонирование продукта 7 и последующее образование продукта 11 протекают медленно, и, следовательно, являются определяющими скорость реакции, тогда как гидратация продукта 11 и все последующие стадии на пути к продукту 13, считаются относительно быстрыми [18, 19].
Протонирование продукта 7 и последующее образование продукта 11 представляют собой предмет двух точно установленных механизмов; а именно общего (через недиссоциированную кислоту НА) - и специфического (через диссоциированную кислоту H+) кислого катализа (схема 2) [18]. В первом случае H-A доставляет протон к атому кислорода ортоэфира, который затем отщепляет молекулу спирта ROH - посредством продукта 10 - с образованием продукта 11 с общей константой скорости KHA. Катион быстро гидратируется и, в конечном счете, распадается до эфира 13 через посредство нескольких стадий и конечное отщепление второй молекулы ROH. В случае специфического кислого катализа диссоциированный катион H+ протонирует ортоэфир 7 с образованием - через продукт 10 - диалкоксикарбениум-иона 11 с общей константой скорости KH+. Судьба гидратированного иона 11 одинакова для обоих маршрутов механизма. Поэтому ясно, что общая скорость процесса, представленного на схеме 2, будет зависеть от более медленного из двух маршрутов механизма.
Общему кислому катализу, как правило, способствуют более слабые недиссоциированные кислоты; напротив, специфический кислый катализ имеет тенденцию к активированию более сильными, полностью диссоциированными кислотами. Однако, для всех кислот, кроме самых сильных, будут действительны оба маршрута. Принимая во внимание физическое окружение, в котором, как ожидают авторы, будет действовать поглотитель воды, а именно внутри топливного бака воздушного судна, авторы изобретения добивались оптимизации скорости реакции при использовании, по возможности, наиболее слабой кислоты. С учетом вышесказанного, было необходимо определить величины констант скорости KH+ и KHA, связанных с одновременно протекающими процессами.
Как упомянуто выше, реактивное топливо является слабокислым. В присутствии полярных растворителей, таких как вода, степень кислотной диссоциации будет пропорциональна константам диссоциации (Ka) присутствующих индивидуальных кислот (уравнение II).
Подход, примененный для определения KH+ и KHA, заключался в использовании постоянного значения Ka (=1,75×10-5 моль/л) при варьировании числителей (т.е. [А] 2 → 0,1 и pH 5,07 → 3,74) и поддержании постоянным значения [HA] (т.е. 0,192 моль/л). Поскольку общая скорость реакции (уравнение III) представляет суммирование обоих процессов, описываемых K