Хиназолины в качестве ингибиторов киназы
Иллюстрации
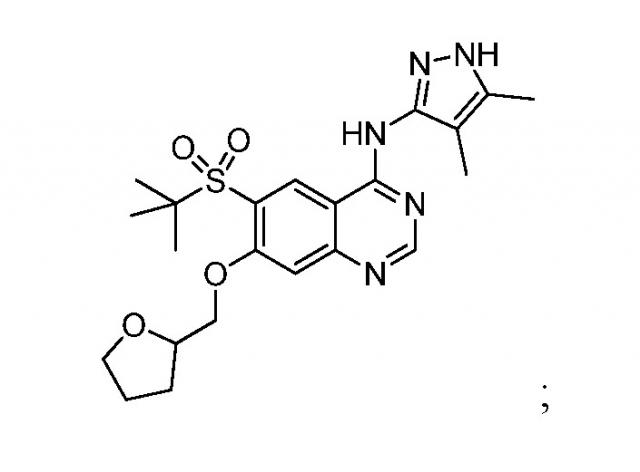
Показать всеИзобретение относится к новому соединению, выбранному из нижеуказанной группы, или его фармацевтически приемлемой соли, которые обладают свойствами ингибиторов киназы RIP21. Соединения могут найти применение для лечения заболевания или нарушения, выбранного из увеита, лихорадочного синдрома, связанного с интерлейкин-1-превращающим ферментом, дерматита, острого повреждения легких, сахарного диабета типа 2, артрита, ревматоидного артрита, язвенного колита, болезни Крона, раннего воспалительного заболевания кишечника, имеющего внекишечные проявления воспалительного заболевания кишечника, предотвращения ишемического реперфузионного повреждения трансплантата паренхиматозного органа, неалкогольного стеатогепатита, алкогольного стеатогепатита, аутоиммунного гепатита, астмы, реакции “трансплантат против хозяина”, системной красной волчанки, множественного склероза, саркоидоза, синдрома Блау, раннего саркоидоза, гранулематоза Вегенера и интерстициального заболевания легких. Новые соединения имеют формулу
7 н. и 11 з.п. ф-лы,2 ил., 2 табл., 4 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к хиназолинам, которые ингибируют киназу RIP2, и к способам их получения и их применению.
Уровень техники
Киназа взаимодействующего с рецептором белка-2 (RIP2), которую также называют CARD3, RICK, CARDIAK или RIPK2, представляет собой сериновую/треониновую протеинкиназу семейства TKL, вовлеченную во врожденный иммунный сигнальный путь. Киназа RIP2 состоит из N-терминального киназного домена и C-терминального домена рекрутирования каспазы (CARD), связанных через промежуточную (IM) область ((1998) J. Biol. Chem. 273, 12296-12300; (1998) Current Biology 8, 885-889; и (1998) J. Biol. Chem. 273, 16968-16975). CARD-домен киназы RIP2 опосредует взаимодействие с другими белками, содержащими CARD, такими как NOD1 и NOD2 ((2000) J. Biol. Chem. 275, 27823-27831 и (2000) EMBO reports 2, 736-742). NOD1 и NOD2 являются цитоплазматическими рецепторами, которые играют ключевую роль во врожденном иммунном надзоре. Они распознают как грамположительные, так и грамотрицательные бактериальные патогены и активируются особыми пептидогликановыми мотивами - диаминопимелиновой кислотой (то есть DAP) и мурамилдипептидом (MDP), соответственно ((2007) J. Immunol. 178, 2380-2386).
Вслед за активацией, киназа RIP2 связывается с NOD1 или NOD2 и, по-видимому, функционирует главным образом как молекулярный каркас, сближающий другие киназы (TAK1, IKKα/β/γ), вовлеченные в активацию NF-κB и митоген-активируемой протеинкиназы ((2006) Nature Reviews Immunology 6, 9-20). Киназа RIP2 подвергается K63-сопряженному полиубиквитинированию по лизину-209, которое облегчает рекрутирование TAK1 ((2008) EMBO Journal 27, 373-383). Данная посттрансляционная модификация необходима для передачи сигнала, так как мутация данного остатка предотвращает опосредованную NOD1/2 активацию NF-κB. Киназа RIP2 также подвергается аутофосфорилированию по серину-176 и, возможно, другим остаткам ((2006) Cellular Signaling 18, 2223-2229). Исследования с использованием мутантов (K47A) с инактивированной киназой и неселективных низкомолекулярных ингибиторов продемонстрировали, что активность киназы RIP2 важна для регуляции стабильности экспрессии киназы RIP2 и передачи сигнала ((2007) Biochem. J. 404, 179-190 и (2009) J. Biol. Chem. 284, 19183-19188).
Нарушение регуляции RIP2-зависимого сигнального пути связывали с аутовоспалительными заболеваниями. Мутации приобретения функции в NACHT-домене NOD2 вызывают синдром Блау, ранний саркоидоз, детскую гранулематозную болезнь, характеризующуюся увеитом, дерматитом и артритом ((2001) Nature Genetics 29, 19-20; (2005) Journal of Rheumatology 32, 373-375; (2005) Current Rheumatology Reports 7, 427-433; (2005) Blood 105, 1195-1197; (2005) European Journal of Human Genetics 13, 742-747; (2006) American Journal of Ophthalmology 142, 1089-1092; (2006) Arthritis & Rheumatism 54, 3337-3344; (2009) Arthritis & Rheumatism 60, 1797-1803 и (2010) Rheumatology 49, 194-196). Мутации в LRR-домене NOD2 определенно связывали с предрасположенностью к болезни Крона ((2002) Am. J. Hum. Genet. 70, 845-857; (2004) European Journal of Human Genetics 12, 206-212; (2008) Mucosal Immunology (2008) 1 (Suppl. 1), S5-S9. 1, S5-S9; (2008) Inflammatory Bowel Diseases 14, 295-302; (2008) Experimental Dermatology 17, 1057-1058; (2008) British Medical Bulletin 87, 17-30; (2009) Inflammatory Bowel Diseases 15, 1145-1154 и (2009) Microbes and Infection 11, 912-918). Мутации в NOD1 связывали с астмой ((2005) Hum. Mol. Genet. 14, 935-941) и ранним и имеющим внекишечные проявления воспалительным заболеванием кишечника ((2005) Hum. Mol. Genet. 14, 1245-1250). Генетические и функциональные исследования также указывали на роль RIP2-зависимого сигнального пути в различных других гранулематозных нарушениях, таких как саркоидоз ((2009) Journal of Clinical Immunology 29, 78-89 и (2006) Sarcoidosis Vasculitis and Diffuse Lung Diseases 23, 23-29) и гранулематоз Вегенера ((2009) Diagnostic Pathology 4, 23).
Активный, селективный, низкомолекулярный ингибитор активности киназы RIP2 мог бы блокировать RIP2-зависимый провоспалительный сигнальный путь и тем самым обеспечивать терапевтически полезный эффект в аутовоспалительных и/или аутоиммунных заболеваниях, характеризующихся повышенной и/или разрегулированной активностью киназы RIP2.
Сущность изобретения
Изобретение относится к соединению, выбираемому из:
6-(трет-бутилсульфонил)-N-(4,5-диметил-1H-пиразол-3-ил)-7-(2-метоксиэтокси)хиназолин-4-амина, имеющего формулу:
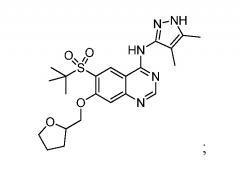
6-(трет-бутилсульфонил)-N-(4,5-диметил-1H-пиразол-3-ил)-7-этоксихиназолин-4-амина, имеющего формулу:
6-(трет-бутилсульфонил)-N-(4,5-диметил-1H-пиразол-3-ил)-7-пропоксихиназолин-4-амина, имеющего формулу:
и 6-(трет-бутилсульфонил)-N-(4,5-диметил-1H-пиразол-3-ил)-7-((тетрагидрофуран-2-ил)метокси)хиназолин-4-амина, имеющего формулу:
или его соли, в частности фармацевтически приемлемой соли.
Соответственно, настоящее изобретение относится к способу ингибирования киназы RIP2, где способ включает в себя приведение в контакт клетки с соединением по изобретению или с его солью, в частности фармацевтически приемлемой солью.
Изобретение дополнительно относится к способу лечения опосредованного киназой RIP2 заболевания или нарушения, который включает в себя введение терапевтически эффективного количества соединения по изобретению или его соли, в частности фармацевтически приемлемой соли, пациенту (человеку или другому млекопитающему, в частности человеку), нуждающемуся в нем. Изобретение также дополнительно относится к применению соединения по изобретению или фармацевтической композиции, содержащей соединение по изобретению, для ингибирования киназы RIP2 и/или лечения опосредованного киназой RIP2 заболевания или нарушения.
Примеры опосредованных киназой RIP2 заболеваний или нарушений включают в себя увеит, болезнь Крона, язвенный колит, раннее и имеющее внекишечные проявления воспалительное заболевание кишечника и гранулематозные нарушения, такие как саркоидоз, синдром Блау, ранний саркоидоз и гранулематоз Вегенера.
Настоящее изобретение дополнительно относится к фармацевтической композиции, содержащей соединение по изобретению или его соль, в частности фармацевтически приемлемую соль, и фармацевтически приемлемое вспомогательное вещество. В частности, данное изобретение относится к фармацевтической композиции для лечения опосредованного киназой RIP2 заболевания или нарушения, где композиция содержит соединение по изобретению или его соль, в частности фармацевтически приемлемую соль, и одно или более фармацевтически приемлемых вспомогательных веществ.
Краткое описание чертежей
На Фиг. 1 представлена порошковая рентгенодифрактограмма (PXRD) кристаллической формы 6-(трет-бутилсульфонил)-N-(4,5-диметил-1H-пиразол-3-ил)-7-этоксихиназолин-4-амина (свободное основание).
На Фиг. 2 показан объединенный IL8-цитокиновый ответ в образцах крысиной цельной крови, полученных после предварительного введения крысам доз соединения 6-(трет-бутилсульфонил)-N-(4,5-диметил-1H-пиразол-3-ил)-7-этоксихиназолин-4-амина с последующим введением доз L18-MDP.
Подробное описание изобретения
Использованные здесь термины “соединение(я) по изобретению” и “соединение(я) по данному изобретению” означают любое из соединений, определенных здесь, в любой форме, то есть в любой солевой или несолевой форме (например, в виде формы свободной кислоты или свободного основания, или в виде соли, в частности его фармацевтически приемлемой соли) и его любой физической форме (например, включая нетвердые формы (например, жидкие или полутвердые формы) и твердые формы (например, аморфные или кристаллические формы, особые полиморфные формы, сольватные формы, включая гидратные формы (например, моно-, ди- и полугидраты)), и в виде смесей различных форм (гидрат соли). А именно, будет понятно, что настоящее изобретение охватывает соединения по изобретению в виде свободного основания и в виде его солей, например в виде его фармацевтически приемлемой соли. В одном варианте осуществления изобретение относится к соединениям по изобретению в форме свободного основания. В другом варианте осуществления изобретение относится к соединениям по изобретению в форме соли, в частности фармацевтически приемлемой соли.
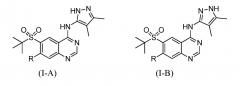
Также специалистам в данной области будет понятно, что пиразолильный фрагмент, присутствующий в соединениях по данному изобретению, может существовать в виде таутомерных пиразолильных изомеров, представляемых формулой (I-A) и формулой (I-B):
Будет понятно, что получающийся в результате пиразолильный фрагмент может быть назван либо как 3,4-диметил-1H-пиразол-5-ильный фрагмент, либо как 4,5-диметил-1H-пиразол-3-ильный фрагмент. Следует также понимать, что любая ссылка на названное соединение по данному изобретению подразумевается как охватывающая все таутомеры названного соединения и любые смеси таутомеров названного соединения. Например, название соединения 6-(трет-бутилсульфонил)-N-(4,5-диметил-1H-пиразол-3-ил)-7-этоксихиназолин-4-амин подразумевается как охватывающее соединения 6-(трет-бутилсульфонил)-N-(4,5-диметил-1H-пиразол-3-ил)-7-этоксихиназолин-4-амин и 6-(трет-бутилсульфонил)-N-(3,4-диметил-1H-пиразол-5-ил)-7-этоксихиназолин-4-амин и их смеси. Подразумевается, что все таутомерные формы описанных здесь соединений охватываются объемом настоящего изобретения.
Соединения по изобретению могут содержать один или более асимметрических центров (также именуемых хиральным центром) и, следовательно, могут существовать в виде индивидуальных энантиомеров, диастереомеров или других стереоизомерных форм, или в виде их смесей. Хиральные центры, такие как хиральный углерод, могут также присутствовать в соединениях по данному изобретению. Если стереохимия хирального центра, присутствующего в соединении по данному изобретению (например, относясь к названию соединения) или в любой проиллюстрированной здесь химической структуре, конкретно не указана, то подразумевается, что соединение, название соединения или структура охватывает все индивидуальные стереоизомеры и все их смеси. Таким образом, соединения по изобретению, содержащие один или более хиральных центров, могут присутствовать в виде рацемических смесей, энантиомерно обогащенных смесей или в виде энантиомерно чистых индивидуальных стереоизомеров.
Индивидуальные стереоизомеры соединения по изобретению, которые содержат один или более асимметрических центров, могут быть разделены способами, известными специалистам в данной области. Например, такое разделение может быть выполнено (1) формированием диастереомерных солей, комплексов или других производных; (2) селективной реакцией со специфичным к стереоизомеру реагентом, например ферментативным окислением или восстановлением; или (3) газожидкостной или жидкостной хроматографией в хиральной среде, например на хиральном носителе, таком как диоксид кремния с закрепленным хиральным лигандом, или в присутствии хирального растворителя. Квалифицированному специалисту будет понятно, что если желаемый стереоизомер превращается в другую химическую единицу в результате одной из описанных выше процедур разделения, для высвобождения желаемой формы требуется дополнительная стадия. Альтернативно, конкретные стереоизомеры могут быть синтезированы асимметрическим синтезом, используя оптически активные реагенты, субстраты, катализаторы или растворители, или путем превращения одного энантиомера в другой путем асимметрической трансформации.
Следует понимать, что твердая форма соединения по изобретению может существовать в кристаллических формах, некристаллических формах или в виде их смеси. Такие кристаллические формы также могут обнаруживать полиморфизм (то есть способность встречаться в разных кристаллических формах). Данные разные кристаллические формы обычно известны как “полиморфы”. Полиморфы имеют одинаковую химическую композицию, но отличаются упаковкой, геометрическим расположением и другими описательными свойствами кристаллического твердого состояния. Полиморфы, следовательно, могут иметь разные физические свойства, такие как форма, плотность, твердость, деформируемость, стабильность и растворимость. Полиморфы обычно обнаруживают разные температуры плавления, ИК-спектры и порошковые рентгенодифрактограммы, которые можно использовать для идентификации. Специалисту в данной области будет понятно, что разные полиморфы могут быть получены, например, изменением или регулированием условий, используемых при кристаллизации/перекристаллизации соединения.
Специалистам в данной области хорошо известно и понятно, что используемая установка, влажность, температура, ориентация кристаллов в порошке и другие параметры, вовлеченные в получение порошковой рентгенодифрактограммы (PXRD), могут вызывать некоторую вариабельность во внешнем виде, интенсивностях и положениях линий на дифрактограмме. Порошковая рентгенодифрактограмма, которая “по существу соответствует” таковой, приведенной здесь на Фигуре, представляет собой дифрактограмму PXRD, которая рассматривалась бы специалистом в данной области как представляющая соединение, обладающее той же кристаллической формой, что и соединение, которое давало дифрактограмму PXRD, показанную на Фигуре. Например, дифрактограмма PXRD может быть идентичной таковой на Фигуре 1 или, что более вероятно, она может несколько отличаться. Такая дифрактограмма PXRD необязательно может показывать каждую из линий представленных здесь дифракционных картин и/или может показывать слабое изменение во внешнем виде, интенсивности или сдвиг в положении указанных линий в результате различий в условиях, вовлеченных в получение данных. Специалист в данной области способен определить, имеет ли образец кристаллического соединения ту же форму, что и раскрытая здесь форма, или форму, отличную от нее, путем сравнения их дифрактограмм PXRD. Например, специалист в данной области может наложить дифрактограмму PXRD образца кристаллической формы соединения примера 2, то есть 6-(трет-бутилсульфонил)-N-(4,5-диметил-1H-пиразол-3-ил)-7-этоксихиназолин-4-амина (свободное основание), на дифрактограмму PXRD, представленную на Фиг. 1, и, используя навыки и знания в данной области, без труда определить, соответствует ли по существу дифрактограмма PXRD образца дифрактограмме PXRD, приведенной на Фигуре 1. Если дифрактограмма PXRD по существу соответствует таковой на Фиг. 1, то форма образца может быть без труда и точно идентифицирована как имеющая ту же форму, что и описанная здесь кристаллическая форма 6-(трет-бутилсульфонил)-N-(4,5-диметил-1H-пиразол-3-ил)-7-этоксихиназолин-4-амина (свободное основание). Подобно этому специалист в данной области способен определить, расположен ли данный дифракционный угол (выраженный в °2θ), полученный из дифрактограммы PXRD, примерно в том же положении, что и цитированное значение.
По причине их потенциального применения в медицине соли соединений по данному изобретению представляют собой предпочтительно фармацевтически приемлемые соли. Подходящие фармацевтически приемлемые соли включают соли, полученные присоединением кислоты или основания, такие как соли, описанные в статье Berge, Bighley и Monkhouse, J. Pharm. Sci. (1977) 66, стр. 1-19, и монографии “Pharmaceutical Salts: Properties, Selection, and Use”, издание 2ое, исправленное, под редакцией P.H. Stahl и C.G. Wermuth, Wiley, Hoboken, NJ, US (2011).
Термин “фармацевтически приемлемый” относится к тем соединениям, материалам, композициям и лекарственным формам, которые в рамках здравого медицинского суждения являются подходящими для применения в контакте с тканями человеческих существ и животных без избыточной токсичности, раздражения или другой проблемы или осложнения, соразмерно с разумным соотношением пользы/риска.
Термин “фармацевтически приемлемая(ые) соль(и)” относится к соединению, которое подходит для фармацевтического применения. Солевые и сольватные (например, гидраты и гидраты солей) формы соединений по изобретению, которые подходят для применения в медицине, представляют собой таковые, в которых противоион или связанный растворитель является фармацевтически приемлемым. Однако соли и сольваты, содержащие не являющиеся фармацевтически приемлемыми противоионы или связанные растворители, входят в объем настоящего изобретения, например, для применения в качестве промежуточных реагентов при получении других соединений по изобретению и их солей и сольватов.
Когда соединение по изобретению представляет собой основание (содержит основный фрагмент), желаемая солевая форма может быть получена любым подходящим способом, известным в данной области, включая обработку свободного основания кислотой. Примеры фармацевтически приемлемых солей, полученных присоединением кислоты, включают в себя ацетат, адипат, аскорбат, аспартат, бензолсульфонат, бензоат, камфорат, камфорсульфонат (камзилат), капрат (деканоат), капроат (гексаноат), каприлат (октаноат), карбонат, бикарбонат, циннамат, цитрат, цикламат, додецилсульфат (эстолат), этан-1,2-дисульфонат (эдизилат), этансульфонат (эзилат), формиат, фумарат, галактарат (мукат), гентизат (2,5-дигидроксибензоат), глюкогептонат (глюкептат), глюконат, глюкуронат, глутамат, глутарат, глицерофосфорат, гликолят, гиппурат, гидробромид, гидрохлорид, гидроиодид, изобутират, лактат, лактобионат, лаурат, малеат, малат, малонат, манделат, метансульфонат (мезилат), нафталин-1,5-дисульфонат (нападизилат), нафталинсульфонат (напзилат), никотинат, нитрат, олеат, оксалат, пальмитат, памоат, фосфат, дифосфат, пропионат, пироглутамат, салицилат, себацинат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, тозилат, ундециленат, 1-гидрокси-2-нафтоат, 2,2-дихлорацетат, 2-гидроксиэтансульфонат (изетионат), 2-оксоглутарат, 4-ацетамидобензоат и 4-аминосалицилат. Не являющиеся фармацевтически приемлемыми соли, например трифторацетат, могут быть использованы, например, при выделении соединения изобретения и включены в объем данного изобретения.
Когда соединение по изобретению представляет собой кислоту (содержит кислотный фрагмент), желаемая солевая форма может быть получена любым подходящим способом, известным в данной области, включая обработку свободной кислоты неорганическим или органическим основанием. Примеры фармацевтически приемлемых солей, полученных присоединением основания, включают в себя аммонийные, литиевые, натриевые, калиевые, кальциевые, магниевые, алюминиевые соли, цинковые соли, соли триметиламина, триэтиламина, морфолина, пиридина, пиперидина, пиколина, дициклогексиламина, N,N'-дибензилэтилендиамина, 2-гидроксиэтиламина, бис(2-гидроксиэтил)амина, три(2-гидроксиэтил)амина, прокаина, дибензилпиперидина, дегидроабиетиламина, глюкамина, N-метилглюкамина, коллидина, хинина, хинолина, лизина и аргинина. В одном варианте осуществления фармацевтически приемлемая соль, полученная присоединением основания, представляет собой натриевую соль.
Определенные соединения по изобретению могут образовывать соли с одним или более эквивалентами кислоты (если соединение содержит основный фрагмент) или основания (если соединение содержит кислотный фрагмент). Настоящее изобретение включает в свой объем все возможные стехиометрические и нестехиометрические солевые формы.
Данное изобретение также предусматривает превращение одной фармацевтически приемлемой соли соединения по данному изобретению в другую фармацевтически приемлемую соль соединения по данному изобретению.
Если основное соединение выделяют в виде соли, соответствующая форма свободной кислоты или свободного основания такого соединения может быть получена любым подходящим способом, известным в данной области.
Что касается сольватов соединений по изобретению, включая сольваты солей соединений по изобретению, которые находятся в кристаллической форме, специалисту в данной области будет понятно, что могут быть сформированы фармацевтически приемлемые сольваты, в которых молекулы растворителя включаются в кристаллическую решетку в ходе кристаллизации. Сольваты могут включать в себя неводные растворители, такие как этанол, изопропанол, ДМСО, уксусная кислота, этаноламин и EtOAc, или они могут включать в себя воду в качестве растворителя, который включен в кристаллическую решетку. Сольваты, в которых вода представляет собой растворитель, который включен в кристаллическую решетку, обычно называют “гидратами”. Гидраты включают в себя стехиометрические гидраты, а также композиции, содержащие переменные количества воды. Изобретение включает в себя все такие сольваты, в частности гидраты.
Поскольку соединения по изобретению предназначены для применения в фармацевтических композициях, будет совершенно понятно, что их в каждом случае предпочтительно предоставляют в по существу чистой форме, например с чистотой по меньшей мере 60%, предпочтительнее с чистотой по меньшей мере 75% и предпочтительно с чистотой по меньшей мере 85%, в особенности с чистотой по меньшей мере 98% (% приведены по массе в расчете на массу). Соединения, полученные не в чистой форме, могут быть использованы для получения более чистых форм, используемых в фармацевтических композициях.
Общие синтетические способы
Соединения по изобретению могут быть получены с использованием синтетических методик, проиллюстрированных на приведенных ниже схемах, или опираясь на знания квалифицированного специалиста в области органической химии. Показанные на данных схемах синтезы применимы для получения соединений по изобретению, содержащих разнообразные замещающие группы, с использованием надлежащих предшественников, которые при необходимости подходящим образом защищены для того, чтобы добиться совместимости с изложенными здесь реакциями. Последующее удаление защит, где это необходимо, дает соединения раскрытой в общем виде природы. Хотя на схемах показаны соединения лишь общей формулы, они иллюстрируют способы, которые можно использовать для получения соединений по изобретению.
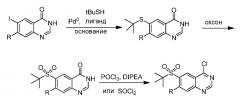
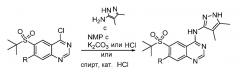
Перед введением пиразолильного фрагмента можно было бы ввести заместитель в положение C6. Катализируемое палладием сочетание тиола с 6-иодхиназолиноном может давать сульфид, который впоследствии может быть окислен до сульфона. Хлорирование с помощью POCl3 или SOCl2 может давать 4-хлорхиназолин.
Схема 1
Анилины/амины можно было бы вводить в реакцию с 4-хлорхиназолинами в основных или кислых условиях с получением 4-аминохиназолинов, которые могли бы представлять собой конечные соединения или можно было бы использовать в качестве промежуточных реагентов для дальнейшего синтеза.
Схема 2
Альтернативно, некоторые соединения по изобретению можно получать из 6-бром-7-фторхиназолин-4-ола реакцией с подходящими спиртами в присутствии основания при нагревании, что дает соответствующий 6-бром-7-алкоксихиназолин-4-ол. Последующее хлорирование и замещение аминами/анилинами будет давать 4-амино-6-бром-алкоксихиназолины. Дальнейшая реакция данных соединений с тиолами или тиолятами в присутствии подходящего сочетания палладиевого катализатора, лиганда и основания при нагревании будет давать 4-амино-6-алкилтио-7-алкоксихиназолины. Окисление будет приводить к 4-амино-6-сульфонил-7-алкоксихиназолинам, которые могут представлять собой конечные соединения или можно использовать в качестве промежуточных реагентов в дальнейших химических превращениях.
Схема 3
Получение некоторых из соединений по изобретению можно осуществлять из 7-фтор-6-сульфонил-4-хиназолинона. Синтез данного промежуточного реагента начинается с бромирования 4-фтор-2-аминобензойной кислоты с последующей конденсацией с ацетатом формамидина, проводимой in situ. Катализируемое палладием сочетание с тиолом дает сульфид, который впоследствии окисляют до сульфона.
Схема 4
Замещение фторного заместителя на алкоксильную группу может быть достигнуто обработкой соответствующим спиртом и т-бутоксидом калия.
Схема 5
Конкретным соединением по изобретению является 6-(трет-бутилсульфонил)-N-(4,5-диметил-1H-пиразол-3-ил)-7-этоксихиназолин-4-амин (в виде свободного основания). В другом варианте осуществления конкретным соединением по изобретению является 6-(трет-бутилсульфонил)-N-(4,5-диметил-1H-пиразол-3-ил)-7-этоксихиназолин-4-амин или его соль. В другом варианте осуществления конкретным соединением по изобретению является 6-(трет-бутилсульфонил)-N-(4,5-диметил-1H-пиразол-3-ил)-7-этоксихиназолин-4-амин или его фармацевтически приемлемая соль. В другом варианте осуществления конкретным соединением по изобретению является кристаллическая форма 6-(трет-бутилсульфонил)-N-(4,5-диметил-1H-пиразол-3-ил)-7-этоксихиназолин-4-амина, отличающаяся дифрактограммой PXRD, представленной на Фигуре 1. В другом варианте осуществления конкретным соединением по изобретению является кристаллическая форма 6-(трет-бутилсульфонил)-N-(4,5-диметил-1H-пиразол-3-ил)-7-этоксихиназолин-4-амина, характеризующаяся дифракционными данными, представленными в Таблице 1.
Соединения по данному изобретению являются ингибиторами киназы RIP2. Соответственно, в одном варианте осуществления изобретение относится к способу ингибирования киназы RIP2, включающему в себя приведение в контакт клетки с соединением по изобретению. В другом варианте осуществления изобретение относится к способу лечения опосредованного киназой RIP2 заболевания или нарушения, включающему в себя введение терапевтически эффективного количества соединения по изобретению человеку, нуждающемуся в нем.
В другом конкретном варианте осуществления изобретение относится к способу лечения опосредованного киназой RIP2 заболевания или нарушения, включающему в себя введение терапевтически эффективного количества 6-(трет-бутилсульфонил)-N-(4,5-диметил-1H-пиразол-3-ил)-7-этоксихиназолин-4-амина или его фармацевтически приемлемой соли человеку, нуждающемуся в нем.
Соединения по изобретению могут быть полезны, в частности, для лечения опосредованных киназой RIP2 заболеваний или нарушений, в частности заболеваний или нарушений, при которых ингибирование киназы RIP2 обеспечило бы полезный эффект. Примеры таких опосредованных киназой RIP2 заболеваний или нарушений включают в себя увеит, лихорадочный синдром (ИПФ-лихорадка), связанный с интерлейкин-1-превращающим ферментом (ИПФ, также известен как каспаза-1), дерматит, острое повреждение легких, сахарный диабет типа 2, артрит (в особенности ревматоидный артрит), воспалительные кишечные нарушения (такие как язвенный колит и болезнь Крона), раннее воспалительное заболевание кишечника, имеющее внекишечные проявления воспалительное заболевание кишечника, предотвращение ишемического реперфузионного повреждения паренхиматозных органов (в особенности почки) в ответ на ишемию, вызванную операциями на сердце, состояние после трансплантации органов, сепсис и другие поражения, заболевания печени (неалкогольный стеатогепатит, алкогольный стеатогепатит и аутоиммунный гепатит), аллергические заболевания (такие как астма), реакции на трансплантат (такие как реакция “трансплантат против хозяина”), аутоиммунные заболевания (такие как системная красная волчанка и множественный склероз) и гранулематозные нарушения (такие как саркоидоз, синдром Блау, ранний саркоидоз, гранулематоз Вегенера и интерстициальное заболевание легких).
Соединения по данному изобретению могут быть полезны, в частности, для лечения увеита, ИПФ-лихорадки, синдрома Блау, раннего саркоидоза, язвенного колита, болезни Крона, гранулематоза Вегенера и саркоидоза. Лечение опосредованных киназой RIP2 заболеваний или нарушений или, в более широком смысле, лечение иммуноопосредованных заболеваний, включая следующие, но без ограничения ими: аллергические заболевания, аутоиммунные заболевания, предотвращение отторжения трансплантата и тому подобное, может быть достигнуто с применением соединения по данному изобретению в виде монотерапии или в двухкомпонентной или многокомпонентной комбинированной терапии, в частности для лечения упорных случаев, как, например, в сочетании с другими противовоспалительными агентами и/или агентами анти-ФНО (ингибиторы фактора некроза опухолей), которые могут быть введены в терапевтически эффективных количествах, как известно в данной области.
Соединения по данному изобретению можно использовать в одиночку или в сочетании с другими терапевтическими агентами. Комбинированная терапия по настоящему изобретению включает в себя, таким образом, введение по меньшей мере одного соединения по изобретению и применение по меньшей мере одного другого терапевтически активного агента. Предпочтительно, комбинированная терапия по настоящему изобретению включает в себя введение по меньшей мере одного соединения по изобретению и по меньшей мере одного другого терапевтически активного агента. Соединение(я) по изобретению и другой(ие) терапевтически активный(е) агент(ы) можно вводить совместно в единственной фармацевтической композиции или по отдельности, и при введении по отдельности введение может происходить одновременно или последовательно в любом порядке. Количества соединения(й) по изобретению и другого(их) терапевтически активного(ых) агента(ов) и относительные времена введения будут выбираться в целях достижения желаемого комбинированного терапевтического эффекта. Таким образом, в дополнительном аспекте предоставляется сочетание, содержащее соединение по изобретению вместе с одним или более другими терапевтически активными агентами. В дополнительном аспекте предоставляется сочетание, содержащее 6-(трет-бутилсульфонил)-N-(4,5-диметил-1H-пиразол-3-ил)-7-этоксихиназолин-4-амин или его фармацевтически приемлемую соль вместе с одним или более другими терапевтически активными агентами.
Таким образом, в одном аспекте данного изобретения соединение по изобретению и фармацевтические композиции, содержащие соединение по данному изобретению, могут быть использованы в сочетании с одним или более другими терапевтическими агентами или включать в себя один или более других терапевтических агентов, например противовоспалительный агент и/или агент анти-ФНО.
Соединения по данному изобретению могут быть введены в сочетании с кортикостероидами и/или агентами анти-ФНО для лечения синдрома Блау, раннего саркоидоза; или в сочетании с биопрепаратами анти-ФНО или другими противовоспалительными биопрепаратами для лечения болезни Крона; или в сочетании с 5-АСК (месаламином) или сульфасалазином для лечения язвенного колита; или в сочетании с низкодозовыми кортикостероидами и/или метотрексатом для лечения гранулематоза Вегенера или саркоидоза или интерстициального заболевания легких; или в сочетании с биопрепаратом (например, анти-ФНО, анти-ИЛ-6 и так далее) для лечения ревматоидного артрита; или в сочетании с анти-ИЛ-6 и/или метотрексатом для лечения ИПФ-лихорадки.
Примеры подходящих противовоспалительных агентов включают в себя 5-аминосалициловую кислоту и препараты месаламина, сульфасалазин, гидроксихлорохин, тиопурины (азатиоприн, меркаптопурин), метотрексат, циклофосфамид, циклоспорин, ингибиторы JAK (тофацитиниб), кортикостероиды, в частности низкодозовые кортикостероиды (такие как преднизон (Deltasone®) и бундесонид) и противовоспалительные биопрепараты, такие как моноклональные антитела анти-ИЛ6Р (Actemra® (тоцилизумаб)), биопрепараты анти-ИЛ6, биопрепараты анти-ИЛ1 или анти-ИЛ12 или анти-ИЛ23 (устекинумаб (Stelara®)), антиинтегриновые агенты (натализумаб (Tysabri®)), моноклональные антитела анти-CD20 (ритуксимаб (Rituxan®) и офатумумаб (Arzerra®)) и другие агенты, такие как абатацепт (Orencia®), анакинра (Kineret®) и белимумаб (Benlysta®), биопрепараты CD4 и другие ингибиторы цитокинов или биопрепараты, активные по отношению к рецепторам T-клеток или B-клеток или интерлейкинам. Примеры подходящих агентов анти-ФНО включают в себя биопрепараты анти-ФНО, такие как Enbrel® (этанерцепт), Humira® (адалимумаб), Remicade® (инфликсимаб), Cimzia® (цертолизумаб) и Simponi® (голимумаб).
Другие примеры подходящих противовоспалительных агентов включают в себя 5-аминосалициловую кислоту и препараты месаламина, сульфасалазин, гидроксихлорохин, тиопурины (азатиоприн, меркаптопурин), метотрексат, циклофосфамид, циклоспорин, ингибиторы кальциневрина (циклоспорин, пимекролимус, такролимус), микофеноловую кислоту (CellCept®), ингибиторы mTOR (темсиролимус, эверолимус), ингибиторы JAK (тофацитиниб (Xeljan®)), ингибиторы Syk (фостаматиниб), кортикостероиды, в частности низкодозовые кортикостероиды (такие как преднизон (Deltasone®) и бундесонид) и противовоспалительные биопрепараты, такие как моноклональные антитела анти-ИЛ6Р (Actemra® (тоцилизумаб)), биопрепараты анти-ИЛ6, биопрепараты анти-ИЛ1 (анакинра (Kineret®), канакинумаб (Ilaris®), рилонацепт (Arcalyst®)), анти-ИЛ12 или анти-ИЛ23 (устекинумаб (Stelara®)), биопрепараты анти-ИЛ17 (секукинумаб), анти-CD22 (эпратузумаб), антиинтегриновые агенты (натализумаб (Tysabri®)), ведолизумаб (Entyvio®), анти-IFNa (сифалимумаб), моноклональные антитела анти-CD20 (ритуксимаб (Rituxan®) и офатумумаб (Arzerra®)) и другие агенты, такие как абатацепт (Orencia®), анакинра (Kineret®), канакинумаб (Ilaris®), рилонацепт (Arcalyst®), секукинумаб, эпратузумаб, сифалимумаб и белимумаб (Benlysta®), биопрепараты CD4 и другие ингибиторы цитокинов или биопрепараты, активные по отношению к рецепторам T-клеток или B-клеток или интерлейкинам. Примеры подходящих агентов анти-ФНО включают в себя биопрепараты анти-ФНО, такие как Enbrel® (этанерцепт), Humira® (адалимумаб), Remicade® (инфликсимаб), Cimzia® (цертолизумаб) и Simponi® (голимумаб). Данное изобретение также предоставляет соединение по изобретению для применения в терапии. А именно, данное изобретение предоставляет описанные здесь соединения или их фармацевтически приемлемую соль для применения в терапии. Конкретнее, данное изобретение предоставляет 6-(трет-бутилсульфонил)-N-(4,5-диметил-1H-пиразол-3-ил)-7-этоксихиназолин-4-амин или его фармацевтически приемлемую соль для применения в терапии.
В другом варианте осуществления данное изобретение предоставляет соединение по изобретению для применения в лечении опосредованного киназой RIP2 заболевания или нарушения. А именно, данное изобретение предоставляет описанные здесь соединения или их фармацевтически приемлемую соль для применения в лечении опосредованного киназой RIP2 заболевания или нарушения.
В другом варианте осуществления данное изобретение предоставляет описанные здесь соединения или их фармацевтически приемлемую соль для применения в лечении увеита, лихорадочного синдрома, связанного с интерлейкин-1-превращающим ферментом, дерматита, острого повреждения легких, сахарного диабета типа 2, артрита (в особенности ревматоидного артрита), воспалительных кишечных нарушений (таких как язвенный колит и болезнь Крона), раннего воспалительного заболевания кишечника, имеющего внекишечные проявления воспалительного заболевания кишечника, для предотвращения ишемического реперфузионного повреждения паренхиматозных органов (в особенности почки) в ответ на ишемию, вызванную операциями на сердце, в лечении состояния после трансплантации органов, сепсиса и других поражений, заболеваний печени (неалкогольного стеатогепатита, алкогольного стеатогепатита и аутоиммунного гепатита), аллергических заболеваний (таких как астма), реакций на трансплантат (таких как реакция “трансплантат против хозяина”), аутоиммунных заболеваний (таких как системная красная волчанка и множественный склероз) и гранулематозных нарушений (таких как саркоидоз, синдром Блау, ранний саркоидоз, гранулематоз Вегенера и интерстициальное заболевание легких).
В другом варианте осуществления данное изобретение предоставляет описанные здесь соединения или их фармацевтически приемлемую соль для применения в лечении увеита. В другом варианте осуществления данное изобретение предоставляет описанные здесь соединения или их фармацевтически приемлемую соль для применения в лечении лихорадочного синдрома, связанного с интерлейкин-1-превращающим ферментом. В другом варианте осуществления данное изобретение предоставляет описанные здесь соединения или их фармацевтически приемлемую соль для применения в лечении синдрома Блау. В другом варианте осуществления данное изобретение предоставляет описанные здесь соединения или их фармацевтически приемлемую соль для применения в лечении