Бициклические гетероциклические соединения и их применения в терапии
Иллюстрации
Показать всеИзобретение относится к соединению формулы (Ic) или его таутомерным или стереохимически изомерным формам, N-оксидам или фармацевтически приемлемым солям. В формуле (Ic) A представляет собой СН, U представляет собой CR8 и V представляет собой N, или A представляет собой СН, U представляет собой N и V представляет собой CR9, или A представляет собой N, U представляет собой CR8 и V представляет собой CR9, или A представляет собой СН, U представляет собой CR8 и V представляет собой CR9; R1 выбран из C1-4 алкила, необязательно замещенного 1, 2 или 3 атомами галогена; R3a выбран из водорода, C1-6 алкила, -C(=O)NH(2-q)(C1-6 алкил)q, -CH2-(5-6-членный ароматический или неароматический гетероциклил), -CH2-(9-10-членный бициклический ароматический или неароматический гетероциклил), и -C(=O)-(4-6-членный ароматический или неароматический гетероциклил); R6 и R7 независимо выбраны из водорода, C1-6 алкила, -CH2-фенила, -СН2-О-СН2-фенила, или группы R6 и R7, вместе с атомом углерода, с которым они связаны, могут объединяться с образованием 3-6-членной насыщенной карбоциклической или гетероциклической группы, выбранной из циклопропила, циклобутила, циклопентила, азетидина, пиперидина, которая, необязательно, может быть конденсирована с фенильным кольцом. Значения остальных радикалов представлены в формуле изобретения. Изобретение также относится к индивидуальным соединениям, фармацевтической композиции, к применениям соединения и к способам его получения. Технический результат: получены новые соединения формулы (Ic), которые могут быть полезны для профилактики или лечения заболевания или состояния, опосредованного одним или более белков семейства IAP. 14 н. и 41 з.п. ф-лы, 10 табл., 266 пр.
(Ic)
Реферат
Область изобретения
Настоящее изобретение относится к новым бициклическим гетероциклическим соединениям, к фармацевтическим композициям, включающим указанные соединения, и к применению указанных соединений для лечения заболеваний, например, рака.
Родственные заявки
Настоящая заявка является родственной: временной патентной заявке США № 61/477726, поданной 21 апреля 2011 года, и патентной заявке Великобритании № 1106817.8, поданной 21 апреля 2011 года, содержание которых включено в настоящую заявку посредством ссылки во всей их полноте.
Предпосылки изобретения
IAP семейство
Семейство белков-ингибиторов апоптоза (IAP) включает 8 членов, XIAP, cIAP1, cIAP2, NAIP, ILP2, ML-IAP, сурвирин и BRUCE (также известный как аполлон). Было показано, что члены IAP семейства ингибируют запрограммированную клеточную гибель через их способность к ингибированию непосредственно членов каспазного семейства апоптических ферментов, хотя точная роль всех 8 членов еще не полностью определена. Общей структурной особенностью всех членов IAP семейства является цинк-связывающая складка в молекуле ~70 аминокислот, называемая доменом бакуловирусного IAP повтора (BIR), который присутствует в одной из трех копий.
Многие взаимодействия между IAP и другими белками опосредованы через поверхностную бороздку в BIR домене. BIR домены могут быть классифицированы в соответствии с их пептид-связывающей специфичностью. Существуют три типа BIR доменов; домены III типа (способны к связыванию каспазных (и каспаза-подобных) пептидов со специфичностью в отношении пролина в третьем (P3) положении (например, XIAP BIR3), домены II типа (подобные доменам III типа, но без специфичности в отношении пролина, например, XIAP BIR2) и домены I типа (которые не связывают каспазы или подобные пептиды, например, XIAP BIR1) (Eckelman et al. Cell Death and Differentiation 2008; 15: 920-928). BIR представляют собой небольшие (~70 аминокислот) Zn-координированные домены, и различные белки используют их N-конец для взаимодействия с бороздками BIR доменов. Антагонисты BIR препятствуют связыванию каспаз с BIR и, таким образом, приводят к повышенной каспазной активности, индуцируя аутоубихитинирование и протеасомное расщепление IAP.
IAP чрезмерно экспрессируются во многих типах рака, включая ренальный рак, меланому, рак толстой кишки, рак легкого, рак молочной железы, рак яичника и рак предстательной железы (Tamm et al., Clin. Cancer Research 2000; 6(5): 1796-803), и вовлечены в опухолевый рост, патогенез и резистентность к химио- и лучевой терапии (Tamm 2000).
XIAP
XIAP представляет собой 57 кДа белок с тремя BIR доменами, второй и третий из которых связывают каспазы и цинковый палец RING-типа (E3 лигаза). XIAP связывает некоторые белки помимо каспаз, включая субстраты для лигирования, такие как TAK1 и кофактор TAB1, MURR1, вовлеченный в гомеостаз меди (Burstein et al., EMBO 2004; 23: 244-254), эндогенные ингибиторы, такие как второй активатор каспаз митохондриального происхождения (SMAC), и те, функция которых является менее ясной, такие как MAGE-D1, NRAGE (Jordan et al., J. Biol. Chem. 2001; 276: 39985-39989).
BIR3 домен связывает и ингибирует каспазу-9, апикальную каспазу в митохондриальном пути активации каспазы. Бороздка на поверхности BIR3 домена взаимодействует с N-концом малой субъединицы каспазы-9, фиксируя каспазу-9 в ее неактивной мономерной форме с недостаточным каталитическим сайтом (Shiozaki et al., Mol. Cell 2003; 11: 519-527).
Помимо связывания каспазы, XIAP также ингибирует апоптоз через другие механизмы. XIAP образует комплекс с TAK1 киназой и ее кофактором TAB1, что приводит к активации путей сигнальной трансдукции JNK и MAPK, приводя, в свою очередь, к активации NFκB (Sanna et al., Mol Cell Biol 2002; 22: 1754-1766). XIAP также активирует NFκB путем промотирования NFκB транслокации к ядру и расщепления IκB (Hofer-Warbinek et al., J. Biol. Chem. 2000; 275: 22064-22068, Levkau et al., Circ. Res. 2001; 88: 282-290).
Клетки, трансфицированные XIAP, способны блокировать запрограммированную клеточную гибель в ответ на различные апоптические стимулы (Duckett et al., EMBO 1996; 15: 2685-2694, Duckett et al., MCB 1998; 18: 608-615, Bratton, Lewis, Butterworth, Duckett and Cohen, Cell Death and Differentiation 2002; 9: 881-892).
XIAP повсеместно экспрессируется во всех нормальных тканях, но его уровень патологически повышается во многих типах острого и хронического лейкоза, раке предстательной железы, раке легкого, ренальном раке и других типах опухолей (Byrd et al., 2002; Ferreira et al., 2001; Hofmann et al., 2002; Krajewska et al., 2003; Schimmer et al., 2003; Tamm et al., 2000). В de novo остром миелогенном лейкозе (AML) экспрессия XIAP соотносится с миеломоноцитарными Французский-Американский-Британский (FAB) подтипами M4/M5 (P<0,05) и экспрессией моноцитных маркеров в AML бластах. Кроме того, было обнаружено, что XIAP чрезмерно экспрессируется в нормальных моноцитах, но не поддается обнаружению в гранулоцитах. В AML экспрессия XIAP была значительно ниже у пациентов с благоприятной, но не со средней или плохой цитогенетикой (n=74; P<0,05) (Tamm et al., Hematol. J. 2004; 5(6): 489-95).
Чрезмерная экспрессия делает клетки резистентными к нескольким терапевтическим средствам и ассоциируется с плохим клиническим результатом при заболевании, включая AML, ренальный рак, меланому (Tamm et al., Clin. Cancer Research 2000; 6: 1796-1803) и рак легкого (Hofmann et al., J. Cancer Res. Clin. Oncology 2002; 128(10): 554-60).
XIAP транслируется кэп-независимым механизмом инициации трансляции, который опосредован уникальным элементом последовательности внутреннего сайта входа в рибосому (IRES), расположенным в его 5' нетранслируемой области. Это делает возможной активную трансляцию мРНК XIAP в условиях клеточного стресса, когда большая часть синтеза клеточных белков ингибируется. Трансляционная активация XIAP в ответ на стресс повышает резистентность к индуцированному облучением некрозу клеток (Holcik et al., Oncogene 2000; 19: 4174-4177).
Ингибирование XIAP было исследовано in vitro несколькими методами, включая РНК сайленсинг, генный нокаут, миметики пептидных лигандов и малые молекулы-антагонисты, и, как было показано, промотирует апоптоз в качестве монотерапии и сенсибилизирует многие типы опухолей к химиотерапии, в том числе опухоли мочевого пузыря (Kunze et al., 2008; 28(4B): 2259-63). Мыши с XIAP-нокаутом рождаются с ожидаемой по Менделю частотой, без каких-либо очевидных физических или гистологических дефектов, и имеют нормальную продолжительность жизни (Harlin et al., Mol. Cell Biol. 2001; 21(10): 3604-3608). Это говорит о том, что отсутствие XIAP активности не является токсичным в нормальных тканях и предполагает терапевтическое окно для опухолевых клеток. Было замечено, что регуляция уровней cIAP1 и cIAP2 повышается у мышей с XIAP-нокаутом и может защитить от патологии через компенсаторный механизм, и это дает основание предположить, что pan-ингибирование может быть необходимым для функционального нокаута. Подобным образом, мыши с cIAP1 и cIAP2 нокаутом также являются асимптоматическими (Conze et al., Mol. Biol. Cell 2005; 25(8): 3348-56). В то время как отсутствие любого одного из IAP не продуцировало никакого явного фенотипа у мышей, делеция cIAP1 с cIAP2 или XIAP приводила к средней эмбрионной летальности (Moulin, EMBO J., 2012).
Эндогенные антагонисты IAP, такие как SMAC, применяются для подтверждения членов этого семейства в качестве мишеней для терапевтических средств. SMAC пептиды хемосенсибилизируют опухолевые клетки, и в комбинации с препаратами платины и лигандом, индуцирующим связанный с фактором α некроза опухоли апоптоз (TRAIL) в ксенотрансплантатах, приводят к замедлению роста опухоли (Fulda et al., Nat. Med. 2002; 808-815; Yang et al., Cancer Res. 2003; 63: 831-837).
Природный продукт, эмбеллин, был идентифицирован как связывающийся на поверхностной бороздке BIR3 домена XIAP с подобным сродством, как природный SMAC пептид. Эмбеллин индуцирует апоптоз в клеточных линиях in vitro и приводит к замедлению роста опухоли в ксенотрансплантатах (Nikolovska-Coleska et al., J. Med. Chem. 2004; 47(10): 2430-2440; Chitra et al., Chemotherapy 1994; 40: 109-113).
XIAP антисмысловые олигонуклеотиды были разработаны как терапевтические средства для солидных опухолей и гематологических злокачественных заболеваний. Как было показано in vitro, эти антисмысловые олигонуклеотиды снижают уровни экспрессии белка на ~70%, индуцируют апоптоз и сенсибилизируют клетки к химиотерапии и замедляют рост опухоли in vivo. Одно из этих средств, AEG351156, было исследовано в клинических испытаниях (Hu et al., Clin. Cancer Res. 2003; 9: 2826-2836; Cummings et al., Br. J. Рак 2005; 92: 532-538).
Малые молекулы-антагонисты XIAP, которые были разработаны, включают пептидомиметики, а также синтетические средства. Пептидомиметики направленно действуют на BIR3 домен, имитируя разрушение посредством SMAC связывания каспаза-9 с XIAP, и показали индукцию апоптоза в различных опухолевых клеточных линиях при применении в качестве отдельного средства, а также являются хемосенсибилизаторами, и в настоящее время проходят дополнительные клинические исследования (Oost et al., J. Med. Chem. 2004; 47: 4417-4426; Sun et al., Bioorg. Med. Chem. Lett. 2005; 15: 793-797).
Синтетические малые молекулы-антагонисты BIR3 и BIR2 доменов также демонстрируют противоопухолевую активность в некоторых различных моделях, включая индукцию апоптоза с аннексин-V окрашиванием и значения ИК50<10 мкМ против более чем одной трети панели NCI60 клеточных линий. XIAP антагонисты также индуцировали дозо-зависимую клеточную гибель первично-культивированных лейкозных клеток в 5 из 5 клеточных линий хронического лимфоцитарного лейкоза и в 4 из 5 клеточных линий острого миелогенного лейкоза (Schimmer et al., Рак Cell 2004; 5: 25-35; Berezovskaya et al., Cancer Res. 2005; 65(6): 2378-86).
Высокие уровни XIAP белка в опухолевых клеточных линиях обратно соотносится с чувствительностью к некоторым противораковым лекарственным средствам, в частности, цитарабину и другим нуклеозидам (Tamm et al., Clin. Cancer Research 2000; 6: 1796-1803). XIAP ингибирование усиливает TRAIL-индуцированную противоопухолевую активность в двух предклинических моделях панкреатического рака in vivo (Vogler 2008). Исследования генной экспрессии и трансфекции говорят о том, что повышенная экспрессия супрессора апоптоза XIAP играет важную роль в резистентности к аноикису и в выживании циркулирующих клеток карциномы предстательной железы человека, промотируя, таким образом, метастазы. Было обнаружено, что малые молекулы-антагонисты являются анти-метастатическими в этих моделях (Berezovskaya et al., Cancer Res. 2005; 65(6): 2378-86).
Также было обнаружено, что XIAP вовлечен в другие пути, ассоциированные с раком и другими заболеваниями, и для этого также могут быть полезны XIAP-таргетирующие средства. Активность E3 лигазы RING пальцевого домена XIAP может обеспечить связывание как с TAB1, так и находящимся на этом пути выше BMP рецептором (тип 1), и это говорит о том, что XIAP может передавать сигнал в TGF-β-опосредованном пути (Yamaguchi et al., EMBO 1999; 179-187). Было показано, что чрезмерная экспрессия киназы фокальной адгезии (FAK) приводят к повышенной регуляции экспрессии XIAP (Sonoda et al., J. Biol. Chem. 2000; 275: 16309-16315). E3 лигазы являются привлекательными терапевтическими мишенями, и в настоящее время разрабатываются молекулы, которые направленно действуют на эту активность в других белках, таких как MDM2 (Vassilev et al., Science 2004; 303: 844-848). Непосредственное или опосредованное ингибирование активности XIAP лигазы также может быть полезным для лечения рака и других заболеваний. Нарушенная регуляция передачи сигналов апоптоза, которая может быть результатом ингибирования функции IAP, заключающейся в контроле запрограммированной клеточной гибели, также вовлечена во многие заболевания, включая расстройства, ассоциированные с клеточной аккумуляцией (например, рак, аутоиммунное заболевание, воспаление и рестеноз), или расстройства, где чрезмерный апоптоз приводит к потере клеток (например, удар, сердечная недостаточность, нейродегенерация, такая как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, амиотрофический боковой склероз, СПИД, ишемия (удар, инфаркт миокарда) и остеопороз).
XIAP является важным апоптическим регулятором в экспериментальном аутоиммунном энцефаломиелите и потенциальной фармакологической мишенью для лечения аутоиммунных заболеваний, таких как рассеянный склероз (MS) (Moore et al., 2004; 203(1): 79-93). Опосредованный антисмысловыми нуклеотидами нокдаун XIAP приводит к регрессии паралича в животной модели MS, и это говорит о том, что лечения, мишенью которых является XIAP, и возможно другие IAP, могут быть полезными для лечения MS (Hebb et al., Curr. Drug Disc. Tech. 2008; 5(1): 75-7).
cIAP1, cIAP-2, XIAP и сурвирин чрезмерно экспрессируются в злокачественной плевральной мезотелиоме и являются ответственными за высокую степень резистентности культивированных клеток мезотелиомы к цисплатину. Уровни циркулирующего TNF-α значительно выше у пациентов с мезотелиомой до хирургического уменьшения массы опухоли по сравнению с уровнями после хирургической операции. TNF-α повышает уровни мРНК и белка IAP-1, IAP-2 и XIAP (Gordon et al., 2007). Повышающая регуляция NF-κb играет важную для выживания роль в мезотелиомах в ответ на воспалительные эффекты воздействия асбестовых волокон (Sartore-Bianchi et al., 2007). IAP антагонисты обладают потенциалом, задающим обратное развитие про-выживающего эффекта TNF-α.
Способность клеточных линий повышать экспрессию TNF-альфа достаточно, чтобы действовать аутокринным образом и убивать клетки, как только cIAP1 & 2 истощаются, считается важной для IAP активности (Nature Reviews Cancer (2010), 10(8), 561-74, Gryd-Hansen, M). In vivo, однако, некоторые типы опухолей окружены сетью про-воспалительных цитокинов, и, следовательно, опухолевые клетки, которые при истощении cIAP1/2 переключаются на клеточную гибель посредством апоптоза, могут приводиться в действие, направленное на апоптоз, посредством TNF-альфа (или другими цитокиновыми агонистами рецептора апоптоза), который уже продуцируется окружающими клетками в микроокружении опухоли, такими как опухоль-ассоциированные макрофаги, или самими опухолевыми клетками. Некоторые типы опухолей, такие как рак молочной железы, рак яичника и меланома, демонстрируют этот «воспалительный фенотип», потенциальное прицельное действие на который могут оказывать IAP антагонисты.
cIAP1 и cIAP2
Клеточные IAP (cIAP) 1 и 2 являются близкородственными членами IAP семейства с тремя BIR доменами, RING доменом и каспаза-рекрутинговым (CARD) доменом. Функциональный ядерный экспортный сигнал существует в CARD домене cIAP1, который, как оказалось, является важным для клеточной дифференциации (Plenchette et al., Blood 2004; 104: 2035-2043). Присутствие этого CARD домена является уникальным для cIAP1 и cIAP2, входящих в IAP семейство белков. Эти два гена находятся в тандеме на хромосоме 11q22, и, учитывая высокую степень их сходства, считают, что их происхождение имело место в результате генной дупликации.
cIAP1, такой как XIAP и сурвирин, широко экспрессируется в опухолевых клеточных линиях, и высокие уровни его экспрессии были обнаружены, в частности, в колоректальных раках, а также раке легкого, раке яичника, ренальном раке, раке ЦНС и молочной железы (Tamm et al., Clin. Cancer Res. 2000; 6: 1796-1803). Экспрессия cIAP2, как правило, более ограничена, и считают, что она регулируется через конститутивное убихитинирование и расщепление посредством cIAP1 (Conze et al., Mol. Biol. Cell 2005; 25(8): 3348-56; Mahoney et al., PNAS 2008; 105: 11778-11783). Иммуногистохимический и вестерн-блот анализ определили cIAP1 и cIAP2 как потенциальные онкогены, поскольку они оба чрезмерно экспрессируются в различных типах рака легкого с или без большого числа копий (Dia et al., Human Mol. Genetics 2003; 12(7): 791-801). По-видимому, уровень экспрессии cIAP1 преимущественно играет важную роль в низкой стадии аденокарциномы (Hofmann et al., J. Cancer Res. Clin. Oncology 2002; 128(10): 554-60).
Повышенные уровни cIAP1 и cIAP2 и пониженные уровни эндогенных ингибиторов ассоциируются с хеморезистентностью, как это наблюдали для XIAP. Было обнаружено, что чрезмерная экспрессия cIAP соотносится с in vitro резистентностью к ДНК алкилирующим средствам, таким как карбоплатин, цисплатин и ингибитор топоизомеразы VP-16 (Tamm et al., Clin. Cancer Res. 2000; 6: 1796-1803). Было обнаружено, что уровни cIAP1 и сурвирина являются высокими в клетках рака щитовидной железы после лечения цисплатином и доксорубицином. Клетки, резистентные к химиотерапии, такой как таксол, демонстрировали пониженную экспрессию SMAC и высвобождали минимальные количества этого белка из митохондрий. Было обнаружено, что даун-регуляция cIAP1 и сурвирина повышает цитотоксичность цисплатина и доксорубицина, тогда как чрезмерная экспрессия SMAC повышает эффективность таксола. Однако сайленсинг cIAP1 и сурвирина посредством РНК интерференции восстанавливал чувствительность к доксорубицину и цисплатину (Tirrò et al.; Cancer Res. 2006; 66(8): 4263-72).
Изначально считалось, что SMAC миметики, такие как LBW242, преимущественно нацелены на XIAP. Однако исследования показали, что cIAP1 является мишенью для расщепления путем аутоубихитинирования в клетках (Yang et al., J. Biol. Chem. 2004; 279(17): 16963-16970) и мог способствовать апоптическим эффектам, которые имели место. Было обнаружено, что siРНК cIAP1 и индукция (или стимуляция) Фактора Некроза Опухоли (TNF)-альфа объединяются синергетически и делают клеточные линии более чувствительными (Gaither et al. Cancer Res. 2007; 67 (24): 11493-11498).
cIAP1 и cIAP2, как было продемонстрировано, являются критическими регуляторами сигнального пути NFκB, который вовлечен в различные биологические процессы, в частности, во врожденный и приобретенный иммунитет, а также в пролиферацию и выживание. Нарушение регуляции NFκB пути ассоциируется с воспалением и раковыми заболеваниями, включая гепатит и язвенный колит, гастрит, гепатоклеточную карциному колоректальный рак и различные типы гастрального рака, а также ангиогенез и метастазы (Shen et al., Апоптоз 2009; 14: 348-363).
При связывании с лигандом, TNF Рецептор (TNFR) осуществляет рекрутинг TNFR-ассоциированного Домена Апоптоза (TRADD) и взаимодействующего с рецептором белка (RIP) 1. Затем следует рекрутмент TRAF2 и cIAP1/cIAP2 с образованием большого мембранного комплекса. RIP1 убихитинируется, и эти полиубихитиновые цепи служат в качестве стыковочного сайта для действующих по ходу транскрипции киназ, приводя к эффектам пути передачи сигнала NFκB (Ea et al., Mol. Cell 2006; 22: 245-257; Wu et al., Nat. Cell Biol. 2006; 8: 398-406). Более широкие роли являются сложными и еще полностью не определены, но cIAP1 и cIAP2 определены в качестве ключевых компонентов TNF-альфа-опосредованной регуляции сигнального пути NFκB, а также конститутивного (лиганд-независимого/классического) сигнального пути NFκB (Varfolomeev et al., Cell 2007; 131(4): 669-81). Было показано, что cIAP1 и cIAP2 связываются с TRAF2, адаптерным белком, который функционирует как в классическом, так и в альтернативном NFκB путях, а также в MAPK сигнальном пути (Rothe et al., Cell 2005; 83: 1243-1252). cIAP1 и cIAP2 непосредственно нацелены на RIP1 для убихитинирования in vitro (Betrand et al., Mol. Cell 2008; 30: 689-700).
TNF-альфа регулирует многие клеточные функции, включая апоптоз, воспаление, иммунный ответ и клеточный рост и дифференциацию (Trace et al., Annu. Rev. Med. 1994; 45: 491-503), и терапевтические IAP антагонисты могут быть полезны при состояниях, где эти функции поражаются.
Продукцию TNF-альфа наблюдают во многих злокачественных опухолях, и он является одним из ключевых драйверов связанного с раком воспаления, который направляет развитие и/или прогрессирование опухоли. cIAP защищают раковые клетки от летальных эффектов TNF-альфа.
NAIP
NAIP был первым IAP, который был обнаружен (Roy et al., Cell 1995; 80: 167-178). NAIP является уникальным среди IAP, поскольку он обладает нуклеотид-связывающим и олигомеризационным доменом, а также лейцин-обогащенными повторами, аналогичными тем, которые содержатся в белках, обычно вовлеченных в врожденный иммунитет. Существуют показания, что NAIP также может чрезмерно экспрессироваться в некоторых типах рака, включая рак молочной железы и эзофагеальный рак (Nemoto et al., Exp. Mol. Pathol. 2004; 76(3): 253-9), а также MS (Choi et al., J. Korean Med. 2007; 22 Suppl: S17-23; Hebb et al., Mult. Sclerosis 2008; 14(5): 577-94).
ML-IAP
Ингибитор белка апоптоза меланомы (ML-IAP) содержит один BIR и RING пальцевый мотив. ML-IAP представляет собой сильный ингибитор апоптоза, индуцируемый рецепторами апоптоза и химиотерапевтическими средствами, возможно функционирующий как непосредственный ингибитор действующих по ходу транскрипции эффекторных каспаз (Vucic et al., Curr. Biol. 2000; 10(21): 1359-66). ML-IAP также известен как Бакуловирусный IAP повтор-содержащий белок 7 (BIRC7), ингибитор белка апоптоза почек (KIAP), белок Ring пальца 50 (RNF50) и Ливин. BIR домен ML-IAP содержит эволюционно сохранившуюся складку в молекуле, которая необходима для анти-апоптической активности. Было обнаружено, что большинство меланомных клеточных линий экспрессируют высокие уровни ML-IAP в отличие от первичных меланоцитов, которые экспрессировали неопределяемые уровни. Эти меланомные клетки были значительно более резистентными к лекарственно-индуцируемому апоптозу. Повышенная экспрессия ML-IAP делает меланомные клетки резистентными к апоптическим стимулам и, таким образом, потенциально способствует патогенезу этого злокачественного развития.
ILP-2
ILP-2, также известный как BIRC8, содержит один BIR домен и RING домен. ILP-2 экспрессируется только в мужских половых железах в нормальных клетках и связывается с каспазой 9 (Richter et al, Mol. Cell. Biol. 2001; 21: 4292-301).
Сурвирин
Сурвирин, также известный как BIRC5, ингибирует как каспазу 3, так и каспазу 7, но его основной функцией является регуляция митотической прогрессии, а не регуляция апоптоза. Сурвирин промотирует образование микротрубочек в митотическом веретене, противодействуя апоптозу на протяжении клеточного цикла. Ингибирование апоптоза сурвирином является плохим прогнозом при колоректальном раке (Kawasaki et al., Cancer Res. 1998; 58(22): 5071-5074) и стадии III рака желудка (Song et al., Japanese J. Clin. Oncol. 2009; 39(5): 290-296).
BRUCE
BRUCE (BIR повтор-содержащий убихитин-конъюгирующий фермент) представляет собой периферический мембранный белок в транс-Гольджи сети с одним BIR доменом, наиболее схожим с присутствующим в сурвирине. BRUCE ингибируется через три механизма: (i) SMAC связывание, (ii) HtrA2 протеаза и (iii) каспаза-опосредованное расщепление. Кроме того, BRUCE действует как E2/E3 убихитинлигаза через убихитин-конъюгирующий (UBC) домен.
Краткое описание изобретения
Настоящее изобретение обеспечивает соединения формулы (I). Настоящее изобретение обеспечивает соединения, которые являются полезными в терапии, в частности, для лечения рака. Соединения формулы (I) могут быть антагонистами IAP семейства белков (IAP), и особенно XIAP, и/или cIAP (таких как cIAP1 и/или cIAP2) и могут быть полезными для лечения IAP-опосредованных состояний.
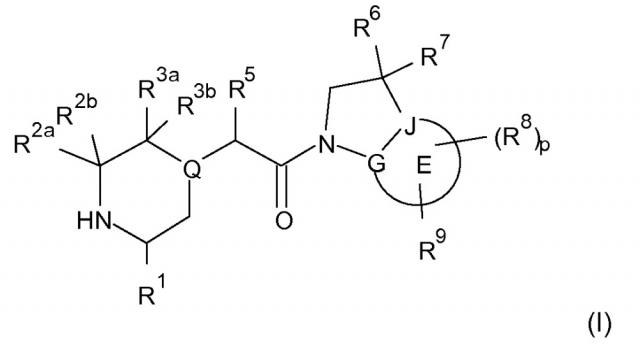
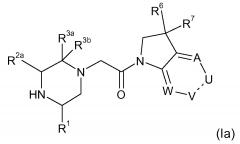
В соответствии с первым аспектом настоящего изобретения, обеспечивается соединение формулы (I):
или его таутомерные или стереохимически изомерные формы, N-оксиды, фармацевтически приемлемые соли или сольваты; где
Кольцо E представляет собой 6-членную ароматическую карбоциклическую или гетероциклическую группу;
G и J независимо выбраны из C или N;
Q представляет собой CR4 или N;
R1 выбран из C1-4 алкила, C2-4 алкенила и -(CH2)s-C3-8 циклоалкила, где указанный C1-4 алкил, C2-4 алкенил и C3-8 циклоалкил, необязательно, может быть замещен одной или несколькими группами Ra;
Ra выбран из галогена, -OH и -O-C1-6алкила;
R2a и R2b независимо выбраны из водорода, C1-6 алкила, C2-6 алкенила, C2-6 алкинила, -C(=O)NH(2-q)(C1-6 алкил)q, -(CH2)s-(3-12-членный гетероциклил) и -(CH2)s-C3-12 карбоциклила,
или R2a и R2b группы, вместе с атомом углерода, с которым они связаны, могут объединяться с образованием 3-10-членной насыщенной карбоциклической или гетероциклической группы, где указанные C1-6 алкильные, C2-6 алкенильные, C2-6 алкинильные, гетероциклические и карбоциклические группы, необязательно, могут быть замещены одной или несколькими группами Rb;
R3a и R3b независимо выбраны из водорода, C1-6 алкила, C2-6 алкенила, C2-6 алкинила, -C(=O)NH(2-q)(C1-6 алкил)q, -(CH2)s-(3-12-членный гетероциклил), -(CH2)s-C3-12 карбоциклила, -C(=O)-(3-12-членный гетероциклил) и -C(=O)-C3-12 карбоциклила,
или R3a и R3b группы, вместе с атомом углерода, с которым они связаны, могут объединяться с образованием 3-10-членной насыщенной карбоциклической или гетероциклической группы, где указанные C1-6 алкильные, C2-6 алкенильные, C2-6 алкинильные, гетероциклические и карбоциклические группы, необязательно, могут быть замещены одной или несколькими группами Rb;
R4 выбран из водорода, C1-6 алкила, C2-6 алкенила, C2-6 алкинила, -C(=O)NH(2-q)(C1-6 алкил)q, -(CH2)s-(3-12-членный гетероциклил), -(CH2)s-C3-12 карбоциклила, -C(=O)-(3-12-членный гетероциклил) и -C(=O)-C3-12 карбоциклила, где указанные C1-6 алкильные, C2-6 алкенильные, C2-6 алкинильные, гетероциклические и карбоциклические группы, необязательно, могут быть замещены одной или несколькими группами Rb;
R5 выбран из водорода, C1-6 алкила, C2-6 алкенила, C2-6 алкинила, -(CH2)s-C3-8 циклоалкила и -(CH2)s-C3-8 циклоалкенила, где указанный C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-8 циклоалкил и C3-8 циклоалкенил, необязательно, может быть замещен одной или несколькими группами Ra;
R6 и R7 независимо выбраны из водорода, C1-8 алкила, C2-8 алкенила, C2-8 алкинила, -Y-C3-12 карбоциклила, -Z-(3-12-членный гетероциклил), -(CRxRy)s-O-Rz, -O-(CRxRy)n-ORz, -(CH2)s-CN, -S(O)q-Rx, -C(=O)Rx, -C(=S)Rx, -C(=N)Rx, -(CRxRy)s-C(=O)ORz, -(CRxRy)s-O-C(=O)-Rz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxC(=O)Ry, -(CH2)s-OC(=O)NRxRy, -(CH2)s-NRxC(=O)ORy, -(CH2)s-NRxRy, -NRx-(CH2)s-Rz, -(CRxRy)s-C(=S)NRz, -(CRxRy)s-C(=N)NRz, -(CH2)s-O-C(=O)-C1-4алкил-NRxRy, -(CH2)s-NRx-(CH2)n-O-C(=O)-Rz, -(CH2)s-NRx-(CH2)s-SO2-Ry, -(CH2)s-NH-SO2-NRxRy и -(CH2)s-SO2NRxRy групп,
или R6 и R7 группы, вместе с атомом углерода, с которым они связаны, могут объединяться с образованием 3-10-членной частично или полностью насыщенной карбоциклической или гетероциклической группы, и которая, необязательно, может быть конденсирована с 5-6-членным ароматическим карбоциклическим или гетероциклическим кольцом,
где указанные C1-8 алкильные, C2-8 алкенильные и C2-8 алкинильные группы, необязательно, могут быть замещены одной или несколькими группами Rb, и где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb;
R8 и R9 независимо выбраны из водорода, галогена, C1-8 алкила, C2-8 алкенила, C2-8 алкинила, -Y-C3-12 карбоциклила, -Z-(3-12-членный гетероциклил), -(CRxRy)s-O-Rz, -O-(CRxRy)n-ORz, =O, =S, нитро, Si(Rx)4, -(CH2)s-CN, -S(O)q-(CRxRy)s-Rz, -C(=O)Rx, -C(=S)Rx, -C(=N)Rx, -(CRxRy)s-C(=O)ORz, -(CRxRy)s-O-C(=O)-Rz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxC(=O)Ry, -(CH2)s-OC(=O)NRxRy, -(CH2)s-NRxC(=O)ORy, -(CH2)s-NRxRy, -NRx-(CH2)s-Rz, -(CRxRy)s-C(=S)NRz, -(CRxRy)s-C(=N)NRx, -S(O)(=NRx)Ry, -(CH2)s-O-C(=O)-C1-4алкил-NRxRy, -(CH2)s-NRx-(CH2)n-O-C(=O)-Rz, -(CH2)s-NRx-(CH2)s-SO2-Ry, -(CH2)s-NH-SO2-NRxRy, -(CH2)s-SO2NRxRy групп и -P(=O)(Rx)2, где указанные C1-8 алкильные, C2-8 алкенильные и C2-8 алкинильные группы, необязательно, могут быть замещены одной или несколькими группами Rb, и где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb;
Rb независимо выбран из галогена, C1-6 алкила, C2-6 алкенила, C2-6 алкинила, -(CH2)s-C3-8 циклоалкила, -(CH2)s-C3-8 циклоалкенила, -(CH2)s-фенила, -(CH2)s-(4-7-членный насыщенный гетероциклил), -(CRxRy)s-O-Rz, -O-(CRxRy)n-ORz, галогенC1-6 алкила, галогенC1-6 алкокси, C1-6 алканола, =O, =S, нитро, Si(Rx)4, -(CH2)s-CN, -S(O)q-Rx, -C(=O)Rx, -(CRxRy)s-C(=O)ORz, -(CRxRy)s-O-C(=O)-Rz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxC(=O)Ry, -(CH2)s-OC(=O)NRxRy, -(CH2)s-NRxC(=O)ORy -(CH2)s-NRxRy, -NRx-(CH2)s-Rz, -(CH2)s-O-C(=O)-C1-4алкил-NRxRy, -(CH2)s-NRx-(CH2)n-O-C(=O)-Rz, -(CH2)s-NRx-(CH2)s-SO2-Ry, -(CH2)s-NH-SO2-NRxRy, -(CH2)s-SO2NRxRy групп и -P(=O)(Rx)2, где указанные C1-6 алкильные, C2-6 алкенильные, C2-6 алкинильные, C3-8 циклоалкильные, C3-8 циклоалкенильные и гетероциклические группы, необязательно, могут быть замещены одной или несколькими группами Rx;
Rx, Ry и Rz независимо представляют собой галоген, водород, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, -(CH2)s-C3-8 циклоалкил, -(CH2)s-C3-8 циклоалкенил, -(CH2)s-фенил, -(CH2)s-(4-7-членный насыщенный гетероциклил), C1-6 алканол, необязательно замещенный одним или несколькими галогенами, -C(=O)OC1-6 алкил, гидрокси, C1-6 алкокси, галогенC1-6 алкил, -(CH2)n-O-C1-6алкил, -C(=O)-(CH2)n-C1-6алкокси, -C(=O)-C1-6алкил, -(CH2)s-CN, C1-6 алкил-N(H)2-q(C1-6алкил)q, -N(H)2-q(C1-6алкил)q, -C(=O)-N(H)2-q(C1-6алкил)q, -(CH2)s-NH-SO2-N(H)2-q (C1-6алкил)q, -(CH2)s-N(C1-4алкил)-SO2-N(H)2-q(C1-6алкил)q и -(CH2)s-O-C(=O)-C1-4алкил-N(H)2-q(C1-6алкил)q, и, когда они связаны с атомом азота, углерода, кремния или фосфора, Rx и Ry могут объединяться с образованием 3-7-членного кольца, необязательно содержащего один или два дополнительных гетероатома, выбранных из O, N, S и окисленных форм N или S;
Y и Z независимо выбраны из связи, -(CRxRy)m-, -C(=CRx)-, -C(=O)-, -NRx, -C(=O)NRx-, -NRxC(=O)-, -(CRxRy)q-O-, -O-(CRxRy)q-, -S(O)2-NH, NH-S(O)2- и -S(O)q-;
s независимо представляет собой целое число, имеющее значение 0-4;
n независимо представляет собой целое число, имеющее значение 1-4;
p независимо представляет собой целое число, имеющее значение 0-4;
q представляет собой целое число, имеющее значение 0-2; и
m представляет собой целое число, имеющее значение 1-2.
В следующем аспекте настоящего изобретения обеспечиваются соединение формулы (I) для применения в профилактике или лечении заболевания или состояния, описанного в настоящей заявке, фармацевтические композиции, включающие соединение формулы (I), и способы синтеза соединения формулы (I).
Определения
Если в контексте не указано иное, ссылки на формулу (I) во всех разделах настоящего документа (включая применения, способы и другие аспекты настоящего изобретения) включают ссылки на все другие подформулы, подгруппы, предпочтения, варианты воплощения и примеры, определенные в настоящей заявке.
Под “IAP” подразумевается любой из членов IAP семейства XIAP, cIAP (cIAP1 и/или cIAP2), NAIP, ILP2, ML-IAP, сурвирин и/или BRUCE, в частности, XIAP, cIAP1, cIAP2, ML-IAP, более конкретно, XIAP, cIAP1 и/или cIAP2, особенно XIAP и/или cIAP1. В частности, подразумеваются BIR домены IAP, в особенности, BIR домены XIAP, cIAP1 или cIAP2.
Под выражением “один или несколько членов IAP семейства” подразумеваются любые из членов IAP семейства, в частности, XIAP, cIAP1 и/или cIAP2, более конкретно, XIAP и/или cIAP1.
“Действенность” представляет собой показатель активности лекарственного средства, выражаемый как количество, необходимое для обеспечения эффекта определенной силы. Высокодейственное лекарственное средство вызывает более сильный ответ при низких концентрациях. Действенность пропорциональна сродству и эффективности. Сродство означает способность лекарственного средства к связыванию с рецептором. Эффективность означает взаимосвязь между занятостью рецептора и способностью инициировать ответ на молекулярном, клеточном, тканевом или системном уровне.
Термин “антагонист” относится к типу лиганда рецептора или лекарственного средства, который блокирует или подавляет агонист-опосредованные биологические ответы. Антагонисты обладают сродством, но не агонистической эффективностью в отношении их родственных рецепторов, и связывание будет разрушать взаимодействие и ингибировать функцию любого лиганда (например, эндогенных лигандов или субстратов, агониста или обратного агониста) на рецепторах. Антагонизм может возникать непосредственно или опосредованно и может быть опосредован любым механизмом и на любом физиологическом уровне. Примером опосредованного антагонизма может быть опосредованный антагонизм cIAP как результат убихинирования cIAP, в результате чего происходит его расщепление. Как результат, антагонизм лигандов может в разных обстоятельствах проявляться функционально различными путями. Антагонисты опосредуют их эффекты путем связывания с активным сайтом или с аллостерическими сайтами на рецепторах, или они могут взаимодействовать на уникальных сайтах связывания, которые в нормальных условиях не вовлечены в биологическую регуляцию активности рецептора. Антагонистическая активность может быть обратимой или необратимой, в зависимости от долговечности комплекса антагонист-рецептор, которая, в свою очередь, зависит от природы связывания антагониста с рецептором.
Термин «лечение», как он используется в настоящей заявке в контексте лечения состояния, т.е. состояния, расстройства или заболевания, как правило, относится к лечению и терапии, либо в применении к человеку, либо животному (например, для применения в ветеринарии), при котором достигается некоторый желаемый терапевтический эффект, например, ингибирование прогрессирования состояния, и включает уменьшение скорости прогрессирования, задержку скорости прогрессирования, улучшение состояния, ослабление или облегчение по меньшей мере одного симптома, связанного с, или вызванного, состоянием, подлежащего лечению, и излечение такого состояния. Например, лечение может означать ослабление одного или нескольких симптомов расстройства или полную ликвидацию расстройства.
Термин “профилактика” (т.е. применение соединения для профилактических целей), как он используется в настоящей заявке в контексте лечения состояния, т.е. состояния, расстройства или заболевания, как правило, относится к профилактике или предотвращению, либо в применении к человеку, либо животному (например, для применения в ветеринарии), при котором достигается некоторый желаемый превентивный эффект, например, предотвращение возникновения заболевания или защита от заболевания. Профилактика включает полное и общее блокирование всех симптомов расстройства на неопределенный период времени, просто замедление возникновения одного или нескольких симптомов заболевания или обеспечение меньшей вероятности возникновения заболевания.
Ссылки на профилактику или лечение заболевания или состояния, такого как рак, включают в своем объеме облегчение симптомов или уменьшение вероятности возникновения рака.
Как он используется в настоящей заявке, термин “опосредованный”, используемый, например, в связи с IAP, как описано в настоящей заявке (и в применении, например, к различным физиологическим процессам, заболеваниям, состояниям, терапиям, лечениям или вмешательствам) следует рассматривать как ограничительный, т.е. различные процессы, заболевания, состояния, лечения и вмешательства, к которым применим этот термин, представляют собой такие, в которых этот белок играет биологическую роль. В случаях, когда термин применяют к заболеванию или состоянию, биологическая роль, которую выполняет белок, может быть непосредственной или опосредованной и может быть необходимой и/или достаточной для проявления симптомов заболевания или состояния (или его этиологии или прогрессирования). Таким образом, функция белка (и, в частности, аберрантные уровни функции, например, чрезмерная или недостаточная экспрессия) необязательно должна быть проксимальной причиной заболевания или состояния: скорее считаетс