Способ терапии метастатического рака с использованием вируса сендай
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии, и может быть использовано для лечения метастатического рака у пациентов. Для этого предварительно у пациента определяют процентное содержание Т-цитотоксических лимфоцитов субпопуляции CD8 периферической крови с рецепторами программированной клеточной смерти (PD-1) по отношению к общему числу лимфоцитов указанной субпопуляции (содержание PD-1-позитивных Т-лимфоцитов). Лечение осуществляют в три этапа. На первом этапе осуществляют проведение комплексной процедуры, включающей воздействие на поверхность кожи пациента импульсно-периодическим лазерным излучением и последующее введение в зону указанного воздействия композиции, содержащей вирус Сендай, либо введение рекомбинантного человеческого БТШ70 (Препарат-1 БТШ70). На втором этапе повторно назначают указанные комплексные процедуры и дополнительно вводят гибридный белок на основе рчБТШ70 и Fc-фрагмента человеческого иммуноглобулина G (Препарат-2 БТШ70). На третьем этапе в зависимости от размера опухоли, метаболической активности опухолевой ткани, содержания PD-1-позитивных Т-лимфоцитов дополнительно пациенту назначают позитрон-излучающий радионуклид, конъюгированный с опухоль-специфической субстанцией. Изобретение обеспечивает лечение метастатического рака у пациента. 22 з.п. ф-лы, 22 табл., 8 пр.
Реферат
Изобретение относится к медицине, а именно к онкологии и иммунологии, точнее к способам комбинированной терапии онкопатологии с использованием биологических, лазерных и ядерных технологий, и может быть использовано для лечения больных с распространенным и метастатическим раком, в частности раком легкого, молочной железы, колоректальным раком, раком поджелудочной железы, почки, простаты, раком яичников, матки, желудка и т.п.
В настоящее время метастатический рак по-прежнему остается во многих случаях неизлечимым заболеванием. По официальной статистике, около трети жителей России, болеющих раком, умирают в течение года после того, как им поставили диагноз. Из этой трети 90% смертей связано с метастазированием опухолей. В целом у больных с метастазами злокачественных новообразований медиана выживаемости (время, к которому умирают 50% больных) составляет 147 дней [105].
Традиционные терапевтические схемы, основанные преимущественно на комплексном применении химио- и радиотерапии, остаются малоэффективными, особенно для больных с метастазами. В частности, в работах ряда исследователей приводятся данные, свидетельствующие о том, что лечебный эффект от химиотерапии проявляется у одного из четырех раковых больных; что химиотерапия практически не дает выраженного положительного результата при лечении, например плоскоклеточного рака легких или аденокарциномы поджелудочной железы; что эффективность химиотерапии в 5-летней выживаемости стремится к нулю при раке поджелудочной железы, яичников, мочевого пузыря, предстательной железы, почки, желудка и т.д. С другой стороны, классические виды терапии обладают целым рядом побочных эффектов, и, в первую очередь, выраженным иммунодепрессивным эффектом. Это обусловлено, тем, что принцип лечебного действия как химио-, так и радиотерапии, базируется на более высокой скорости развития опухолевой массы в сравнении с регенерирующими клетками здоровых органов и тканей, однако на практике химиопрепараты и облучение повреждают не только опухолевые клетки, но и быстро обновляющиеся клетки пищеварительного тракта, костного мозга, волосяных фолликулов и т.д., что может приводить к таким негативным последствиям как алопеция, изъязвление слизистых оболочек и т.п. [99, 100]. Отмечается также низкая эффективность классических методов терапии в плане предупреждения прогрессирования онкологических заболеваний [106].
В этой связи, в современных условиях особую актуальность приобретает создание оригинальных методов и средств, позволяющих повысить эффективность лечения онкопатологии при сокращении побочных эффектов.
Примером оригинального пути решения проблем в сфере терапии рака может служить способ позитронной терапии метаболически активного метастатического рака [24, 127], примененный в эксперименте на моделях меланомы, рака груди, рака толстой кишки. Предложенный способ предусматривает внутривенное введение пациенту позитрон-излучающего радиофармпрепарата (далее по тексту - «П-РФП») в качестве которого используют глюкозу, меченную 18F, или ее аналоги, в частности 2-фтор-[18F]-2-дезокси-D-глюкозу (18F-ФДГ), в дозе более 15 мКи, но не более 10 Ки на пациента.
18F-ФДГ традиционно применяется в качестве РФП для позитронной эмиссионной томографии (далее по тексту - «ПЭТ») при исследовании опухолей различной локализации [121, 122]. Использование 18F-ФДГ в качестве диагностического средства основано на том, что при внутривенном введении указанный П-РФП повторяет начальный этап метаболического пути глюкозы, проникая из сосудистого русла в клетки, где фосфорилируется фосфокиназами с образованием 18F-дезокси-глюкоза-6-фосфата, который не вступает в дальнейшие реакции и накапливается в клетках [24]. Соответственно, терапевтическое действие 18F-ФДГ в рассматриваемом способе-аналоге базируется на системной доставке радионуклида 18F как в первичные очаги, так и в зоны регионарного метастазирования, и взаимодействии испускаемых данным радионуклидом позитронов с окружающими тканями. Предполагается, что позитроны способны вызывать гибель раковых клеток, реализуя те же механизмы воздействия на живую клетку, что и электроны - повреждения структуры и функций ДНК, грубые нарушения свойств белков, цитоплазмы, ферментов, всех метаболических процессов, и, как следствие, индуцирование некроза/апоптоза неопластических клеток [24].
Однако известный способ-аналог не обеспечивает достижения технического результата заявленного способа. Учитывая, что 18F-ФДГ характеризуется низкой специфичностью (физиологически накапливается в ткани головного мозга и миокарде, а также в органах выделения) [24], использование в способе-аналоге доз облучения (до 370000 МБк), значительно превышающих диагностические дозы (130-550 МБк на пациента [122, 123]), существенно увеличивает вероятность развития лучевых поражений активно-функционирующих органов и тканей. Негативное влияние на эффективность лечения с использованием рассматриваемого способа-аналога может оказывать также наличие в популяции клеток опухоли (у абсолютного большинства опухолей) субпопуляции раковых стволовых клеток (далее по тексту - «РСК»), обладающих максимальной степенью независимости от внешних сигналов, мультипотентностью, самой высокой пролиферативной активностью среди всех опухолевых клеток, способностью к бесконечному самообновлению и восстановлению поврежденной ДНК. РСК чрезвычайно устойчивы ко всем известным видам лечения, в том числе к радиотерапии, в частности за счет их экстремальной устойчивости к апоптозу. Именно поэтому после, например, тяжелого ионизирующего облучения РСК не погибают, а активизируют восстановление повреждений ДНК и через какое-то время вновь приобретают способность к делению. Однако процесс репарации ДНК может сопровождаться новыми мутациями, в результате чего РСК становятся еще злокачественнее. Таким образом, субпопуляция РСК, которая обеспечивает радиорезистентность опухоли, с большой вероятностью может служить источником рецидива опухоли после облучения [123].
К числу наиболее перспективных направлений, где могут быть успешно реализованы принципиально новые подходы к решению основных проблем лечения онкопатологии, в настоящее время относят биотерапию, в частности иммунотерапию, вирусную терапию и вакцинотерапию рака.
Примером подобного подхода, названного «прорывным» в иммунотерапии, является применение моноклональных антител, блокирующих ключевые рецепторы, отвечающие, в частности, за программируемую гибель клеток. Разработка препаратов данной группы базировалась на том, что одной из стратегий ускользания рака от надзора иммунной системы является использование «тормозных» механизмов, которые в норме служат для контроля выраженности и длительности иммунного ответа, что позволяет предотвратить развитие аутоиммунной агрессии и повреждение собственных тканей. Это реализуется, в частности, благодаря существованию «Иммунологических контрольных точек» (от англ. «Immunological checkpoints))) - системы ингибиторных механизмов, которые регулируют активацию иммунного ответа, препятствуя запуску аутоиммунных процессов (далее по тексту - «ИКТ»). При прогрессии злокачественной опухоли ИКТ блокируют иммунную реакцию в отношении опухолевых клеток. В ответ на попытку иммунокомпетентной клетки уничтожить опухолевую клетку, последняя усиливает экспрессию находящихся на ее поверхности молекул-лигандов, в результате чего при взаимодействии этих лигандов с рецептором опухоль-специфического лимфоцита ингибирующие сигналы будут преобладать над ко-стимулирующими и лимфоцит не будет атаковать опухолевую клетку. Предотвращая таким образом активацию опухоль-специфических лимфоцитов, опухоль приобретет устойчивость к действию иммунной системы [2, 112, 64,].
К наиболее изученным из ИКТ относятся белок CTLA-4, белок программируемой клеточной гибели PD-1 (от англ. «Programmed cell Death 1») и белок Tim-3 (от англ. «Т cell immunoglobulin and mucin-domain-containing molecule 3»). PD-1 экспрессируется на поверхности активированных эффекторных Т-лимфоцитов и имеет два лиганда PD-L1 и PD-L2. Взаимодействие рецептора с лигандом на поверхности антиген-презентирующих клеток или клеток-мишеней является стимулом, угнетающим активность Т-лимфоцитов, вызывающим их апоптоз. Tim-3 экспресируется на поверхности активированных эффекторных Т-лимфоцитов, преимущественно в сочетании с рецептором PD-1, и имеет четыре лиганда: галектин-9 (Gal-9), HMGB-1 (амфотерин), фосфатидилсерин (PtdSer) и молекула клеточной адгезии, относящаяся к карциноэмбриональному антигену-1 (Сеасат-1) [2, 72, 56, 49, 60].
В настоящее время известны способы иммунотерапии с применением препаратов (моноклональных антител), блокирующих рецептор PD-1 (ниволюмаб /Opdivo®/, пембролизумаб /Keytruda®/) или лиганд PD-L1 (атезолизумаб); рецептор CTLA-4 (ипилимумаб), у пациентов с метастатической меланомой, немелкоклеточным раком легкого, раком почек и раком мочевого пузыря [2, 111, 112, 113, 114]. Указанные анти-PD-1 и анти-PD-L1 моноклональные антитела вводят внутривенно курсами продолжительностью до 6 мес.Эффективность лечения, оцениваемая, в частности, по частоте объективных ответов, в зависимости от вида опухоли и конкретного препарата варьировала в диапазоне 10,9-40,0%, при этом токсичность, как частота нежелательных явлений всех степеней и частота нежелательных явлений 3-4 степени (далее по тексту - «ЧНЯ3-4»), находилась в пределах 42-52 и 7,6-42,0%, соответственно. Имеются сведения, что эффективность терапии возрастала с повышением дозы препарата, однако при этом ЧНЯ3-4 превышала 50%. В частности, имеются данные, что использование ипилимумаба в сочетании с ниволюмабом обеспечивало частоту объективных ответов 40%, при этом ЧНЯ3-4 возрастала до 62%.
Использование блокаторов ИКТ не позволяет получить технический результат заявленного изобретения по следующим причинам. Вмешательство в супрессорные механизмы приводит к тому, что стимулированная иммунная система может атаковать здоровые органы - кишечник, печень, легкие, почки, надпочечники, поджелудочную железу, сердце и т.д., вызывая их аутоиммунные поражения. Предполагается, что этот эффект связан с активацией синтеза противовоспалительного цитокина интерлейкина 10 (IL-10) [5, 7, 44].
В настоящее время считается признанным, что способность к индукции иммунного ответа у опухолей различна и определяется их биологическими свойствами [117]. Это является важным фактором, определяющим эффективность иммунотерапии, в том числе основанной на применении ингибиторов ИКТ. Так, по результатам клинических наблюдений установлено, что малоиммуногенные опухоли не отвечают на указанную терапию [2]. Одной из причин неимунногенности может являться отсутствие или низкий уровень экспрессии опухоль-ассоциированных антигенов опухолевыми клетками, что определяется биологическими особенностями данных клеток [117]. В этом случае активация реактивированных Т-клонов лимфоцитов в результате введения рассматриваемых препаратов может приводить к еще большей стимуляции аутоиммунной агрессии. Кроме того, вероятность высокого содержание Т-лимфоцитов с пониженной функциональной активностью, которое может быть обусловлено индивидуальным воздействием опухоли на иммунокомпетентные клетки, будет негативно влиять на эффективность данной терапии. Также предполагается [2], что каждый конкретный препарат подобного типа, основанный на нейтрализации ингибирующего сигнала, передающегося через определенную ИКТ, может приводить к реактивации противоопухолевого иммунного ответа только в случае, если сигнальные каскады в данной ИКТ способны оказывать доминантный эффект в неоплазии данного пациента.
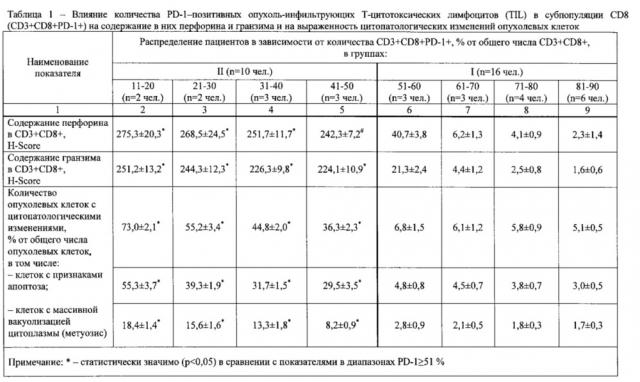
И наконец, имеются сведения, что блокаторы PD-1 рецепторов могут вызывать прогрессирование (гиперпрогрессию) опухолей [68, 69]. Это связывают с компенсаторной активацией Tim-3 рецепторов на поверхности Т-лимфоцитов, особенно субпопопуляции CD3+CD8+PD-1+Tim-3+, которые наиболее эффективно подавляют противоопухолевый иммунный ответ [70, 71].
Известно применение блокаторов ИКТ в сочетании с противовоспалительными препаратами, такими как блокаторы фактора некроза опухоли (TNF), интерлейкина 1 (IL-1), кортикостероиды [9, 10, 11]. На основании результатов клинических наблюдений авторами цитируемых источников информации сделан вывод, что подобная сочетанная терапия препятствует развитию серьезных аутоиммунных осложнений. Однако, по мнению авторов заявленного изобретения, введение противовоспалительных препаратов полностью исключает (особенно в случае неиммуногенных опухолей) или значимо снижает возможность достижения целевого противоопухолевого эффекта, что, соответственно, приводит к прогрессированию онкозаболевания.
Известен способ терапии опухолевых заболеваний, в частности опухолей мозга и меланомы, с применением рекомбинантного человеческого БТШ70 (далее по тексту - «рчБТШ70»), полученного с использованием штамма-продуцента Е. coli ВВ, трансформированного векторной плазмидой pMSHsp70 [3П]. Указанный препарат БТШ70 вводят в виде раствора интратуморально в однократной суточной дозе 0,5 мг белка. Лечение включает введение указанного препарата курсом из 5-8 инъекций с интервалом 1-2 дня. Интратуморальное введение БТШ70 в модели внутричерепной глиомы С6 у крыс приводило к замедлению роста опухоли, увеличению количества CD8+ лимфоцитов, специфических к клеткам опухоли, и, как следствие, увеличению продолжительности жизни животных. Технология внутриопухолевого введения препарата очищенного рчБТШ70 была использована в ограниченном исследовании на пациентах с опухолями мозга, которое показало безопасность технологии, ее пригодность и эффективность для нейроонкологических больных.
Экспериментально установлено, что терапевтический эффект таргетного введения экзогенного БТШ70 по способу-аналогу [3П] основывается на феномене транслокации внутриклеточного шаперона под влиянием экзогенного очищенного БТШ70. В рамках концепции противоопухолевого действия БТШ70, при введении в опухоль экзогенный БТШ70 проникает внутрь опухолевых клеток и вытесняет собственный эндогенный БТШ70 как на поверхность мембраны опухолевой клетки, так и в микроокружение опухоли. Мембранно-связанный БТШ70, взаимодействуя с рецептором CD94 на поверхности натуральных киллеров (NK-клеток), вызывает активацию их цитолитической функции, что свидетельствует об активации врожденного иммунного ответа. Внеклеточный БТШ70 в комплексе с опухолевыми пептидами может связываться с антиген-презентирующими клетками (ДК) с последующей презентацией опухолевых антигенов в комплексе с антигенами главного комплекса гистосовместимости класса 1 (МНС-1) и развитием специфического противоопухолевого иммунного ответа. Таким образом, опухолевые клетки уничтожают либо NK-клетки, узнавая антигены, находящиеся на поверхности опухоли, либо Т-лимфоциты по специфическому механизму (13, 124].
Однако указанный способ-аналог не позволяет получить технический результат, достигаемый при реализации заявленного способа, так как набор опухолевых антигенов, который выходит из раковых клеток с эндогенным БТШ70 представляет небольшую часть от их общего репертуара, недостаточную для получения целевого иммунного ответа. Клональная эволюция опухоли изменяет антигенный состав опухоли и ее метастазов, что приводит к снижению эффективности иммунотерапии рака (14, 15). Для ее повышения необходимо получить иммунную реакцию против расширенного спектра опухолевых антигенов с учетом его гетерогенности в опухоли и ее метастазах (50).
Известно применение белков теплового шока-70 (далее по тексту - «БТШ70»), в частности рчБТШ70), и гибридных белков на основе БТШ70, обладающих пролонгированным действием, для лечения рака, в частности меланомы в эксперименте [124, 125]. Гибридный белок на основе БТШ70 содержит молекулу БТШ70 и соединенный с ней Fc-фрагмент, идентичный нативному константному Fc-фрагменту иммуноглобулина G человека (IgG), которые дополнительно сшиты линкерным фрагментом (далее по тексту - «БТШ70-Fc»). Препараты БТШ70 и БТШ70-Fc вводили интратуморально в дозе 50 мкг/мышь на 12-й, 14-й и 16-й дни эксперимента. Установлено, что в группах животных, которым вводили указанные препараты БТШ70, значительно уменьшился (по сравнению с контролем) рост опухоли, увеличилось время выживания, снизилось количество случаев метастазирования и среднее число метастазов на одно животное. При этом снижение указанных показателей в группе мышей, получавших рчБТШ70-Fc, было существенно выше, чем у животных, получавших БТШ70.
Известно применение БТШ70 и БТШ70-Fc, меченных радиоактивными изотопами йода (1-123, 1-124, 1-125 или 1-131), для лечения рака, в частности меланомы в эксперименте [4П, 5П]. Препараты БТШ70 и БТШ70-Fc, меченные радиоактивными изотопами, были приготовлены путем йодирования в осадках тирозина и гистидина с использованием гранул радиоактивного йода. Результаты исследований биораспределения 123I-БТШ70 и 123I-БТШ70-Fc показали преимущественное накопление 123I-БТШ70-Fc в опухоли (12-ти кратное превышение по сравнению с накоплением другими исследуемыми органами). Двукратное внутривенное введение 131I-БТШР70 и 131I-БТШ70-Fc мышам двух групп (на 12 и 16 сут после введения опухолевых клеток, в дозе 2×18,5 МБк, которая обеспечивала поступление 49 Гр в опухоль) привело к значительному снижению роста опухоли, увеличению времени выживания, уменьшению количества животных с метастазами, а также числа метастазов на мышь. При этом эффективность применения меченных радиоактивным йодом БТШ70 и БТШ70-Fc превышала эффективность немеченых БТШ70 и БТШ70-Fc, а противоопухолевый эффект 131I-БТШ70-Fc был наиболее выражен в сравнении с другими препаратами.
Лечение рака с использованием гибридных белков пролонгированного действия на основе БТШ70 и Fc-фрагмента IgG позволяет получить более выраженный защитный противоопухолевый иммунный эффект в сравнении с немодифицированным БТШ70. Однако применение конъюгатов БТШ70 с радионуклидами сопряжено с относительно высоким риском поражения здоровых органов и тканей (печень, почки, миокард, головной мозг, мышцы) при неспецифическом накоплении в них этих конъюгатов.
Перспективным направлением биотерапии является вакцинотерапия, базирующаяся на использовании отдельных антигенов или их комплексов, и представляющая собой активную специфическую иммунотерапию, в основе которой лежит стимуляция иммунного ответа пациента на собственную опухоль. В настоящее время исследуются и проходят клинические испытания различные виды вакцин, в частности вакцины на основе цельных опухолевых клеток (аутологичных или аллогенных), пептидные вакцины, вакцины на основе ДК и т.п. Повышение иммуногенности вакцин может достигаться использованием адъювантов - компонентов или факторов, стимулирующих иммунный ответ на антиген и (или) модулирующих желательные иммунные реакции. Адъюванты могут быть непосредственно включены в состав вакцин, например вакцины на основе БТШ, вакцины на основе вирус-модифицированных опухолевых клеток и т.п.Адъюванты также могут представлять собой различного рода факторы, воздействующие на организм пациента в сочетании с введением вакцин, например лазерное облучение, дооперационная стимуляция организма пациента ВБН и т.п. Большинство подходов к созданию противоопухолевых вакцин направлено на предотвращение рецидивирования и метастизирования новообразований после их хирургического удаления, химио- или лучевой терапии [199, 44; 100; 101].
Так, известен способ лазерной вакцинации больных с метастатическими формами рака [122]. Согласно указанному способу-аналогу лазерную вакцинотерапию проводят после выполнения условно-радикальной хирургической операции. При этом, предварительно полученную из биопсийного материала культуру опухолевых клеток, инактивированную гамма-лучами, или лизат опухолевых клеток модифицируют излучением углекислотного лазера (CO2-лазера) или обработкой широкоапертурными импульсными электронными пучками (далее по тексту - «модифицированная излучением вакцина»). Воздействуют на 4-6 участков кожи спины пациента диаметром 5-15 мм излучением лазера на парах меди с длиной волны 510,6 и 578 нм при плотности мощности свыше 3 Вт/см2, длительности импульсов 10-20 нс и частоте следования импульсов 5-15 кГц или излучением инфракрасного лазера с длиной волны 830 нм при плотности мощности 1,5-15 Вт/см2. Через 24-48 ч после облучения в каждую из зон образования клеточного инфильтрата вводят внутрикожно модифицированную излучением вакцину (в суммарной дозе 3×106 клеток, содержащейся в 1 мл физиологического раствора). Процедуры лазерной вакцинации проводят один раз в неделю. Курс лечения 10-15 процедур. Применение у 42 больных модифицированной излучением вакцины с антигенами из операционного материала IV стадии показало отсутствие признаков прогрессирования заболевания в течение одного года у 62% больных (в группе сравнения, где применяли вакцину на основе ДК, стимулированных аутоантигенами из лизатов опухолей, - в 71% случаев), а также увеличение продолжительности жизни в 1,6 раза (по сравнению с группой сравнения), что сопровождалось развитием специфического Т-клеточного иммунного ответа.
Способ-аналог [122] основан на активации противоопухолевого иммунного ответа вследствие мобилизации эндогенных БТШ70 из клеток кожи под воздействием высокоинтенсивного импульсного лазерного излучения, активации ДК, миграции их в зону облучения (с повышенным содержанием БТШ) и захвате ДК введенных в зону клеточного инфильтрата аутологичных опухолевых антигенов с повышенной иммуногенностью с последующим представлением их иммунокомпетентным клеткам.
Невозможность достижения заявленного технического результата при реализации способа-аналога [122] обусловлена следующим. В рассматриваемом способе используется аутологичная вакцина, характерной особенностью которой является ее идентичность клеткам опухоли с соответствующими структурами, активирующими клеточный иммунный ответ. Присутствующий в такой вакцине широкий спектр опухолевых антигенов определяет возможность их использования при соответствующей опухоли без оценки экспрессии отдельных антигенных детерминант. Однако вакцина данного вида представляет собой живые аутологичные опухолевые клетки, пролиферативные способности которых ограничены гамма-излучением, либо лизирванные (многократным повтором процедур замораживания-размораживания) клетки. Подобное воздействие может изменять структуру и свойства опухолевых антигенов и, соответственно, снижать эффективность вакцины.
Вследствие фенотипической гетерогенности опухолевых клеток, а также их антигенной изменчивости, обусловленной клональной эволюцией опухоли, направленной, в первую очередь, на уничтожение клонов с более выраженной иммуногенностью и дальнейшее усиление злокачественности, антигенный профиль опухолевых клеток, полученных из разных мест (основная опухоль, метастазы, лимфоузлы), может существенно различаться. В этой связи, ограниченный набор опухолевых антигенов, представленный в конкретной аутологичной вакцине, будет составлять только незначительную часть от общего антигенного репертуара опухоли и ее метастазов, что в ряде случаев может оказаться недостаточным для получения выраженного продолжительного целевого иммунного ответа, несмотря на повышенную (с помощью лазерного воздействия) иммуногенность собственных опухолевых клеток [14, 15, 100]. Кроме того, высказано предположение [125], что часть опухолевых антигенов, из числа содержащихся в приготовленной вакцине, может быть представлена в контексте собственных МНС-антигенов, не имеющих отношения к цели вакцинации, при этом не исключается возможность их отрицательного воздействия на формирование специфического иммунного ответа. Все это обусловливает относительно низкую эффективность известного способа-аналога.
В настоящее время к числу ведущих направлений биотерапии относят терапию с использованием онколитических вирусов, которые способны вызывать специфическую гибель именно злокачественных, но не нормальных клеток (далее по тексту - «виротерапия рака»). Специфическое разрушение злокачественных клеток обусловлено способностью онколитического вируса к избирательной репликации в этих клетках и способностью воздействовать на регуляторные системы организма, ответственные за активацию противоопухолевого иммунного ответа [107]. Многопрофильность влияния вируса на клеточные процессы значимо снижает вероятность резистентности [104]. Несомненный интерес в плане клинического применения представляют непатогенные для человека, но обладающие высоким онколитическим потенциалом вакцинные штаммы парамиксовирусов (Paramyxoviridae) (далее по тексту - «ПМВ»), в частности вируса Сендай (вирус парагриппа мышей 1 типа или гемагглютинирующий японский вирус) (далее по тексту также - «СеВ»), вируса болезни Ньюкасла (далее по тексту - «ВБН»), вируса кори [103]. Виротерапию рака применяют на поздних стадиях онкологического процесса, когда возможности специализированного лечения ограничены или исчерпаны, а также для предотвращения развития метастазов и рецидивов.
В настоящее время установлено, что онколитическое действие ПМВ, в частности СеВ и ВБН, может реализоваться по нескольким потенциальным механизмам. При этом степень онколитического действия и запуск того или иного механизма зависят от ряда факторов.
Первый механизм разрушения опухолевых клеток - ПМВ могут оказывать прямое цитолитическое действие, возникающее в результате репликации вирусов в малигнизированных клетках. Это осуществляется за счет: продуцирования неопластическими клетками гликопротеинов, которые могут служить рецепторами для ПМВ; частых генетических дефектов раковых клеток в системе интерферонового и апоптозного ответов, которые создают режим благоприятствования репликации вирусов; образования многоядерных клеточных конгломератов (сцинтиев) из злокачественных клеток, что лишает клетки возможности делиться, обрекая их на коллективную гибель, а также позволяет вирусу ускользать от нейтрализующего воздействия антител. Указанные цитопатологические изменения (патология ядра и цитоплазмы), как правило, не совместимы с дальнейшим существованием этой клетки и, в конечном итоге, приводят к ее гибели.
Второй механизм - иммуномодулирующее действие ПМВ, которое заключается в их способности активировать Т-клеточное звено иммунитета, неспецифически индуцировать естественные защитные силы организма, изменять антигенные и иммуногенные характеристики опухолевых клеток, стимулировать синтез интерферонов (далее по тексту - «ИФН»), в частности ИФН-альфа и ИФН-гамма, в лейкоцитах периферической крови человека; стимулировать продукцию других цитокинов (TNF), что, в свою очередь, ведет к активации NK, макрофагов, сенсибилизированных Т-лимфоцитов, антигенпредставляющих ДК, а также подавлять опосредованную Т-лимфоцитами регуляторную иммуносупрессию путем секреции интерлейкина 6 (IL-6) зрелыми ДК [43, 104; 119].
Известно применение ВБН в комплексной терапии рака (химио- и лучевой терапии) у больных с диссеминированными солидными опухолями, в частности у пациентов с меланомой кожи, раком молочной железы, раком толстой кишки, раком шейки матки, раком яичников, с увеальной меланомой [119, С. 53-64]. Применяемый препарат ВБН изготавливали из живого вируса апатогенного штамма La Sota, выращиваемого в свободных от патогенной микрофлоры куриных эмбрионах, который очищали центрифугированнием. Препарат ВБН вводили пациентам в дозе (1-5)×107 под/внутрикожно в сочетании с человеческим рекомбинантным гранулоцитарным колониестимулирующим фактором (Г-КСФ) раз в неделю в течение 4-х недель, начиная с 4-й по 8-ю недели после операции. В последующем курс продолжали аналогичными инъекциями раз в две недели в течение одного года, далее инъекции делали с возрастающим до трех мес.интервалом на протяжении 2,5 лет. При проведении комплексного лечения с включением курсов адъювантной химиотерапии и по показаниям лучевой терапии в течение 6 мес. Препарат ВБН получили 67 больных - до 16 внутрикожных введений при 6-ти месячном курсе лечения.
Эффективность лечения (по шкале RECIST) с использованием ВБН в комплексной терапии охарактеризована следующим образом: полный ответ - у 28,3% больных (при средней продолжительности эффекта 11 мес.); частичный ответ - у 26,8% больных (средняя продолжительность эффекта 11,7 мес.); стабилизация процесса - у 23,8% больных (средняя продолжительность эффекта 14 мес.); прогрессирование процесса - у 20,8% больных.
В качестве побочных эффектов лечения было зафиксировано следующее: лихорадка I и II степени наблюдалась практически у всех больных, сопровождалась кратковременным ухудшением самочувствия, не требовала какого-либо лечения и в течение суток самостоятельно купировалась. Локальные кожные реакции в месте введения вакцины, как при первичном, так и при повторных ее введениях; гиперемия и локальный отек в месте введения стихали в течение нескольких дней после вакцинации и не требовали дополнительного лечения. По мнению авторов рассматриваемого способа-аналога, подобные симптомы, как правило, традиционно наблюдаются при вакцинации разных типов. Возможные побочные эффекты при повторных вакцинациях (через 4-5 суток после вакцинации), которые могут проявляться вследствие выработки специфических антител (лихорадка, озноб, ощущение жара, кожной сыпи и т.п.), ни в одном из случаев зарегистрированы не были [119, С. 53-64].
Достижение терапевтического эффекта способа-аналога [119, С. 53-64; 2 X1] базируется на основных механизмах разрушения опухолевых клеток -прямом цитопатическом действии на опухолевые клетки в процессе вирусной репликации и индукции противоопухолевого звена иммунитета. Однако результаты клинических наблюдений авторов заявленного способа показали, что только приблизительно у 40% пациентов в системе in vitro определяется чувствительность опухолевых клеток к ВБН, что свидетельствует об относительно низкой вероятности запуска цитопатической составляющей. Вероятность высокого содержания лимфоцитов с пониженной функциональной активностью, что может быть обусловлено индивидуальными особенностями опухоли может препятствовать реализации иммунной составляющей ВБН. Кроме того, в условиях системного введения ВБН не исключается вероятность нейтрализации вируса клетками-эффекторами врожденного иммунитета (NK-клетками, макрофагами, полиморфноядерными лимфоцитами), что препятствует целевой доставке вирусных частиц и не позволяет обеспечить присутствие этих частиц в зонах опухолевых очагов в количестве, необходимом и достаточном для запуска цитопатической и иммунной составляющих вирусспецифических механизмов гибели раковых клеток и, соответственно, развития выраженного целевого противоопухолевого эффекта. Все это оказывает негативное влияние на возможность получения положительного результата лечения.
Известно применение вирусов в сочетании с ингибиторами блокирующих противоопухолевый иммунный ответ PD-1 и Tim-3 рецепторов ИКТ (25, 26; 27), лучевой терапией (28; 29) и бактериальными ЛПС (30; 31). Однако имеются сведения, что при сочетании онколитической виротерапии с ЛПС в 40% случаев у животных возникают летальные осложнения -септический шок, развивается «цитокиновая буря» из-за многократного повышения уровня воспалительных цитокинов ИЛ-6 и TNF (31). Это препятствует внедрению данного метода в практическую медицину.
Известно применение аутологичной, облученной и модифицированной ВБН вакцины на основе лизата или культуры опухолевых клеток (далее по тексту - «ВБН-вакцина») в комплексной терапии рака (химио- и лучевая терапия) у пациентов с меланомой кожи, меланомой влагалища, увеальной меланомой, раком молочной железы, раком толстой кишки, раком яичников [119, С. 53-64; 101]. Для приготовления ВБН-вакцины использовали опухолевые клетки, выделенные непосредственно в ходе удаления опухоли, или перевиваемые опухолевые линии, полученные из операционного или биопсийного материала, инактивированные гамма-излучением, замороженные в жидком азоте и обработанные ВБН (10-100 ID50 вируса на клетку опухоли) перед введением пациентам. ВБН-вакцину вводили пациентам в дозе (1-5)×107 под/внутрикожно в сочетании с Г-КСФ раз в неделю в течение 4-х недель, начиная с 4-й по 8-ю недели после операции. В последующем курс продолжали аналогичными инъекциями раз в две недели в течение одного года, далее инъекции делали с возрастающим до трех мес.интервалом на протяжении 2,5 лет. При проведении комплексного лечения с включением курсов адъювантной химиотерапии и по показаниям лучевой терапии в течение 6 мес. ВБН-вакцину получили 36 больных - от 8 до 16 внутрикожных инъекций при 6-ти месячном курсе лечения.
Эффективность лечения (по шкале RECIST) с использованием ВБН-вакцины в комплексной терапии охарактеризована следующим образом: полный ответ - у 19,4% больных (при средней продолжительности эффекта 11 мес.); частичный ответ - у 36,1% больных (средняя продолжительность эффекта 11,7 мес.); стабилизация процесса - у 36,1% больных (средняя продолжительность эффекта 12,7 мес.); прогрессирование процесса - у 8,3% больных. Полученные результаты исследований свидетельствовали о более выраженном противоопухолевом эффекте при использовании ВБН-вакцин в сравнении с ВБН в чистом виде в комплексной терапии рака. Побочные эффекты лечения были аналогичны описанным выше для способа-аналога, касающегося применения препарата ВБН в чистом виде [119. С. 53-64].
Невозможность получения заявленного технического результата с помощью способа-аналога [119, С. 53-64; 101] вызвана следующими причинами. Вследствие гетерогенности антигенного состава опухоли и ее метастазов, а также его изменений, обусловленных клональной эволюцией опухоли, и связанных, в первую очередь, с уничтожением клонов с более выраженной иммуногенностью и дальнейшим усилением злокачественности, антигенный профиль опухолевых клеток, полученных из разных мест (основная опухоль, метастазы, лимфоузлы), может существенно различаться. В этой связи, ограниченный набор из общего репертуара опухолевых антигенов, представленный в лизате или культуре аутологичных опухолевых клеток, инактивированных гамма-излучением, в ряде случаев оказывается недостаточным для получения выраженного продолжительного целевого иммунного ответа [14, 15, 100]. Повышение иммуногенности собственных опухолевых клеток с помощью вирусной модификации [119, С. 53-64; 101] не всегда является достаточной.
Известен способ лечения онкологических заболеваний, в частности рака молочной железы, включающий применение ВБН и аутологичной вакцины, представляющей собой сочетание белков теплового шока (БТШ) в комплексе с опухолевыми антигенами, выделенными из опухолевой ткани пациента (далее по тексту - «БТШ-вакцина») [132; 119, С. 99-107]. Применяемый препарат ВБН изготавливали из живого вируса апатогенного штамма La Sota, выращиваемого в свободных от патогенной микрофлоры куриных эмбрионах, который очищали центрифугированием. Указанный способ-аналог включал следующие этапы. Перед операцией (на этапе неоадъювантной терапии) производили инъекции препарата ВБН в дозе 1×109 внутрикожно (4-6 инъекций) в область передней брюшной стенки с интервалом 7-10 дней. Осуществляли хирургическое лечение. Получали БТШ-вакцину, используя обогащенную фракцию БТШ, выделенную из опухолевой ткани пациента до операции (БТШ70-, БТШ90- и БТШ96-пептидные комплексы). Затем проводили курс лечебной вакцинотерапии: БТШ-вакцину начинали вводить спустя двое суток после операции и повторяли с интервалами 7-10 дней в течение 4-6 мес. (8-10 раз) - амбулаторно.
Эффективность применения БТШ-вакцины оценивали по повышению уровня Т-цитотоксических лимфоцитов субпопуляции CD8 (CD3+CD8+), которое свидетельствовало о формировании специфического противоопухолевого иммунитета. Стимуляция специфического иммунного ответа получена в 7 случаях из 8. [119, С. 99-107].
В качестве побочных эффектов лечения отмечены следующие. При введении ВБН и БТШ-вакцины подкожно имела место умеренная болезненность, не требующая какого-либо лечения, припухлость в месте инъекции (местная реакция), повышение температуры, ухудшение общего самочувствия, озноб. Повышение температуры тела пациента до 38°C непосредственно после вакцинации (ревакцинации) счит