Способ получения образцов биоплёнок холерных вибрионов для исследования методом трансмиссионной электронной микроскопии
Иллюстрации
Показать всеИзобретение относится к экспериментальной биологии и медицине. Предложен способ получения образцов биопленок холерных вибрионов для исследования методом трансмиссионной электронной микроскопии, включающий культивирование биопленок в суспензии исследуемого штамма на поверхности пленок-подложек субстрата в течение не менее 5 суток при температуре 22°С. Формваровые пленки-подложки размещают на медных опорных сеточках для трансмиссионного электронного микроскопа, которые прикреплены на предметном стекле. Биопленки фиксируют, контрастируют. Субстрат с образцами биопленок высушивают на воздухе, отделяют сетки от предметного стекла и просматривают полученные образцы в электронном микроскопе. Способ обеспечивает получение информативных образцов биопленок холерных вибрионов. 2 з.п. ф-лы, 9 ил., 2 пр.
Реферат
Предлагаемое изобретение относится к экспериментальной биологии и медицине и может быть использовано при проведении научно-исследовательских работ, связанных с изучением пространственной структуры биопленок холерных вибрионов.
Известно, что в естественной среде обитания до 99% всех микроорганизмов существуют в виде биопленок - организованных сообществ бактерий, состоящих из активно функционирующих клеток и покоящихся форм, заключенных в экстрацеллюлярный матрикс и формирующихся на границе раздела твердой и жидкой или твердой и газообразной фаз.
Электронная микроскопия является основным методом для визуализации ультраструктуры биопленок. Наиболее применимыми для исследования биопленок являются трансмиссионная (просвечивающая) электронная микроскопия, растровая (санирующая) электронная микроскопия и атомно-силовая (зондовая) электронная микроскопия.
Трансмиссионная (просвечивающая) электронная микроскопия, несмотря на сложность в пробоподготовке объектов, позволяет визуализировать наружные и внутренние структуры как самой биопленки, так и составляющих ее клеток, причем в различных плоскостях, а применение гистохимических методов контрастирования дает возможность определять химический состав различных ее компонентов [1, 2, 3, 4, 5].
Известен способ получения препаратов биопленок микроорганизмов методом полутонких срезов [6], заключающийся в том, что биопленки заключают в агарозу, фиксируют глутаровым альдегидом и тетраоксидом осмия, вырезают фрагменты 1×1 мм и обезвоживают в серии спиртов восходящей концентрации, пропитывают смолой, заливают в блоки и полимеризуют, затем блоки с образцами затачивают на пирамитоме в форме усеченной пирамиды и получают серию ультратонких срезов с помощью ультрамикротома, помещают срезы на сеточки или бленды, контрастируют ацетатом свинца по Рейнолдсу и просматривают с помощью просвечивающего электронного микроскопа.
Однако в известном способе неизбежно происходит нарушение структуры биопленки при заливке агарозой, обезвоживании и полимеризации образцов, что снижает их качество и приводит к искажениям результатов вследствие как воздействия сил поверхностного натяжения, так и вымывания большей части компонентов матрикса.
В качестве прототипа выбран способ моделирования образования биопленок холерных вибрионов в условиях эксперимента и устройство для его осуществления (см. пат. RU №2559546, кл. C12Q 1/24, C12N 11/14, С12М 3/04, опубликовано 10.08.2015 г. Бюл. №22), заключающийся в формировании биопленки на покровных стеклах, которые помещают между витками пружинообразного приспособления внутри емкости, заполняемой экспериментальной средой с суспензией холерных вибрионов в nx108 КОЕ/мл с доведением до минимального порога чувствительности 0,1 КОЕ/мл при комнатной температуре.
Недостатком прототипа является то, что для проведения исследований биопленки, полученной на покровном стекле с помощью трансмиссионного электронного микроскопа, необходимо отделить ее от стекла, разместить на опорную сеточку, покрытую пленкой-подложкой, и контрастировать. В результате этих манипуляций неизбежно будет нарушена истинная структура биопленки, что повлияет на объективность полученных данных, отражающих ее структуру.
Технической задачей предлагаемого изобретения является получение качественных и информативных образцов биопленок холерных вибрионов, позволяющих визуализировать как наружные, так и внутренние структуры самой биопленки и входящих в ее состав клеток.
Поставленная задача достигается тем, что в способе получения образцов биопленок холерных вибрионов для исследования методом трансмиссионной электронной микроскопии, включающем приготовление субстрата и культивирование биопленки в суспензии холерных вибрионов, причем культивирование биопленки осуществляют на поверхности пленок-подложек субстрата в течение не менее 5 суток при температуре 22°С, при этом пленки-подложки размещают на медных опорных сеточках для трансмиссионного электронного микроскопа, которые прикреплены на предметном стекле, затем биопленки фиксируют и контрастируют по методу Лофта, после этого субстрат с образцами биопленок высушивают на воздухе, отделяют сетки от предметного стекла и просматривают полученные образцы в электронном микроскопе.
При этом подготовку субстрата осуществляют поэтапно: первоначально готовят 1% раствор поливинилформалина в дихлорэтане, который выдерживают сутки при комнатной температуре для полного растворения и погружают в этот раствор предметное стекло на 10 с, затем его извлекают, сушат в вертикальном положении на фильтровальной бумаге в течение 1 мин, получая на стекле пленку, которую надрезают по периметру и вместе со стеклом погружают под углом 45° в емкость с дистиллированной водой, отделяют пленку от стекла и оставляют ее плавать на поверхности воды, затем на пленке размещают 5 медных сеточек, на которые сверху накладывают предметное стекло, быстро погружают в воду, переворачивают и извлекают, получая субстрат, состоящий из стекла, на котором размещены медные сеточки, покрытые формваровой пленкой-подложкой.
Кроме того, суспензию для культивирования готовят из чистой культуры исследуемого штамма путем посева его на агар Мартена с рН 7,4 и инкубируют в течение 24 часов при 37°С, после чего отбирают колонии холерных вибрионов и суспендируют в стерильной водопроводной воде до концентрации 104 КОЕ/мл.
Сущность предполагаемого изобретения поясняется чертежами и фотографиями, где на:
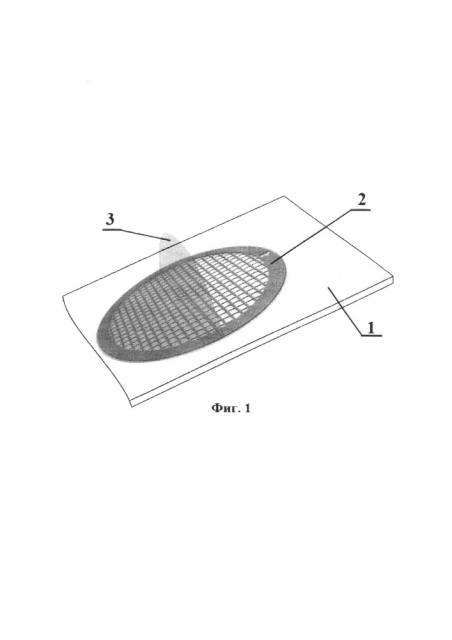
Фиг. 1 - изображен общий вид субстрата;
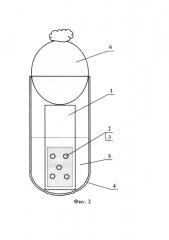
Фиг. 2 - схема исследования субстрата при культивировании;
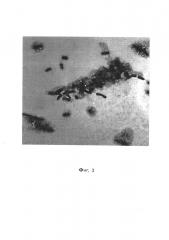
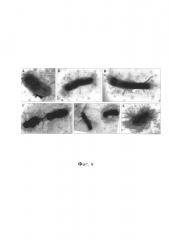
Фиг. 3 - Биопленка V. cholerae El Tor 5879, 20-е сутки, трансмиссионная электронная микроскопия, контрастирование рутениевым красным и тетраоксидом осмия, увеличение ×8000;
Фиг. 4 - Клетки V. cholerae El Tor 5879 на разных этапах формирования биопленки, трансмиссионная электронная микроскопия, контрастирование рутениевым красным и тетраоксидом осмия, увеличение ×40000;
Фиг. 5 - Планктонная форма V. cholerae El Tor 5879, 20-е сутки, трансмиссионная электронная микроскопия, контрастирование рутениевым красным и тетраоксидом осмия, увеличение ×40000;
Фиг. 6 - Биопленочная форма V. cholerae El Tor 5879, 20-е сутки, ТЭМ, контрастирование рутениевым красным и тетраоксидом осмия, увеличение ×40000;
Фиг. 7 - Визуализация экстрацеллюлярного матрикса, V. cholerae El Tor 5879, 20-е сутки, ТЭМ, контрастирование рутениевым красным и тетраоксидом осмия, увеличение ×40000;
Фиг. 8 - Планктонная форма V. cholerae El Tor 19667, 10-е сутки, трансмиссионная электронная микроскопия, контрастирование рутениевым красным и тетраоксидом осмия, увеличение ×15000;
Фиг. 9 - Планктонная форма V. cholerae El Tor 19667, 10-е сутки, трансмиссионная электронная микроскопия, контрастирование рутениевым красным и тетраоксидом осмия, увеличение ×15000.
Способ осуществляется следующим образом.
На первом этапе выделяют чистую культуру штамма холерных вибрионов, взятого из коллекции Ростовского-на-Дону противочумного института. Для этого исследуемый штамм культивируют на агаре Мартена (рН 7,4) в течение 24 часов при 37°C. Затем отбирают колонии холерных вибрионов и суспендируют их в стерильной водопроводной воде до концентрации 104 КОЕ/мл.
Второй этап заключается в подготовке субстрата:
- готовят 1% раствор формвара (поливинилформаля) в дихлорэтане и выдерживают его сутки при комнатной температуре до полного растворения;
- погружают в этот раствор предметное стекло на 10 сек, после чего извлекают его, сушат в вертикальном положении на фильтровальной бумаге 1 минуту и получают на стекле пленку;
- подрезают пленку на стекле (лезвием бритвы или препаровальной иглой) и погружают стекло под углом 45° в емкость с дистиллированной водой, отделяют пленку от стекла и оставляют плавать ее на поверхности воды;
- на пленку укладывают 5 медных опорных сеточек для электронной микроскопии, прикладывают поверх предметное стекло, которое быстро погружают в воду, переворачивают и извлекают, получая таким образом субстрат, состоящий из стекла 1, на котором смонтированы медные опорные сеточки 2, покрытые формваровой пленкой-подложкой 3 (см. Фиг. 1).
Третий этап - стерилизация субстрата. Стерилизацию осуществляют методом тиндализации.
Четвертый этап заключается в том, что полученный субстрат помещают в емкость 4, заполненную суспензией 5 бактерий (полученной по 1 этапу). Емкость закрывают ватно-марлевой пробкой 6 и проводят культивирование при 22°С в статических условиях без дополнительной аэрации (см. Фиг. 2). Время культивирования определяют в зависимости от условий эксперимента, но оно не должно составлять менее 5 суток.
После культивирования бактерий в условиях, соответствующих поставленной задаче, субстрат извлекают из микробной взвеси, отмывают от планктонных форм микроорганизмов в фосфатном буфере (рН 7,2-7,4) и фиксируют-контрастируют по следующей схеме, предложенной Лофтом [7, 8]:
а) 3,6% раствор глутарового альдегида в фосфатном буфере (рН 7,2-7,4) с 0,2% водным раствором рутениевого красного 1:1 - 1 час при 4°С;
б) промывка в фосфатном буфере (рН 7,2-7,4) - 10 минут при комнатной температуре;
в) 2% водный раствор тетраоксида осмия, 0,2% водный раствор рутениевого красного, фосфатный буфер (рН 7,2-7,4) 2:1:1 - 1 час при комнатной температуре;
г) промывка в фосфатном буфере (рН 7,2-7,4) - 10 минут при комнатной температуре.
Данная схема позволяет одновременно обеззараживать, фиксировать и контрастировать биопленку. На первом этапе положительно заряженный рутениевый красный связывается с отрицательно заряженными полисахаридами матрикса. Так как рутениевый красный не виден при микроскопии, на втором этапе мы добавляем тетраоксид осмия (VIII), который, являясь сильным окислителем, восстанавливается до низших окислов, а те, в свою очередь, связываются с рутениевым красным, который связан с матриксом [7, 8]. Рутениевый красный не проникает в клетку, поэтому контрастирует только внеклеточный матрикс [7, 8], а тетраоксид осмия проникает и окрашивает саму бактерию.
После высушивания на воздухе сетки с образцами отделяют от предметного стекла и просматривают в электронном микроскопе при ускоряющем напряжении 80 кВ.
Пример 1, подтверждающий практическое использование способа.
В исследованиях использовали штамм Vibrio cholerae ElTor 5879 из коллекции Ростовского-на-Дону противочумного института Роспотребнадзора.
Первоначально выделили чистую культуру штамма холерных вибрионов путем культивирования на агаре Мартена (рН 7,4) в течение 24 часов при 37°С. Затем отобрали колонии холерных вибрионов и суспендировали их в стерильной водопроводной воде до концентрации 104 КОЕ/мл. Приготовили субстрат для биопленки. Для этого получили 1% раствор поливинилформалина в дихлорэтане, который выдержали сутки при комнатной температуре для полного растворения. В данный раствор погрузили на половину предметное стекло на 10 с, затем извлекли и просушили в вертикальном положении на фильтровальной бумаге в течение 1 мин, получив на стекле пленку, которую надрезали по периметру и вместе со стеклом погрузили под углом 45° в емкость с дистиллированной водой, где пленка отделилась от стекла. На плавающую на поверхности воды пленку разместили 5 медных сеточек 2 для электронной микроскопии, а сверху наложили предметное стекло 1, которое быстро погрузили вместе с пленкой 3 в воду, перевернули и извлекли, получив субстрат, состоящий из стекла 1, на котором размещены медные сеточки 2, покрытые формваровой пленкой-подложкой 3 (см. Фиг. 1).
Затем субстрат стерилизовали методом тиндализации и поместили в подготовленную бактериальную суспензию и инкубировали при 22°С в статичных условиях без дополнительной аэрации в течение 20 суток (см. фиг. 2).
По истечении указанного времени субстрат извлекли из микробной взвеси, отмыли от планктонных форм микроорганизмов в фосфатном буфере (рН 7,2-7,4) и фиксировали-контрастировали по следующей схеме:
а) 3,6% раствор глутарового альдегида в фосфатном буфере (рН 7,2-7,4) с 0,2% водным раствором рутениевого красного 1:1 - 1 час при 4°С;
б) промывка в фосфатном буфере (рН 7,2-7,4) - 10 минут при комнатной температуре;
в) 2% водный раствор тетраоксида осмия, 0,2% водный раствор рутениевого красного, фосфатный буфер (рН 7,2-7,4) 2:1:1 - 1 час при комнатной температуре;
г) промывка в фосфатном буфере (рН 7,2-7,4) - 10 минут при комнатной температуре.
После высушивания на воздухе сетки с образцами отделили от предметного стекла и просмотрели в электронном микроскопе JEM-1011 (Япония) при ускоряющем напряжении 80 кВ. Изображения получили при помощи CCD-камеры Olympus-SIS Veleta.
Общий вид биопленки Vibrio cholerae var. ElTor (штамм 5879) представлен на фиг. 3.
При детальном изучении биопленок при больших увеличениях можно проследить изменение морфологии клеток на разных этапах биопленкообразования, от планктонной формы до зрелой биопленки (фиг. 4), где:
А - планктонная форма V.cholerae;
Б-В - стадия, соответствующая адгезии планктонных клеток к поверхности субстрата;
Г-Д - стадия, соответствующая созреванию биопленки;
Е - стадия зрелой биопленки.
При этом на фиг. 3 видно, что в составе биопленки находятся клетки на разных этапах биопленкообразования, а на примере фиг. 5 и 6 видно, что планктонная и биопленочная формы V.cholerae отличаются рядом морфологических признаков. У клеток, находящихся в составе биопленки, наблюдаются изменения размеров, формы и субмикроскопической организации клеточных компонентов.
Клетки в составе биопленки (фиг. 5, 6) расположены цепочками, окружены электроннопрозрачной капсулой, осмиефильны и заключены в экстрацеллюлярный матрикс. Между клетками четко видна линия деления, а образование клетками цепочек в плоскости деления объясняется адгезией материнских клеток к субстрату и удерживанием дочерних клеток веществом матрикса.
Клетки планктонной культуры (фиг. 5), в отличие от биопленочных форм (фиг. 6), расположены одиночно, у них отсутствует капсула, они менее осмиефильны и не окружены матриксом.
Экстрацеллюлярный матрикс биопленки (фиг. 7) представляет собой складчатое образование средней электронной плотности с многочисленными филаментоподобными тяжами, идущими от клетки и прикрепляющимися к поверхности субстрата. При этом количество складок и тяжей зависит от степени зрелости биопленки и в пределах одного образца встречаются участки формирующейся биопленки с разной степенью зрелости (фиг. 4).
Пример 2, подтверждающий практическое использование способа.
Получение образцов осуществляли по технологии, описанной в Примере 1. В исследовании использовали штамм Vibrio cholerae ElTor 19667 из коллекции Ростовского-на-Дону противочумного института Роспотребнадзора. Культивирование биопленок осуществляют в течение 10 суток.
На фиг. 8 представлены планктонные формы Vibrio cholerae ElTor 19667. Морфология планктонных форм, как и в примере 1, представлена одиночно расположенными вибрионами, у них отсутствует капсула, и они не окружены экстрацеллюлярным матриксом.
На фиг. 9 представлена биопленочная форма того же штамма. Клетки в составе биопленки расположены цепочками, окружены электроннопрозрачной капсулой, осмиефильны и заключены в экстрацеллюлярный матрикс. Между клетками четко видна линия деления, а дочерние клетки образуют цепочки в плоскости деления.
Использование предлагаемого изобретения дает возможность благодаря выращиванию биопленок непосредственно на сеточках, покрытых пленкой-подложкой, исключить необходимость отделения биопленки от стекла и переноса ее на сетки, не нарушая тем самым истинную структуру биопленки и получать качественные и информативные образцы биопленок холерных вибрионов.
Практическое применение данного способа позволяет получать качественные и информативные образцы биопленок холерных вибрионов, визуализировать их отдельные структуры, проследить динамику формирования и изменения клеток в процессе ее развития, определить пространственную структуру экстрацеллюлярного матрикса.
Источники информации
1. Кошель Е.И. Образование биопленки штаммами Yersinia pestis разных подвидов и их взаимодействие с членами почвенных биоценозов. Диссертация на соискание ученой степени кандидата биологических наук. Саратов, 2014 г.
2. Чеботарь И.В. Биопленки Staphylococcusaureus: структурно-функциональные характеристики и взаимоотношение с нейтрофилами. Диссертация на соискание ученой степени доктора медицинских наук. Нижний Новгород, 2014 г.
3. Мальник В.В. Микробное сообщество биопленок на поверхности раздела фаз «вода - твердое тело» литоральной зоны оз. Байкал. Автореферат диссертации на соискание ученой степени кандидата биологических наук. Улан-Удэ, 2010 г.
4. Terry J. Beveridge Visualizing Bacterial Cell Walls and Biofilms. Microbe / Volume 1, Number 6, 2006.
5. Jeff Zahller, Philip S. Stewart. Transmission electron microscopic study of antibiotic action on Klebsiella pneumoniae biofilm. antimicrobial agents and chemotherapy, Vol. 46, No. 8 Aug. 2002, p. 2679-2683.
1. Способ получения образцов биопленок холерных вибрионов для исследования методом трансмиссионной электронной микроскопии, включающий приготовление субстрата, культивирование биопленки в суспензии холерных вибрионов, отличающийся тем, что биопленки культивируют в суспензии на поверхности пленок-подложек субстрата в течение не менее 5 суток при температуре 22°С, при этом пленки-подложки размещают на медных опорных сеточках для трансмиссионного электронного микроскопа, которые прикреплены на предметном стекле, затем биопленки фиксируют и контрастируют по методу Лофта, после этого субстрат с образцами биопленок высушивают на воздухе, отделяют сетки от предметного стекла и просматривают полученные образцы в электронном микроскопе.
2. Способ по п. 1, отличающийся тем, что подготовку субстрата осуществляют поэтапно: первоначально готовят 1% раствор поливинилформалина в дихлорэтане, который выдерживают сутки при комнатной температуре для полного растворения и погружают в этот раствор предметное стекло на 10 с, затем его извлекают, сушат в вертикальном положении на фильтровальной бумаге в течение 1 мин, получая на стекле пленку, которую надрезают по периметру и вместе со стеклом погружают под углом 45° в емкость с дистиллированной водой, отделяют пленку от стекла и оставляют ее плавать на поверхности воды, затем на пленке размещают 5 медных сеточек, на которые сверху накладывают предметное стекло, быстро погружают в воду, переворачивают и извлекают, получая субстрат, состоящий из стекла, на котором размещены медные сеточки, покрытые формваровой пленкой-подложкой.
3. Способ по п. 1, отличающийся тем, что суспензию для культивирования готовят из чистой культуры исследуемого штамма путем посева его на агар Мартена с pH 7,4 и инкубируют в течение 24 ч при 37°С, после чего отбирают колонии холерных вибрионов и суспендируют в стерильной водопроводной воде до концентрации 104 КОЕ/мл.