Средство для лечения состояний человеческого организма, связанных с уменьшением уровня экспрессии гена prok 1 и/или уменьшением количества белка прокинетицина 1 на основе генно-терапевтических субстанций с геном prok 1, способ получения и использования
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к терапевтическим генно-инженерным средствам, и может быть использовано для коррекции патологических состояний человека, связанных с уменьшением экспрессии гена PROK 1 и/или уменьшением количества белка прокинетицина 1. Средство включает генно-терапевтическую субстанцию, выбранную из группы векторных плазмид, включающих кДНК гена PROK 1 с кодирующей последовательностью белка прокинетицина 1 с делециями 5' и 3'-нетранслируемых областей, полученной на основе участка нативной немодифицированной кДНК гена PROK 1 или модифицированной кДНК гена PROK 1. Изобретение обеспечивает высокий уровень экспрессии гена PROK 1 в эукариотических клетках, увеличивая тем самым количество белка прокинетицина 1 в клетках органов и/или тканей человека, в частности в фибробластах, в эндотелиоцитах семенников, надпочечников, яичников и плаценты, в вагине, шейке, придатках матки, отделах головного мозга, мозжечке и гипофизе. 3 н. и 2 з.п. ф-лы, 20 ил., 18 пр.
Реферат
Область, к которой относится изобретение
Изобретение относится к молекулярной биологии, биотехнологии, генной и медицине и может быть использовано для коррекции патологических состояний клеток различных органов и тканей, а также собственно органов и тканей человека, связанных с уменьшением уровня экспрессии гена PROK 1 и/или уменьшением количества белка прокинетицина 1, в частности, в терапевтических целях.
Предшествующий уровень
Ангиогенез подразделяют на два этапа: васкулогенез и собственно ангиогенез. При этом васкулогенез представляет собой процесс образования кровеносных сосудов de novo из мезодермальных клеток-предшественников, тогда как ангиогенез - развитие новых сосудов из сосудов, сформировавшихся во время васкулогенеза. Ангиогенез начинается с секреции растворимого ангиогенного фактора, воздействующего на близрасположенный кровеносный сосуд и приводящего к изменениям в капиллярной стенке в виде деградации базальной мембраны, митотическому делению эндотелиоцитов, их последующей миграцией в строму и протеолитической деградацией экстрацеллюлярного матрикса. На следующем этапе происходит организация сосудистых эндотелиоцитов в трубчатую структуру и инициализация кровотока во вновь сформированном участке.
Ангиогенез не характерен для неповрежденных тканей организма взрослого человека в физиологических условиях и активизируется при патологическом росте тканей при опухолях, остром или хроническом воспалительном процессе, диабетической ретинопатии. Эндометрий и ткани яичника являются уникальным исключением из этого правила, так как процессы циклического ангиогенеза в них происходят ежемесячно.
Процесс ангиогенеза играет важную роль в развитии и нормальном росте тканей, заживлении ран, репродуктивном цикле у женщин (развитие плаценты и желтого тела, овуляции), и вовлечен в патогенез различных заболеваний. Основными медиаторами ангиогенеза являются: фактор роста фибробластов, тромбоцитарный фактор роста, сосудистый эндотелиальный фактор роста (VEGF), трансформирующий фактор роста бета. Известно индуцирующее действие других факторов: плацентарного фактора роста, интерлейкина-8, фактора роста гепатоцитов, колониестимулирующего фактора роста гранулоцитов. Действие индукторов ангиогенеза направлено на эндотелиальные клетки, а также на сосудистые гладкомышечные клетки и фибробласты. Регуляция неоваскуляризации представляет собой динамический процесс тонкого взаимодействия ингибиторов и активаторов ангиогенеза.
Фактор роста, выделяемый клетками эндокринных желез, который получил название прокинетицин 1 (PROK 1). По своей структуре он близок к семейству VEGF и поэтому первоначально был назван сосудистым эндотелиальным фактором роста, выделенным из эндокринных желез (EG-VEGF). Данная молекула вызывала пролиферацию, миграцию и образование мембранных разрывов в эндотелиальных клетках капилляров, полученных из эндокринных желез. При этом прокинетицин 1 практически не оказывал никакого влияния на другие типы тестируемых эндотелиальных и не эндотелиальных клеток. Подобно VEGF, прокинетицин 1 обладает сайтом связывания HIF-1, и его экспрессия индуцируется гипоксией. Оба фактора приводили к обширному ангиогенезу и формированию кисты при их доставке в яичник. Однако, в отличие VEGF, с помощью прокинетицина 1 удалось стимулировать ангиогенез в роговице или скелетной мышце. Прокинетицин 1 (EG-VEGF) является примером класса узкоспециализированных митогенов, которые действуют, чтобы регулировать тканеспецифичные пролиферацию и дифференцировку эндотелия сосудов.
Белок Bv8, который обозначается как прокинетицин 2 (PROK 2) и представляет собой близко связанный секретируемый белок с EG-VEGF (PROK 1). Показано, что Bv8 индуцирует пролиферацию, выживаемость и миграцию клеток эндотелия сосудов коры надпочечников (LeCouter, J. et al, Proc Natl Acad Sci USA 100, 2685-2690 (2003)). Если PROK 1 (EG-VEGF) экспрессируется преимущественно в эндокринных железах и половых органах, то PROK 2 (Bv8) связан преимущественно с нервной системой.
Сигнальная система прокинетицинов представлена двумя парами лиганд/рецептор - парой PROK1/PROKR1, область действия которой ограничивается желудочно-кишечным трактом (здесь продукты этих генов участвуют в запуске действия мотилина - полипептидного гормона, регулирующего моторику желудка и кишечника).
Экспрессия PROK1 выявлена в клетках семенников, надпочечников, яичников и плаценты, а его эффекты ограничены эндотелиоцитами этих органов. Также экспрессия выявлена в вагине, шейке, придатках матки, отделах головного мозга, мозжечке, гипофизе, коре головного мозга, спинном мозге, предстательной железе, сердце, молочных железах, селезенке, скелетной мышечной ткани, мочевом пузыре, желчном пузыре, коже ноги, надлобковой коже, роговице, слизистой оболочке канала шейки матки, подкожной жировой клетчатке, висцеральной жировой ткани (http://www.proteinatlas.org/ENSG00000143125-PROK1/tissue).
В патенте RU 2559542 описана кодирующая нуклеиновая кислота; вектор экспрессии на ее основе для получения антитела к Bv8 (PROK 2); клетка-хозяин для экспрессии антитела на основе вектора, а также способ получения антитела с использованием клетки. Раскрыта фармацевтическая композиция, использующая антитело в эффективном количестве, а также применение антитела - для лечения опухоли, рака или нарушения пролиферации клеток. Предложено применение антитела для снижения или ингибирования ангиогенеза у субъекта, а также для ингибирования пролиферации клеток эндотелия. Использование изобретения обеспечивает новые антитела с аффинностью в отношении Bv8 человека или макака (KD) менее 10-11 М, как измерено методом BIACORE 3000, которые могут найти применение в терапии различных раковых заболеваний.
В заявке WO 2004081229 описано изобретение, которое содержит способы применения полипептидов Bv8 (PROK 2) и EG-VEGF (PROK 1) и соответствующих нуклеиновых кислот для содействия процессу кроветворения. Кроме того, содержит методы скрининга модуляторов для активности Bv8 и EG-VEGF. Кроме того, в заявке предусмотрены способы лечения с использованием полипептидов Bv8 и EG-VEGF или их антагонистов.
За прототип авторами было принято решение по заявке WO 2003/020892, в котором описаны способы применения полипептида Bv8 (PROK 2), чтобы индуцировать пролиферацию эндотелиальных клеток и повысить выживаемость эндотелиальных клеток. Также содержит методы скрининга модуляторов для активности Bv8. Кроме того, в заявке предусмотрены способы лечения с использованием полипептида Bv8. В одном из вариантов реализации изобретения способ включает в себя контактирование клетки с Bv8 в количестве, эффективном для индукции пролиферации клеток. Способ может дополнительно включать в себя контактирование клеток с VEGF. В другом варианте осуществления настоящего изобретения способ включает введение нуклеиновой кислоты, кодирующей Bv8 в клетки в количестве, эффективном для индукции пролиферации клеток.
Недостатком данного подхода является высокая стоимость получения чистого белка, более частое его введение при терапии (что увеличивает стоимость терапии и повышает риск побочных явлений) и сложность внутриклеточной доставки препарата, а также то, что при создании генно-терапевтического средства в этом изобретении не учитываются индивидуальные характеристики пациента, в связи с которыми может понадобиться группа вариаций для данного средства.
Раскрытие изобретения
Задачей данного изобретения является создание высокоэффективного средства для лечения состояний человеческого организма, связанных с уменьшением уровня экспрессии гена PROK 1 и/или уменьшением количества белка прокинетицина 1, на основе генно-терапевтических субстанций с геном PROK 1.
Указанная задача решается за счет того, что создано средство для лечения состояний человеческого организма, связанных с уменьшением экспрессии гена PROK 1 и/или уменьшением количества белка прокинетицина 1, на основе генно-терапевтических субстанций с геном PROK 1, представляющее собой, по крайней мере, одну генно-терапевтическую субстанцию, выбранную из группы генно-терапевтических субстанций, каждая из которых представляет генетическую конструкцию на основе векторной плазмиды, включающей кДНК гена PROK 1, с кодирующей последовательностью белка прокинетицина 1, с делециями 5' и 3'-нетранслируемых областей, а именно, полученной на основе участка нативной немодифицированной кДНК гена PROK 1 SEQ ID No:1, или модифицированной кДНК гена PROK 1, при этом в качестве модифицированной кДНК гена PROK 1 используют SEQ ID No:2, или SEQ ID No:3, или SEQ ID No:4, или SEQ ID No:5, или SEQ ID No:6, или SEQ ID No:7, или сочетание этих генетических конструкций, каждая из которых содержит также регуляторные элементы, обеспечивающие высокий уровень экспрессии гена PROK 1 в эукариотических клетках, в частности в клетках органов и тканей человека, и способную увеличить количество белка прокинетицина 1, в клетках органов и тканей и/или органах и тканях человека, в частности в фибробластах, в эндотелиоцитах семенников, надпочечников, яичников и плаценты, в вагине, шейке, придатках матки, отделах головного мозга, мозжечке, гипофизе, коре головного мозга, спинном мозге, предстательной железе, сердце, молочных железах, селезенке, скелетной мышечной ткани, мочевом пузыре, желчном пузыре, коже ноги, надлобковой коже, роговице, слизистой оболочке канала шейки матки, подкожной жировой клетчатке, висцеральной жировой ткани в сочетании с транспортной молекулой или без нее при введении этих генно-терапевтических субстанций в органы и ткани человека. При этом каждая генетическая конструкция с модифицированной кДНК гена PROK 1 содержит последовательность нуклеотидов, включающую в себя белок-кодирующую область кДНК гена PROK 1, которая несет модификации, не затрагивающие структуру белка прокинетицина 1, а именно: нуклеотидные замены, не приводящие к аминокислотным заменам или обрыву аминокислотной цепи, или комбинации вышеперечисленных модификаций и, не влияющие на кодируемую этой последовательностью аминокислотную последовательность.
В качестве транспортной молекулы используют липосомы, или дендримеры 5-го и выше поколений, или амфифильные блок-сополимеры.
Способ получения средства для лечения состояний человеческого организма связанного с уменьшением экспрессии гена PROK 1 и/или уменьшением количества белка прокинетицина 1, заключается в получении каждой генно-терапевтической субстанции из группы созданных генно-терапевтических субстанций, при этом получают кДНК гена PROK 1, затем помещают кДНК в векторную плазмиду, способную обеспечить высокий уровень экспрессии этой кДНК в клетках различных органов и тканей человека, наращивают и выделяют необходимое количество генетической конструкции, затем комбинируют генетическую конструкцию с транспортной молекулой для трансфекции полученной генно-терапевтической субстанцией клеток органов и тканей и/или введения полученной генно-терапевтической субстанции в органы и ткани человека, при этом используют кДНК гена PROK 1 с кодирующей последовательностью белка прокинетицина 1, с делециями 5' и 3'-нетранслируемых областей, а именно, полученной на основе участка нативной немодифицированной кДНК гена PROK 1 SEQ ID No:1, или модифицированной кДНК гена PROK 1, при этом в качестве модифицированной кДНК гена PROK 1 используют, или SEQ ID No:2, или SEQ ID No:3, или SEQ ID No:4, или SEQ ID No:5, или SEQ ID No:6, или SEQ ID No:7, или сочетание этих генетических конструкций.
Способ использования средства для лечения состояний человеческого организма, связанных с уменьшением экспрессии гена PROK 1 и/или уменьшением количества белка прокинетицина 1, заключается в трансфекции генно-терапевтической субстанцией, выбранной из группы созданных генно-терапевтических субстанций клеток органов и тканей пациента и/или во введении в органы и ткани пациента аутологичных клеток пациента, трансфицированных генно-терапевтической субстанцией, выбранной из группы созданных генно-терапевтических субстанций, и/или во введении в органы и ткани пациента генно-терапевтической субстанции или нескольких субстанций, выбранной/ выбранных из группы созданных генно-терапевтических субстанций, или сочетанием обозначенных способов.
Описание фигур
На фиг. 1 представлена нуклеотидная последовательность немодифицированной кДНК гена PROK 1 длиной 318 н.п. SEQ ID No:1, которая имеет высокую гомологию с приводимой в базе данных GenBank под номером NM_032414. и кодирует белок прокинетицина 1 (GenBank NP_115790.1).
На фиг. 2 представлена нуклеотидная последовательность модифицированной кДНК гена PROK 1, SEQ ID No:2, которая содержит 1 нуклеотидную замену G→C в позиции 66 и 1 нуклеотидную замену A→G в позиции 69, не приводящих к изменениям в аминокислотной последовательности белка прокинетицина 1.
На фиг. 3 представлена нуклеотидная последовательность модифицированной кДНК гена PROK 1, SEQ ID No:3, которая
содержит 1 нуклеотидную замену G→C в позиции 66, две нуклеотидных замены A→G в позиции 69, 90, не приводящих к изменениям в аминокислотной последовательности белка прокинетицина 1.
На фиг. 4 представлена нуклеотидная последовательность модифицированной кДНК гена PROK 1, SEQ ID No:4, которая
содержит 1 нуклеотидную замену G→C в позиции 66, 3 нуклеотидных замены A→G в позициях 69, 90, 93, не приводящих к изменениям в аминокислотной последовательности белка прокинетицина 1.
На фиг. 5 представлена нуклеотидная последовательность модифицированной кДНК гена PROK 1, SEQ ID NO:5, которая
содержит 1 нуклеотидную замену G→C в позиции 66, 4 нуклеотидных замены A→G в позициях 69, 90, 93, 186, не приводящих к изменениям в аминокислотной последовательности белка прокинетицина 1.
На фиг. 6 представлена нуклеотидная последовательность модифицированной кДНК гена PROK 1, SEQ ID NO:6, которая
содержит 2 нуклеотидных замены G→C в позициях 66, 207; 4 нуклеотидных замены A→G в позициях 69, 90, 93, 186, не приводящих к изменениям в аминокислотной последовательности белка прокинетицина 1.
На фиг. 7 представлена нуклеотидная последовательность модифицированной кДНК гена PROK 1, SEQ ID No:7, которая
содержит 3 нуклеотидных замены G→C в позициях 66, 207, 321; 4 нуклеотидных замены A→G в позициях 69, 90, 93, 186, не приводящих к изменениям в аминокислотной последовательности белка прокинетицина 1.
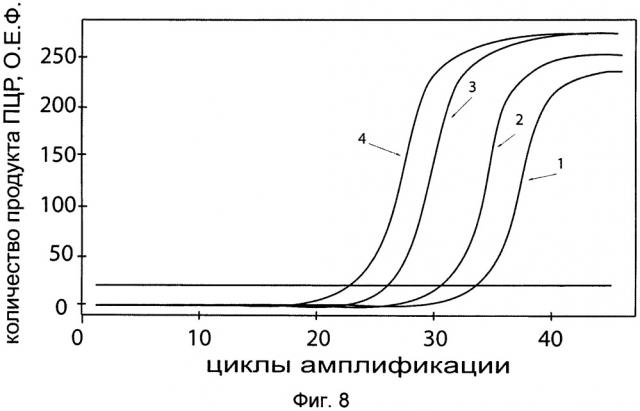
Фиг. 8. С целью последующего корректного определения генно-терапевтического эффекта после трансфекции фибробластов генно-терапевтической субстанцией с кДНК гена PROK 1 проводили анализ эндогенной экспрессии гена PROK 1 в культуре первичных фибробластов. На фигуре представлены графики накопления продуктов полимеразной цепной реакции (ПЦР), соответствующих:
1 - кДНК гена PROK 1, фибробласты со сниженной экспрессией гена PROK 1,
2 - кДНК гена PROK 1, фибробласты с нормальной экспрессией гена PROK 1,
3 - кДНК гена В2М, фибробласты со сниженной экспрессией гена PROK 1,
4 - кДНК гена В2М, фибробласты с нормальной экспрессией гена PROK 1.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенного в базе данных GenBank под номером NM 004048.2.
Фиг. 9. С целью подтверждения увеличения экспрессии гена PROK 1 в клеточной культуре фибробластов со сниженной экспрессией гена PROK 1 при трансфекции данных клеток генно-терапевтической субстанцией с кДНК гена PROK 1 с генетической конструкцией pCMV6- PROK 1 SEQ ID No:1 представлены графики накопления ПЦР-продуктов, соответствующих:
1 - кДНК гена PROK 1 в фибробластах с нормальной экспрессией гена PROK 1,
2 - кДНК гена PROK 1 в фибробластах со сниженной экспрессией гена PROK 1 до трансфекции ГТС с кДНК гена PROK 1,
3 - кДНК гена PROK 1 в фибробластах со сниженной экспрессией гена PROK 1 после трансфекции ГТС с кДНК гена PROK 1,
4 - кДНК гена PROK 1 в фибробластах со сниженной экспрессией гена PROK 1 после трансфекции вектором без кДНК гена PROK 1,
5 - кДНК гена В2М в фибробластах с нормальной экспрессией гена PROK 1,
6 - кДНК гена В2М в фибробластах со сниженной экспрессией гена PROK 1 до трансфекции ГТС с кДНК гена PROK 1,
7 - кДНК гена В2М в фибробластах со сниженной экспрессией гена PROK 1 после трансфекции ГТС с кДНК гена PROK 1,
8 - кДНК гена В2М в фибробластах со сниженной экспрессией гена PROK 1 после трансфекции вектором без кДНК гена PROK 1.
Из графиков следует, что в случае трансфекции вектором без вставки кДНК гена PROK 1 уровень кДНК гена PROK 1 в фибробластах не изменился, а в случае трансфекции вектором с кДНК гена PROK 1 - уровень кДНК фибробластов со сниженной экспрессией гена PROK 1 многократно увеличился (до уровня выше, чем уровень кДНК гена PROK 1 в нормальных фибробластах).
Фиг. 10. С целью подтверждения увеличения количества белка прокинетицина 1, в клеточной культуре фибробластов с нормальной экспрессией гена PROK 1 при трансфекции данных клеток генно-терапевтической субстанцией содержащей кДНК гена PROK 1 представлен график изменения количества белка прокинетицина 1, нетрансфицированных фибробластов (культура А), трансфицированных вектором pCDNA 3.1 (+) не содержащим кДНК гена PROK 1 (культура В) и трансфицированных генно-терапевтической субстанцией с генетической конструкцией pCDNA 3.1-PROK 1SEQ ID No:1 (культура С). Из графика следует, что при трансфекции фибробластов генно-терапевтической субстанцией с кДНК гена PROK 1 происходит увеличение количества белка прокинетицина 1, в клеточном лизате.
Фиг. 11. С целью подтверждения увеличения количества белка прокинетицина 1, в коже человека при введении в кожу клеточной культуры фибробластов, трансфицированной генно-терапевтической субстанцией, представлен анализ изменения количества белка прокинетицина 1, в коже пациентов. При этом пациентам вводили три варианта культуры аутологичных фибробластов - нетрансфицированные (А), трансфицированные вектором pCMV6-XL5 (В) и трансфицированные генно-терапевтической субстанцией с генетической конструкцией pCMV6- PROK 1 SEQ ID No:7 (С) - в кожу голени. Также анализировали количественный уровень белка прокинетицина 1, в интактной коже. Показано повышение количества белка прокинетицина 1, в коже пациента в области введения фибробластов, трансфицированных генно-терапевтической субстанцией кДНК гена PROK 1 (С).
Фиг. 12. С целью подтверждения увеличения количества белка прокинетицина 1 до различного индивидуального уровня в клеточных культурах фибробластов пациентов при трансфекции данных клеток генно-терапевтическими субстанциями с участком нативной немодифицированной кДНК гена PROK 1 и модифицированных кДНК гена PROK 1, представлен анализ изменения количественного уровня белка прокинетицина 1, в культурах фибробластов кожи человека в зависимости от наличия и типа модификаций в кДНК гена PROK 1, используемой для трансфекции фибробластов.
Культуры фибробластов 24 пациентов делили на 8 частей каждую с (А) по (Н); первые части (А) клеточных культур пациентов трансфицировали генно-терапевтической субстанцией pCMV6-PROK 1 SEQ ID No:1, части (В) трансфицировали генно-терапевтической субстанцией pCMV6-PROK 1 SEQ ID No:2, части (С) трансфицировали генно-терапевтической субстанцией pCMV6-PROK 1 SEQ ID No:3, части (D) трансфицировали генно-терапевтической субстанцией pCMV6-PROK 1 SEQ ID No:4, части (E) трансфицировали генно-терапевтической субстанцией pCMV6-PROK 1 SEQ ID No:5, части (F) трансфицировали генно-терапевтической субстанцией pCMV6-PROK 1 SEQ ID No:6, части (G) трансфицировали генно-терапевтической субстанцией pCMV6-PROK 1 SEQ ID No:7, части (H) трансфицировали векторной плазмидой, не содержащей кДНК гена PROK 1.
По итогам анализа количественного уровня белка прокинетицина 1, выбрали показатели, касательно каждой части клеточной культуры от каждого пациента, продемонстрировавшие максимальное количество белка прокинетицина 1, и объединили их в семь групп, исходя из следующего критерия:
В группе 1 максимальное количество белка прокинетицина 1, наблюдалось при трансфекции pCMV6-PROK 1 SEQ ID No:1,
в группе 2 максимальное количество белка прокинетицина 1, наблюдалось при трансфекции pCMV6-PROK 1 SEQ ID No:2,
в группе 3 максимальное количество белка прокинетицина 1, наблюдалось при трансфекции pCMV6-PROK 1 SEQ ID No:3,
в группе 4 максимальное количество белка прокинетицина 1, наблюдалось при трансфекции pCMV6-PROK 1 SEQ ID No:4,
в группе 5 максимальное количество белка прокинетицина 1, наблюдалось при трансфекции pCMV6-PROK 1 SEQ ID No:5,
в группе 6 максимальное количество белка прокинетицина 1, наблюдалось при трансфекции pCMV6-PROK 1 SEQ ID No:6,
в группе 7 максимальное количество белка прокинетицина 1, наблюдалось при трансфекции pCMV6-PROK 1 SEQ ID No:7.
Ни в одной из клеточных культур не наблюдалось того, что максимальное количество белка прокинетицина 1, присутствует при трансфекции вектором без вставки кДНК гена PROK 1.
На фигуре 12 для каждой группы клеточных культур приведены диаграммы показателей концентрации белка прокинетицина 1, (усредненных в рамках группы, в случае, если в группу входит более одной клеточной культуры) применительно ко всем, участвующим в эксперименте генно-терапевтическим субстанциям, после трансфекции этих клеточных культур генно-терапевтическими субстанциями, содержащими модифицированные и нативную кДНК гена PROK 1.
Из фигуры следует, что достижение максимального количества белка прокинетицина 1, в культурах фибробластов кожи различных пациентов при их трансфекции генно-терапевтическими субстанциями, связано с индивидуальными особенностями пациентов и зависит от наличия и типа модификаций в кДНК гена PROK 1, входящих в генно-терапевтические субстанции.
Каждая генно-терапевтическая субстанция из группы генно-терапевтических субстанций является эффективной в некоторой значительной группе пациентов. Следовательно, для выбора наиболее эффективной генно-терапевтической субстанции из группы генно-терапевтических субстанций для терапевтических целей необходимо предварительное персонализированное исследование пациента.
Обозначения:
части клеточных культур, трансфицированных ГТС PROK 1 SEQ ID No:1 (A)
части клеточных культур, трансфицированных ГТС PROK 1 SEQ ID No:2 (В)
части клеточных культур, трансфицированных ГТС PROK 1 SEQ ID No:3 (С)
части клеточных культур, трансфицированных ГТС PROK 1 SEQ ID No:4 (D)
части клеточных культур, трансфицированных ГТС PROK 1 SEQ ID No:5 (E)
части клеточных культур, трансфицированных ГТС PROK 1 SEQ ID No:6 (F)
части клеточных культур, трансфицированных ГТС PROK 1 SEQ ID No:7 (G)
части клеточных культур, трансфицированных плацебо (Н)
Фиг. 13. С целью подтверждения увеличения экспрессии гена PROK 1 в клеточной культуре эпителия эндометрия матки при трансфекции данных клеток генно-терапевтической субстанцией с кДНК гена PROK 1 в генетической конструкции pCMV6-Kan/Neo PROK 1 SEQ ID No:2 приведены графики накопления ПЦР-продуктов, соответствующих:
1 - кДНК гена PROK 1, эпителий эндометрия до трансфекции
2 - кДНК гена PROK 1, эпителий эндометрия после трансфекции
3 - кДНК гена В2М, эпителий эндометрия до трансфекции
4 - кДНК гена В2М, эпителий эндометрия после трансфекции
Ген В2М использовали в качестве референтного.
Из фигуры следует, что в результате трансфекции уровень специфической кДНК гена PROK 1 в культуре эпителия эндометрия матки многократно вырос.
Фиг. 14. С целью подтверждения увеличения экспрессии гена PROK 1 в клеточной культуре эпителиальных клеток роговицы глаза человека при трансфекции данных клеток генно-терапевтической субстанцией с кДНК гена PROK 1 приведены графики накопления ПЦР-продуктов, соответствующих:
1 - кДНК гена PROK 1, до трансфекции
2 - кДНК гена PROK 1, после трансфекции
3 - кДНК гена В2М, до трансфекции
4 - кДНК гена В2М, после трансфекции
Ген В2М использовали в качестве референтного.
Из фигуры следует, что в результате трансфекции уровень специфической кДНК гена PROK 1 вырос многократно.
Фиг. 15. С целью подтверждения увеличения количества белка прокинетицина 1, в коже человека при введении в кожу генно-терапевтической субстанции представлен анализ изменения количественного уровня белка прокинетицина 1, в коже. При этом пациенту вводили генно-терапевтическую субстанцию, содержащую векторную плазмиду с кДНК гена PROK 1 pCMV6-PROK 1 SEQ ID No:4 (В) и параллельно вводили плацебо, представляющее собой комбинацию векторной плазмиды pCMV-XL5 не содержащей кДНК гена PROK 1 с транспортной молекулой (А) - в кожу в зоне голени. Показано увеличение количества белка прокинетицина 1, в биоптате кожи пациента 1В, которому вводились генно-терапевтическая субстанция, содержащая генетическую конструкцию с кДНК гена PROK 1, что говорит об эффективности генно-терапевтической субстанции.
Обозначения:
пациент 1А
пациент 1В
пациент 1В до введения ГТС
Фиг. 16. С целью подтверждения увеличения количества белка прокинетицина 1 в хрящевой ткани человека при введении в хрящевую ткань генно-терапевтической субстанции представлен анализ изменения количественного уровня белка прокинетицина 1 хрящевой ткани. При этом пациенту вводили генно-терапевтическую субстанцию, содержащую векторную плазмиду с кДНК гена PROK 1 pCDNA 3.1 PROK 1 SEQ ID No:5 (В) и параллельно вводили плацебо pCDNA 3.1(+), представляющее собой комбинацию векторной плазмиды не содержащей кДНК гена PROK 1 с транспортной молекулой (А) - в хрящевую ткань.
Показано увеличение количественного уровня белка прокинетицина 1, в лизате биоптата хрящевой ткани пациента 1В, которому вводились генно-терапевтическая субстанция, содержащая генетическую конструкцию с кДНК гена PROK 1, что говорит об эффективности генно-терапевтической субстанции.
Обозначения:
пациент 1А
пациент 1В
пациент 1В до введения ГТС
Фиг. 17. С целью подтверждения увеличения количества белка прокинетицина 1, в мышечной ткани человека при введении в мышечную ткань генно-терапевтической субстанции представлен анализ изменения количества белка прокинетицина 1, в мышечной ткани. При этом пациенту вводили генно-терапевтическую субстанцию, содержащую векторную плазмиду с кДНК гена PROK 1 - pCMV6-Kan/Neo PROK 1 SEQ ID No:6 (В) и параллельно вводили плацебо pCMV6-Kan/Neo, представляющее собой комбинацию векторной плазмиды не содержащей кДНК гена PROK 1 с транспортной молекулой (А) - в мышечную ткань в зоне предплечья. Показано увеличение количества белка прокинетицина 1, в биоптате мышечной ткани пациента 1В, которому вводились генно-терапевтическая субстанция, содержащая генетическую конструкцию с кДНК гена PROK 1, что говорит об эффективности генно-терапевтической субстанции. Обозначения:
пациент 1А
пациент 1В
пациент 1В до введения ГТС
Фиг. 18. С целью подтверждения увеличения количества белка прокинетицина 1, до различного индивидуального уровня при введении в кожу пациентов генно-терапевтических субстанций с модифицированными кДНК гена PROK 1 и участком нативной немодифицированной кДНК гена PROK 1 анализировали количественный уровень белка прокинетицина 1 в коже человека в зависимости от наличия и типа модификаций в кДНК гена PROK 1.
Каждому из 23-х пациентов, которые были отобраны в случайном порядке, вводили в кожу голени 7 генно-терапевтических субстанций pCMV6-SEQ ID No:1, pCMV6-SEQ ID No:2, pCMV6-SEQ ID No:3, pCMV6-SEQ ID No:4, pCMV6-SEQ ID No:5, pCMV6-SEQ ID No:6, pCMV6-SEQ ID No:7, и плацебо pCMV6- XL5.
По итогам анализа количества белка прокинетицина 1, в биоптатах выбрали показатели, касательно каждого биоптата от каждого пациента, продемонстрировавшие максимальные количественные уровни белка прокинетицина 1, и объединили их в семь групп, исходя из следующего критерия:
В группе 1 максимальное количество белка прокинетицина 1, наблюдалось при введении pCMV6-PROK 1 SEQ ID No:1,
в группе 2 максимальное количество белка прокинетицина 1, наблюдалось при введении pCMV6-PROK 1 SEQ ID No:2,
в группе 3 максимальное количество белка прокинетицина 1, наблюдалось при введении pCMV6-PROK 1 SEQ ID No:3,
в группе 4 максимальное количество белка прокинетицина 1, наблюдалось при введении pCMV6-PPOK 1 SEQ ID No:4,
в группе 5 максимальное количество белка прокинетицина 1, наблюдалось при введении pCMV6-PROK 1 SEQ ID No:5,
в группе 6 максимальное количество белка прокинетицина 1, наблюдалось при введении pCMV6-PROK 1 SEQ ID No:6,
в группе 7 максимальное количество белка прокинетицина 1, наблюдалось при введении pCMV6-PROK 7 SEQ ID No:7.
Ни в одном из биоптатов не наблюдалось того, что максимальное количество белка прокинетицина 1, присутствует в случае введения плацебо.
На фигуре 18 для каждой группы биоптатов приведены диаграммы показателей концентрации белка прокинетицина 1, (усредненных в рамках группы, в случае, если в группу входит более одного биоптата) применительно ко всем, участвующим в эксперименте генно-терапевтическим субстанциям, после введения пациентам этих генно-терапевтических субстанций, содержащих модифицированные кДНК гена PROK 1 и участок нативной немодифицированной кДНК гена PROK 1.
Из данного примера следует, что достижение максимального количества белка прокинетицина 1, в биоптатах кожи различных пациентов при введении им в кожу генно-терапевтических субстанций, связано с индивидуальными особенностями пациентов и зависит от наличия и типа модификаций в кДНК гена PROK 1, входящих в генно-терапевтические субстанции.
Каждая генно-терапевтическая субстанция из группы генно-терапевтических субстанций является эффективной в некоторой значительной группе пациентов. Следовательно, для выбора наиболее эффективной генно-терапевтической субстанции из группы генно-терапевтических субстанций для терапевтических целей, необходимо предварительное персонализированное исследование пациента. Обозначения:
биоптаты пациентов после введения ГТС PROK 1 SEQ ID No:1 (A)
биоптаты пациентов после введения ГТС PROK 1 SEQ ID No:2 (В)
биоптаты пациентов после введения ГТС PROK 1 SEQ ID No:3 (С)
биоптаты пациентов после введения ГТС PROK 1 SEQ ID No:4 (D)
биоптаты пациентов после введения ГТС PROK 1 SEQ ID No:5 (E)
биоптаты пациентов после введения ГТС PROK 1 SEQ ID No:6 (F)
биоптаты пациентов после введения ГТС PROK 1 SEQ ID No:7 (G)
биоптаты пациентов после введения плацебо (Н)
Фиг. 19. С целью определения наиболее эффективной применительно к конкретному пациенту генно-терапевтической субстанции анализировали количественный уровень белка прокинетицина 1, в клеточных лизатах фибробластов этого пациента, трансфицированных разными генетическими конструкциями, содержащими участок нативной немодифицированной кДНК гена PROK 1 или модифицированные кДНК гена PROK 1.
По итогам анализа количества белка прокинетицина 1, в культуре фибробластов пациента выделили вариант генно-терапевтической субстанции, при трансфекции которой выявляется максимальная концентрация белка прокинетицина 1, в лизате клеточной культуры. В данном эксперименте максимальная концентрация белка прокинетицина 1, в лизате наблюдается при трансфекции генно-терапевтической субстанцией на базе pCMV6 PROK 1 SEQ ID No:1, содержащей участок нативной немодифицированной кДНК гена PROK 1, что показано на фигуре 19.
Таким образом, выбрана наиболее эффективная применительно к данному пациенту генно-терапевтическая субстанция для последующей трансфекции клеток пациента в рамках терапевтической процедуры.
Обозначения:
1 - клеточный лизат после трансфекции ГТС PROK 1 SEQ ID No:1 (A)
2 - клеточный лизат после трансфекции ГТС PROK 1 SEQ ID No:2 (В)
3 - клеточный лизат после трансфекции ГТС PROK 1 SEQ ID No:3 (С)
4 - клеточный лизат после трансфекции ГТС PROK 1 SEQ ID No:4 (D)
5 - клеточный лизат после трансфекции ГТС PROK 1 SEQ ID No:5 (E)
6 - клеточный лизат после трансфекции ГТС PROK 1 SEQ ID No:6 (F)
7 - клеточный лизат после трансфекции ГТС PROK 1 SEQ ID No:7 (G)
8 - клеточный лизат после трансфекции плацебо (Н)
Фиг. 20. С целью определения наиболее эффективной применительно к конкретному пациенту генно-терапевтической субстанции анализировали количество белка прокинетицина 1, в лизатах биоптатов кожи этого пациента, после введения ему генно-терапевтических субстанций, содержащих участок нативной немодифицированной кДНК гена PROK 1 или участки модифицированных кДНК гена PROK 1.
По итогам анализа количества белка прокинетицина 1, в лизате биоптатов кожи пациента выделили вариант генно-терапевтической субстанции, при введении которой выявляется максимальная концентрация белка прокинетицина 1, в лизате биоптата. В данном эксперименте максимальная концентрация белка прокинетицина 1, отмечена при введении генно-терапевтической субстанции на базе pCMV6 PROK 1 SEQ ID No:7, содержащей модифицированную кДНК гена, что показано на фигуре 20.
Таким образом, выбрана наиболее эффективная применительно к данному пациенту генно-терапевтическая субстанция для ее последующего введения пациенту в рамках терапевтической процедуры.
Обозначения:
1 - лизат биоптата после введения ГТС PROK 1 SEQ ID No:1 (A)
2 - лизат биоптата после введения ГТС PROK 1 SEQ ID No:2 (В)
3 - лизат биоптата после введения ГТС PROK 1 SEQ ID No:3 (С)
4 - лизат биоптата после введения ГТС PROK 1 SEQ ID No:4 (D)
5 - лизат биоптата после введения ГТС PROK 1 SEQ ID No:5 (E)
6 - лизат биоптата после введения ГТС PROK 1 SEQ ID No:6 (F)
7 - лизат биоптата после введения ГТС PROK 1 SEQ ID No:7 (G)
8 - лизат биоптата после введения плацебо (Н) Реализация изобретения.
При снижении экспрессии генов, кодирующих белки, например, гена PROK 1, происходит снижение количества белка в организме, что приводит к патологическим состояниям.
Преимущества использования генетической конструкции с геном PROK1 для коррекции количественного уровня белка прокинетицина 1 в клетках органов и тканей человека, по сравнению с использованием белка прокинетицина 1 человека и нуклеиновой кислоты, кодирующей белок прокинетицин 1 человека, решение по заявке WO 2003/020892 (прототип) следующие:
1) легче обеспечить более высокий и стабильный уровень белка в клетках,
2) не требуется сложная и дорогостоящая процедура рефолдинга и очистки белкового препарата,
3) обеспечивается транспортировка генно-терапевтической субстанции в больший спектр клеток органов и тканей человека, а также более эффективная внутриклеточная транспортировка генно-терапевтической субстанции.
4) учтены индивидуальные особенности пациентов.
Таким образом, для создания группы генно-терапевтических субстанций по данному изобретению был выбран ген PROK 1, а не белок прокинетицина 1 человека, кодируемый этим геном.
Для получения группы генно-терапевтических субстанций осуществляют следующие действия:
1. Получение участка нативной кДНК гена PROK 1, содержащей белок-кодирующую область гена PROK 1, клонирование его в промежуточную плазмиду, переклонирование его в экспрессионные векторные плазмиды под контроль эукариотических регуляторных элементов для экспрессии целевого гена таким образом, что полученные генетические конструкции содержат кодирующую нуклеотидную последовательность кДНК белка прокинетицина 1, которая является участком нативной немодифицированной кДНК гена PROK 1 и которая используются для дальнейших модификаций.
2. Внесение в последовательность нуклеотидов кДНК гена PROK 1 модификаций с целью создания ряда кДНК гена PROK 1, обеспечивающих достаточный для борьбы с патологическими проявлениями уровень трансляции белка прокинетицина 1.
3. Клонирование участка нативной немодифицированной кДНК гена PROK 1 и полученных на его основе модифицированных кДНК гена PROK 1 в векторные плазмиды, способные обеспечить эффективную экспрессию этой кД