Пептидомиметики
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии, конкретно к пептидомиметикам эпитопа аполипопротеина А-I, и может быть использовано в медицине. Пептидомиметик эпитопа аполипопротеина А-I, способный специфично связываться с антителами против аполипопротеина А-I, используется в диагностическом иммунологическом методе анализа и позволяет выявить ряд сердечно-сосудистых заболеваний по образцу биологической жидкости. Пептидомиметик эпитопа аполипопротеина А-I также может быть применим в способе лечения таких сердечно-сосудистых заболеваний. 9 н. и 17 з.п. ф-лы, 9 ил., 3 табл., 6 пр.
Реферат
Область техники, к которой относится изобретение
Данное изобретение относится к пептидам, которые можно использовать для прогнозирования, диагностики или лечения сердечно-сосудистых заболеваний.
Уровень техники
Среди липопротеинов высокой плотности (HDL), концентрация которых в крови, как известно, находится в отрицательной корреляции с риском сердечно-сосудистой патологии, наиболее многочисленным белком, на долю которого приходится 70% HDL, является аполипопротеин A-I (ApoA-I). Аполипопротеин A-I в составе HDL играет ключевую роль в поддержании гомеостаза холестерина, участвуя в регуляции обратного транспорта холестерина и доставки его в печень (Yancey et аl., 2003, Arterioscler. Thromb. Vasc. Biol. 23:712-719). Аполипопротеин A-I в составе HDL также обладает противовоспалительными и антиоксидантными свойствами.
Обнаружено, что при аутоиммунном заболевании, называемом системной красной волчанкой (SLE), с которым ассоциирован высокий риск ишемической болезни сердца, имеет место высокий уровень аутоантител против аполипопротеина Α-I - имуноглобулинов класса G (анти-ApoA-I IgG) (Dinu et al., 1998, Lupus 7:355-360,). Аутоантитела класса IgG против аполипопротеина A-I присутствуют у лиц других групп с высоким риском сердечно-сосудистой патологии, включая пациентов, перенесших инфаркт миокарда (Vuilleumier et al., 2010а, Eur. Heart J. 31:815-823), больных ревматоидным артритом (Vuilleumier et al., 2010b, Arthritis Rheum. 62:2640-2650,), пациентов с острой болью в груди (Keller et al., 2012, J. Intern. Med. 271:451-462) и с тяжелым стенозом сонной артерии (Montecucco et al., 2011, Eur. Heart J. 32:412-421). В случаях инфаркта миокарда и ревматоидного артрита также показано, что аутоантитела класса IgG против аполипопротеина A-I IgG ассоциированы с повышенным риском ишемической болезни сердца в группах с высоким риском сердечно-сосудистой патологии (Vuilleumier et al., 2010a,b см. выше; Keller et al., 2012, см. выше), а у больных с тяжелым стенозом сонной артерии эти антитела ассоциированы с повышенной подверженностью образованию атеросклеротических бляшек (Montecucco et al., 2011, Eur. Heart J. 32:412-421). Наконец, в недавно проведенном прямом сравнительном исследовании было показано, что аутоантитела класса IgG против аполипопротеина A-I являются наилучшим гуморальным аутоиммунным маркером для прогнозирования ишемической болезни сердца после инфаркта миокарда (Vuilleumier, 2011, J. Clinic. Experiment. Cardiology. 2:69), и единственным биологическим маркером, позволяющим делать поэтапное прогнозирование в отношении традиционных факторов риска сердечнососудистой патологии для выделения групп риска ишемической болезни сердца у больных ревматоидным артритом (Finckh et al., 2012, Arthritis Care Res (Hoboken) 64:817-825).
С патофизиологической точки зрения аутоантитела IgG против аполипопротеина Α-I являются, как было показано в экспериментах на мышах с дефицитом аполипопротеина Е, потенциальными посредниками в процессе атерогенеза и связанных с ним осложнений, увеличивая размеры атеросклеротических повреждений и подверженность им (Montecucco et al., 2011, см. выше). Хотя эти способствующие атерогенезу эффекты не вполне понятны, имеются данные, свидетельствующие об их синергизме на нескольких различных уровнях. Установлено, что аутоантитела IgG против аполипопротеина A-I (i) ослабляют защитное для сосудов действие липопротеинов высокой плотности (Batuca et al., 2009, Rheumatology (Oxford) 48:26-31,), (ii) способствуют стерильному воспалению с участием комплекса Toll-подобных рецепторов-2/CD4 (Pagano et al., 2012, J Intern Med. 1365-2796,), (iii) действуют как проаритмогенные факторы, участвуя в активации кальциевых каналов L-типа рецепторами минералокортикоидов в направлении от первичного сигнала к внутриклеточной мишени (Rossier et al., 2012, Endocrinology 153:1269-1278), и (iv) способствуют хемотаксису нейтрофилов (Montecucco et al., 2011, см. выше)
Разработаны методы прогнозирования/диагностирования сердечно-сосудистых расстройств, основанные на определении присутствия аутоантител против аполипопротеина Α-I у пациента. Однако эти методы, как правило, предполагают иммунологическую реакцию между указанными антителами и цельным (то есть всей длины полипептидной цепи) аполипопротеином Α-I (Dinu et al., 1998, см. выше; Vuilleumier et al., 2010a, см. выше; Keller et al., 2012, см. выше, Montecucco et al., 2011, см. выше; Batuca et al., 2009, см. выше). Основные ограничения использования в таком иммунологическом анализе цельного аполипопротеина Α-I связаны с дороговизной получения цельного белка в большом количестве и с его нестабильностью, что нивелирует эффективность анализа. С целью решения этой проблемы данным изобретением предлагается новый диагностический способ иммунологического анализа, основанный на использовании пептидов, которые дешевле получать, которые более стабильны, чем цельный белок, и которые специфично связываются с аутоантителами против аполипопротеина Α-I, присутствующими у индивидов с сердечно-сосудистыми заболеваниями. Способы по данному изобретению полезны, в частности, для индивидуального выбора адекватного лечения, отвечающего потребностям конкретного больного, а также для проведения мероприятий с целью предотвращать развитие сердечно-сосудистых расстройств, не допускать первичные и рецидивные сердечнососудистые инциденты в группах населения с повышенным риском сердечно-сосудистой патологии.
Раскрытие изобретения
В первом аспекте данного изобретения его целью являются пептиды, имитирующие эпитоп аполипопротеина Α-I (пептидомиметики), в которых имеются:
(a) аминокислотная последовательность длиной 15-80 аминокислотных остатков,
(b) аминокислотная последовательность, содержащая какую-либо из последовательностей:
(i) SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24; или их вариантов, или
(ii) аминокислотную последовательность, идентичную какой-либо из последовательностей, перечисленных в пункте (i), за тем исключением, что 1, 2, 3, 4, 5 или 6 аминокислотных остатков указанной последовательности из пункта (i) заменены, делетированы, вставлены и/или химически модифицированы, причем это не ликвидирует способности указанного пептидомиметика специфично связываться с антителами против аполипопротеина Α-I, или
(iii) какую-либо комбинацию двух аминокислотных последовательностей из пункта (i) и/или (ii); и
(c) внутримолекулярные поперечные сшивки между по меньшей мере двумя не смежными аминокислотными остатками аминокислотной последовательности по пункту b);
причем указанный пептидомиметик способен специфично связываться с антителами против аполипопротеина A-I.
Во втором аспекте данного изобретения его целью являются пептиды, имитирующие эпитоп (пептидомиметики) аполипопротеина Α-I, в которых имеются:
(a) аминокислотная последовательность длиной 15-80 аминокислотных остатков,
(b) аминокислотная последовательность, содержащая какую-либо из последовательностей:
(i) SEQ ID NO: 5, SEQ ID NO: 21, SEQ ID NO: 23; или их вариантов, или
(ii) SEQ ID NO: 8, SEQ ID NO: 9 или SEQ ID NO: 25; или их вариантов, или
(iii) аминокислотную последовательность, идентичную какой-либо из последовательностей, перечисленных в пункте (i) и/или (ii), за тем исключением, что 1, 2, 3, 4, 5 или 6 аминокислотных остатков указанной последовательности из пункта (iii) заменены, делегированы, вставлены и/или химически модифицированы, причем это не ликвидирует способности указанного пептидомиметика специфично связываться с антителами против аполипопротеина Α-I, или
(iii) какую-либо комбинацию двух аминокислотных последовательностей из пункта (i), (ii) и/или (iii);
причем указанный пептидомиметик способен специфически связываться с антителами против аполипопротеина A-I.
В третьем своем аспекте данное изобретение касается изолированного полинуклеотида, кодирующего указанный пептидомиметик, рекомбинантного вектора, содержащего указанный полинуклеотид, клеток-хозяев, несущих указанный рекомбинангаый вектор, а также способа получения указанного пептидомиметика, включающего этапы культивирования указанных клеток-хозяев в культуральной среде и выделения указанного пептида из этой культуральной среды или из лизата клеток-хозяев после их лизиса, и при необходимости создание поперечных сшивок между двумя не смежными аминокислотными остатками этого пептида посредством дисульфидного мостика, лактамного мостика или углеводородной сшивки.
В четвертом своем аспекте данное изобретение относится к диагностическим композициям, препаратам или планшетам для иммунологического анализа, содержащим по меньшей мере один пептидомиметик по данному изобретению.
В пятом аспекте данного изобретения предлагается фармацевтическая композиция, содержащая по меньшей мере один пептидомиметик по данному изобретению.
В шестом своем аспекте данное изобретение касается набора для выявления антител против аполипопротеина Α-I, играющих роль биологического маркера сердечнососудистого заболевания в образцах биологических жидкостей; указанный набор включает по меньшей мере один петидомиметик по данному изобретению или комбинацию таких пептидов.
В седьмом своем аспекте данное изобретение относится к способу выявления эндогенных антител против аполипопротеина Α-I в образцах биологических жидкостей млекопитающих, включающему следующие этапы:
(а) забор образца биологической жидкости у млекопитающего;
(b) обеспечение контактирования указанного образца биологической жидкости с твердой подложкой, несущей по меньшей мере один связанный пептидомиметик по данному изобретению, причем это контактирование осуществляется в условиях, достаточных для связывания антител против аполипопротеина Α-I, присутствующих в указанном образце биологической жидкости, с по меньшей мере одним указанным пептидомиметиком по типу взаимодействия антиген-антитело;
(c) удаление не связанных антител с поверхности указанной твердой подложки;
(d) выявление присутствия комплексов антиген-антитело, связанных с указанной твердой подложкой;
при этом присутствие указанных комплексов свидетельствует о том, что данный образец биологической жидкости содержит эндогенные антитела против аполипопротеина A-I.
В восьмом своем аспекте данное изобретение касается способа выявления сердечно-сосудистых заболеваний или определения их профиля риска по образцам биологических жидкостей млекопитающих, включающего следующие этапы:
(a) забор образца биологической жидкости у млекопитающего;
(b) обеспечение контактирования указанного образца биологической жидкости с твердой подложкой, несущей по меньшей мере один связанный пептидомиметик по данному изобретению, причем это контактирование осуществляется в условиях, достаточных для связывания антител против аполипопротеина Α-I, присутствующих в указанном образце биологической жидкости, с по меньшей мере одним указанным пептидомиметиком по типу взаимодействия антиген-антитело;
(c) удаление не связанных антител с поверхности указанной твердой подложки;
(d) выявление присутствия комплексов антиген-антитело, связанных с указанной твердой подложкой;
при этом присутствие указанных комплексов свидетельствует о том, что данный образец биологической жидкости содержит одно или более аутоантител против аполипопротеина Α-I, ассоциированных с сердечно-сосудистым заболеванием.
В девятом своем аспекте данное изобретение относится к способу предотвращения и/или лечения сердечно-сосудистого заболевания у нуждающегося в том индивида, включающему введение указанному индивиду указанного пептидомиметика, содержащей его фармацевтической композиции или аналога указанного пептидомиметика по пространственной структуре.
В десятом своем аспекте данное изобретение касается способа предотвращения и/или лечения сердечно-сосудистого заболевания у индивида, страдающего от острой боли в груди, острого коронарного синдрома, ревматоидного артрита, системной красной волчанки, тяжелого стеноза сонной артерии, терминальной стадии почечной недостаточности или периодонтита, причем этот способ включает следующие этапы:
(a) выявление эндогенных антител против аполипопротеина Α-I в образце биологической жидкости млекопитающего способом по данному изобретению; и
(b) введение пациенту по меньшей мере одного агента, выбираемого из: (i) пептидомиметика по данному изобретению или содержащей его фармацевтической композиции, (ii) структурного аналога указанного пептидомиметика по любому из пунктов 1-5 формулы изобретения, (iii) фармацевтической композиции, содержащей аполипопротеин Α-I, и (iv) агента, подходящего для предотвращения и/или лечения сердечно-сосудистого заболевания.
Другие признаки и преимущества данного изобретения явствуют из приведенного ниже описания осуществления изобретения.
Описание фигур
Фиг. 1. Химическая реакция для создания дисульфидного мостика в молекуле пептида по данному изобретению в растворе (А), углеводородной сшивки в молекуле пептида по данному изобретению при твердофазном пептидном синтезе по Fmoc-стратегии (В) или лактамного мостика в молекуле пептида по данному изобретению на твердой фазе (С). DMSO - диметилсульфоксид; РуВОР - бензотриазол-1-ил-окситрипирроллидинофосфонийгексафторфосфат; DIEA - Ν,Ν-диизопропилэтиламин; аллильная группа описывается структурной формулой Н2С=СН-СН2-; alloc - аллилоксикарбонильная группа. Буквы m, k и l возле скобок относятся к положениям аминокислотных остатков в последовательности пептида.
Фиг. 2. Развернутые химические формулы примеров поперечных сшивок в молекулах пептидов по данному изобретению: дисульфидный мостик (А), углеводородная сшивка (В), лактамный мостик (С). В формуле (А): k равно 3 или 6, R представляет боковую цепь аминокислоты; в формуле (В): для поперечной сшивки между аминокислотными остатками в положениях n и n+4 k=3, n=1, *=(S)-2-(4'-пентенил)-аланин; для поперечной сшивки между аминокислотными остатками в положениях n и n+7 k=6, n=4, *=(R)-2-(7'-октенил)-аланин); R представляет боковую цепь аминокислоты; в формуле (С): если X=-CO-NH-, то n=2, p=4, k=3; если Χ=-NH-CO-, то n=4, p=2, k=3; R представляет боковую цепь аминокислоты. Буквы m, k и l возле скобок относятся к положениям аминокислотных остатков в последовательности пептида.
Фиг. 3. Данные спектроскопии кругового дихроизма для пептидомиметиков F3L1 и F3S2A (F3S2A=F3S2) (A), F3S1B и F4S2B (В), F3L1 и F4L1 (С) показывают большее содержание альфа-спиральных участков по сравнению с контрольным пептидом F3, в котором нет поперечных сшивок..
Фиг. 4. Данные конкурентного твердофазного иммуноферментного анализа (ELISA) показывают, что пептидомиметик F3L1 эффективно конкурирует с интактным аполипопротеином Α-I за связывание с антителами против аполипопротеина Α-I. Образцы сыворотки крови, взятые у индивидов, у которых было установлено наличие антител против аполипопротеина Α-I, преинкубировали с пептидомиметиком F3L1 в указанных концентрациях, а затем наносили на планшеты для ELISA, покрытые интактным аполипопротеином Α-I, и проводили последующие этапы анализа согласно стандартному протоколу (А). Для сравнения такой же опыт выполняли с аполипопротеином Α-I в качестве конкурента (В).
Фиг. 5. Данные конкурентного твердофазного иммуноферментного анализа (ELISA) показывают, что пептидомиметик F3L1 эффективно конкурирует с интактным аполипопротеином Α-I за связывание с антителами против аполипопротеина A-I.. Образцы сыворотки крови, взятые у трех индивидов, у которых было установлено наличие антител против аполипопротеина A-I (+), преинкубировали с пептидомиметиком F3L1 (А), пептидом F3 (В) или рандомизированным пептидом F3 (С), в указанных концентрациях, а затем наносили на планшеты для ELISA, покрытые интактным аполипопротеином Α-I и проводили последующие этапы анализа согласно стандартному протоколу. Контролем служили образцы сыворотки крови, взятые у трех индивидов, у которых не выявлялись антитела против аполипопротеина A-I (-).
Фиг. 6. Пептидомиметик F3L1 подавляет провоспалительную реакцию, связанную с иммуноглобулинами G против аполипопротеина Α-I. Изменение продукции фактора некроза опухолей (TNF-α) макрофагами, вызванное IgG против аполипопротеина Α-I (А) или объединенными иммуноглобулинами G от индивидов, у которых было установлено наличие антител против аполипопротеина Α-I (В).
Фиг. 7. Пептидомиметик F3L1 подавляет хронотропный эффект, связанный с иммуноглобулинами G против аполипопротеина A-I.
Фиг. 8. Идентификация эпитопа аполипопротеина Α-I использованием расщепления полипептидной цепи по остаткам лизина (К). Показана иммунореактивность каждой фракции с сывороткой крови от индивидов, у которых имеются аутоантитела (А), и от тех, у которых их не выявлено (В).
Фиг. 9. Идентификация эпитопа аполипопротеина Α-I использованием расщепления полипептидной цепи по остаткам аргинина (R). Показана иммунореактивность каждой фракции с сывороткой крови от индивидов, у которых имеются аутоантитела (А), и от тех, у которых их не выявлено (В).
Осуществление изобретения
Аполипопротеин А-1, обозначаемый в настоящем документе также АроА-I и АроА-1, - это белок, кодируемый у человека геном APOA1 Человеческий АроА-I имеет молекулярную массу 28 кДа (регистрационный номер UniProt Р02647). Зрелый человеческий белок АРО-А1 содержит 243 аминокислотных остатка (SEQ ID NO: 1). Аполипопротеин A-I играет особую роль в липидном обмене. Он является основным белковым компонентом липопротеинов высокой плотности (HDL) в плазме крови. Аполипопротеин Α-I способствует переходу холестерина из тканей в печень для последующего выведения из организма. Он является кофактором для лецитин-холестерин-ацилтрансферазы (LCAT), которая обеспечивает образование большинства эфиров холестерина, содержащихся в плазме крови. Аполипопротеин Α-I был также идентифицирован как стабилизирующий фактор для простациклина (PGI2) и, таким образом, он обладает противосвертывающим действием. Дефекты гена, кодирующего аполипопротеин Α-I, связаны с состояниями, обусловленными дефицитом HDL, включая болезнь Танжера, и с системным не нейропатическим амилоидозом. Белок Аро А-I конформационно изменчив и динамичен, переходя из одной конформации в другую, которых существует по меньшей мере две существенно различных - без липидов и со связанными липидами. В исследованиях структуры интактного аполипопротеина А-1 без липидов в этом конформере было выявлено наличие шести α-спиральных участков, а именно: α-спиральный участок А от остатка аргинина в положении 10 до остатка глицина в положении 39 последовательности SEQ ID NO: 1; α-спиральный участок В от остатка аспарагина в положении 48 до остатка глутамина в положении 84 последовательности SEQ ID NO: 1; α-спиральный участок С от остатка лизина в положении 94 до остатка глутаминовой кислоты в положении 136 последовательности SEQ ID NO: 1; α-спиральный участок D от остатка глутаминовой кислоты в положении 146 до остатка аланина в положении 187 последовательности of SEQ ID NO: 1; α-спиральный участок Ε от остатка аланина в положении 196 до остатка глутаминовой кислоты в положении 212 последовательности SEQ ID NO: 1; α-спиральный участок F от остатка пролина в положении 220 до остатка глутамина в положении 243 последовательности SEQ ID NO: 1.
Термины «пептидомиметик эпитопа» или «мимотоп» в настоящем документе относятся к пептидам, имитирующим эпитоп белка-мишени. Пептидомиметик достаточно похож на природный эпитоп белка-мишени, чтобы его распознавали антитела, специфичные к природному эпитопу (таким образом, пептидомиметик обладает свойствами антигена) и, по всей вероятности, также вызывает иммунологическую реакцию, специфичную для природного эпитопа (таким образом, обладает свойствами иммуногена). Более конкретно, термин «пептидомиметик эпитопа АроА-I" относится к пептиду, имитирующему антигенную детерминанту аполипопротеина Α-I, который поэтому распознается антителами, специфично связьшающимися с аполипопротеином ΑΙ, называемыми также антителами против аполипопротеина Α-Ι.
Термин «эпитоп», в настоящем документе также называемый «антигенная детерминанта» - это часть антигена, распознаваемая иммунной системой, а именно антителами, В- либо Т-клетками.
Термин «антигенность» относится к антигенным свойствам эпитопа и обозначает способность эпитопа соединяться с конечными продуктами иммунного ответа, например с секретированными антителами и/или рецепторами на поверхности Т-клеток. Термин «иммуногенность» относится к иммуногенным свойствам эпитопа и обозначает способность эпитопа вызывать гуморальный и/или клеточно-опосредованный иммунный ответ. Все эпитопы, обладающие иммуногенностью, имеют также и антигенность, но не все антигенные эпитопы иммуногенны.
Выражение «две не смежных аминокислоты»/«два не смежных аминокислотных остатка» применительно к аминокислотной последовательности в настоящем документе относится к двум не соседним остаткам аминокислот, то есть расположенным не непосредственно рядом друг с другом в первичной структуре пептида, имеющего указанную аминокислотную последовательность.
Термин «антитело против АроА-I» или «антитело к АроА-I» в настоящем документе относится к любому антителу или его варианту/форме, включая (но не ограничиваясь перечисленным здесь) фрагмент антитела, доменное антитело или одноцепочечное антитело, способные избирательно (специфично) связываться с белком АроА-I, например с безлипидной формой аполипопротеина Α-I или ее фрагментом. В частности, антитела против АроА-I включают антитела, способные связываться с эпитопами аполипопротеина Α-I млекопитающих, а именно человека, в частности белка АроА-I с аминокислотной последовательностью SEQ ID NO: 1, или с любым эпитопом, расположенным в пределах области, состоящей из какой-либо из аминокислотных последовательностей SEQ ID NO: 2-9 или SEQ ID NO: 23. Антитела против ApoA-I включают мышиные, химерные, гуманизированные или полностью человеческие антитела, полученные путем генетической инженерии, или биспецифичные, или полиспецифичные антитела, а также их фрагменты, например одноцепочечные антитела (scFv) или доменные антитела против белка Аро Α-I или их фрагменты и т.п. Антитела против АроА-I могут быть моноклональными или поликлональными антителами, их фрагментами или производными, обладающими в основном такой же антигенной специфичностью. В частности, антитела против АроА-I могут быть аутоантителами (называемыми также эндогенными антителами), образующимися у индивидов, для которых высок риск сердечно-сосудистых расстройств, в том числе у лиц с острой болью в груди, острым коронарным синдромом, ревматоидным артритом, системной красной волчанкой, тяжелым стенозом сонной артерии, терминальной стадией почечной недостаточности и периодонтитом. Термин «избирательно/специфично» указывает, что данные антитела распознают предпочтительно полипептид-мишень или определенный эпитоп и/или связываются с ним, то есть проявляют к ним более высокое сродство связывания, чем в отношении любого другого антигена или эпитопа и поэтому связывание с полипептидом-мишенью можно отличить от неспецифичного связывания с другими антигенами. Определить сродство связывания для того или иного антитела, например путем анализа по Скатчарду (Scatchard et al., 1949, Ann. N.Y. Acad. 1949. 51, 660-672), не составит особого труда для рядового специалиста в данной области техники.
Термин «фармацевтически приемлемый» относится к носителям, состоящим из материалов, не являющихся нежелательными с биологической или иных точек зрения.
Термин «носитель» относится к любому присутствующему в фармацевтической композиции компоненту, отличному от активного агента, и, таким образом, включает разбавители, связующие вещества, агенты, улучшающие скольжение, дезинтегрирующие агенты, наполнители, красители, увлажняющие или эмульгирующие агенты, забуферивающие агенты, консерванты и т.п.
Термин «лечение» и его синонимы в настоящем документе, как правило, означают получение желаемого фармакологического или физиологического эффекта. Этот эффект может быть профилактическим в том смысле, что заболевание, симптом или состояние полностью или частично предотвращается, и/или терапевтическим в том смысле, что заболевание, состояние, симптом или негативный эффект, относимые к данному заболеванию, полностью или частично излечиваются. Термин «лечение» в настоящем документе охватывает всякое лечение заболевания у млекопитающих, в частности у людей, и включает: (а) предотвращение возникновения заболевания у предрасположенного к нему индивида, у которого оно еще не диагностировано, например при наличии данного с заболевания в семейном анамнезе; (b) подавление заболевания, то есть остановка его развития, или ослабление заболевания, например регрессирование заболевания и/или его симптомов, например улучшение состояния индивида или репарация поражений.
В частности, лечение сердечно-сосудистых заболеваний включает предотвращение, ослабление или даже ликвидацию симптомов заболевания или расстройства, например снижения числа случаев и частоты инфаркта миокарда или поражения периферических артерий среди населения в целом (первичная профилактика) или у индивидов, у которых уже имели место такие заболевания или расстройства (вторичная профилактика).
Термин «сердечно-сосудистые заболевания» в настоящем документе относится к заболеваниям или расстройствам, затрагивающим сердце или кровеносные сосуды. Примеры сердечно-сосудистых заболеваний, не имеющие ограничительного характера, включают в основном острые и хронические проявления артериосклероза, например острый коронарный синдром, инсульт, транзиторную ишемическую атаку, аритмии, сердечную недостаточность и поражение периферических кровеносных сосудов.
Термины «риск сердечно-сосудистых заболеваний» или «сердечно-сосудистый риск» в настоящем документе определяются как вероятность развития какого-либо сердечно-сосудистого заболевания у индивидов, у которых пока нет значительных атеросклеротических поражений. Эта вероятность обычно оценивается на основании наблюдения различных типичных факторов сердечно-сосудистого риска, например половой принадлежности, возраста, семейного анамнеза, табакокурения, диабета, повышенного кровяного давления (гипертензии), высокого уровня холестерина в крови (дислипидемии), избыточной массы тела, недостаточной физической активности и нездорового питания; эти факторы обычно объединяют в специальных таблицах для расчета риска, например по шкале SCORE или по Фрамингемской шкале. (D'Agostino et al., 2008, Circulation 117:743-53). Индивид считается имеющим высокий сердечнососудистый риск, если вероятность развития сердечно-сосудистого заболевания в ближайшие 10 лет больше 10% по Фрамингемской шкале суммарного сердечнососудистого риска (D'Agostino, et al., 2008, Circulation 117:743-53).
Термины «индивид/пациент/больной» в настоящем документе относятся к млекопитающим. Например, млекопитающие, к которым относится данное изобретение, включают человека, приматов, домашних животных (например, крупный рогатый скот, овец, свиней, лошадей, лабораторных грызунов и проч.).
Термин «образец биологической жидкости» относится к клиническим образцам жидкостей тела (слюны, крови, мочи и др.), взятым у млекопитающего для анализа, например образцом биологической жидкости является образец сыворотки крови, взятый у человека.
Термин «контрольный образец» относится к образцу, служащему положительным либо отрицательным контролем. Образцы для отрицательного контроля включают образцы жидкостей тела, взятые у индивида того же или родственного вида, что и индивид, у которого определяют наличие аутоантител против аполипопротеина A-I, причем об индивиде - источнике контрольного образца известно, что его биологическое состояние нормальное, то есть у него нет детектируемых аутоантител против аполипопротеина Α-I; или же отрицательным контролем служит раствор, не содержащий антител, иммунологически взаимодействующих с аполипопротеином Α-I. Образцы для положительного контроля включают образцы жидкостей тела, взятые у индивида того же или родственного вида, что и индивид, у которого определяют наличие аутоантител против аполипопротеина Α-I, причем об индивиде - источнике контрольного образца известно, что у него имеются детектируемые аутоантитела против аполипопротеина A-I; или же положительным контролем служит раствор, содержащий антитела, иммунологически взаимодействующие с аполипопротеином A-I.
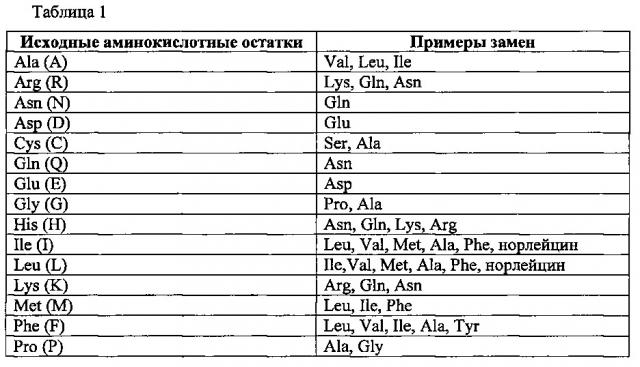
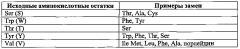
Термин «вариант» применительно к пептиду или полипептиду в настоящем документе означает пептид или полипептид, в основном гомологичный исходному или референсному полипептиду, с которым проводят сравнение, но имеющий аминокислотную последовательность, отличающуюся от исходной или референсной одной или более делецией, инсерцией и/или заменой аминокислотных остатков. Выражение «в основном гомологичный» означает, что аминокислотная последовательность пептида/полипептида - варианта идентична аминокислотной последовательности исходного/референсного пептида/полипептида, за исключением делеции, инсерции и/или замены 1, 2, 3, 4, 5 или 6 аминокислотных остатков. Идентичность двух аминокислотных последовательностей можно установить на глаз и/или путем математических расчетов, или же путем сравнения информации о последовательностях с помощью известных компьютерных программ, используемых для сравнения последовательностей, например пакета программ Clustal (версия 1.83). Вариант пептида/полипептида может иметь аминокислотную последовательность с по меньшей мере одной консервативной заменой аминокислотного остатка, то есть в данном положении аминокислотной последовательности находится остаток другой, чем в исходном пептиде/полипептиде, аминокислоты, но с близкими физико-химическими свойствами. Как правило, замены одного или более аминокислотных остатков в исходном полипептиде должны быть консервативными. Примеры консервативных замен включают замену одного алифатического аминокислотного остатка на другой, например в пределах группы, состоящей из валина, лейцина, изолейцина и аланина, или замену одного полярного аминокислотного остатка на другой, например лизина на аргинин (или наоборот), аспарагина на глутамин (или наоборот), аспарагиновой кислоты на глутаминовую (или наоборот). Хорошо известны и другие консервативные замены, например замены целой области полипептидной цепи на область со сходной гидрофобностью (Kyte, et al., 1982, J. MoI. Biol., 157: 105-131). Например, «консервативная аминокислотная замена может включать такую замену остатка природной аминокислоты на остаток неприродной аминокислоты, которая не влияет или мало влияет на полярность или заряд в данном положении полипептидной цепи. Желательные аминокислотные замены (будь то консервативные замены или не консервативные) специалист в данной области техники может определить тогда, когда это потребуется. Примеры аминокислотных замен представлены в таблице 1, приведенной ниже. Термин «вариант» применительно к пептиду или полипептиду включает также пептид или полипептид, в основном гомологичный исходному (референсному) пептиду/полипептиду, но имеющий аминокислотную последовательность, отличающуюся от исходной (референсной) последовательности тем, что один или более аминокислотных остатков химически модифицированы или заменены на свои аналоги. Например, могут быть химически модифицированы 1, 2, 3, 4, 5 или 6 аминокислотных остатков. Химические модификации одного или более аминокислотных остатков включают создание углеводородной сшивки, например превращение какого-либо аминокислотного остатка в (S)-2-(4'-пентенил)-аланин или (R)-2-(7'-октенил)-аланин. Таким образом, в настоящем документе термин «вариант» применительно к пептиду или полипептиду также включает исходную (референсную) полипептидную цепь, в которой один или более аминокислотных остатков заменены на (S)-2-(4'-пентенил)-аланин или (R)-2-(7'-октенил)-аланин для создания углеводородной сшивки.
Варианты также включают пептидомиметики по данному изобретению, содержащие α,α-диалкилированные аминокислотные остатки, например 2-аминоизомасляную кислоту для стабилизации α-спиральных структур. Для добавления α,α-диалкилированных аминокислотных остатков предпочтительны положения аминокислотной последовательности, занимаемые аминокислотными остатками, которым не присуща способность к формированию спиральной структуры или эта способность не выражена, например остатками пролина, глицина или валина, причем последней из перечисленных аминокислот присуща способность стабилизировать структуру типа «складчатый слой» β-лист). К этой группе соединений принадлежат также (S)-2-(4'-пентенил)-аланин и (R)-2-(7'-октенил)-аланин, которые можно использовать для создания описанных в настоящем документе углеводородных сшивок. Такие аминокислотные остатки можно также включать в те положения полипептидной цепи, которые склонны к протеолитическому расщеплению пептида, если указанному пептиду есть какое-либо терапевтическое применение. Примеры положений аминокислотной последовательности аполипопротеина A-I, в которые можно добавлять α,α-диалкилированные аминокислотные остатки, включают положения в α-спиральной области F, а именно, например, пролин-229, валин-220, фенилаланин-221, лизин-225, валин-226 или фенилаланин-228 (положения указаны по аминокислотной последовательности зрелого белка ApoA-I SEQ ID NO: 1.
Термин «твердая подложка» включает любую твердофазную основу для проведения иммунологического анализа или для осуществления способа по данному изобретению. Он включает шарики, микрочастицы, наночастицы, стенки пробирки, материалы типа ткани или планшеты, пленки, пластинки, лунки, сделанные или имеющие покрытие из стекла, полистирола, полипропилена, нитроцеллюлозы, кварца, керамики, декстрана или иных материалов. Например твердой подложкой могут служить лунки титрационного микропланшета, например 96-луночного титрационного микропланшета.
Термин «набор» подразумевает по меньшей мере один пептидомиметик по данному изобретению или его вариант, или их комбинацию, описанные в настоящем документе, присоединенные или подлежащие присоединению к твердой подложке, и при необходимости инструкции по применению.
Термин «эффективность» применительно к лечению или способу по данному изобретению подразумевает оценку на основании изменений в течение заболевания или состояния в ответ на применение способа по данному изобретению. Например, эффективность лечения или способа по данному изобретению может быть измерена по влиянию указанного лечения или способа на i) различные клинические результаты (например, на общую смертность, смертность от сердечно-сосудистых заболеваний, рецидивирование острого коронарного синдрома или инсульта, госпитализацию…) и/или ii) суррогатные маркеры, например действие терапевтических агентов у различных животных или в системах in vitro.
Термин «эффективное количество» в настоящем документе относится к количеству по меньшей мере одного пептидомиметика по данному изобретению или содержащей его фармацевтической композиции, которое вызывает детектируемое ослабление симптомов сердечно-сосудистых заболеваний у индивидов, которым вводят указанный пептидомиметик; эти симптомы включают, например, общую смертность, смертность от сердечно-сосудистых заболеваний, рецидивирование острого коронарного синдрома или инсульта, госпитализацию в связи с сердечно-сосудистой патологией.
Пептидомиметики эпитопов аполипопротеина A-I
В одном из своих аспектов данное изобретение относится к пептидомиметикам - пептидам, имитирующим эпитоп (эпитопы) аполипопротеина А-1 в не связанной с липидами форме и способным специфично связываться с аутоантителами к аполипопротеину Α-I, присутствующими у индивидов с сердечно-сосудистыми заболеваниями или расстройствами.
В первом аспекте данного изобретения в пептидомиметиках имеются внутримолекулярные поперечные сшивки.
Одно из воплощений данного изобретения относится к пептидомиметикам эпитопа АроА-I, которые имеют:
(a) аминокислотную последовательность длиной 15-80 аминокислотных остатков;
(b) аминокислотную последовательность, содержащую какую-либо из последовательностей
(i) SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 25, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24; или какой-либо из их