Слитые иммуномодулирующие белки и способы их получения
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к способу получения терапевтически активного слитого белка, содержащего группировку направленного взаимодействия с опухолью и по меньшей мере одну иммуномодулирующую группировку, противодействующую иммунной толерантности раковой клетки, а также к препарату для лечения эпителиальных форм рака, содержащему эффективное количество гомогенных терапевтически активных слитых белков, полученных указанным способом. Также раскрыта нуклеиновая кислота, кодирующая слитый белок, содержащий группировку направленного взаимодействия с опухолью и по меньшей мере одну иммуномодулирующую группировку. Изобретение также относится к экспрессионному вектору, содержащему вышеуказанную нуклеиновую кислоту. Изобретение позволяет эффективно получать терапевтически активный слитый белок. 4 н. и 7 з.п. ф-лы, 64 ил., 6 табл., 9 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В настоящей заявке испрашивается приоритет согласно предварительной заявке на патент США №61/777016, поданной 12 марта 2013 года, содержание которой включено сюда посредством ссылки для любых задач.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Область изобретения
Настоящее изобретение в общем относится к области получения рекомбинантных химерных слитых белков, предназначенных для использования в терапии рака, и более конкретно к слитым молекулам анти-EGFR1-TGFβRII, анти-EGFR1-PD1 и анти-CTLA4-PD1 и способам их получения, причем способы уменьшают стоимость получения и увеличивают гомогенность рекомбинантных химерных слитых белков.
Предшествующий уровень техники
Несмотря на многочисленные достижения в медицинском исследовании, рак остается второй главной причиной смерти в Соединенных Штатах Америки. При традиционных способах клинического лечения, таких как хирургическая резекция, радиотерапия и химиотерапия, имеет место значительный процент неблагоприятных исходов, в особенности в отношении солидных опухолей. Неблагоприятные исходы возникают либо вследствие толерантности исходной опухоли, либо вследствие рецидива из-за возобновления роста в исходной области или метастаза. Рак остается в центре внимания для медицинского исследования и разработки.
Иммунотерапия рака исследовалась больше века, но только в течение последнего десятилетия различные продукты на основе антител были введены в стратегию лечения пациентов с различными форм рака. В настоящее время она представляет собой одну из наиболее активно развивающихся областей клинического исследования с многочисленными терапевтическими продуктами на основе антител, уже одобренными в онкологии.
Использование специфических антител в качестве терапевтических агентов обеспечивает преимущества по сравнению с воздействующими не направленно способами терапии, такими как системная химиотерапия путем перорального или внутривенного введения лекарственных средств или радиационная терапия. Существуют два типа терапии на основе антител. Самый распространенный тип заключается в идентификации опухолевого антигена (т.е. белка, экспрессирующегося в опухолях и раковых клетках, но не в нормальных тканях) и разработке антитела, предпочтительно моноклонального антитела (mAb), направленного против опухолевого антигена. Тогда можно конъюгировать любой терапевтический агент, такой как химиотерапевтический агент, радионуклид, модифицированный токсин и тому подобное, с этим антителом для обеспечения воздействующей направленно терапии опухоли терапевтическим агентом. Другая разновидность терапии на основе антител заключается в том, чтобы обеспечить антитело, которое само по себе обладает терапевтическими свойствами против опухолевых/раковых клеток, на которых оно нацелено. Дополнительное преимущество этой второй формы терапии на основе антител заключается в том, что можно дополнительно конъюгировать еще один терапевтический агент с терапевтическим антителом для достижения более эффективного лечения. Основное преимущество любой терапии направленными антителами и терапии с использованием моноклональных антител (mAb) заключается, в частности, в способности доставлять к опухоли увеличенные дозы терапевтического агента при большем сбережении нормальной ткани от побочных действий терапевтического агента.
Несмотря на идентификацию нескольких антител для терапии рака, все еще сохраняется потребность в идентификации новых и более эффективных терапевтических средствах для преодоления иммунной толерантности и активации Т-клеточных ответов. Кроме того, даже при том, что молекулярная инженерия улучшилась, перспективы таких терапевтических средств на основе антител все еще продолжают непрерывно рассматриваться в отношении получения рекомбинантных продуктов.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложен новый и надежный способ синтеза для создания гомогенных рекомбинантных слитых иммуномодулирующих молекул и более конкретно рекомбинантных химерных полипептидов, содержащих антитела направленного взаимодействия, связанные с иммуномодулирующими белками.
Для того чтобы опосредовать иммунный ответ против рака, важны как Т-клеточная активация, так и костимуляция. Костимуляция Т-клеток в основном опосредуется путем вовлечения CD28 с его лигандами семейства В7 на антигенпрезентирующих клетках (АРС). Тем не менее, после активации Т-клетки экспрессируют молекулу, называемую антиген 4 цитотоксических Т-лимфоцитов (CTLA-4), которая связывается с лигандами В7 с гораздо большей аффинностью по сравнению с CD28, и такое связывание оказывает понижающую модуляцию Т-клеточной активности. Таким образом, включение антитела, связывающегося с рецептором CTLA-4, может блокировать взаимодействие с лигандами семейства В7 и усиливать противоопухолевый ответ.
Лиганд 1 запрограммированной гибели (PDL1), представляющий собой один из лигандов В7, обсуждаемых выше, препятствует противоопухолевому иммунитету путем того, что (1) лишает иммуногенности опухоль-реактивные Т-клетки путем связывания со своим рецептором PD1 (CD279) на Т-клетках; (2) придает опухолевым клеткам резистентность к CD8+ Т-клеткам и FasL-опосредованному лизису путем передачи сигналов PD-1 через экспрессируемый опухолевыми клетками PDL1; и (3) способствуют развитию и поддержанию индуцированных Т-регуляторных клеток. Таким образом, PDL1 представляет собой основное препятствие для природного противоопухолевого иммунитета и для иммунотерапий рака, требующих активацию опосредованного Т-клетками противоопухолевого иммунитета хозяина. Данная концепция поддерживается исследованиями, демонстрирующими, что блокировка антителом взаимодействий PDL1-PD1 улучшает Т-клеточную активацию и уменьшает прогрессирование опухоли. Хотя антитела против PDL1 или PD1 демонстрируют терапевтическую эффективность в подгруппе пациентов с раком, большая часть пациентов не получают пользу от лечения антителами. Таким образом, необходим механизм регулирования функции PD-L1, который приведет к новому универсально применимому лечению для минимизирования PD-L1-опосредованной иммунной супрессии у пациентов с раком и который является более эффективным по сравнению с доступными в настоящее время mAb против PD-1 или PD-L1.
Характеристикой множества эпителиальных форм рака, таких как рак толстой кишки, головы и шеи, молочной железы, яичника, немелкоклеточный рак легкого (NSCL) и рак поджелудочной железы, является аномально высокие уровни рецептора эпидермального фактора роста (EGFR) на поверхности раковых клеток. Семейство рецепторов эпидермального фактора роста (EGFR; HER1, HER2/new, HER3 и HER4) включает рецепторы клеточной мембраны с собственной тирозинкиназной активностью, которая запускает каскад биофизиологических сигнальных реакций в ответ на связывание различных лигандов. Эти рецепторы играют ключевую роль в поведении злокачественных клеток во множестве человеческих опухолей, вызывая увеличенную пролиферацию, уменьшая апоптоз и усиливая подвижность опухолевой клетки и ангиогенез. Таким образом, настоящее изобретение включает антитела, направленного взаимодействия с членами семейства EGFR.
Таким образом, в настоящем изобретении предложены способы снижения роста раковых клеток путем противодействия иммунной толерантности раковых клеток, где Т-клетки остаются активными и ингибируют рекрутинг Т-регуляторных клеток, которые, как известно, подавляют ответ иммунной системы на опухоль. Таким образом, химерные полипептиды, продуцированные полинуклеотидными последовательностями по настоящему изобретению, полезны для лечения рака из-за экспрессирующихся слитых или химерных полипептидов.
В одном из аспектов в настоящем изобретении предложены химерные полипептиды, содержащие по меньшей мере одну группировку направленного взаимодействия для нацеливания на раковую клетку и по меньшей мере одну иммуномодулирующую группировку, противодействующую иммунной толерантности раковой клетки, где группировка направленного взаимодействия и иммуномодулирующая группировка связаны аминокислотным спейсером с достаточной длиной, измеряемой количеством аминокислотных остатков, так, что обе группировки могут успешно связываться с их отдельными мишенями. Альтернативно, группировка направленного взаимодействия и иммуномодулирующая группировка, противодействующая иммунной толерантности раковой клетки, могут быть связаны непосредственно друг с другом. Химерные/слитые полипептиды по изобретению полезны для связывания с рецептором раковой клетки и снижения способности раковых клеток избегать иммунного ответа.
Предпочтительно, группировка направленного взаимодействия представляет собой антитело, обладающее связывающей аффинностью в отношении CTLA-4 или EGFR1, транскрибирующееся из полинуклеотидной последовательности, лишенной нуклеотидов для экспрессии С-концевого лизина тяжелой цепи экспрессирующегося антитела. Обнаружено, что при удалении С-концевого лизина тяжелой цепи антитела во время транскрипции конечный продукт демонстрирует увеличенную гомогенность, таким образом уменьшая необходимость в дальнейшей очистке и ее стоимость.
Известно, что во время процесса транскрипции и трансляции молекулы IgG в клетках СНО (клетки яичника китайского хомячка) будет экспрессироваться лизин (К) на С-конце тяжелой цепи. В имеющемся в продаже продукте такие экспрессированные лизины должны быть удалены для увеличения чистоты. Существует значительная гетерогенность в получаемом продукте, как представлено на Фиг. 1. Это происходит потому, что в клетках СНО имеется эндогенный фермент карбоксипептидаза В (СРВ), который расщепляет С-концевой лизин до тех пор, пока экспрессирующееся антитело все еще находится внутри клетки. Тем не менее, как только антитело секретируется в среду, этот фермент не расщепляет лизин. Таким образом, эффективность расщепления этой эндогенной СРВ основана на доступности внутри клетки. Сами по себе некоторые из антител будут секретироваться с лизином, а некоторые без него, и такая комбинация вызовет значительную гетерогенность в секретированном продукте, заключающуюся в том, что некоторые антитела будут иметь С-концевой лизин, а некоторые нет. Поскольку рекомбинантный продукт используется для терапевтического применения, его необходимо очищать до гомогенности. Таким образом, рекомбинантные продукты предшествующего уровня техники требуют дополнительных стадий очистки, где рекомбинантный продукт необходимо сначала обрабатывать ферментом СРВ и очищать еще раз, используя дополнительную стадию для удаления любого лизина и фермента СРВ из конечного продукта. Эти дополнительные стадии добавляют значительную стоимость способу получения.
Настоящее изобретение позволяет избежать недостатков предшествующих способов синтеза рекомбинантных антител против CTLA-4 и против EGFR1 путем транскрибирования экспрессирующегося белка из полинуклеотидной последовательности, лишенной нуклеотидов для экспрессии С-концевого лизина на тяжелой цепи экспрессирующегося антитела.
Настоящее изобретение основано на получении химерных/слитых белков путем экспрессии полинуклеотидов, кодирующих слитые белки, противодействующие или обращающие иммунную толерантность раковых клеток. Раковые клетки способны избежать элиминации химиотерапевтическими агентами или антителами направленного взаимодействия с опухолью при помощи специфических иммуносупрессивных механизмов в опухолевом микроокружении, и такая способность раковых клеток рассматривается как иммунная толерантность. Такие иммуносупрессивные механизмы включают иммуносупрессивные цитокины (например трансформирующий фактор роста бета (TGF-β)) и регуляторные Т-клетки и/или иммуносупрессивные миелоидные дендритные клетки (DC). Путем противодействия вызванной опухолью иммунной толерантности в настоящем изобретении предложены эффективные композиции и способы лечения рака, возможно в комбинации с другим существующим лечением рака. В настоящем изобретении предложены стратегии противодействия вызванной опухолью иммунной толерантности и усиления противоопухолевой эффективности химиотерапии путем активации и эффективного использования опосредованного Т-клетками адаптивного противоопухолевого антитела против резистентных или диссеминированных раковых клеток.
В другом аспекте настоящего изобретения предложена молекула, содержащая по меньше мере одну группировку направленного взаимодействия, слитую с по меньшей мере одной иммуномодулирующей группировкой. Группировка направленного взаимодействия специфически связывается с молекулой-мишенью, а иммуномодулирующая группировка специфически связывается с одной из следующих молекул: (1) трансформирующий фактор роста бета (TGF-β) и/или (2) лиганд 1 запрограммированной гибели-1 (PD-L1).
В еще одном аспекте группировка направленного взаимодействия включает антитело, содержащее как тяжелую цепь, так и легкую цепи, специфически связывающееся с компонентом опухолевой клетки, опухолевым антигеном, сосудистой сетью опухоли, микроокружением опухоли или инфильтрирующей опухоль иммунной клеткой. Стоит отметить, что тяжелая цепь и/или легкая цепь может быть отдельно связана с иммуномодулирующей группировкой того же типа или отдельной и отличной иммуномодулирующей группировкой. Кроме того, тяжелая или легкая цепь антительной группировки направленного взаимодействия может быть связана с иммуномодулирующей группировкой, которая, в свою очередь, может быть дополнительно связана со второй иммуномодулирующей группировкой, причем имеется линкер между двумя иммуномодулирующими группировками.
В еще одном аспекте предложен химерный полипептид, содержащий группировку направленного взаимодействия с опухолью и иммуномодулирующую группировку, включающую молекулу, связывающую трансформирующий фактор роста бета (TGF-β), где группировка направленного взаимодействия с опухолью представляет собой антитело, связывающееся с EGFR1, где антитело может представлять собой полноразмерное антитело, тяжелую цепь или легкую цепь.
Группировка направленного взаимодействия с опухолью может включать моноклональные антитела, которые направленно взаимодействуют с раковой клеткой, включая цетуксимаб, трастузумаб, ритуксимаб, ипилимумаб, тремелимумаб, муромонаб-CD3, абциксимаб, даклизумаб, базиликсимаб, паливизумаб, инфликсимаб, гемтузумаб озогамицин, алемтузумаб, ибритумомаб тиуксетан, адалимумаб, омализумаб, тозитумомаб, I-131 тозитумомаб, эфализумаб, бевацизумаб, панитумумаб, пертузумаб, натализумаб, этанерцепт, IGN101 (Aphton), волоциксимаб (Biogen Idee и PDL BioPharm), mAb против CD80 (Biogen Idee), mAb против CD23 (Biogen Idel), CAT-3888 (Cambridge Antibody Technology), CDP-791 (Imclone), эпратузумаб (Immunomedics), MDX-010 (Medarex и BMS), MDX-060 (Medarex), MDX-070 (Medarex), матузумаб (Merck), CP-675,206 (Pfizer), CAL (Roche), SGN-30 (Seattle Genetics), занолимумаб (Serono и Genmab), адекатумумаб (Sereno), ореговомаб (United Therapeutics), нимотузумаб (YM Bioscience), ABT-874 (Abbott Laboratories), деносумаб (Amgen), AM 108 (Amgen), AMG 714 (Amgen), фонтолизумаб (Biogen Idee и PDL BioPharm), даклизумаб (Biogent Idee и PDL BioPharm), голимумаб (Centocor и Schering-Plough), CNTO 1275 (Centocor), окрелизумаб (Genetech и Roche), HuMax-CD20 (Genmab), белимумаб (HGS и GSK), эпратузумаб (Immunomedics), MLN1202 (Millennium Pharmaceuticals), визилизумаб (PDL BioPharm), тоцилизумаб (Roche), окрелизумаб (Roche), цертолизумаб пегол (UCB, ранее Celltech), экулизумаб (Alexion Pharmaceuticals), пекселизумаб (Alexion Pharmaceuticals и Procter & Gamble), абциксимаб (Centocor), ранибизумаб (Genentech), меполизумаб (GSK), TNX-355 (Tanox), или MYO-029 (Wyeth), но не ограничиваясь ими.
В предпочтительном воплощении группировка направленного взаимодействия с опухолью представляет собой моноклональные антитело, связывающееся с CTLA-4 или EGFR1, созданное способами по настоящему изобретению, включающими осуществление следующих стадий:
а. получение кодон-оптимизированной нуклеотидной последовательности, кодирующей слитый белок, где кодон-оптимизированная последовательность для антитела лишена нуклеотидов для экспрессии лизина на С-конце тяжелых цепей антитела;
б. клонирование оптимизированной последовательности указанного слитого белка в клетке-хозяине, способной к транзиентной или непрерывной экспрессии;
в. выращивание клетки-хозяина в среде в условиях, подходящих для выращивания и обеспечения клетке-хозяину возможности экспрессировать слитый белок; и
г. сбор секретированных слитых белков.
В еще одном аспекте иммуномодулирующая группировка включает молекулу, связывающуюся с TGF-β и ингибирующую его функцию. Конкретно, иммуномодулирующая группировка включает внеклеточный связывающийся с лигандом домен рецептора трансформирующего фактора роста бета TGF-βRII, TGF-βRIIb или TGF-βRIII. В еще одном аспекте иммуномодулирующая группировка включает внеклеточный связывающийся с лигандом домен (ECD) TGF-βRII
В еще одном аспекте группировка направленного взаимодействия включает антитело, специфически связывающееся с HER2/neu, EGFR1, CD20 или антигеном 4 цитотоксических Т-лимфоцитов (CTLA-4), и где иммуномодулирующая группировка включает внеклеточный связывающийся с лигандом домен TGF-βRII.
В еще одном аспекте иммуномодулирующая группировка включает молекулу, специфически связывающуюся с лигандом 1 запрограммированной гибели-1 (PD-L1) и ингибирующую его активность.
В еще одном аспекте группировка направленного взаимодействия включает антитело, фрагмент антитела или полипептид, специфически связывающиеся с HER2/neu, EGFR1, CD20, антигеном 4 цитотоксических Т-лимфоцитов (CTLA-4), CD25 (рецептор IL-2a; IL-2aR) или CD4, и где иммуномодулирующая группировка включает внеклеточный связывающийся с лигандом домен или эктодомен запрограммированной гибели-1 (PD-1).
В еще одном аспекте группировка направленного взаимодействия включает антитело, специфически связывающееся с EGFR1 и CTLA-4, а иммуномодулирующая группировка включает последовательность, взаимодействующую с трансформирующим фактором роста-β (TGF-β).
В одном из аспектов настоящего изобретения предложены оптимизированные гены, кодирующие слитый полипептид, содержащий по меньшей мере одну группировку направленного взаимодействия и по меньшей мере одну иммуномодулирующую группировку, для лечения рака у субъекта-человека, где гены оптимизированы для повышения их экспрессии у субъекта-человека и/или в клетках.
В еще одном аспекте настоящего изобретения предложен вектор, содержащий оптимизированные гены, для лечения рака у субъекта-человека, модифицированные для увеличения содержания последовательностей CG. Предпочтительно, вектор содержит нуклеотидные последовательности, кодирующие по меньшей мере одну группировку направленного взаимодействия, по меньшей мере одну иммуномодулирующую группировку и связывающую группировку, где оптимизированные нуклеотидные последовательности выбраны из SEQ ID NO: 1-7, как представлено на Фиг. 2.
В еще одном аспекте настоящего изобретения предложен способ лечения рака у субъекта, включающий:
получение по меньшей мере одного рекомбинантного вектора, содержащего нуклеотидные последовательности, кодирующие по меньшей мере одну группировку направленного взаимодействия, по меньшей мере одну иммуномодулирующую группировку и связывающую группировку, расположенную между группировкой направленного взаимодействия и иммуномодулирующей группировкой, где нуклеотидные последовательности выбраны из SEQ ID NO: 1-7; и
введение субъекту рекомбинантного вектора в таких условиях, что указанные нуклеотидные последовательности экспрессируются на уровне, при котором у субъекта продуцируется терапевтически эффективное количество кодируемых слитых белков.
В еще одном аспекте настоящего изобретения предложена рекомбинантная клетка-хозяин, трансфицированная полинуклеотидной последовательностью, кодирующей слитый пептид по настоящему изобретению, где полинуклеотидные последовательности выбраны из SEQ ID NO: 1-7.
В еще одном аспекте настоящее изобретение охватывает способ получения химерного слитого белка по настоящему изобретению, включающий:
трансфицирование клетки-хозяина полинуклеотидной последовательностью, кодирующей химерный слитый белок, с получением трансформированной клетки-хозяина, где полинуклеотидная последовательность кодирует по меньшей мере одну группировку направленного взаимодействия и по меньшей мере одну иммуномодулирующую группировку, где полинуклеотидная последовательность содержит комбинацию последовательностей, выбранных из SEQ ID NO: 1-7; и
поддержание трансформированной клетки-хозяина в биологических условиях, достаточных для экспрессии химерного слитого белка.
В еще одном аспекте настоящее изобретение относится к применению химерного слитого белка, содержащего анти-EGFR1-линкер-PD1 (SEQ ID NO: 8, 9, 10 и 11); анти-EGFR1-линкер-TGFβRII (SEQ ID NO: 8, 9, 10 и 12); анти-CTLA-4-линкер-PD1 (SEQ ID NO: 13, 14, 10 и 11), как показано на Фиг. 3, 4 и 5, соответственно, при использовании лекарственного средства для лечения рака. Предпочтительно, слитый белок экспрессируется в клетке-хозяине, и такие экспрессированные белки вводят в терапевтическом количестве для уменьшения эффектов рака у субъекта, нуждающегося в этом.
В еще одном аспекте настоящего изобретения предложен способ лечения неопластического заболевания. Способ включает введение субъекту, нуждающемуся в этом, одного или более чем одного слитого белка по настоящему изобретению, в различных аспектах, субъекту вводят один или более чем один слитый белок по настоящему изобретению в комбинации с другой противораковой терапией. В одном из аспектов противораковая терапия включает химиотерапевтическую молекулу, антитело, низкомолекулярный киназный ингибитор, гормональный агент или цитотоксический агент. Антираковая терапия может также включать ионизирующее излучение, ультрафиолетовое излучение, криоабляцию, термическую абляцию или радиочастотную абляцию.
В предпочтительном воплощении терапевтически активные слитые белки антитело-пептид представляют собой антитело направленного взаимодействия, слитое с одной или более чем одной иммуномодулирующей группировкой, противодействующей иммунной толерантности раковой клетки. В одном из аспектов иммуномодулирующая группировка может быть связана посредством аминокислотного спейсера, длина которого достаточна для обеспечения возможности биспецифического связывания молекулы. Иммуномодулирующая группировка может быть связана либо с N-концом или с С-концом тяжелой цепи, либо с N-концом или С-концом легкой цепи антитела.
В способе по настоящему изобретению предложены нуклеотидные последовательности, кодирующие терапевтически активные слитые белки антитело-пептид, и такая экспрессия может быть проведена в транзиентной клеточной линии или стабильной клеточной линии. Транзиентную экспрессию осуществляют путем трансфицирования или трансформирования клетки-хозяина векторами, несущими кодируемые слитые белки, в клетки-хозяева млекопитающих.
После экспрессии слитых пептидов их предпочтительно подвергают очистке и тестам in vitro для проверки их биспецифичности, то есть того, обладают ли они способностью связываться как с группировкой направленного взаимодействия, так и с иммуномодулирующей группировкой. Такие тесты могут включать тесты in vitro, такие как ELISA (иммуноферментный анализ) или анализы связывания с NK/T-клетками, для валидации бифункционального связывания с мишенями или стимулирования иммунной клетки.
Стоит отметить, что когда специфические слитые пептиды демонстрируют желаемую биспецифичность, тогда полинуклеотидные последовательности, кодирующие такие слитые пептиды отбирают для субклонирования в стабильную клеточную линию для более крупномасштабной экспрессии и очистки. Такие стабильные клеточные линии были раскрыты ранее, такие как линия клеток млекопитающих, включая НЕК293, СНО или NSO, но не ограничиваясь ими.
В другом аспекте настоящего изобретения предложен способ ингибирования и/или уменьшения связывания PDL1 с PD1, увеличивая тем самым иммунный ответ против опухолевых клеток, включающий:
а. получение химерного полипептида, содержащего PD1 и антитело против EGFR1 или против CTLA-4; и
б. приведение опухолевой клетки в контакт с химерным полипептидом, связывающимся с по меньшей мере PDL1 опухолевой клетки.
В еще одном аспекте настоящего изобретения предложен способ получения терапевтически активных слитых белков антитело-пептид, включающий:
а. получение кодон-оптимизированной последовательности указанного слитого белка, где кодон-оптимизированные последовательности для антител против EGFR1 и против CTLA-4 лишены нуклеотидов для экспрессии лизина на С-конце тяжелых цепей антител;
б. клонирование оптимизированной последовательности указанного слитого белка в клетке-хозяине, способной к транзиентной или непрерывной экспрессии;
в. выращивание клетки-хозяина в среде в условиях, подходящих для выращивания и обеспечения клетке-хозяину возможности экспрессировать слитый белок; и
г. сбор секретированных слитых белков.
В еще одном аспекте настоящего изобретения предложена последовательность нуклеиновой кислоты, кодирующая химерный слитый белок, содержащий по меньшей мере одну группировку направленного взаимодействия, обладающую аффинностью в отношении раковой клетки, и по меньшей мере одну иммуномодулирующую группировку, противодействующую иммунной толерантности раковой клетки, где группировка направленного взаимодействия представляет собой антитело, и последовательность нуклеиновой кислоты группировки направленного взаимодействия лишена нуклеотидов для экспрессии лизина на С-конце тяжелых цепей антитела. Последовательность нуклеиновой кислоты, кодирующая тяжелую цепь антитела предпочтительно включает SEQ ID NO: 1 или SEQ ID NO: 5. Последовательность нуклеиновой кислоты, кодирующая химерные слитые белки, предпочтительно содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, 2, 4 и 7; SEQ ID NO: 1, 2, 3 и 4; и SEQ ID NO: 5, 6, 3 и 4.
В еще одном аспекте настоящего изобретения предложен способ лечения рака у субъекта, включающий:
а. получение терапевтически активного слитого белка, содержащего группировку направленного взаимодействия с опухолью и по меньшей мере одну иммуномодулирующую молекулу, где группировка направленного взаимодействия с опухолью представляет собой антитело, связывающееся с CTLA-4 или EGFR1, и где слитый белок получают осуществлением следующих стадий:
1) получение кодон-оптимизированной нуклеотидной последовательности, кодирующей слитый белок, где кодон-оптимизированная нуклеотидная последовательность для антитела лишена нуклеотидов для экспрессии лизина на С-конце тяжелых цепей антитела;
2) клонирование оптимизированной последовательности указанного слитого белка в клетке-хозяине, способной к транзиентной или непрерывной экспрессии;
3) выращивание клетки-хозяина в среде в условиях, подходящих для выращивания и обеспечения клетке-хозяину возможности экспрессировать слитый белок; и
4) сбор секретированных слитых белков;
б. введение субъекту терапевтически активного количества секретированных слитых белков.
Слитый белок выбран из группы аминокислотных последовательностей, состоящей из SEQ ID NO: 15 и 9; SEQ ID NO: 8 и 16; SEQ ID NO: 17 и 9; SEQ ID NO: 8 и 18; SEQ ID NO: 27 и 9; SEQ ID NO: 8 и 28; SEQ ID NO: 29 и 9; SEQ ID NO: 8 и 30; SEQ ID NO: 31 и 28; SEQ ID NO: 31 и 30; SEQ ID NO: 29 и 28; SEQ ID NO: 29 и 30; SEQ ID NO: 32 и 14; SEQ ID NO: 13 и 33; SEQ ID NO: 34 и 14; SEQ ID NO: 13 и 35; SEQ ID NO: 32 и 33; SEQ ID NO: 32 и 35; SEQ ID NO: 34 и 33 и SEQ ID NO: 34 и 35.
В другом аспекте настоящего изобретения предложен способ лечения неопластического заболевания, включающий введение субъекту, нуждающемуся в этом, одного или более чем одного слитого белка, кодируемого по меньшей мере одной полинуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 4 и 7; SEQ ID NO: 1, 2, 3 и 4; и SEQ ID NO: 5, 6, 3 и 4. Стоит отметить, что путем использования указанных выше полинуклеотидных последовательностей может экспрессироваться следующая комбинация слитых белков, включая анти-EGFR1-линкер-PD1 (SEQ ID NO: 8, 9, 10 и 11); анти-EGFR1-линкер-TGFβRII (SEQ ID NO: 8, 9, 10 и 12); и анти-CTLA-4-линкер-PD1 (SEQ ID NO: 13, 14, 10 и 11).
Другие признаки и преимущества изобретения станут понятны из следующего подробного описания, графических материалов и формулы изобретения.
Краткое изложение графических материалов
На Фиг. 1 показаны различные возможности расположения лизина на тяжелой цепи, и такая гетерогенность приводит к необходимости производить очистку.
На Фиг. 2 показаны кодон-оптимизированные нуклеотидные последовательности, использованные для экспрессии слитых белков антитело-пептид по настоящему изобретению, включая тяжелую цепь антитела против EGFR1 (SEQ ID NO: 1); легкую цепь антитела против EGFR1 (SEQ ID NO: 2); PD1 (SEQ ID NO: 7); линкер (SEQ ID NO: 4); тяжелую цепь антитела против CTLA-4 (SEQ ID NO: 5); легкую цепь антитела против CTLA-4 (SEQ ID NO: 6) и TGFβRII (SEQ ID NO: 3).
На Фиг. 3 показаны аминокислотные остатки для конструкции анти-EGFR1-линкер-PD1 (SEQ ID NO: 8, 9, 10 и 11).
На Фиг. 4 показаны аминокислотные остатки для конструкции анти-EGFR1-линкер-TGFβRII (SEQ ID NO: 8, 9, 10 и 12).
На Фиг. 5 показаны аминокислотные остатки для анти-CTLA-4-линкер-PD1 (SEQ ID NO: 13, 14, 10 и 11).
На Фиг. 6 показаны различные возможности для расположения молекулы PD1 на антителе против EGFR1 для FMab5, FMab6, FMab7 и FMab8.
На Фиг. 7 показаны аминокислотные последовательности для анти-EGFR1 HC-PD1 + анти-EGFR1 LC, где молекула PD1 связана с С-концом тяжелой цепи, отделенной линкером; включают SEQ ID NO: 15 и 9.
На Фиг. 8 показаны аминокислотные последовательности для анти-EGFR1 НС + анти-EGFR1 LC-PD1, где молекула PD1 связана с С-концом легкой цепи, отделенной линкером; включают SEQ ID NO: 8 и 16.
На Фиг. 9 показаны аминокислотные последовательности для анти-EGFR1 НС + анти-EGFR1 LC-PD1, где молекула PD1 связана с N-концом тяжелой цепи, отделенной линкером; включают SEQ ID NO: 17 и 9.
На Фиг. 10 показаны аминокислотные последовательности для анти-EGFR1 НС + PD1-анти-EGFR1 LC, где молекула PD1 связана с N-концом легкой цепи, отделенной линкером; включают SEQ ID NO: 8 и 18.
На Фиг. 11 показаны экспрессионные конструкции, разработанные с использованием кДНК, как представлено в SEQ ID NO: 1, 2 и 7.
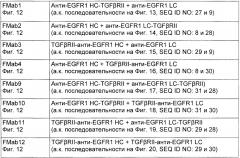
На Фиг. 12 показаны различные возможности для размещения молекулы TGFβRII на антителе против EGFR1, FMabI, FMab2, FMab3, FMab4, FMab9, FMab10, FMab11 и FMab12.
На Фиг. 13 показаны аминокислотные последовательности для анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC, где молекула TGFβRII связана с С-концом тяжелой цепи, отделенной линкером; включают SEQ ID NO: 27 и 9.
На Фиг. 14 показаны аминокислотные последовательности для анти-EGFR1 НС + анти-EGFR1 LC-TGFβRII, где молекула TGFβRII связана с С-концом легкой цепи, отделенной линкером; включают SEQ ID NO: 8 и 28.
На Фиг. 15 показаны аминокислотные последовательности для TGFβRII-анти-EGFR1 НС + анти-EGFR1 LC, где молекула TGFβRII связана с N-концом тяжелой цепи, отделенной линкером; включают SEQ ID NO: 29 и 9.
На Фиг. 16 показаны аминокислотные последовательности для анти-EGFR1 НС + TGFβRII-анти-EGFR1 LC, где молекула TGFβRII связана с N-концом легкой цепи, отделенной линкером; включают SEQ ID NO: 8 и 30.
На Фиг. 17 показаны аминокислотные последовательности для анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC-TGFβRII, где молекула TGFβRII связана с С-концом тяжелой и легкой цепи, отделенной линкером; включают SEQ ID NO: 31 и 28.
На Фиг. 18 показаны аминокислотные последовательности для анти-EGFR1 HC-TGFβRII + TGFβRII-анти-EGFR1 LC, где молекула TGFβRII связана с С-концом тяжелой цепи и N-концом легкой цепи, отделенной линкером; включают SEQ ID NO: 31 и 30.
На Фиг. 19 показаны аминокислотные последовательности для TGFβRII-анти-EGFR1 НС + анти-EGFR1 LC-TGFβRII, где молекула TGFBRII связана с N-концом тяжелой цепи и С-концом легкой цепи, отделенной линкером; включают SEQ ID NO: 29 и 28.
На Фиг. 20 показаны аминокислотные последовательности для TGFβRII-анти-EGFR1 НС + TGFβRII-анти-EGFR1 LC, где молекула TGFβRII связана с N-концом тяжелой цепи и N-концом легкой цепи, отделенной линкером; включают SEQ ID NO: 29 и 30.
На Фиг. 21 показаны экспрессионные конструкции, разработанные с использованием кДНК, как представлено в SEQ ID NO: 1, 2 и 3.
На Фиг. 22 показаны образцы, очищенные на белке А, анализируемые на 12% редуцирующем SDS-PAGE (элекрофорез в полиакриламидном геле с додецилсульфатом натрия).
На Фиг. 23 показаны образцы, очищенные на белке А, анализируемые на 6% нередуцирующем SDS-PAGE.
На Фиг. 24 показаны различные возможности для размещения молекулы PD1 на антителе против CTLA4.
На Фиг. 25 показаны аминокислотные последовательности анти-CTLA4 HC-PD1 + анти-CTLA4 LC, где молекула PD1 связана с С-концом тяжелой цепи, отделенной линкером; включают SEQ ID NO: 32 и 14.
На Фиг. 26 показаны аминокислотные последовательности для анти-CTLA4 НС + анти-CTLA4 LC-PD1, где молекула PD1 связана с С-концом легкой цепи, отделенной линкером; включают SEQ ID NO: 13 и 33.
На Фиг. 27 показаны аминокислотные последовательности для PD1-анти-CTLA4 НС + анти-CTLA4 LC, где молекула PD1 связана с N-концом тяжелой цепи, отделенной линкером; включают SEQ ID NO: 34 и 14.
На Фиг. 28 показаны аминокислотные последовательности для анти-CTLA4 НС + PD1-анти-CTLA4 LC, где молекула PD1 связана с N-концом легкой цепи, отделенной линкером; включают SEQ ID NO: 13 и 35.
На Фиг. 29 показаны аминокислотные последовательности для анти-CTLA4 HC-PD1 + анти-CTLA4 LC-PD1, где молекула PD1 связана с С-концом тяжелой цепи и легкой цепи, отделенной линкером; включают SEQ ID NO: 32 и 33.
На Фиг. 30 показаны аминокислотные последовательности для анти-CTLA4 HC-PD1 + PD1-анти-CTLA4 LC, где молекула PD1 связана с С-концом тяжелой цепи, отделенной линкером, и N-концом легкой цепи; включают SEQ ID NO: 32 и 35.
На Фиг. 31 показаны аминокислотные последовательности для PD1-анти-CTLA4 НС + анти-CTLA4 LC-PD1, где молекула PD1 связана с N-концом тяжелой цепи, отделенной линкером, и С-концом легкой цепи, и включают SEQ ID NO: 34 и 33.
На Фиг. 32 показаны аминокислотные последовательности для PD1-анти-CTLA4 НС + PD1-анти-CTLA4 LC, где молекула PD1 связана с N-концом тяжелой цепи, отделенной линкером, и N-концом легкой цепи; включают SEQ ID NO: 34 и 35.
На Фиг. 33 показаны экспрессионные конструкции, разработанные с использованием кДНК, как представлено в SEQ ID NO: 7, 5 и 6.
На Фиг. 34 показано связывание с мишенью EGFR1 в ELISA. Слитое анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC Mab связывается со своей иммобилизованной мишенью EGFR1.
На Фиг. 35 показано связывание с мишенью TGFβ в ELISA. Слитое анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC Mab связывается со своей мишенью TGFβ.
На Фиг. 36 показан бифункциональный ELISA. Слитое анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC Mab одновременно связывается с обеими своими мишенями EGFR1 и TGFβ.
На Фиг. 37 показан анализ путем проточной цитометрии связывания слитого анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC Mab с клетками А431, экспрессирующими EGFR1.
На Фиг. 38 показана ADCC (антителозависимая клеточнаяцитотоксичность) против клеток А-431, экспрессирующих EGFR1. Слитое анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC Mab опосредует ADCC против клеток А-431, экспрессирующих EGFR1, и эффект является дозозависимым.
На Фиг. 39 показан анализ ингибирования пролиферации. Слитое анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC Mab ингибирует пролиферацию клеток А-431, экспрессирующих EGFR1.
На Фиг. 40 показано связывание с мишенью EGFR1 в ELISA. Слитое анти-EGFR1 НС + анти-EGFR1 LC-TGFβRII Mab связывается со своей иммобилизованной мишенью EGFR1.
На Фиг. 41 показано связывание с мишенью TGFp в ELISA. Слитое анти-EGFR1 НС + анти-EGFR1 LC-TGFβRII Mab связывается со своей мишенью TGFβ.
На Фиг. 42 показан бифункциональный ELISA. Слитое анти-EGFR1 НС + анти-EGFR1 LC-TGFβRII Mab одновременно связывается с обеими своими мишенями EGFR1 и TGFβ.
На Фиг. 43 показан анализ ингибирования пролиферации. Слитое анти-EGFR1 НС + анти-EGFR1 LC-TGFβRII Mab ингибирует пролиферацию клеток А-431, экспрессирующих EGFR1.
На Фиг. 44 показано связывание с мишенью EGFR1 в ELISA. Слитое TGFβRII-анти-EGFR1 НС + анти-EGFR1 LC Mab связывается со своей иммобилизованной мишенью EGFR1.
На Фиг. 45 показано связывание с мишенью TGFβ в ELISA. Слитое TGFβRII-анти-EGFR1 НС + анти-EGFR1 LC Mab связывается со своей мишенью TGFβ.
На Фиг. 46 показан бифункциональный ELISA. Слитое TGFβRII-анти-EGFR1 НС + анти-EGFR1 LC Mab одновременно связывается с обеими своими мишенями EGFR1 и TGFβ.
На Фиг. 47 показан анализ ингибирования пролиферации. Слитое TGFβRII-анти-EGFR1 НС + анти-EGFR1 LC Mab ингибирует пролиферацию клеток А-431, экспрессирующих EGFR1.
На Фиг. 48 показано связывание с мишенью EGFR1 в ELISA. Слитое анти-EGFR1 НС + TGFβRII-анти-EGFR1 LC Mab связывается со своей иммобилизованной мишенью EGFR1.
На Фиг. 49 показано связывание с мишенью TGFβ в ELISA. Слитое анти-EGFR1 НС + TGFβRII-анти-EGFR1 LC Mab связывается со своей мишенью TGFβ.
На Фиг. 50 показан бифункциональный ELISA. Слитое анти-EGFR1 НС + TGFβRII-анти-EGFR1 LC Mab одновременно связывается с обеими своими мишенями EGFR1 и TGFβ.
На Фиг. 51 показан анализ путем проточной цитометрии связывания слитого анти-EGFR1 НС