Человеческие антитела с высокой аффинностью к рецепторам il-4 человека
Иллюстрации
Показать всеИзобретение относится к биохимии. Описано антитело, или антиген-связывающий фрагмент антитела, которое специфически связывается с IL-4R человека. Также описана нуклеиновая кислота, кодирующая указанное антитело, соответствующий вектор и клетка-хозяин. Также представлены способ получения указанного антитела и терапевтическая композиция для лечения заболевания, связанного с IL-4R, содержащая указанное антитело. Изобретение расширяет арсенал средств для лечения астмы. 8 н. и 11 з.п. ф-лы, 3 табл., 3 пр.
Реферат
УРОВЕНЬ ТЕХНИКИ
[0001] Интерлейкин-4 (IL-4, также известный как стимулирующий фактор В-клеток, или BSF-1) первоначально был охарактеризован по своей способности стимулировать пролиферацию В-клеток в ответ на низкие концентрации антител к поверхностному иммуноглобулину. Было показано, что IL-4 обладает широким спектром биологической активности, включая стимулирование роста Т-клеток, мастоцитов, гранулоцитов, мегакариотов и эритроцитов. IL-4 индуцирует экспрессию молекул II класса главного комплекса гистосовместимости в дремлющих B-клетках и усиливает секрецию изотипов IgE и IgG1 стимулированными B-клетками.
[0002] Биологическая активность IL-4 опосредована рецепторами поверхности конкретных клеток для IL-4. Альфа рецептор человека IL-4 (hIL-4R) (SEQ ID №: 274) описан, например, в патентах США №№5,599,905, 5,767,065 и 5,840,869. Антитела к hIL-4R описаны в патенте США №5,717,072 и 7,186,809.
[0003] Способы получения антител, полезных в качестве лекарственных препаратов для человека, включают производство химерных антител и гуманизированных антител (см., например, патент США 6,949,245). См., например, WO 94/02602 и патент США 6,596,541, где описаны способы создания не относящихся к человеку трансгенных мышей, способных производить антитела человека.
[0004] Способы использования антител к hIL-4R описаны в патентах США №№5,714,146; 5,985,280 и 6,716,587.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0005] В первом аспекте настоящее изобретение описывает антитела человека, предпочтительно рекомбинантные антитела человека, которые специфически связывают рецепторы интерлейкина-4 человека (hIL-4R). Для антител человека характерно связывание с hIL-4R с высокой аффинностью и способность нейтрализовать активность hIL-4. В конкретных осуществлениях настоящего изобретения антитела человека в состоянии блокировать связывание комплекса hIL-13/hIL-13R1 с hIL-4R и тем самым ингибировать передачу сигнала через hIL-13. Антитела могут быть полноразмерными (например, антитела IgG1 или IgG4) или включать только антиген-связывающую часть (например, фрагмент Fab, F(abʹ)2 или scFv) и могут быть модифицированы с целью воздействовать на функциональность, например, удалять остаточные эффекторные функции (Reddy et al. (2000) J. Immunol. 164: 1925-1933).
[0006] В общем осуществлении настоящего изобретения рассматривается антитело или его антиген-связывающий фрагмент, который специфическим образом связывает ML-4R (SEQ ID №: 274) с KD порядка 300 пМ или менее по данным поверхностного плазмонного резонанса по результатам мономерного или димерного анализа. В более конкретном осуществлении антитело или его антиген-связывающая область демонстрирует KD около 200 пМ или менее, около 150 пМ или менее, около 100 пМ или менее, либо около 50 пМ или менее. В различных осуществлениях антитело или его антиген-связывающий фрагмент блокирует активность hIL-4 с IC50 примерно 100 пМ или менее по результатам измерения биологической активности люциферазы. В более конкретных осуществлениях антитело или антиген-связывающий фрагмент демонстрирует IC50 около 50 пМ или менее, около 30 пМ или менее, либо около 25 пМ или менее по результатам измерения биологической активности люциферазы STAT6. В различных осуществлениях антитело или антиген-связывающий фрагмент блокирует активность hIL-13 с IC50 около 100 пМ или менее, около 90 пМ или менее, около 50 пМ или менее, либо около 20 пМ или менее по результатам измерения биологической активности люциферазы STAT6.
[0007] Во втором аспекте антитело настоящего изобретения содержит вариабельную область тяжелой цепи (HCVR), выбираемую из группы, включающей SEQ ID №: 2, 18, 22, 26, 42, 46, 50, 66, 70, 74, 90, 94, 98, 114, 118, 122, 138, 142, 146, 162, 166, 170, 186, 190, 194, 210, 214, 218, 234, 238, 242, 258 и 262, или его существенно аналогичную последовательность.
[0008] В третьем аспекте антитело настоящего изобретения содержит вариабельную область легкой цепи (LCVR), выбираемую из группы, включающей SEQ ID №: 10, 20, 24, 34, 44, 48, 58, 68, 72, 82, 92, 96, 106, 116, 120, 130, 140, 144, 154, 164, 168, 178, 188, 192, 202, 212, 216, 226, 236, 240, 250, 260 и 264, или его существенно аналогичную последовательность.
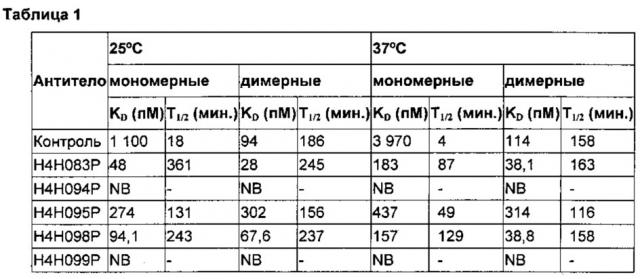
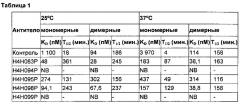
[0009] В одном осуществлении антитело или фрагмент антитела настоящего изобретения содержит пары последовательностей HCVR и LCVR (HCVR/LCVR), выбираемые из группы, включающей SEQ ID №: 2/10, 18/20, 22/24, 26/34, 42/44, 46/48, 50/58, 66/68, 70/72, 74/82, 90/92, 94/96, 98/106, 114/116, 118/120, 122/130, 138/140, 142/144, 146/154, 162/164, 166/168, 170/178, 186/188, 190/192, 194/202, 210/212, 214/216, 218/226, 234/236, 238/240, 242/250, 258/260 и 262/264. В предпочтительном осуществлении антитело или фрагмент антитела содержит пары последовательностей HCVR/LCVR SEQ ID №: 162/164, 210/212 или 18/20; примерами антител с такими парами последовательностей HCVR/LCVR являются антитела, обозначаемые H4H098P (SEQ ID №№: 162/164), H4H083P SEQ ID №№: 210/212) и H4H095P (SEQ ID №№: 18/20).
[0010] В четвертом аспекте настоящего изобретения приводятся молекулы нуклеиновой кислоты, кодирующие HCVR, где молекула нуклеиновой кислоты является нуклеотидной последовательностью, выбираемой из группы, включающей SEQ ID №: 1, 17, 21, 25, 41, 45, 49, 65, 69, 73, 89, 93, 97, 113, 117, 121, 137, 141, 145, 161, 165, 169, 185, 189, 193, 209, 213, 217, 233, 237, 241, 257 и 261, или ее существенно идентичную последовательность с гомологией не менее 95%.
[0011] В пятом аспекте настоящего изобретения приводятся молекулы нуклеиновой кислоты, кодирующие LCVR, где молекула нуклеиновой кислоты является последовательностью, выбираемой из группы, включающей SEQ ID I №: 9, 19, 23, 33, 43, 47, 57, 67, 71, 81, 91, 95, 105, 115, 119, 129, 139, 143, 153, 163, 167, 177, 187, 191, 201, 211, 215, 225, 235, 239, 249, 259 и 263, или ее существенно идентичную последовательность с гомологией не менее 95%.
[0012] В одном осуществлении антитело настоящего изобретения содержит HCVR и LCVR, кодированные парами нуклеотидной последовательности, выбираемыми из группы, включающей SEQ ID №: 1/9, 17/19, 21/22, 25/33, 41/43, 45/47, 49/57, 65/67, 69/71, 73/81, 89/91, 93/95, 97/105, 113/115, 117/119, 121/129, 137/139, 141/143, 145/153, 161/163, 165/167, 169/177, 185/187, 189/191, 193/201, 209/211, 213/215, 217/225, 233/235, 237/239, 241/249, 257/259 и 261/263. В предпочтительном осуществлении изобретения антитело или фрагмент антитела содержит последовательности HCVR/LCVR, кодируемые последовательностями нуклеиновых кислот, выбираемых из SEQ ID NO: 161/163, 209/211 и 17/19. В еще более предпочтительном осуществлении антитело или фрагмент антитела содержит HCVR/LCVR, кодируемые последовательностями нуклеиновых кислот SEQ ID NO: 161/163.
[0013] В шестом аспекте настоящего изобретения приводится антитело или антиген-связывающий фрагмент, содержащий HCDR3 и LCDR3, где домен HCDR3 выбирается из группы, включающей SEQ ID №: 8, 32, 56, 80, 104, 128, 152, 176, 200, 224 и 248; а домен LCDR3 выбирается из группы, включающей SEQ ID №: 16, 40, 64, 88, 112, 136, 160, 184, 208, 232 и 256. В предпочтительном осуществлении последовательностями HCDR3/LCDR3 являются SEQ ID №: 152/160, 8/16 или 200/208. В еще более предпочтительном осуществлении последовательностями HCDR3 и LCDR3 являются SEQ ID №: 152 и 160.
[0014] В дополнительном осуществлении антитело или фрагмент антитела дополнительно содержит последовательность HCDR1, выбираемую из группы, включающей SEQ ID №: 4, 28, 52, 76, 100, 124, 148, 172, 196, 220 и 244, или ее существенно аналогичную последовательность; последовательность HCDR2, выбираемую из группы, включающей SEQ ID №: 6, 30, 54, 78, 102, 126, 150, 174, 198, 222 и 246, или ее существенно аналогичную последовательность; последовательность HCDR3, выбираемую из группы, включающей SEQ ID №: 8, 32, 56, 80, 104, 128, 152, 176, 200, 224 и 248, или ее существенно аналогичную последовательность; последовательность LCDR1, выбираемую из группы, включающей SEQ ID №: 12, 36, 60, 84, 108, 132, 156, 180, 204, 228 и 252, или ее существенно аналогичную последовательность; последовательность LCDR2, выбираемую из группы, включающей SEQ ID №: 14, 38, 62, 86, 110, 134, 158, 182, 206, 230 и 252, или ее существенно аналогичную последовательность; и последовательность LCDR3, выбираемую из группы, включающей SEQ ID №: 16, 40, 64, 88, 112, 136, 160, 184, 208, 232 и 256, или ее существенно аналогичную последовательность. В предпочтительном осуществлении антитело или антиген-связывающий фрагмент содержит последовательности HCDR SEQ ID №: 148, 150 и 152 и последовательности LCDR SEQ ID №: 156, 158 и 160; последовательности HCDR SEQ ID №:4, 6 и 8 и последовательности LCDR SEQ ID №: 12, 14 и 16; и последовательности HCDR SEQ ID №: 196, 198 и 200 и последовательности LCDR SEQ ID №: 204, 206 и 208.
[0015] В некоторых осуществлениях настоящее изобретение предлагает антитела анти-hIL-4R или его антиген-связывающие фрагменты, причем последовательности HCDR1/HCDR2/HCDR3/LCDR1/LCDR2/LCDR3 выбираются из группы, включающей SEQ ID №№: 148/150/152/156/158/160; 4/6/8/12/14/16; и 196/198/200/204/206/208. Примерами антител с такими последовательностями HCDR1/HCDR2/HCDR3/LCDR1/LCDR2/LCDR3 являются антитела, обозначаемые H4H098P (SEQ ID №№: 148/150/152/156/158/160), H4H083P (SEQ ID №№: 196/198/200/204/206/208) и H4H095P (SEQ ID №№:4/6/8/12/14/16).
[0016] В седьмом аспекте приводится антитело человека или фрагмент антитела, содержащий HCDR3 и LCDR3, где HCDR3 кодируется нуклеотидной последовательностью выбираемой из группы, содержащей SEQ ID №:7, 31, 55, 79, 103, 127, 151, 175, 199, 223 и 247, или существенно идентичной последовательностью с гомологией не менее 95%, a LCDR3 кодируется нуклеотидной последовательностью, выбираемой из группы, включающей SEQ ID №: 15, 39, 63, 87, 111, 135, 159, 183, 207, 231 и 255, или существенно идентичной последовательностью с гомологией не менее 95%.
[0017] В дополнительном осуществлении настоящего изобретения приводится антитело человека или фрагмент антитела, содержащий домен HCDR1, кодируемый нуклеотидной последовательностью, выбираемой из группы, включающей SEQ ID №: 3, 27, 51, 75, 99, 123, 147, 171, 195, 219 и 243, или существенно идентичной последовательностью с гомологией не менее 95%; домен HCDR2, кодируемый нуклеотидной последовательностью, выбираемой из группы, включающей SEQ ID №: 5, 29, 53, 77, 101, 125, 149, 173, 197, 221 и 245, или существенно идентичной последовательностью с гомологией не менее 95%; домен HCDR3, кодируемый нуклеотидной последовательностью, выбираемой из группы, включающей SEQ ID №: 7, 31, 55, 79, 103, 127, 151, 175, 199, 223 и 247, или существенно идентичной последовательностью с гомологией не менее 95%; домен LCDR1, кодируемый нуклеотидной последовательностью, выбираемой из группы, включающей SEQ ID №: 11, 35, 59, 83, 107, 131, 155, 179, 203, 227 и 251, или существенно идентичной последовательностью с гомологией не менее 95%; домен LCDR2, кодируемый нуклеотидной последовательностью, выбираемой из группы, включающей SEQ ID №: 13, 37, 61, 85, 109, 133, 157, 181, 205, 229 и 253, или существенно идентичной последовательностью с гомологией не менее 95%; домен LCDR3, кодируемый нуклеотидной последовательностью, выбираемой из группы, включающей SEQ ID №: 15, 39, 63, 87, 111, 135, 159, 183, 207, 231 и 255, или существенно идентичной последовательностью с гомологией не менее 95%. В предпочтительном осуществлении антитело или антиген-связывающий фрагмент содержит последовательности HCDR и LCDR, кодируемые нуклеотидными последовательностями SEQ ID №: 147, 149, 151, 155, 157 и 159; 195, 197, 199, 203, 205 и 207; и 3, 5, 7, 11, 13 и 15.
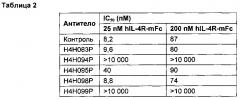
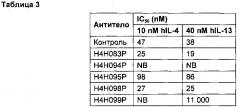
[0018] В конкретном осуществлении антитело анти-hIL-4R или антиген-связывающий фрагмент настоящего изобретения содержит HCVR, включающую аминокислотную последовательность, показанную в SEQ ID №: 162, и LCVR, включающую аминокислотную последовательность, показанную в SEQ ID №: 164, и характеризуется KD около 100 пМ или менее (мономерный субстрат) или 70 пМ или менее (димерный субстрат); KD около 160 пМ или менее (мономерный субстрат) или 40 пМ или менее (димерный субстрат) при 25°C и 37°C соответственно; и IC50 около 10 пМ или менее (25 пМ димерного субстрата) или около 100 пМ или менее (200 пМ мономерного субстрата), который способен блокировать активность hIL-4 и hIL-13 с IC50 около 30 пМ или менее (по результатам измерения биологической активности) и вступает в перекрестную реакцию с IL-4R обезьяны.
[0019] В конкретном осуществлении антитело анти-hIL-4R или антиген-связывающий фрагмент настоящего изобретения содержит HCVR, включающую аминокислотную последовательность, показанную в SEQ ID №: 18, и LCVR, включающую аминокислотную последовательность, показанную в SEQ ID №: 20, и характеризуется KD около 450 пМ или менее (мономерный или димерный субстрат) и IC50 около 40 пМ или менее (25 пМ димерного субстрата) или около 100 пМ или менее (200 пМ мономерного субстрата), который способен блокировать активность hIL-4 и hIL-13 с IC50 около 100 пМ или менее (по результатам измерения биологической активности).
[0020] В конкретном осуществлении антитело анти-hIL-4R или антиген-связывающий фрагмент настоящего изобретения содержит HCVR, включающую аминокислотную последовательность, показанную в SEQ ID №: 210, и LCVR, включающую аминокислотную последовательность, показанную в SEQ ID №: 212, и характеризуется KD около 50 пМ или менее (мономерный субстрат) или 30 пМ или менее (димерный субстрат); KD около 200 пМ или менее (мономерный субстрат) или 40 пМ или менее (димерный субстрат) при 25°C и 37°C соответственно; и IC50 около 10 пМ или менее (25 пМ димерного субстрата) или около 90 пМ или менее (200 пМ мономерного субстрата), который способен блокировать активность hIL-4 и hIL-13 с IC50 около 25 пМ или менее (по результатам измерения биологической активности) и не вступает в перекрестную реакцию с IL-4R обезьяны.
[0021] В восьмом аспекте настоящего изобретения приводится антитело или антиген-связывающий фрагмент антитела, который специфическим образом связывает hIL-4R, с содержанием трех определяющих комплементарность областей тяжелой цепи и трех определяющих комплементарность областей легкой цепи (HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3), где HCDR1 содержит аминокислотную последовательность формулы X1-X2-X3-X4-X5-X6-X7-X8 (SEQ ID №:265), где X1=Gly; X2=Phe; Χ3=Thr; Χ4=Phe; Χ5=Asp или Arg; Xs=Asp или Ser; X7=Tyr; и Χ8=Ala или Gly; HCDR2 содержит аминокислотную последовательность формулы X1-X2-X3-X4-X5-X6-X7-X8 (SEQ ID №:266), где X1=Ile или Leu, X2=Ser, Χ3=Gly, Tyr или Arg, Х4=Ser, Asp или Thr, Χ5=Gly или Ser, Χ6=Gly, Ser или Val, X7=Ser или Asn и X8=Thr, Lys или He; HCDR3 содержит аминокислотную последовательность формулы Χ1-Χ2-Χ3-Χ4-Χ5-X6-Χ7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18 (SEQ ID №: 267), где Χ1=Ala, Χ2=Lys, Χ3=Asp, Glu или Trp, Χ4=Gly или Arg, Χ5=Leu, Thr или Arg, X6=Gly, Arg или Ser, X7=Ile или Gly, X8=Thr, Phe или Tyr, Χ9=Ile, Asp или Phe, X10=Arg, Tyr или Asp, X11=Pro, Tyr или отсутствует, Χ12=Arg или отсутствует, Χ13=Tyr или отсутствует, X14=Tyt или отсутствует, X15=Gly или отсутствует, X16=Leu или отсутствует, X17=Asp или отсутствует и X18=Val или отсутствует; LCDR1 содержит аминокислотную последовательность формулы X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11 (SEQ ID №: 268), где X1=Gln, X2=Asp, Ser или Val, Χ3=Ile или Leu, Χ4=Ser, Leu или Asn, Χ5=Asn, Tyr или Ile, Χ6=Trp, Ser или Tyr; Χ7=Ile или отсутствует; Χ8=Gly или отсутствует; Χ9=Tyr или отсутствует; X10=Asn или отсутствует; и X11=Tyr или отсутствует; LCDR2 содержит аминокислотную последовательность формулы X1-X2-X3 (SEQ ID №: 269), где X1=Leu, Ala или Val, Χ2=Ala или Gly и Χ3=Ser; и LCDR3 содержит аминокислотную последовательность формулы X1-X2-X3-X4-X5-X6-X7-X8-X9 (SEQ ID №: 270), где X1=Gln или Met, X2=Gln, Χ3=Ala или Tyr, Χ4=Leu или Asn, Χ5=Gln или Ser, Χ6=Thr, Phe или His, X7=Pro, X8=Tyr, Ile или Trp и X9=Thr.
[0022] В более конкретном осуществлении HCDR1 содержит аминокислотную последовательность формулы X1-X2-X3-X4-X5-X6-X7-X8 (SEQ ID №:265), где X1=Gly; X2=Phe; Χ3=Thr; Χ4=Phe; X5=Arg; X6=Asp или Ser; X7=Tyr; и X8=Ala или Gly; HCDR2 содержит аминокислотную последовательность формулы Χ1-Χ2-Χ3-Χ4-X5-X6-X7-X8 (SEQ ID №: 266), где Χ1=Ile, Χ2=Ser, Χ3=Gly или Tyr, Χ4=Ser или Thr, Χ5=Gly, Χ6=Gly или Ser, Χ7=Asn и Χ8=Thr или Lys; HCDR3 содержит аминокислотную последовательность формулы X1-X2-X3-X4-X5-Χ6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-Χ17-X18 (SEQ ID №: 267), где X1=Ala, X2=Lys, Χ3=Asp или Glu, Χ4=Gly или Arg, Χ5=Leu или Arg, Χ6=Gly или Ser, Χ7=Ile или Gly, Χ8=Thr или Phe, Χ9=Ile или Asp, Χ10=Arg или Tyr, Χ11=Pro или отсутствует, Χ12=Arg или отсутствует, Χ13=Туг или отсутствует, X14=Tyr или отсутствует, X15=Gly или отсутствует, X16=Leu или отсутствует, X17=Asp или отсутствует и X18=Val или отсутствует; LCDR1 содержит аминокислотную последовательность формулы X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11 (SEQ ID №: 268), где X1=Gln, X2=Ser или Val, Χ3=Ile или Leu, Χ4=Leu или Asn, X5=Asn или Tyr, Χ6=Ser или Tyr; X7=Ile или отсутствует; X8=Gly или отсутствует; X9=Tyr или отсутствует; X10=Asn или отсутствует; и X11=Tyr или отсутствует; LCDR2 содержит аминокислотную последовательность формулы Χ1-X2-X3 (SEQ ID №: 269), где X1=Leu, Ala или Val, Χ2=Ala или Gly и Χ3=Ser; и LCDR3 содержит аминокислотную последовательность формулы X1-X2-X3-X4-X5-Χ6-X7-X8-X9 (SEQ ID №: 270), где X1=Gln или Met, X2=Gln, Χ3=Ala или Tyr, Χ4=Leu или Asn, X5=Gln или Ser, X6=Thr или His, X7=Pro, X8=Tyr или Trp и X9=Thr.
[0023] В дополнительном более конкретном осуществлении HCDR1 содержит аминокислотную последовательность формулы X1-X2-X3-X4-X5-X6-X7-X8 (SEQ ID №:265), где X1=Gly; X2=Phe; Χ3=Thr; Χ4=Phe; Χ5=Asp или Arg; X6=Asp; Χ7=Tyr; и X8=Ala; HCDR2 содержит аминокислотную последовательность формулы X1-X2-X3-X4-X5-X6-X7-X8 (SEQ ID №:266), где X1=Ile или Leu, X2=Ser, Χ3=Gly или Arg, X4=Ser или Thr, X5=Gly или Ser, Xs=Gly или Val, X7=Ser или Asn и X8=Thr или lie; HCDR3 содержит аминокислотную последовательность формулы Χ1-Χ2-Χ3-Χ4-X5-Χ6-Χ7-Χ8-Χ9-Χ10-Χ11-Χ12-Χ13-Χ14-Χ15-Χ16-Χ17-Χ18 (SEQ ID №: 267), где Χ1=Ala, Χ2=Lys, Χ3=Asp или Trp, Χ4=Gly или Arg, Χ5=Leu или Thr, Χ6=Arg или Ser, Χ7=Ile или Gly, Χ8=Thr или Tyr, X9=Ile или Phe, X10=Arg или Asp, Χ11=Pro, Tyr или отсутствует, X12=Arg или отсутствует, X13=Tyr или отсутствует, X14=Tyr или отсутствует, X15=Gly или отсутствует, X16=Leu или отсутствует, X17=Asp или отсутствует и X18=Val или отсутствует; LCDR1 содержит аминокислотную последовательность формулы X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11 (SEQ ID №: 268), где X1=Gln, X2=Asp или Ser, Χ3=Ile или Leu, Χ4=Ser или Leu, Χ5=Tyr или Ile, X6=Trp или Ser; X7=Ile или отсутствует; X8=Gly или отсутствует; X9=Tyr или отсутствует; X10=Asn или отсутствует; и X11=Tyr или отсутствует; LCDR2 содержит аминокислотную последовательность формулы X1-X2-X3 (SEQ ID №: 269), где X1=Leu или Val, X2=Ala или Gly и Χ3=Ser; и LCDR3 содержит аминокислотную последовательность формулы X1-X2-X3-X4-X5-X6-X7-X8-X9 (SEQ ID №: 270), где X1=Gln или Met, X2=Gln, Χ3=Ala, Χ4=Leu или Asn, Χ5=Gln или Ser, Χ6=Thr или Phe, Χ7=Pro, Χ8=Tyr или Ile и X9=Thr.
[0024] В девятом аспекте настоящего изобретения приводится антитело или антиген-связывающий фрагмент, содержащий последовательности HCDR1/HCDR2/HCDR3/LCDR1/LCDR2/LCDR3 из пары HCVR и LCVR, где последовательности HCVR/LCVR выбираются из группы, включающей SEQ ID №: 162/164, 210/212 и 18/20. В более конкретном осуществлении последовательностями CDR тяжелой и легкой цепей являются последовательности, содержащиеся в HCVR SEQ ID №: 162 и LCVR SEQ ID №: 164. В дополнительном более конкретном осуществлении последовательностями CDR тяжелой и легкой цепей являются последовательности, содержащиеся в HCVR SEQ ID №: 18 и LCVR SEQ ID №: 20. В еще одном дополнительном более конкретном осуществлении последовательностями CDR тяжелой и легкой цепей являются содержащиеся в HCVR SEQ ID №: 210 и LCVR SEQ ID №: 212.
[0025] Настоящее изобретение включает антитела анти-hIL-4R с модифицированной структурой гликозилирования. В некоторых осуществлениях может оказаться полезным удалить нежелательные сайты гликозилирования или использовать антитело без фукозного фрагмента в олигосахаридной цепи, например для усиления функции антителозависимой клеточно-обусловленной цитотоксичности (ADCC) (см. Shield et al. (2002) JBC 277: 26733). В других осуществлениях может осуществляться модификация галактозилирования, с тем чтобы изменить комплементзависимую цитотоксичность (CDC).
[0026] В десятом аспекте настоящего изобретения приводятся рекомбинантные векторы экспрессии, несущие молекулы нуклеиновой кислоты настоящего изобретения, и клетки-хозяева, в которые включаются такие векторы, а также способы приготовления антител или антиген-связывающих фрагментов настоящего изобретения, полученных культивированием клеток-хозяев настоящего изобретения. Клеткой-хозяином может быть прокариотическая или эукариотическая клетка, предпочтительной клеткой-хозяином является клетка Е. coli или клетка млекопитающего, например клетка СНО (из яичников китайского хомячка).
[0027] В одиннадцатом аспекте настоящего изобретения характеризуется состав, включающий рекомбинантное антитело человека, которое специфически связывает hIL-4R, и приемлемый носитель.
[0028] В двенадцатом аспекте настоящего изобретения приводятся способы ингибирования активности hIL-4 с помощью приведенного в настоящем изобретении антитела или его антиген-связывающей области. В отдельных осуществлениях антитела настоящего изобретения также блокируют связывание комплекса hIL-13/hIL-13R1 с hIL-4R. В одном из осуществлений способ включает взаимодействие hIL-4R с антителом настоящего изобретения или его антиген-связывающей областью таким образом, что при этом происходит ингибирование активности hIL-4 или hIL-4/hIL-13. В другом осуществлении способ включает введение антитела настоящего изобретения или его антиген-связывающей области человеку, страдающему нарушением, которое можно облегчить ингибированием активности hIL-4 или hIL-4/hIL-13. Таким подлежащим лечению нарушением является любое заболевание или состояние, которое улучшается, облегчается, подавляется или предупреждается за счет устранения, ингибирования или снижения активности hIL-4 или hIL-4/hIL-13.
[0029] К связанным с IL-4 нарушениям, которые лечатся антителами или фрагментами антител настоящего изобретения, относятся, например, артрит (в том числе септический артрит), герпетиформные заболевания, хроническая идиопатическая уртикария, склеродерма, гипертрофическое рубцевание, синдром Уиппла, доброкачественная гиперплазия простаты, заболевания легких, такие как слабая, умеренная или острая астма, воспалительные заболевания, например воспалительные заболевания кишечника, аллергические реакции, синдром Кавасаки, серповидноклеточная анемия, синдром Черджа-Стросс, диффузный токсический зоб, предэклампсия, синдром Шегрена, аутоиммунный лимфопролиферативный синдром, аутоиммунная гемолитическая анемия, пищевод Барретта, аутоиммунный увеит, туберкулез и нефроз.
[0030] Другие цели и преимущества станут очевидными при ознакомлении с приведенным ниже подробным описанием.
ПОЛНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0031] Прежде чем приступить к описанию представляемых способов, необходимо отметить, что настоящее изобретение не ограничивается конкретными способами и изложенными экспериментальными условиями, поскольку такие способы и условия могут меняться. Следует также понимать, что используемая в настоящем документе терминология предназначена исключительно для описания конкретных осуществлений и не носит ограничительного характера, поскольку охват настоящего изобретения ограничивается только прилагаемой формулой изобретения.
[0032] Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют такое же значение, которое общеизвестно рядовым специалистам в области, к которой относится настоящее изобретение. Хотя на практике или при проверке настоящего изобретения могут использоваться любые способы и материалы, аналогичные или идентичные описанным в настоящем документе, ниже приводится описание предпочтительных способов и материалов.
Определения
[0033] Используемый в настоящем документе термин «IL4R человека» (hIL-4R) предназначен для обозначения рецептора цитокина человека, который специфически связывает интерлейкин-4 (IL-4), IL-4Ra (SEQ ID №: 274). Термин «человеческий интерлейкин-13» (hIL-13) относится к цитокину, который специфически связывает рецептор IL-13, а «комплекс hIL-13/hIL-13R1» означает комплекс, образующийся в результате связывания hIL-13 с комплексом hIL-13R1, при этом получающийся комплекс связывается с рецептором hIL-4, чтобы инициировать биологическую активность.
[0034] Используемый в настоящем документе термин «антитело» предназначен для обозначения молекул иммуноглобулина, составленных из четырех полипептидных цепей, при этом две тяжелые (H) цепи и две легкие (L) цепи связываются друг с другом дисульфидными связями. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (HCVR, или VH) и константную область тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов: CH1, CH2 и CH3. Каждая легкая цепь содержит вариабельную область легкой цепи (LCVR, или VL) и константную область легкой цепи. Константная область легкой цепи содержит один домен (CL1). Области VH и VL могут подразделяться на области гипервариабельности, которые называются определяющими комплементарность областями (CDR), перемежаемые областями с более высоким уровнем консервативности, называемые остовными областями (FR). Каждая область VH и VL образована тремя CDR и четырьмя FR, расположенными от амино-терминального конца к карбокси-терминальному концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
[0035] Используемый в настоящем документе термин «антиген-связывающая область» антитела (или просто «часть антитела» или «фрагмент антитела») обозначает один или несколько фрагментов антитела, которые сохраняют способность к специфическому связыванию с антигеном (например, hIL-4R). Было показано, что антиген-связывающая функция антитела может осуществляться фрагментами всей последовательности антитела. К примерам связывающих фрагментов, включенных в термин «антиген-связывающая область» антитела, относятся (i) фрагмент Fab, моновалентный фрагмент, состоящий из доменов VL, VH, CL1 и CH1; (ii) фрагмент F(abʹ)2, бивалентный фрагмент, состоящий из двух фрагментов F(ab)ʹ, связанных дисульфидным мостиком в шарнирной области; (iii) фрагмент Fd, состоящий из доменов VH и CH1; (iv) фрагмент Fv, состоящий из доменов VL и VH отдельной области антитела; (v) фрагмент dAb (Ward et al. (1989) Nature 241: 544-546), состоящий из домена VH; и (vi) CDR. Более того, несмотря на то что два домена в фрагменте Fv, VL и VH, кодируются различными генами, их можно объединить, используя рекомбинантные технологии, посредством синтетического линкера, который позволяет построить из них единую непрерывную цепочку, в которой области VL и VH связываются с образованием моновалентных молекул (известных как одиночная цепь Fv (scFv); см., например, Bird et al. (1988) Science 242: 423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85: 5879-5883). Такие одноцепочечные антитела также включаются в сферу охвата термина «антиген-связывающая область» антитела. Сюда же входят и другие формы одноцепочечных антител, например диатела (см., напр., Holliger et al. (1993) Proc. Natl. Acad Sci. USA 90: 6444-6448).
[0036] Под используемым в настоящем документе термином «нейтрализующее», или «блокирующее» антитело понимается антитело, связывание которого с hIL-4R приводит к ингибированию биологической активности hIL-4 и/или hIL-13. Такое ингибирование биологической активности hIL-4 и/или IL-13 может оцениваться посредством измерения одного или нескольких показателей биологической активности hIL-4 и/или hIL-13, известных специалистам в данной области, например клеточной активации, индуцированной hIL-4 и/или IL-13, и связывания hIL-4 с hIL-4R (см. примеры ниже).
[0037] «CDR», или определяющая комплементарность область представляет собой область гипервариабельности, перемежаемую областями с более высоким уровнем консервативности, называемыми «остовными областями» (FR). В различных осуществлениях антитела анти-hIL-4R или предлагаемого в настоящем изобретении фрагмента FR могут быть идентичны последовательностям зародышевых линий человека или могут естественным или искусственным образом модифицироваться.
[0038] Используемый в настоящем документе термин «поверхностный плазмонный резонанс» относится к оптическому явлению, которое позволяет проводить анализ взаимодействий в реальном времени за счет детектирования изменений концентраций белка в биосенсорной матрице, например с помощью системы BIACORE™ (Pharmacia Biosensor AB).
[0039] Термином «эпитоп» обозначается антигенный детерминант, который взаимодействует со специфическим сайтом связывания антигена в вариабельной области молекулы антитела, известной как паратоп. Отдельный антиген может содержать более одного эпитопа. Эпитопы могут быть конформационными или линейными. Конформационный эпитоп образуется пространственно расположенными аминокислотами из различных сегментов линейной полипептидной цепи. Линейным называется эпитоп, образованный соседними аминокислотными остатками в полипептидной цепи. В определенных обстоятельствах эпитоп может включать фрагменты сахаридов, фосфорильные группы или сульфонильные группы антигена.
[0040] Термин «существенная идентичность» или «по существу идентичны» в отношении нуклеиновой кислоты или ее фрагмента означает, что при оптимальном выравнивании соответствующих добавлений или делеций нуклеотидов относительно другой нуклеиновой кислоты (или ее комплементарной цепи) наблюдается идентичность нуклеотидной последовательности по крайней мере на уровне 95%, более предпочтительно по крайней мере на уровне примерно 96%, 97%, 98% или 99% оснований нуклеотидов, что измеряется с помощью любого известного алгоритма идентичности последовательностей, например FASTA, BLAST или Gap, которые обсуждаются ниже.
[0041] Применяемый в отношении полипептидов термин «существенное сходство» или «по существу подобные» означает, что две пептидные последовательности при их оптимальном выравнивании, например с помощью программ GAP или BESTFIT с учетом «веса» разрывов, заданного по умолчанию, демонстрируют по крайней мере 95%-ную идентичность последовательностей, более предпочтительно по крайней мере 98%-ную или 99%-ную идентичность последовательностей. Предпочтительно, положения неидентичных остатков отличаются консервативными замещениями аминокислот. «Консервативное замещение аминокислот» - это такое замещение, при котором один аминокислотный остаток замещается другим аминокислотным остатком, имеющим боковую цепь (группу R) с аналогичными химическими свойствами (например, заряд или гидрофобность). В общем случае консервативное замещение аминокислот не будет приводить к существенным изменениям функциональных свойств белка. В случае если две или более аминокислотные последовательности отличаются друг от друга консервативным замещением, процент идентичности последовательности или степень аналогичности можно корректировать в сторону увеличения, с тем чтобы учесть консервативный характер замещения. Способы такой корректировки хорошо известны специалистам в данной области. См., например, Pearson (1994) Methods Mol. Biol. 24: 307-331. К примерам групп аминокислот, имеющих боковые цепи с подобными химическими свойствами, относятся (1) алифатические боковые цепи: глицин, аланин, валин, лейцин и изолейцин; (2) алифатические гидроксилированные боковые цепи: серии и треонин; (3) боковые цепи с амидной группой: аспарагин и глутамин; (4) ароматические боковые цепи: фенилаланин, тирозин и триптофан; (5) боковые цепи со свойствами основания: лизин, аргинин и гистидин; (6) боковые цепи со свойствами кислоты: аспартат и глутамат; и (7) серосодержащие боковые цепи - цистеин и метионин. Предпочтительными группами для консервативного замещения аминокислот являются: валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин, глутамат-аспартат и аспарагин-глутамин. В альтернативном варианте консервативное замещение представляет собой любое изменение, приводящее к положительному значению в логарифмической матрице правдоподобия PAM250, описанной в работе Gonnet et al. (1992) Science 256: 1443-1445. «Умеренно консервативным» замещением называется любое изменение, приводящее к неотрицательному значению в логарифмической матрице правдоподобия PAM250.
[0042] Подобие последовательностей полипептидов, которое также называют идентичностью последовательностей, обычно определяют с помощью программного обеспечения для анализа последовательности. Программа для анализа белков сопоставляет подобные последовательности с использованием показателей аналогичности, задаваемых для различных замещений, делеций и других модификаций, в том числе для консервативного замещения аминокислот. Например, программное обеспечение GCG содержит такие программы как Gap и Bestfit, которые могут использоваться с параметрами по умолчанию для определения гомологии или идентичности последовательности между близкородственными полипептидами, например гомологичными полипептидами различных видов организмов или между исходным белком и его мутантом. См., например, GCG Вер. 6.1. Полипептидные последовательности можно также сопоставлять с помощью FASTA - программы, включенной в GCG Вер. 6.1, - с использованием параметров по умолчанию или рекомендуемых параметров. FASTA (например, FASTA2 и FASTA3) обеспечивает выравнивание и определяет процент идентичности последовательностей в областях с наибольшим перекрыванием между заданной и исследуемой последовательностями (см. выше Pearson (2000)). Другим предпочтительным алгоритмом сопоставления последовательности настоящего изобретения с базой данных, содержащей большое число последовательностей различных организмов, является компьютерная программа BLAST, особенно BLASTP или TBLASTN, которая использует параметры по умолчанию. См., например, Altschul et al. (1990) J. Mol. Biol. 215: 403-410 и Altschul et al. (1997) Nucleic Acids Res. 25: 3389-402. (1990) J. Mol. Biol. 215: 403-410 и Altschul et al. (1997) Nucleic Acids Res. 25: 3389-402.
Получение антител человека
[0043] К методам получения антител человека относятся, например, методы, описываемые в патенте США 6,596,541, Green et al. (1994) Nature Genetics 7: 13-21), в патентах США 5,545,807 и US 6,787,637.
[0044] Грызуны могут быть иммунизированы с помощью любого метода, известного специалистам в области (см., напр., Harlow and Lane (1988) Antibodies: A Laboratory Manual 1988 Cold Spring Harbor Laboratory; Malik and Lillehoj (1994) Antibody Techniques, Academic Press, CA). Антитела настоящего изобретения предпочтительно получают с использованием технологии VELOCIMMUNE™ (патент США 6,596,541). Трансгенные мыши, у которых вариабельные области тяжелой и легкой цепей эндогенного иммуноглобулина заменяют соответствующими вариабельными областями человека, стимулируют представляющим интерес антигеном, и у мыши, экспрессирующей антитела, берут лимфатические клетки (например, B-клетки). Лимфатические клетки можно сливать с линией клеток миеломы для получения иммортализованных линий клеток гибридомы, и такие линии клеток гибридомы проходят скрининг и селекцию для идентификации тех линий клеток гибридомы, которые продуцируют антитела к представляющему интерес антигену. ДНК, кодирующую вариабельные области тяжелой и легкой цепи антитела, можно выделить и связать с нужными изотипическими константными областями тяжелой и легкой цепей. Такой белок антитела может продуцироваться в клетке, например в клетке CHO. В альтернативном варианте ДНК, кодирующую антиген-специфические химерные антитела или вариабельные области легкой и тяжелой цепей, можно выделить непосредственно из антиген-специфических лимфоцитов.
[0045] ДНК, кодирующую вариабельные области тяжелой и легкой цепи антитела, выделяют и функционально связывают с ДНК, кодирующей константные тяжелые и легкие цепи человека. Затем ДНК экспрессируется в клетке, которая в состоянии экспрессировать полное антитело человека. В конкретном применении такой клеткой является клетка CHO.
[0046] Антитела могут использоваться в терапевтических целях для блокирования лиганд-рецепторного взаимодействия или ингибирования рецепторной компоненты взаимодействия вместо уничтожения клеток за счет фиксации комплемента (комплементзависимая цитотоксичность, CDC) и участия в антителозависимой клеточно-обусловленной цитотоксичности (ADCC). Константная область антитела важна для обеспечения способности антитела фиксировать комплемент и опосредовать клеточно-обусловленную цитотоксичность. Поэтому изотип антитела можно выбирать в зависимости от того, желательно ли, чтобы антитело опосредовало цитотоксичность.
[0047] Иммуноглобулины человека могут существовать в двух формах, что связано с гетерогенностью шарнирной области. В одной из форм молекула иммуноглобулина содержит стабильную че