Клеточный продукт инсулин-продуцирующих клеток млекопитающих и его использование для терапии сахарного диабета
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Изобретение представляет собой способ получения клеточного продукта инсулин-продуцирующих клеток человека, включающий получение эпителиальных прогениторных клеток из биоптата эпителиальной ткани и их последующую панкреатическую дифференцировку в клетки, способные к глюкозозависимой секреции инсулина, в котором панкреатическую дифференцировку клеток проводят в две стадии в культуральной среде для эукариотических клеток, обеспечивающей концентрацию ионов кальция в пределах от 0,5 мМ до 2,5 мМ: на первой стадии клетки культивируют в течение 4-15 суток в культуральной среде, содержащей, по крайней мере, сыворотку крови - 2-20 объемных %, глутамин - не менее 1 мМ, эпидермальный фактор роста - 1-300 нг/мл, трансферрин - не менее 0,1 мкг/мл, селенит натрия - 0,1-20 нг/мл, ретиноевую кислоту - 0,1-20 мкМ, изопротеренол - 0,1-10 мкМ; на второй стадии клетки культивируют в течение 4-15 суток в культуральной среде, содержащей, по крайней мере, сыворотку крови - 2-20 объемных %, глутамин - не менее 1 мМ, эпидермальный фактор роста - 1-300 нг/мл, трансферрин - не менее 0,1 мкг/мл, селенит натрия - 0,1-20 нг/мл, ретиноевую кислоту - 10 нМ - 20 мкМ, никотинамид - 1-100 мМ, фактор роста гепатоцитов - 1-300 нг/мл, дексаметазон - 0,01-5 мкМ, где культивирование на обеих стадиях проводят при 37°С в присутствии 5% CO2. Группа изобретений включает клеточный продукт инсулин-продуцирующих клеток млекопитающего, а также способ заместительной терапии сахарного диабета с использованием клеточного продукта. Изобретение позволяет упростить технологии получения инсулин-продуцирующих клеток, получить не менее 70% функционально активных инсулин-продуцирующих клеток в клеточной культуре, прошедшей дифференцировку. 3 н. и 11 з.п. ф-лы, 10 табл., 7 пр., 11 ил.
Реферат
Область изобретения
[001] Группа изобретений относится к области регенеративной медицины и клеточных технологий.
Уровень техники
[002] Сахарный диабет - заболевание эндокринной системы, характеризующееся нарушениями усвоения глюкозы и возникающее из-за недостатка гормона инсулина. Вследствие этого развивается гипергликемия - устойчивое увеличение уровня глюкозы в крови, что приводит к нарушению всех видов обмена веществ (углеводного, жирового, белкового, минерального, водно-солевого). В организме инсулин продуцируют бета-клетки поджелудочной железы, собранные в анатомические структуры, называемые островками Лангерганса и характеризующееся способностью к глюкозозависимой секреции инсулина. Основные виды сахарного диабета - это диабет 1 и 2 типов. Сахарный диабет 1 типа (или инсулинозависимый диабет) - это аутоиммунное заболевание эндокринной системы, вызванное недостаточностью инсулина, возникающей из-за деструкции бета-клеток иммунными клетками организма вследствие выработки аутоантител против белков бета-клеток. Наиболее часто данным типом диабета заболевают люди молодого возраста: дети, подростки, взрослые люди моложе 30 лет. Сахарный диабет 2 типа (инсулиннезависимый диабет) - метаболическое заболевание, характеризующееся хронической гипергликемией, обусловленной снижением чувствительности тканей к инсулину (инсулинорезистентностью). На начальных этапах данного заболевания инсулин секретируется в повышенных количествах. Со временем избыточная секреция инсулина истощает бета-клетки. Диабет 2 типа составляет 85-90% всех случаев сахарного диабета, наиболее часто развивается у людей после 40 лет [Gavin J.R., Davidson М.В., DeFronzo R.A., Drash A, Gabbe S.G., Genuth S., Harris M.I., Kahn R., Keen H., Knowler W.C., Lebovitz H., Maclaren N.K., Palmer J.P., Raskin P., Rizza R.A., Stern M.P. Report of the Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Diabetes Care. 2003. 26(1). s5-s20].
[003] При разработке способов терапии диабета и его последствий обычно используют модели экспериментального диабета у лабораторных животных. Некоторые модели основаны на генетических особенностях линий лабораторных мышей, у которых генетически обусловлено возникновение диабета. [Antoniou A.N., Elliott J., Rosmarakis E., Dyson P.J. MHC class II Ab diabetogenic residue 57 Asp/non-Asp dimorphism influences T-cell recognition and selection. Immunogenetics. 1998. 47(3). 218-225, Driver J.P., Serreze D.V., Chen Y.G. Mouse models for the study of autoimmune type 1 diabetes: a NOD to similarities and differences to human disease. Semin. Immunopathol. 2011. 33. 67-87].
[004] Другой группой экспериментальных моделей сахарного диабета являются модели химически индуцированного диабета, при котором воздействием химических веществ селективно разрушают бета-клетки. В частности, может применяться антибиотик стрептозотоцин, вызывающий специфический некроз бета-клеток. [Lenzen S. The mechanisms of alloxan- and streptozotocininduced diabetes. Diabetologia. 2008. 51(2). 216-226].
[005] Один из возможных путей преодоления проблем сахарного диабета - заместительная клеточная терапия, осуществляемая через восполнение функции утраченных бета-клеток по глюкозозависимой секреции инсулина путем введения в организм инсулин-продуцирующих клеток.
[006] Описаны способы трансплантации больным сахарным диабетом донорских клеток человека или животных (ксенотрансплантация). В частности, известна работа по трансплантации донорских островков Лангерганса пациентам с сахарным диабетом [Shapiro AM, et al., N. Engl. J. Med. 2006. 355(13). 1318-1330].
[007] Однако подобные методы имеют серьезные ограничения, связанные с малой доступностью донорских клеток человека из поджелудочной железы и с не до конца решенным вопросом биологической безопасности материала, полученного из животных, в том числе с опасностью заражения человека инфекциями и/или прионами, которые могут содержаться в клетках свиньи. Кроме того, аллогенная и ксеногенная трансплантации требуют использования иммуносупрессии для подавления иммунного ответа на введенный чужеродный биологический материал. В качестве альтернативы иммуносупрессии предложен ряд способов, подразумевающих помещение чужеродных клеток в специальные контейнеры из биосовместимых материалов, которые пропускают питательные вещества и инсулин, но не пропускают внутрь клетки иммунной системы, например, описанные в [Skinner SJM, et al., InTech. 2011. V. 11. 391-408, US 20040197374 A1 от 07.10.2004]. Однако такие контейнеры постепенно зарастают соединительной тканью с образованием фиброзной капсулы, что со временем снижает эффективность снабжения организма инсулином, а клеток питательными веществами и в конечном результате приводит к их гибели.
[008] Предложены методы получения инсулин-продуцирующих клеток из эмбриональных стволовых клеток или из индуцированных плюрипотентных клеток путем эндокринной панкреатической дифференцировки in vitro. В работе [WO 2002092756 А2, 21.11.2002] эмбриональные стволовые клетки изначально культивируют на фидерном слое в безсывороточной среде, содержащей заменитель сыворотки, незаменимые аминокислоты, меркаптоэтанол, основной фактор роста фибробластов (bFGF, basic fibroblast growth factor). Затем клетки подвергают суспензионному культивированию на культуральных чашках с неадгезивной поверхностью в вышеуказанной среде без bFGF. Образовавшиеся эмбриональные тельца дезагрегируют и помещают в покрытые фибронектином культуральные флаконы в безсывороточной среде, к которой добавляют следующие факторы: добавку «инсулин-трансферрин-селенит», добавку В27; добавку N2, bFGF, ламинин и никотинамид. Через 20-30 дней из получившейся культуры выделяют клетки, обладающие способностью секретировать инсулин в глюкозозависимой манере и получают стабильные клеточные линии.
[009] В другом способе [Jiang W, et al., Cell Res. 2007. 17(4). 333-344] эмбриональные стволовые клетки культивируют на безсывороточной среде, затем пересаживают их в культуральные флаконы, покрытые 1% матригелем (B&D Biosciences, США), заменяют среду культивирования на 50% среду Дульбекко, модифицированную по способу Исков (IMDM - Iscove modified Dulbecco's medium) и 50% смеси F12 (F12 Nutrient Mixture), с добавлением добавки «инсулин-трансферрин-селенит», монотиоглицерина, альбумина. Через два дня к клеткам добавляют активин А, через 4 дня - ретиноевую кислоту. Через 4 дня среду культивирования меняют на DMEM/F12 1:1, с добавлением добавки «инсулин-трансферрин-селенит», альбумина, основного фактора роста фибробластов. Через 3 дня к среде добавляют никотинамид. Через 5 дней клетки подвергают сфероидному культивированию для созревания в течение следующих 5 дней. В результате получают клетки, экспрессирующие С-пептид, инсулин, глюкагон, глюкозный транспортер тип 2 (GLUT2). С помощью описанного способа эффективной панкреатической дифференцировке подвергается только около 15% клеток.
[010] Известен способ дифференцировки стволовых клеток в инсулин-продуцирующие клетки [US 20050054102 А1], основанный на применении ряда дифференцировочных сред с целью активации одного или нескольких генов, необходимых для дифференцировки бета-клеток, выбранных из группы: PDX1, РАХ4, РАХ6, NGN3, NKX6.1, NKX6.2, NKX2.2, НВ9, ВЕТА2, NEUROD, ISI1, HNF1-alpha, HNF1-beta, HNF3 или комбинации этих генов. Стволовые клетки сначала культивируют в посуде с неадгезивной поверхностью для образования эмбриоидных телец, затем дифференцируют в среде IMDM с добавлением эмбриональной телячьей сыворотки, L-глутамина, незаменимых аминокислот, эпидермального фактора роста, основного фактора роста фибробластов, прогестерона, фоллистатина и/или активина. В результате получают не менее 20% инсулин-продуцирующих клеток в течение 15 дней, однако полученная культура неоднородна и содержит разные типы клеток.
[011] Описан протокол панкреатической дифференцировки эмбриональных стволовых клеток и плюрипотентных стволовых клеток, позволяющий получить функциональные инсулин-продуцирующие клетки, способные к глюкозозависимой секреции инсулина [Pagliuca FW, et al., Cell. 2014. 159(2). 428-439]. Дифференцировку человеческих плюрипотентных клеток осуществляют течение 28-33 дней по многостадийному протоколу. Полученные в результате проведенной дифференцировки клетки способны к глюкозозависимой секреции инсулина на высоком уровне, сопоставимом со зрелыми бета-клетками. После трансплантации в организм иммунодефицитных мышей с экспериментальным диабетом (SCID/AKITA), эти клетки нормализуют уровень глюкозы в крови.
[012] Группа методов, основанных на панкреатической дифференцировке плюрипотентных клеток (эмбриональных стволовых и индуцированных плюрипотентных клеток), имеет существенные недостатки, ограничивающие их использование: во-первых, для большинства методов это низкая эффективность дифференцировки - способность синтезировать инсулин приобретают около 15-40% клеток. Во-вторых, при использовании эмбриональных стволовых клеток их источником служит материал из человеческих эмбрионов, а его получение сопряжено с этическими проблемами. В-третьих, получаемые в результате клеточные культуры могут быть использованы только для аллогенной трансплантации, то есть время жизни таких клеток ограниченно, и требуются специальные усилия для сохранения введенных инсулин-продуцирующих клеток в организме. Клетки с индуцированной плюрипотентностью можно использовать в аутологичном варианте, однако методы их получения длительны и дорогостоящи. Наконец, эмбриональные стволовые и индуцированные плюрипотентные клетки проявляют туморогенные свойства и склонны к образованию тератом при введении в организм.
[013] Известен способ регулируемой индукции продукции панкреатических гормонов в непанкреатических тканях [US 6774120 В1, 10.08.2004]. Способ основан на получении эктопической экспрессии гена PDX1 (pancreatic and duodenal homeobox). В данном способе введение полипептида или мРНК PDX1 оказывало временный эффект и не приводило к стабильному синтезу инсулина. В то же время введение чужеродной ДНК имеет определенные ограничения для медицинского применения, так как несет за собой риск возникновения мутаций, нарушения жизнедеятельности клеток реципиента и возможность онкотрансформации. Дополнительными проблемами с использованием векторных конструкций, вводимых в организм реципиента, являются: риск их элиминации со временем и метилирование введенной ДНК. Все это приводит к тому, что экспрессия целевого гена со временем снижается или прекращается.
[014] Для преодоления вышеуказанных проблем, предложены подходы, в которых инсулин-продуцирующие клетки получают из легкодоступных типов клеток человека, таких как мезенхимные или эпителиальные клетки.
[015] Известна работа по дифференцировке мезенхимных стволовых клеток пуповинной крови в инсулин-продуцирующие клетки [Prabakar KR, et al., Cell Transplant. 2012. 21(6). 1321-1339]. Авторы использовали протокол дифференцировки, включающий 5 стадий общей продолжительностью более 3-х недель. На первой стадии клетки инкубировали в течение 3-х дней в среде RPMI, добавляли активин А и Wnt3a (wingless-type MMTV integration site family, member 3А). На второй стадии к среде RPMI с 2% эмбриональной телячьей сывороткой добавляли фактор роста фибробластов 10 (FGF-10, fibroblast growth factor 10) и CYC (3-Keto-N-aminoethyl-amino-caproyl-dihydrocinnamoyl Cyclopamine) и инкубировали клетки в течение 4-х дней. На третьей стадии среда была заменена на DMEM с добавлением ретиноевой кислоты, CYC, FGF10 и добавки В27, клетки были инкубированы 4 дня. На четвертой стадии к среде DMEM с добавкой В27 добавляли DAPT (N-[N-(3,5-difluorophenacetyl)-L-alanyl]-S-phenylglycine t-butyl ester) и экспендин 4 (Ех4, exendin-4), клетки инкубировали 3 дня. На пятой стадии клетки инкубировали 4 дня в среде CMRL с добавкой В27, с добавлением Ех4, фактора роста гепатоцитов (HGF, hepatocyte growth factor) и инсулиноподобного фактора роста 1 (IGF1, insulin-like growth factor 1). Полученные в результате клетки были способны к глюкозозависимой секреции С-пептида in vitro. После трансплантации иммунодефицитным мышам NOD/SCID, в сыворотке животных также обнаруживали С-пептид человека. Однако данный протокол довольно трудоемок и длителен, так как используемые мезенхимные клетки не принадлежат к железистому эпителию, к которому принадлежат бета-клетки поджелудочной железы.
[016] Известна работа, в которой для получения инсулин-продуцирующих клеток авторы использовали клетки поднижнечелюстной слюнной железы, гистогенетически близкие к бета-клеткам [Sato A, et al., Cloning Stem Cells. 2007. 9(2). 191-205]. Панкреатическую дифференцировку клеток индуцировали методом сфероидного культивирования в среде William's Е с добавлением 10% эмбриональной телячьей сыворотки, 10 мМ никотинамида и 20 нг/мл эпидермального фактора роста. В результате на 6-й день культивирования клетки приобретали способность к экспрессии PDX1, инсулина и С-пептида. Клетки также приобретали способность к глюкозозависимой секреции С-пептида. Однако, используемый протокол дифференцировки эпителиальных клеток, в данном случае, не оптимален и позволяет получить относительно низкий уровень секреции С-пептида: около 0,5 нг/мг белка, сравнимый с его фоновой экспрессией у недифференцированных клеток слюнной железы человека.
[017] Наиболее близким аналогом патентуемого является способ получения инсулин-позитивных клеток из CD49f-позитивных клеток слюнной железы человека, культивируемых in vitro [US 7659121 В2, BIOS RES INST INC. 09.02.2010]. Используемые клетки представляют собой клетки железистого эпителия слюнных желез человека и могут быть дифференцированы в инсулин-позитивные клетки в культуре in vitro методом сфероидного культивирования в присутствии эпидермального фактора роста (EGF, epidermal growth factor), основного фактора роста фибробластов (bFGF, basic fibroblast growth factor) и ингибирующего фактора лейкемии (LIF, leukemia inhibitory factor). Для получения инсулин-позитивных клеток, клетки слюнной железы культивируют в неадгезивных условиях для формирования сфероидов в среде Williams'E с добавлением эмбриональной телячьей сыворотки и глюкагоноподобного пептида-1 (GLP-1, Glucagon-like peptide-1). Через 7 суток в сфероидах детектируют экспрессию инсулина. Данные клетки могут быть использованы для терапии патологий поджелудочной железы. Однако способу-прототипу присущи серьезные недостатки: данный подход не позволяет полностью дифференцировать клетки в нужном направлении, в результате чего получается смешанная культура из глюкагон- и инсулин-позитивных клеток, что говорит о начальных стадиях дифференцировки. В данной работе не продемонстрировано получение инсулин-продуцирующих клеток, способных к глюкозозависимой секреции инсулина, нет количественных данных, демонстрирующих эффективность применяемого способа.
[018] Таким образом, в настоящее время не решена проблема получения инсулин-продуцирующих клеток для заместительной клеточной терапии сахарного диабета с использованием клеток из легкодоступного источника и с применением простых и не длительных дифференцировочных протоколов. Настоящее изобретение направлено на решение этой проблемы.
Сущность изобретения
[019] Настоящее изобретение направлено на способ получения клеточного продукта инсулин-продуцирующих клеток млекопитающего, включающий получение эпителиальных прогениторных клеток и их последующую панкреатическую дифференцировку в клетки, способные к глюкозозависимой секреции инсулина, в котором панкреатическую дифференцировку проводят в две стадии:
(а) на первой стадии клетки дифференцируют в течение 4-15 суток в культуральной среде, содержащей, по меньшей мере, сыворотку крови млекопитающего, глутамин, эпидермальный фактор роста, трансферрин, селенит натрия, ретиноевую кислоту, изопротеренол;
(б) на второй стадии клетки дифференцируют в течение 4-15 суток в культуральной среде, содержащей, по меньшей мере, сыворотку крови млекопитающего, глутамин, эпидермальный фактор роста, ретиноевую кислоту, никотинамид, фактор роста гепатоцитов, дексаметазон.
В преимущественных воплощениях культуральная среда первой стадии панкреатической дифференцировки содержит сыворотку крови - 2-20 объемных %, глутамин - 1-4 мМ, эпидермальный фактор роста - 1-300 нг/мл, трансферрин - 0,1-20 мкг/мл, селенит натрия - 0,1-20 нг/мл, ретиноевую кислоту - 0,1-20 мкМ, изопротеренол - 0,1-10 мкМ.
[020] В преимущественных воплощениях культуральная среда второй стадии содержит сыворотку крови - 2-20 объемных %, глутамин - не менее 1 мМ, эпидермальный фактор роста - 1-300 нг/мл, трансферрин - не менее 0,1 мкг/мл, селенит натрия - 0,1-20 нг/мл, ретиноевую кислоту - 10 нМ - 20 мкМ, никотинамид - 1-100 мМ, фактор роста гепатоцитов - 1-300 нг/мл, дексаметазон - 0,01-5 мкМ.
[021] В некоторых воплощениях культуральная среда первой стадии содержит дополнительно, по крайней мере, инсулиноподобный фактор роста 1, фактор роста фибробластов 10, фактор рост фибробластов 4 и/или фактор роста кератиноцитов.
[022] В некоторых воплощениях культуральная среда на второй стадии содержит дополнительно инсулиноподобный фактор роста 1 и/или бетацеллюлин.
[023] Эпителиальные прогениторные клетки выделяют из биоптата слюнной железы, или тонкой кишки, или желудка, или печени, или поджелудочной железы.
[024] Культивирование на обеих стадиях проводят при температуре 37°С в СО2-инкубаторе в присутствии 5% СО2. В некоторых воплощениях культивирование проводят в присутствии 5% СО2 и 5% О2.
[025] В некоторых воплощениях прогениторные эпителиальные клетки перед панкреатической дифференцировкой дополнительно культивируют для увеличения их биомассы.
[026] В отличие от известных методов, предлагаемый способ дифференцировки позволяет производить инсулин-продуцирующие клетки из эпителиальных прогениторных клеток, которые можно легко получить у взрослого человека. Данные клетки образуют хорошо пролиферирующую культуру in vitro, их легко наращивать с целью получения большой клеточной массы. Сама процедура дифференцировки отличается простотой и не требует больших временных затрат.
[027] Технический результат изобретения состоит в упрощении технологии получения инсулин-продуцирующих клеток, получении не менее 70% функционально активных инсулин-продуцирующих клеток в клеточной культуре, прошедшей дифференцировку, и достигается за счет подбора оптимальных условий дифференцировки. Получаемые клетки продуцируют инсулин в глюкозозависимой манере.
[028] Также обеспечивается клеточный продукт инсулин-продуцирующих клеток млекопитающего, включая человека, полученный с помощью способа настоящего изобретения.
[029] Клеточный продукт настоящего изобретения можно использовать для научных исследований и для заместительной терапии сахарного диабета у млекопитающих, включая человека.
[030] Также обеспечивается способ заместительной терапии сахарного диабета, включающий: трансплантацию клеточного продукта, содержащего 50-200 млн клеток, в организм реципиента, страдающего сахарным диабетом. В преимущественных воплощениях клеточный продукт для заместительной терапии содержит не менее 1 млн клеток на 1 мл изотонического раствора либо не менее 10 тысяч сфероидов на 1 мл изотонического раствора. В качестве изотонического раствора используют стерильные растворы: физиологический раствор для инъекций, фосфатно-солевой буфер, раствор Хенкса, раствор Версена и т.д. В некоторых воплощениях настоящего изобретения клеточный продукт вводят 2-5 раз с интервалом 1-6 месяцев. Клеточный продукт может быть использован как в аутологичном, так и в аллогенном вариантах трансплантации. В некоторых случаях клеточный продукт дополнительно культивируют в трехмерных условиях и вводят в виде сфероидов.
[031] Введение клеточного продукта в организм млекопитающего, включая человека, болеющего сахарным диабетом, приводит к снижению у него уровня глюкозы в крови, уменьшению скачков концентрации глюкозы в крови, а также к регенерации островков Лангерганса поджелудочной железы.
Краткое описание фигур
[032] Фигуры 1 и 2 показывают результат иммуноцитохимического окрашивания прогениторных эпителиальных клеток из слюнной железы человека антителами к проинсулину (Фиг. 1) и инсулину (Фиг. 2). Окрашены ядра клеток (краситель DAPI) и проинсулин в цитоплазме (Alexa Fluor 488).
[033] Фигуры 3 и 4 показывают результат иммуноцитохимического окрашивания клеточного продукта инсулин-продуцирующих клеток антителами к проинсулину (Фиг. 3) и инсулину (Фиг. 4). Окрашены ядра клеток (краситель DAPI) и проинсулин в цитоплазме (Alexa Fluor 488).
[034] Фигуры 5 и 6 показывают результаты иммуноцитохимического окрашивания криосрезов сфероида антителами к проинсулину (Фиг. 5) и инсулину (Фиг. 6). Окрашены ядра клеток (краситель DAPI) и проинсулин в цитоплазме (Alexa Fluor 488).
[035] Фигура 7 показывает результат иммуногистохимического окрашивания криосреза поджелудочной железы экспериментальной мыши Nude на третий день после внутрибрюшинной трансплантации. Окрашены ядра клеток (краситель DAPI, серые ядра), ядра клеток человека окрашены антителами к Human nuclei (Alexa Fluor 488, белые ядра), инсулин окрашен в цитоплазме (Alexa Fluor 546).
[036] Фигура 8 показывает результат иммуногистохимического окрашивания криосреза поджелудочной железы мыши Nude на третий день после трансплантации клеточного продукта. Окрашены ядра клеток (краситель DAPI), ядра клеток человека окрашены антителами к Human nuclei (Alexa Fluor 488), маркер макрофагов CD68 окрашен в цитоплазме (Alexa Fluor 546). Толщина криосреза 10 мкм.
[037] Фигуры 9, 10 и 11 показывают фотографии гистологических срезов поджелудочной железы здоровой мыши (Фиг. 9), мыши со стрептозотоциновым диабетом (Фиг. 10) и мыши со стрептозотоциновым диабетом, получившей трансплантацию клеточного продукта (Фиг.11) на 40-й день после начала эксперимента. Окраска гематоксилин-эозином, световая микроскопия, толщина среза 5 мкм.
Подробное описание изобретения
[038] Как указано выше, настоящее изобретение направлено на способ панкреатической дифференцировки прогениторных эпителиальных клеток млекопитающих, включая человека, получение клеточного продукта, содержащего инсулин-продуцирующие клетки, для заместительной терапии сахарного диабета и способа заместительной терапии сахарного диабета путем коррекции уровня глюкозы в крови при введении в организм клеточного продукта настоящего изобретения.
[039] Способ дифференцировки эпителиальных прогениторных клеток млекопитающих, включая человека, в клетки, способные к глюкозозависимой секреции инсулина, представляет собой новый способ панкреатической дифференцировки in vitro и включает две стадии:
[040] (а) на первой стадии клетки культивируют в течение 4-15 суток в культуральной среде с добавлением, по крайней мере, эмбриональной телячьей сыворотки и глутамина в присутствии, по крайней мере, следующих добавок: эпидермального фактора роста, трансферрина, селенита натрия, ретиноевой кислоты, изопротеренола;
[041] (б) на второй стадии клетки культивируют в течение 4-15 суток в культуральной среде с добавлением, по крайней мере, эмбриональной телячьей сыворотки и глутамина в присутствии, по крайней мере, следующих добавок: эпидермального фактора роста, ретиноевой кислоты, никотинамида, фактора роста гепатоцитов, дексаметазона.
[042] Клеточный продукт представляет собой инсулин-продуцирующие клетки, полученные путем панкреатической дифференцировки, описанной выше, из эпителиальных прогениторных клеток человека, экспрессирующих один или несколько маркеров из списка: c-Kit, Sca-1, ЕрСАМ, LGR-5. После дифференцировки клетки приобретают способность к глюкозозависимой секреции инсулина и меняют свой фенотип, в результате чего экспрессируют один или несколько маркеров из списка: PDX1, NGN3, MAFA, NKX6.1, РАХ4, РАХ6 и инсулин. Клеточный продукт настоящего изобретения содержит не менее 70% инсулин-продуцирующих клеток.
[043] Способ заместительной терапии сахарного диабета включает введение клеточного продукта настоящего изобретения пациентам с сахарным диабетом. Введение клеточного продукта приводит к снижению уровня глюкозы в крови при сахарном диабете, к уменьшению скачков концентрации глюкозы, а также к регенерации островков Лангерганса поджелудочной железы.
Определения
[044] Термин «маркер» или «биомаркер» относится к белку или мРНК, который присутствует в определенном типе клеток, и отличает его от другого типа клеток. Так для клеток, относящихся к настоящему изобретению, характерен определенный набор маркеров.
[045] Термины «прогениторный» или «недифференцированный» или подобный по отношению к клеткам обозначают стволовые клетки, детерминированные на дифференцировку в определенные типы клеток (однако не терминально дифференцированные). Прогениторные клетки обладают высоким пролиферативным потенциалом при культивировании in vitro и имеют биомаркеры, которые позволяют отличить их от клеток других типов.
[046] Термин «эпителиальный» по отношению к клеткам обозначает клетки, полученные из эпителиальных тканей (эпителия) - совокупности дифферонов полярно дифференцированных клеток, тесно расположенных в виде пласта на базальной мембране, на границе с внешней или внутренней средой, а также образующих большинство желез организма. Различают две группы эпителиальных тканей: поверхностные эпителии (покровные и выстилающие) и железистый эпителий, составляющий основную ткань большинства желез.
[047] Термин «дифферон» означает совокупность клеточных форм, составляющих ту или иную линию дифференцировки, включающую несколько различных типов популяций клеток, например, (стволовые клетки, делящиеся клетки, простые транзитные клетки), т.е. гистогенетический ряд.
[048] Термин «мезенхимный» обозначает тип клеток мезодермального происхождения, экспрессирующих по крайней мере следующие маркеры: CD29, CD44, CD73, CD90, CD105, а также способных при определенных условиях культивирования к адипогенной, хондрогенной и остеогенной дифференцировкам in vitro.
[049] Термин «пассаж» или «пассирование» обозначает процедуру снятия адгезивных клеточных культур с культуральной посуды (как правило, с применением протеолитических ферментов), перевод клеток в суспензионное состояние для переноса их в новую культуральную посуду с последующим культивированием до образования адгезивной культуры. В терминах настоящего изобретения «нулевой («0») пассаж» в отношении клеточной культуры означает период инкубации до первого пассажа, «1 пассаж» - период инкубации после 1-го пассажа и до второго пассажа и т.д.
[050] Термин «адгезивная культура» относится к клеткам, которые находятся в прикрепленном к поверхности состоянии.
[051] Термин «биоптат» обозначает биологический материал, полученный путем биопсии от организма донора.
[052] Термин «культивирование» обозначает совокупность методов и протоколов, посредством которых поддерживают жизнеспособность и пролиферативные свойства клеток in vitro.
[053] Культивирование клеток осуществляется в культуральной среде. Культуральная среда - это питательная среда, обычно содержащая композицию незаменимых аминокислот, солей, витаминов, минералов, микроэлементов, сахаров, липидов и нуклеотидов. Среда культивирования обеспечивает клетки компонентами, необходимыми для удовлетворения потребностей в питании и росте клеток. Для различных типов клеток, клеток и клеточных культур различной плотности используют среды, отличающиеся составом питательных веществ, pH и осмолярностью. В литературе описаны многочисленные культуральные среды. Многие среды коммерчески доступны, их идентификация проводится по названию и в ряде случаев каталожному номеру среды. Среды культивирования могут быть дополнены любыми компонентами, необходимыми, чтобы поддержать нужную клетку или культуру клеток. Например, в среду могут быть добавлены стимуляторы роста или ингибиторы роста клеток, гормоны, сыворотка крови млекопитающих, содержащая факторы роста, альбумин, глобулины и другие компоненты.
[054] Термин «культивирование прогениторных эпителиальных клеток» означает процесс культивирования с целью увеличения биомассы указанных клеток, в ходе которого не происходит изменения фенотипа указанных клеток.
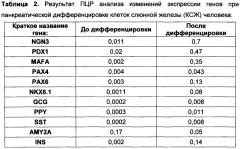
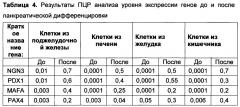
[055] Термин «панкреатическая дифференцировка» используется для обозначения процесса культивирования клеток в определенных условиях, в результате которого клетки приобретают сходство с бета-клетками поджелудочной железы. В частности, в них происходит экспрессия характерных генов-маркеров, таких как PDX1, NGN3, MAFA, NKX6.1, РАХ4, РАХ6 и др., а также клетки приобретают способность к синтезу инсулина. Одним из принятых тестов, демонстрирующих продукцию клетками инсулина, является детекция С-пептида, представляющего собой продукт, образующийся в ходе созревания инсулина из молекулы-предшественника. Наличие С-пептида в клетках говорит о том, что они продуцируют инсулин, и что в них происходит его созревание.
[056] Термин «плюрипотентность» обозначает способность клеток дифференцироваться в производные всех трех зародышевых листков (энтодермы, мезодермы, эктодермы). Термин «эмбриональные стволовые клетки» обозначает клетки, полученные из внутренней клеточной массы бластоцисты, образующие культуру клеток, сохраняющих плюрипотентные свойства при длительном культивировании in vitro. Термин «клетки с индуцированной плюрипотентностью» означает клетки, обладающие плюрипотентными свойствами, полученные из соматических клеток путем эпигенетического перепрограммирования.
[057] Термин «сфероидное культивирование» означает культивирование клеток in vitro в неадгезивных условиях, обеспечивающих слипание клеток между собой в трехмерные глобулы, содержащие 500-10000 клеток.
[058] Термин "выделенный" означает молекулу или клетку, которые находятся в среде, отличной от среды, в которой молекула или клетка находятся в естественных условиях.
[059] Термин «изотонические растворы» означает растворы, обеспечивающие следующие свойства: pH: от 7,3 до 7,7; осмолярность: 280+/-20 мосмоль/кг; буферная емкость: не менее 1,4 мл.
[060] Термин «конфлюэнтный монослой» означает монослой, при котором клетки покрывают более 97% поверхности культурального флакона.
[061] Термин «клеточный продукт» означает клеточную культуру, получаемую путем двухстадийной панкреатической дифференцировки in vitro, описанной выше, из эпителиальных прогениторных клеток млекопитающих, включая человека.
Получение прогениторных эпителиальных клеток для панкреатической дифференцировки
[062] Для реализации панкреатической дифференцировки настоящего изобретения используют прогениторные эпителиальные клетки млекопитающих, включая мышь, крысу, свинью, кролика, человека и т.д. Прогениторные эпителиальные клетки могут быть получены от донора клеток из различных органов: слюнных желез, кишечника, желудка, печени, поджелудочной железы.
[063] Биоптат, содержащий эпителиальные прогениторные клетки, получают с помощью биопсии или хирургической операции способами хорошо известными из уровня техники. В преимущественных воплощениях забор клеток и/или тканей при биопсии осуществляется прижизненно. Если дальнейшее использование клеток предполагает медицинские цели, то донор тканевого материала не должен нести инфекционных заболеваний (ВИЧ, гепатиты В и С, сифилис), а также не должен иметь онкологических заболеваний.
[064] Биоптат сразу после забора переносят в стерильных условиях в чашку Петри, содержащую культуральную среду или изотонический раствор и антибиотик. Например, для нужд настоящего изобретения могут быть использованы культуральные среды DMEM/F12 1:1, 199, DMEM, ИГЛА, Alpha-MEM, Ham, F12, IMDM, RPMI-1640 и др., или изотонические растворы: фосфатно-солевой буфер, раствор Хенкса, физиологический раствор, раствор Версена и т.д. Составы изотонических растворов хорошо известны исследователям в данной области. В качестве антибиотика используют гентамицин в конечной концентрации 1-100 мкг/мл (например, в конечной концентрации 40 мкг/мл), или другие антибиотики: пенициллин в конечной концентрации 5-200 ед/мл (например, в конечной концентрации 50 ед/мл), стрептомицин в конечной концентрации 5-200 мкг/мл (например, в конечной концентрации 50 мкг/мл) или иной антибиотик, известный из уровня техники.
[065] Из уровня техники известно, что различия в условиях выделения клеток не оказывают существенного воздействия на качество дальнейшего культивирования и дифференцировки клеток.
[066] Все дальнейшие манипуляции проводят в стерильных условиях, отвечающих требованиям GMP (Good Manufacturing Practice). Эпителиальную ткань механически измельчают стерильными инструментами (скальпелем, пинцетами и др.) до небольших кусочков, например, размером около от 0,5 до 10 мм3. Затем кусочки ткани промывают изотоническим раствором один-три раза, осаждают центрифугированием, инкубируют с 0,1-10 мг/мл коллагеназы IV типа (оптимально 2 мг/мл коллагеназы) в среде DMEM/F12 1:1 с 1-4 мМ глутамина 20-60 минут при 37°С. После этого суспензию клеток пропускают через нейлоновый фильтр с диаметром пор 40-100 мкм и осаждают клетки центрифугированием.
[067] Способы центрифугирования клеток хорошо известны из уровня техники, например, используют центрифугирование в течение 5-15 минут при 100-400 g.
[068] Далее проводят отбор популяции клеток, обогащенных эпителиальными прогениторными клетками. Для этого могут быть использованы различные методики, известные из уровня техники. Например, клетки могут быть отсортированы по маркеру, выбранному из группы: ЕрСАМ, c-Kit, CD49f, LGR5 с помощью магнитной селекции или флуоресцентной селекции. Например, клетки могут быть получены с помощью магнитной сепарации. Для этого суспензию клеток инкубируют с антителами к выбранному маркеру, коньюгированными с магнитными частицами. Как правило, используют антитела к маркерному белку того вида животного, к которому относится донор клеток.
[069] При селекции клеток, полученных из слюнной железы, печени и поджелудочной железы, преимущественно используют маркер ЕрСАМ, для клеток из кишечника - маркер LGR5, из желудка - маркер c-Kit.
[070] Манипуляции проводят по инструкциям производителя антител. Например, инкубацию проводят при температуре около 4°С (на льду) в течение 10-60 минут, как правило, 15-40 минут, используя антитела из расчета 0,1-10 мкг антитела на 106 клеток. Проводят магнитную сепарацию на колонках по инструкциям производителя. Затем отсортированные клетки осаждают центрифугированием, промывают фосфатно-солевым буфером и ресуспендируют в культуральной ростовой среде.
[071] Полученные клетки могут быть использованы для панкреатической дифференцировки или могут пройти через процедуру культивирования для увеличения клеточной массы прогениторных эпителиальных клеток.
[072] Для культивирования клеток может быть использован любой способ, позволяющий увеличить клеточную массу прогениторных эпителиальных клеток, который сохраняет фенотип и характерный набор маркеров для этого типа клеток, обеспечивает однородность клеточной культуры и ее пролиферативный потенциал.
[073] Например, для культивирования клеток из слюнной железы могут быть использованы способы, описанные для клеток крысы [Okumura K. et al., Hepatology. 2003. 38. 104-113], мыши [Hisatomi Y. et al., Hepatology. 2004. 39(3). 667-675], свиньи [Matsumoto S., et al., Cloning and Stem Cells. 2007. 9. 176-190], человека [WO 2014092575 от 19.06.2014 «Means and methods for obtaining salivary gland stem cells and use thereof», Jang S.I. et al., J. Dent. Res. 2015. 94(2). 304-311, WO 2004074465 от 12.03.2009 Human salivary gland-origin stem cell]. Например, может быть использован способ, описанный в заявке [«Способ культивирования клеток слюнной железы человека», регистрационный номер 2016139283, дата поступления 06.10.2016]. В указанном способе клетки культивируют в среде РСТ Epidermal Keratinocyte Medium в культуральных флаконах, обеспечивающих адгезию клеток, при 37°С в присутствии 5% СО2 с заменой среды каждые 2-4 суток до достижения клетками монослоя. После этого, осуществляют пассаж клеток с разведением 1:3-1:5, включающий снятие клеток с поверхности культурального флакона раствором трипсина в ЭДТА и перенос в новые культуральные флаконы и продолжают культивирование с заменой среды каждые 2-4 сутки в ходе культивирования и пассажами по достижении клетками монослоя с разведением не более 1:2-1:3. В преимущественных воплощениях способа инкубацию клеток осуществляют также в присутствии 5% О2. В некоторых воплощениях этого способа клетки сразу после получения инкубируют в течение 6-48 ч в среде DMEM/F12 1:1, содержащей глутамин в конечной концентрации 1-4 мМ и эмбриональную телячью сыворотку в конечной концентрации 5-20%, при 37°С в присутствии 5% СО2. После чего среду меняют на РСТ Epidermal Keratinocyte Medium. Дополнительно в среду культивирования могут быть добавлены инсулин, трансферрин, селенит натрия, эпидермальный фактор роста (EGF).
[074] Для культивирования прогениторных эпителиальных клеток, полученных из печени, поджелудочной железы, кишечника, желудка может быть использован следующий метод: клетки промывают фосфатно-солевым буфером и ресуспендируют в культуральной среде, например, в DMEM/F12 1:1, содержащей 5-20% эмбриональной телячьей сыворотки, 1% добавку «инсулин-трансферри