Раствор для консервации клеток, его применение и способ получения раствора для консервации клеток
Иллюстрации
Показать всеГруппа изобретений относится к биотехнологии, а именно к консервации клеток. Предложены раствор для консервации клеток и способ его получения, способ консервации клеток, способ изготовления фиксированных клеток и способ анализа клеток. Раствор для консервации клеток содержит от 20 до 60 об.% низшего спирта, включающего 1-6 атомов углерода, и от 6 до 82 ммоль/л иона двухвалентного металла в водном растворителе. Способ консервации клеток включает погружение клеток in vitro в полученный раствор для консервации клеток. Способ изготовления фиксированных клеток включает контакт клеток in vitro с раствором для консервации клеток, в результате чего клетки становятся фиксированными. Фиксированные клетки могут быть подвергнуты анализу для установления количества нуклеиновых кислот. Изобретения способствуют стабилизации ДНК в клетках, при этом ДНК в клетках стабильно сохраняется даже в случае хранения при 30°C. 5 н. и 17 з.п. ф-лы, 22 ил., 13 табл., 12 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001]
Настоящее изобретение относится к раствору для консервации клеток. Кроме того, настоящее изобретение относится к способу консервации клеток, способу получения фиксированных клеток и способу анализа клеток с применением раствора для консервации клеток. Кроме того, настоящее изобретение относится к способу получения раствора для консервации клеток.
Уровень техники
[0002]
При анализе клеток клетки хранят до того как подвергнуть анализу. Например, при анализе клеток, выделенных из живого организма, необходимо надлежащим образом сохранить клетки на время периода с момента изъятия клеток до момента анализа клеток, поскольку клетки, выделенные из живого организма, начинают подвергаться автолизу.
[0003]
В Патентном источнике 1 описано, что клетки хранятся в растворе для консервации клеток перед анализом. В Примере 5 Патентного источника 1 раскрыто, что раствор для консервации клеток содержит 1 мМ ацетата магния, 2 мМ ацетата кальция, 10 мМ хлорида калия, 0,1% хлорида натрия и 20% метанола.
СПИСОК ИСТОЧНИКОВ
ПАТЕНТНАЯ ЛИТЕРАТУРА
[0004]
Патентный источник 1: патент США 5,256,571
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКИЕ ЗАДАЧИ
[0005]
Авторы изобретения обнаружили, что при хранении клеток в стандартном растворе для консервации клеток в течение заданного периода нуклеиновые кислоты в клетках могут становиться нестабильными и разрушаться. Поэтому существует потребность в разработке раствора для консервации клеток, в котором клетки могут с большей стабильность сохраняться in vitro в течение заданного периода.
РЕШЕНИЯ ЗАДАЧ
[0006]
В настоящем изобретении предложен раствор для консервации клеток, содержащий низший спирт, включающий 1-6 атомов углерода, и ион двухвалентного металла в водном растворителе, где концентрация иона двухвалентного металла составляет от приблизительно 6 ммоль/л до приблизительно 82 ммоль/л.
[0007]
В настоящем изобретении предложен способ консервации клеток, включающий погружение клеток в раствор для консервации клеток in vitro.
[0008]
В настоящем изобретении предложен способ получения раствора для консервации клеток, включающий смешивание низшего спирта, включающего 1-6 атомов углерода, и иона двухвалентного металла в водном растворителе, где концентрация иона двухвалентного металла в растворе для консервации клеток составляет от приблизительно 6 ммоль/л до приблизительно 82 ммоль/л.
[0009]
В настоящем изобретении предложен способ получения фиксированных клеток, включающий контакт клеток с раствором для консервации клеток in vitro, в результате чего клетки становятся фиксированными.
[0010]
В настоящем изобретении предложен способ анализа клеток, включающий следующие этапы: контакт клеток с раствором для консервации клеток in vitro, в результате чего клетки становятся фиксированными; и анализ нуклеиновых кислот в фиксированных клетках, которые получены в предыдущем этапе.
ПРЕИМУЩЕСТВА ИЗОБРЕТЕНИЯ
[0011]
Согласно настоящему изобретению анализируемые клетки могут сохраняться в стабильном состоянии in vitro в течение заданного периода, прежде чем быть подвергнутыми анализу.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0012]
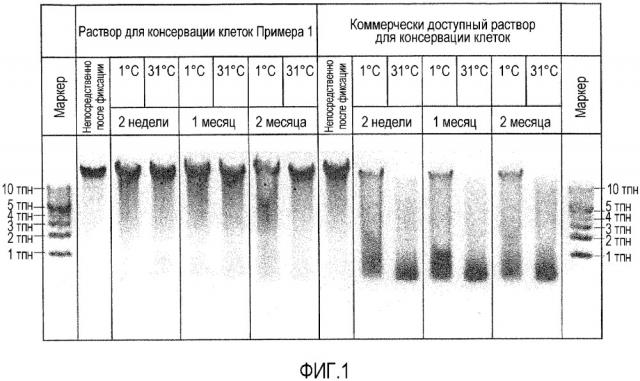
Фиг. 1 является фотографией электрофореза в агарозном геле ДНК, выделенной из клеток HeLa, хранившихся в растворе для консервации клеток согласно варианту осуществления настоящего изобретения или в коммерчески доступном растворе для консервации клеток при заданных условиях.
Фиг. 2A является графиком, на котором показаны измеренные значения, полученные при хранении цервикальных клеток, выделенных у субъектов, в коммерчески доступном растворе для консервации клеток при заданных условиях и обнаружении нуклеиновых кислот, происходящих из вируса папилломы человека (ВПЧ), в ДНК клеток с помощью метода гибридного захвата (HC).
Фиг. 2B является графиком, на котором показаны измеренные значения, полученные при хранении цервикальных клеток, выделенных у субъектов, в коммерчески доступном растворе для консервации клеток при заданных условиях и обнаружении нуклеиновых кислот, происходящих из ВПЧ, в ДНК клеток с помощью метода HC.
Фиг. 3A является графиком, на котором показаны измеренные значения, полученные при хранении цервикальных клеток, выделенных у субъектов, в растворе для консервации клеток согласно варианту осуществления при заданных условиях и обнаружении нуклеиновых кислот, происходящих из ВПЧ, в ДНК клеток с помощью метода HC.
Фиг. 3B является графиком, на котором показаны измеренные значения, полученные при хранении цервикальных клеток, выделенных у субъектов, в растворе для консервации клеток согласно варианту осуществления при заданных условиях и обнаружении нуклеиновых кислот, происходящих из ВПЧ, в ДНК клеток с помощью метода HC.
Фиг. 4 является фотографией, сделанной при хранении цервикальных клеток, выделенных у субъектов, в растворе для консервации клеток согласно варианту осуществления или в коммерчески доступном растворе для консервации клеток в течение 2 дней при комнатной температуре и подвергнутых окраске по Папаниколау.
На Фиг. 5 показаны гистограммы площади флуоресценции, полученные при анализе клеток HeLa, хранившихся в растворах для консервации клеток, содержащих различные концентрации иона магния, при заданных условиях, с помощью проточного цитометра.
Фиг. 6 является диаграммой, на которой показана видимая область диплоидных клеток в гистограмме площади флуоресценции, полученной при анализе клеток HeLa, хранившихся в растворе для консервации клеток согласно варианту осуществления при 25°C в течение 4 часов, с помощью проточного цитометра.
Фиг. 7A является графиком, на котором показаны коэффициенты вариации (CV) площади флуоресценции в видимой области диплоидных клеток в отношении клеток HeLa, хранившихся в растворах для консервации клеток, содержащих различные концентрации иона магния, при 25°C в течение 4 часов или при 30°C в течение 24 часов.
Фиг. 7B является графиком, на котором показаны коэффициенты вариации (CV) площади флуоресценции в видимой области диплоидных клеток в отношении клеток HeLa, хранившихся в растворах для консервации клеток, содержащих различные концентрации иона магния, при 30°C в течение 24 часов.
На Фиг. 8A показаны гистограммы площади флуоресценции, полученные при анализе клеток HeLa, хранившихся в растворах для консервации клеток, содержащих различные концентрации метанола, при заданных условиях, с помощью проточного цитометра.
На Фиг. 8B показаны гистограммы площади флуоресценции, полученные при анализе клеток HeLa, хранившихся в растворах для консервации клеток, содержащих различные концентрации метанола, при заданных условиях, с помощью проточного цитометра.
На Фиг. 8C показаны гистограммы площади флуоресценции, полученные при анализе клеток HeLa, хранившихся в растворах для консервации клеток, содержащих различные концентрации метанола, при заданных условиях, с помощью проточного цитометра.
На Фиг. 9 показаны гистограммы площади флуоресценции, полученные при анализе клеток HeLa, хранившихся в растворе для консервации клеток при pH 6,4 или 7,0 при заданных условиях, с помощью проточного цитометра.
На Фиг. 10 показаны гистограммы площади флуоресценции, полученные при анализе клеток HeLa, хранившихся в растворах для консервации клеток, содержащих различные концентрации иона кальция, при заданных условиях, с помощью проточного цитометра.
Фиг. 11 является гистограммами площади флуоресценции, полученными при анализе клеток HeLa, хранившихся в коммерчески доступном растворе для консервации клеток при заданных условиях, с помощью проточного цитометра.
Фиг. 12 является схематическим изображением, на котором показан пример раствора для консервации клеток, помещенного в контейнер.
На Фиг. 13 показаны гистограммы площади флуоресценции, полученные при анализе клеток HeLa, хранившихся в растворах для консервации клеток, содержащих различные концентрации иона кальция, при заданных условиях, с помощью проточного цитометра.
На Фиг. 14 показаны гистограммы площади флуоресценции, полученные при анализе клеток HeLa, хранившихся в растворе для консервации клеток, содержащем ион магния и ион кальция, при заданных условиях, с помощью проточного цитометра.
Фиг. 15 является гистограммой площади флуоресценции, полученной при анализе клеток HeLa, хранившихся в растворе для консервации клеток, содержащем этанол, при заданных условиях, с помощью проточного цитометра.
На Фиг. 16 показаны гистограммы площади флуоресценции, полученные при анализе клеток HeLa, хранившихся в растворе для консервации клеток Примера 1 или в растворе для консервации клеток, раскрытом в патенте США 5,256,571, при заданных условиях, с помощью проточного цитометра.
На Фиг. 17 показаны гистограммы площади флуоресценции, полученные при анализе клеток HUVEC, хранившихся в растворах для консервации клеток, содержащих различные концентрации иона магния, при заданных условиях, с помощью проточного цитометра.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0013]
[1. Раствор для консервации клеток]
Раствор для консервации клеток согласно данному варианту осуществления содержит низший спирт, включающий 1-6 атомов углерода, и ион двухвалентного металла в водном растворителе, где концентрация иона двухвалентного металла составляет от приблизительно 6 ммоль/л до приблизительно 82 ммоль/л.
[0014]
Низший спирт, включающий 1-6 атомов углерода (в дальнейшем просто называемый "низшим спиртом"), отдельно не ограничен при условии, что он может смешиваться с водой в произвольном отношении при обычной температуре (25°C). Соответствующие примеры включают метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, втор-бутанол, трет-бутанол, н-амиловый спирт, изоамиловый спирт, втор-амиловый спирт, трет-амиловый спирт, 1-этил-1-пропанол, 2-метил-1-бутанол, н-гексанол и циклогексанол. Из них предпочтительными являются метанол или этанол, при этом метанол является наиболее предпочтительным с точки зрения действия, нужного при хранении и фиксации клеток (обезвоживание и коагуляция белка).
[0015]
В данном варианте осуществления может применяться только один тип низшего спирта или два или более типов низшего спирта. Два или более типов спирта могут быть смешаны в произвольном отношении. Например, смешанный спирт, полученный при смешивании метанола и этанола в произвольном отношении, может применяться в качестве раствора для консервации клеток.
[0016]
Концентрация низшего спирта в растворе для консервации клеток может быть надлежащим образом установлена в соответствии с периодом хранения клеток, способом анализа клеток и т.п. Слишком низкая концентрация (например, в случае, когда концентрация ниже, чем приблизительно 20% по объему) делает стабильное хранение клеток сложным. Слишком высокая концентрация (например, в случае, когда концентрация выше, чем приблизительно 60% по объему) может вызывать чрезмерную фиксацию клеток. В варианте осуществления концентрация низшего спирта обычно составляет от приблизительно 20% по объему до приблизительно 60% по объему, предпочтительно от приблизительно 30% по объему до приблизительно 50% по объему и наиболее предпочтительно от приблизительно 40% по объему до приблизительно 45% по объему. В другом варианте осуществления концентрация низшего спирта составляет от 20% по объему до 60% по объему, предпочтительно от 30% по объему до 50% по объему и наиболее предпочтительно от 40% по объему до 45% по объему. Низший спирт содержится в вышеуказанной концентрации, чтобы клетки можно было хранить в стабильном состоянии. Кроме того, также можно ожидать бактериостатическое действие или бактерицидное действие. В данном случае следует отметить, что "% по объему" также обозначают "об./об.%" или "об.%".
[0017]
Ион двухвалентного металла отдельно не ограничен при условии, что он не влияет на сохранение формы и содержимое клеток, и может быть выбран, например, из ионов металлов, которые добавляют в среду для культивирования клеток. В варианте осуществления примеры иона двухвалентного металла включают ион магния, ион кальция, ион цинка, ион железа (II), ион меди, ион стронция и ион молибдена. Из них предпочтительными являются ионы металлов II группы периодической системы химических элементов. В качестве иона металла II группы периодической системы химических элементов наиболее предпочтительны ион магния и ион кальция. В варианте осуществления может применяться только один тип иона двухвалентного металла или два или более типов ионов двухвалентных металлов.
[0018]
В варианте осуществления ион двухвалентного металла в растворе для консервации клеток предпочтительно образуется из соединения двухвалентного металла, растворимого в водном растворителе. Примеры соединения включают соли неорганических или органических кислот с двухвалентными металлами. Примеры солей неорганических кислот с двухвалентными металлами включают соли неорганических кислот (таких как соляная кислота, серная кислота, азотная кислота, хлорная кислота, бромоводородная кислота и иодоводородная кислота) с двухвалентными металлами. Примеры солей органических кислот с двухвалентными металлами включают соли органических кислот (таких как уксусная кислота, лимонная кислота, аскорбиновая кислота и щавелевая кислота) с двухвалентными металлами. Из них предпочтительными являются соли неорганических кислот с двухвалентными металлами. Соответствующие примеры включают хлорид магния, сульфат магния и хлорид кальция. В варианте осуществления соединение двухвалентного металла может быть ангидридом или гидратом.
[0019]
В отношении концентрации иона двухвалентного металла авторы настоящего изобретения обнаружили, что в растворе для консервации клеток, содержащем низший спирт в качестве основного компонента, концентрация иона двухвалентного металла установлена в пределах от приблизительно 6 ммоль/л до приблизительно 82 ммоль/л, в результате чего клетки и нуклеиновые кислоты в клетках могут стабильно сохраняться in vitro в течение заданного периода. В варианте осуществления концентрация иона двухвалентного металла предпочтительно составляет от приблизительно 6 ммоль/л до приблизительно 80 ммоль/л и более предпочтительно от приблизительно 10 ммоль/л до приблизительно 60 ммоль/л. В другом варианте осуществления концентрация иона двухвалентного металла составляет от 6 ммоль/л до 82 ммоль/л, предпочтительно от 6 ммоль/л до 80 ммоль/л и более предпочтительно от 10 ммоль/л до 60 ммоль/л. В данном случае следует отметить, что "ммоль/л" также обозначают "мМ". В варианте осуществления, в том случае, когда соединение двухвалентного металла, растворимое в водном растворителе, в особенности соль неорганической кислоты с двухвалентным металлом, растворяют в растворе для консервации клеток, концентрация иона двухвалентного металла в растворе для консервации клеток может быть выражена концентрацией соединения.
[0020]
Водный растворитель может быть смешан с низшим спиртом в необязательном отношении при обычной температуре (25°C) и отдельно не ограничен при условии, что он не влияет на сохранение формы и содержимое клеток. Примеры водного растворителя включают воду, физиологический солевой раствор, буферный раствор, раствор альбумина, раствор декстрана, раствор нормальной сыворотки человека или млекопитающего и их любую комбинацию.
[0021]
В качестве водного растворителя предпочтительно используется буферный раствор. Буферный раствор отдельно не ограничен при условии, что он является буферным раствором, имеющим буферное действие при pH от 6 до 8. Соответствующие примеры включают хороший буферный раствор, фосфатный буферный раствор (PBS), имидазольный буферный раствор и триэтаноламин гидрохлоридный буферный раствор (ТЭА). Примеры хорошего буферного раствора включают водные растворы буферных веществ, таких как PIPES, MES, бис-Трис, ADA, бис-Трис-пропан, ACES, MOPS, MOPSO, BES, TES, HEPES, HEPPS, Трицин, Трис, Бицин и TAPS. В случае применения водных растворителей помимо буферного раствора любые буферные вещества, применяемые в вышеуказанных буферных растворах, могут быть добавлены в раствор для консервации клеток.
[0022]
В варианте осуществления показатель pH раствора для консервации клеток может находиться в диапазоне, подходящем для хранения клеток, и обычно находится в диапазоне от приблизительно 6 до приблизительно 8 и предпочтительно в диапазоне от приблизительно 6,4 до приблизительно 7. В другом варианте осуществления pH раствора для консервации клеток находится в диапазоне от 6 до 8 и предпочтительно в диапазоне от 6,4 до 7. Осмотическое давление раствора для консервации клеток отдельно не ограничено при условии, что оно не препятствует хранению клеток, при этом оно может быть физиологически изотоническим.
[0023]
В случае необходимости раствор для консервации клеток данного варианта осуществления может содержать добавку в водном растворителе, в дополнение к низшему спирту и иону двухвалентного металла. Добавка отдельно не ограничена при условии, что она не препятствует фиксации, хранению и анализу клеток. Соответствующие примеры включают известные вещества, такие как неорганические соли (например, хлорид натрия, хлорид калия), сахариды (например, глюкозу, трегалозу), консерванты (например, азид натрия, фенилметансульфонилфторид), белковые стабилизаторы (например, бычий сывороточный альбумин), противопенные вещества (например, этиленгликоль), антибиотики (например, пенициллин, стрептомицин) и противогрибковые средства (например, амфотерицин B).
[0024]
Клетки, которые предполагается хранить в растворе для консервации клеток согласно данному варианту осуществления, отдельно не ограничены и могут быть, например, клетками многоклеточных организмов, клетками одноклеточных организмов или линий культивируемых клеток. Клетки многоклеточных организмов могут быть клетками, выделенными из живого организма, или могут быть клетками, выделенными из трупа. Примеры клеток многоклеточных организмов включают клетки, выделенные из млекопитающих, таких как человек. Конкретные соответствующие примеры включают цервикальные клетки, клетки в теле матки, клетки ротовой полости, клетки молочной железы, клетки щитовидной железы, клетки в моче, клетки в мокроте, клетки в бронхиальном браш-биоптате, клетки в перитонеальных смывах и клетки в целомической жидкости. Кроме того, клетки могут быть клетками, содержащимися в тканях, выделенных у млекопитающих, таких как человек. Выделенные ткани могут быть нормальными тканями или тканями, содержащими пораженные участки. Примеры клеток, содержащихся в выделенных тканях, включают первичные культивируемые клетки, эндотелиальные клетки пупочной вены в пупочном канатике и опухолевые клетки, содержащиеся в тканях опухоли, выделенных при операции или биопсии. Клетки могут быть простейшими, такими как Trichomonas, или грибами, такими как Candida. Клетки могут быть клетками, полученными искусственно in vitro, такими как стволовые клетки или иПС клетки. Свойства клеток отдельно не ограничены, при этом клетки могут быть нормальными клетками, бессмертными клетками, раковыми клетками и т.п.
[0025]
На Фиг. 12 показан пример внешнего вида раствора для консервации клеток согласно данному варианту осуществления. На фигуре цифра 11 обозначает контейнер, содержащий раствор для консервации клеток. Контейнер, содержащий раствор для консервации клеток согласно данному варианту осуществления, может быть помещен в коробку и затем предоставлен пользователю. Эта коробка может содержать вкладыш в упаковку, в котором описан способ применения раствора для консервации клеток. Кроме того, когда раствор для консервации клеток данного варианта осуществления предоставлен для хранения цервикальных клеток, коробка может содержать приспособление для отбора клеток для выделения клеток из шейки матки (например, тампон, щетку).
[0026]
[2. Способ получения раствора для консервации клеток]
Далее будет описан способ получения раствора для консервации клеток согласно данному варианту осуществления (в дальнейшем также просто называемый "способом получения"). Способ получения согласно данному варианту осуществления является способом получения раствора для консервации клеток, включающим смешивание низшего спирта, включающего 1-6 атомов углерода, и иона двухвалентного металла в водном растворителе так, чтобы концентрация иона двухвалентного металла составила от приблизительно 6 ммоль/л до приблизительно 82 ммоль/л. Следует отметить, что концентрации и типы низшего спирта, включающего 1-6 атомов углерода, и иона двухвалентного металла являются такими же, как описанные в отношении раствора для консервации клеток.
[0027]
В варианте осуществления соединение двухвалентного металла, растворимое в водном растворителе (в дальнейшем также просто называемое "соединением металла"), предпочтительно используется в качестве иона двухвалентного металла. Следует отметить, что это соединение является таким же, как соединение, описанное в отношении раствора для консервации клеток. Соединение металла, применяемое в способе получения согласно данному варианту осуществления, может находиться в форме раствора или может иметь твердую форму (например, порошка или кристалла).
[0028]
Низший спирт, применяемый в способе получения согласно данному варианту осуществления, может быть абсолютным спиртом. В альтернативе, при условии, что можно регулировать вышеуказанную концентрацию низшего спирта, он может быть гидратированным спиртом.
[0029]
В данном варианте осуществления нет никакого конкретного ограничения в отношении порядка добавления низшего спирта и соединения металла в качестве иона двухвалентного металла в водный растворитель. Например, соединение металла может быть смешано после смешивания низшего спирта и водного растворителя, или низший спирт может быть добавлен после смешивания соединения металла и водного растворителя. Кроме того, низший спирт и ион двухвалентного металла могут быть смешаны в водном растворителе по существу в одно и то же время. Условия смешивания отдельно не ограничены, причем смешивание может быть выполнено, например, при обычной температуре и нормальном давлении (например, при 25°C и давлении 1 атм).
[0030]
В варианте осуществления pH смеси, полученной, как описано выше, предпочтительно регулируют в диапазоне от приблизительно 6 до приблизительно 8, в особенности в диапазоне от приблизительно 6,4 до приблизительно 7, при использовании щелочи, такой как гидроксид натрия, или кислоты, такой как соляная кислота. В другом варианте осуществления предпочтительно, что pH смеси регулируют в диапазоне от 6 до 8, в особенности в диапазоне от 6,4 до 7.
[0031]
В варианте осуществления, в дополнение к низшему спирту и иону двухвалентного металла, может быть добавлена добавка, при необходимости. Следует отметить, что добавка является такой же, как описанная в отношении раствора для консервации клеток.
[0032]
[3. Способ консервации клеток с применением раствора для консервации клеток]
Способ консервации клеток (в дальнейшем просто называемый "способом консервации") согласно данному варианту осуществления будет описан ниже. Способ консервации согласно данному варианту осуществления включает погружение клеток in vitro в раствор для консервации клеток согласно данному варианту осуществления.
[0033]
Клетки, применяемые в способе консервации согласно данному варианту осуществления, являются такими же, как описанные выше.
[0034]
В варианте осуществления клетки погружают in vitro в достаточное количество (например, количество, которое в 100-1000 раз превышает объем клеток) раствора для консервации клеток, обеспечивая, таким образом, фиксацию клеток. После этого клетки можно хранить в течение заданного периода. В случае необходимости клетки, после погружения в раствор для консервации клеток, можно перемешать до такой степени, чтобы не повредить клетки, с получением суспензии. Перед погружением в раствор для консервации клеток клетки можно промыть PBS и т.п. В случае, когда клетки выделены из живого организма, клетки сразу начинают подвергаться автолизу, что приводит к деформации клеток и ядерных структур, а также деградации и модификации компонентов клетки, таких как нуклеиновая кислота и белок. Таким образом, клетки предпочтительно погружают в раствор для консервации клеток в течение не более 1 минуты после выделения. Контейнер для консервации отдельно не ограничен при условии, что это - контейнер, который может быть герметично закрыт крышкой, пробкой и т.п. Соответствующие примеры включают флакон, пробирку, микропробирку, микропланшет, чашку и бутылку.
[0035]
Температура при погружении клеток в раствор для консервации клеток (температура при контакте клеток с раствором для консервации клеток) предпочтительно составляет 35°C или ниже, более предпочтительно 32°C или ниже и еще более предпочтительно 30°C или ниже. Нижний предел температуры при погружении клеток в раствор для консервации клеток отдельно не ограничен при условии, что на последующий анализ не влияет замораживание раствора для консервации клеток и клеток. Например, нижний предел температуры может составлять 1°C или выше или 2°C или выше. Способ консервации согласно данному варианту осуществления может включать этап контакта клеток с раствором для консервации клеток при вышеуказанной температуре, предназначенный для фиксации клеток.
[0036]
Температура хранения клеток предпочтительно составляет 35°C или ниже, более предпочтительно 32°C или ниже и еще более предпочтительно 30°C или ниже. В случае, когда клетки хранятся в растворе для консервации клеток согласно данному варианту осуществления, нуклеиновые кислоты клеток могут стабильно сохраняться не только в случаях хранения в охлажденном состоянии, но также и в случаях хранения при комнатной температуре. Нижний предел температуры хранения отдельно не ограничен при условии, что на последующий анализ не влияет замораживание раствора для консервации клеток и клеток. Например, нижний предел температуры хранения может составлять 1°C или выше или 2°C или выше. Способ консервации согласно данному варианту осуществления может включать этап хранения клеток в растворе для консервации клеток при вышеуказанной температуре в течение заданного периода. Следует отметить, что температура в момент контакта клеток с раствором для консервации клеток и температура хранения клеток могут быть одинаковыми или отличаться друг от друга.
[0037]
Раствор для консервации клеток может быть заменен в течение периода хранения. Хотя частота замены раствора для консервации клеток отдельно не ограничена, раствор для консервации клеток можно заменять, например, один раз в 90 дней.
[0038]
[4. Способ изготовления фиксированных клеток с применением раствора для консервации клеток]
Способ изготовления фиксированных клеток согласно данному варианту осуществления (в дальнейшем также просто называемый "способом изготовления") будет описан ниже. Способ изготовления согласно данному варианту осуществления включает контакт клеток in vitro с раствором для консервации клеток согласно данному варианту осуществления с получением фиксированных клеток. Следует отметить, что клетки, применяемые в способе изготовления согласно данному варианту осуществления, являются такими же, как описанные в способе консервации клеток согласно данному варианту осуществления.
[0039]
В варианте осуществления контакт клеток с раствором для консервации клеток может быть выполнен путем погружения клеток в достаточное количество (например, количество, которое в 100-1000 раз превышает объем клеток) раствора для консервации клеток. В альтернативе контакт клеток с раствором для консервации клеток может быть выполнен путем помещения клеток в пустую емкость и добавления достаточного количества раствора для консервации клеток к ним. Перед контактом с раствором для консервации клеток клетки могут быть промыты PBS и т.п. Клетки начинают немедленно подвергаться автолизу, который приводит к деформации клеток и ядерных структур и деградации и модификации компонентов клетки, таких как нуклеиновая кислота и белок. Таким образом, клетки предпочтительно подвергают контакту с раствором для консервации клеток в течение не более 1 минуты после выделения. Емкость, используемая для контакта, отдельно не ограничена, и соответствующие примеры включают флакон, пробирку, микропробирку, микропланшет, чашку и бутылку. В случае необходимости емкость может быть герметично закрыта крышкой, пробкой и т.п.
[0040]
В способе изготовления согласно данному варианту осуществления клетки, которые подвергают контакту с раствором для консервации клеток, подвергаются фиксации под действием низшего спирта, содержащегося в растворе для консервации клеток (обезвоживание и коагуляция белка). В варианте осуществления время контакта клеток с раствором для консервации клеток отдельно не ограничено при условии, что клетки фиксируются в достаточной степени. Температурные условия в момент контакта совпадают с условиями, описанными в способе консервации согласно данному варианту осуществления.
[0041]
В варианте осуществления полученные фиксированные клетки могут использоваться сразу или после промывки PBS и т.п., в качестве образцов для необходимого анализа. В альтернативе клетки и раствор для консервации клеток можно хранить в состоянии контакта друг с другом перед анализом. Условия хранения клеток совпадают с условиями, описанными в отношении способа консервации согласно данному варианту осуществления.
[0042]
[5. Способ анализа клеток с применением раствора для консервации клеток]
Способ анализа клеток (в дальнейшем просто называемый "аналитическим способом") согласно данному варианту осуществления будет описан ниже. В аналитическом способе согласно данному варианту осуществления клетки сначала подвергают контакту in vitro с раствором для консервации клеток согласно данному варианту осуществления с целью фиксации клеток. Клетки, раствор для консервации клеток и фиксация клеток являются такими же, как описанные выше.
[0043]
Затем нуклеиновые кислоты в полученных фиксированных клетках подвергают анализу. В данном варианте осуществления в анализе нуклеиновых кислот предпочтительно получить информацию, указывающую количество нуклеиновых кислот. Форма информации, указывающей количество нуклеиновых кислот, отдельно не ограничена и может быть определена надлежащим образом согласно способу получения информации. Информация, указывающая количество нуклеиновых кислот, может быть числовой информацией (например, измеренным значением), может быть диаграммой (например, графиком, полученным на основе числовой информации) или может быть визуальной информацией (например, окрашенным изображением, фотографией электрофорезного геля).
[0044]
Нуклеиновые кислоты в фиксированных клетках могут быть нуклеиновыми кислотами, изначально существующими в клетках, или нуклеиновыми кислотами, введенными извне при введении гена, в результате вирусной инфекции и т.п. Типом нуклеиновых кислот может быть либо ДНК, либо РНК. В варианте осуществления нуклеиновые кислоты в фиксированных клетках могут быть кДНК или кРНК, синтезированными с нуклеиновых кислот, выделенных из фиксированных клеток.
[0045]
В варианте осуществления способ анализа нуклеиновых кислот в фиксированных клетках может быть выбран из способов, известных в уровне техники. Примеры способа включают микроскопическое исследование, проточную цитометрию, амплификационные анализы нуклеиновых кислот (например, ПЦР анализ, ОТ-ПЦР анализ, ПЦР анализ в реальном времени), гибридизационные анализы (например, Саузерн-блот анализ, Нозерн-блот анализ), микроматричный метод и метод гибридного захвата (HC) (см. Clavel C. et al., J. Clin. Pathol, vol. 51, p. 737-740 (1998)) (Clavel C. et al., J. Clin. Pathol, vol. 51, p. 737-740 (1998), который включен в настоящую заявку посредством отсылки).
[0046]
В варианте осуществления предпочтительно, чтобы измеряемый образец был подготовлен из фиксированных клеток, и затем образец подвергают анализу. Измеряемый образец может быть подготовлен при разрушении фиксированных клеток или без разрушения фиксированных клеток. Методика подготовки для разрушения фиксированных клеток является, например, методикой выделения нуклеиновых кислот из фиксированных клеток. Методика подготовки без разрушения фиксированных клеток является, например, методикой окрашивания нуклеиновых кислот в состоянии, в котором сохраняется форма фиксированных клеток.
[0047]
Способ выделения нуклеиновых кислот из клеток как таковых известен в уровне техники. При выделении ДНК, например, фиксированные клетки смешивают с лизатом, содержащим поверхностно-активное вещество (например, холат натрия, додецилсульфат натрия). При выделении РНК, например, фиксированные клетки смешивают с лизатом, содержащим гуанидин тиоцианат и поверхностно-активное вещество. Затем полученную смесь подвергают физическому процессу (например, перемешиванию, гомогенизации, ультразвуковой фрагментации) для высвобождения нуклеиновых кислот, содержащихся в биологическом образце, из клеток, с осуществлением, таким образом, выделения нуклеиновых кислот. В этом случае предпочтительно подвергнуть смесь центрифугированию с целью осаждения клеточного дебриса, после чего супернатант, содержащий свободные нуклеиновые кислоты, используется для анализа. В альтернативе полученный супернатант может быть очищен любым способом, известным в уровне техники. Выделение и очистка нуклеиновых кислот из клеток также могут быть выполнены при использовании коммерчески доступного набора.
[0048]
Способ окрашивания нуклеиновых кислот с сохранением формы клетки без изменения известен в уровне техники. Например, фиксированные клетки сначала подвергают контакту с раствором для обработки, содержащим поверхностно-активное вещество (например, Нонидет (зарегистрированная торговая марка) P-40), Тритон (зарегистрированная торговая марка) X-100), при этом клеточная мембрана подвергается некоторому уровню повреждения, при котором краситель для окрашивания нуклеиновой кислоты может проникать в клетку. Затем фиксированные клетки после обработки подвергают контакту с раствором красителя, в результате чего нуклеиновые кислоты могут окрашиваться, при этом сохраняется форма фиксированных клеток.
[0049]
Краситель для окрашивания нуклеиновой кислоты может быть подходящим образом выбран из известных красителей для окрашивания нуклеиновых кислот в соответствии со способом анализа нуклеиновых кислот. Например, в сучае использования оптического микроскопа для получения информации, примеры красителя для окрашивания нуклеиновых кислот включают гематоксилин, пиронин Y (пиронин G) и метиловый зеленый. Кроме того, при использовании флуоресцентного микроскопа, проточного цитометра и т.п. для получения информации, в качестве красителя для окрашивания нуклеиновых кислот предпочтительно использовать флуоресцентный краситель, способный окрашивать нуклеиновую кислоту. Примеры флуоресцентного красителя включают иодистый пропидий, бромистый этидий, гетеродимер этидий-акридина, диазидоэтидий, гомодимер-1 этидия, гомодимер-2 этидия, моноазид этидия, Hoechst33342, Hoechst33258, 4',6-диамидино-2-фенилиндол дигидрохлорид (DAPI), тетраиодид триметилен-бис[[3-[[4-[[(3-метилбензотиазол-3-ий)-2-ил]метилен]-1,4-дигидрохинолин]-1-ил]пропил]диметиламиния] (TOTO-1), дииодид 4-[(3-метилбензотиазол-2(3H)-илиден)метил]-1-[3-(триметиламино)пропил]хинолиния (TO-PRO-1), тетраиодид N,N,N',N'-тетраметил-N,N'-бис[3-[4-[3-[(3-метилбензотиазол-3-ий)-2-ил]-2-пропенилиден]-1,4-дигидрохинолин-1-ил]пропил]-1,3-пропандиаминия (TOTO-3) и дииодид 2-[3-[[1-[3-(триметиламино)пропил]-1,4-дигидрохинолин]-4-илиден]-1-пропенил]-3-метилбензотиазол-3-ия (TO-PRO-3).
[0050]
Измеряемый образец, содержащий нуклеиновые кислоты, выделенные из фиксированных клеток, подходит для аналитического способа обнаружения заданной нуклеиновой кислоты в фиксированных клетках (например, способа амплификации нуклеиновых кислот, способа гибридизации, микроматричного способа, способа HC). Измеряемый образец, содержащий фикс