Носитель для культивирования клеток человека и животных
Иллюстрации
Показать всеИзобретение относится к области биохимии. Предложен носитель для культивирования клеток человека и животных. Причём носитель представляет собой живой мох. Изобретение обеспечивает отсутствие цитотоксических действий на различные линии клеток. 4 ил., 5 табл., 7 пр.
Реферат
Предлагаемое изобретение относится к области применения живого мха по новому назначению, а именно в качестве носителя для культивирования клеток человека и животных в условиях in vitro с использованием живых клеток мха в качестве носителя (подложки). Может быть использовано при промышленном выращивании клеток млекопитающих для производства лекарственных препаратов для лечения и/или для проведения клинических и/или лабораторных исследований с целью разработки и клинической диагностики противоопухолевых или ранозаживляющих препаратов.
Для выполнения многих опытов и/или производства лекарственных препаратов используют клетки организмов, взятые у млекопитающих (животных и человека) и культивируемые в искусственных, лабораторных условиях «в пробирке» - вне живого организма (in vitro).
Преимущественно большинство клеток организма млекопитающих в лабораторных условиях растут (культивируются) в питательной среде, будучи прикрепленными к какому-либо носителю. В качестве носителя обычно используют пластмассовую культуральную посуду преимущественно одноразового применения. Эта посуда оптически прозрачна и подготовлена для использования в культивировании тканей путем модификации пластика, увеличивающей его (пластика) смачиваемость и облегчающей прикрепление клеток.
Для выращивания клеток применяют также носители, представляющие собой синтетический или биологический комплекс, обеспечивающий механическую прочность конструкции и трехмерное ориентирование нанесенной на него клеточной культуры. Основными критериями биологически совместимого носителя для создания тканеинженерной конструкции являются [Ларионов П.М., Садовой М.А., Самохин А.Г., Рожнова О.М., Гусев А.Ф., Принц В.Я., Селезнев В.А., Голод С.В., Принц А.В., Корнеев И.А., Комонов А.И., Мамонова Е.В., Малютина Ю.Н., Батаев В.А. Создание тканеинженерного эквивалента костной ткани и перспективы его использования в травматологии и ортопедии. Хирургия позвоночника, 2014. - №3. - С. 77-85]:
- механическая прочность;
- биологическая инертность;
- отсутствие цитотоксичности (способности химических веществ, включая медикаменты, вирусы и антитела, повреждать клетки);
- поддержание адгезии (способности клеток слипаться друг с другом и с различными субстратами);
- поддержание клеточного размножения (увеличение биомассы);
- для стволовых клеток - поддержание дифференцировки (процесса перехода неспециализированных стволовых клеток в специализированные клетки жировой, костной или хрящевой ткани).
В качестве носителей для выращивания клеток млекопитающих используют синтетические и природные полимеры (высокомолекулярные соединения). Далее заявителем приведены описания основных видов носителей.
Синтетические биодеградируемые носители на основе полимолочной и полигликолевой кислот и их сополимеров широко используют для выращивания клеток человека и животных [Yao J., Radin S., S Leboy P., Ducheyne P. The effect of bioactive glass content on synthesis and bioactivity of composite poly (lactic-co-glycolic acid)/bioactive glass substrate for tissue engineering (Влияние содержания биологически активного стекла на синтез и биологическую активность композитного поли (молочно-когликолевой кислоты)/биоактивного стеклянного субстрата для тканевой инженерии). Biomaterials, 2005. - V. 26. - Р. 1935-1943].
Недостатком применения синтетических носителей на основе полимолочной и полигликолевой кислот является быстрая и непредсказуемая деградация носителей, которая сопровождается локальным понижением рН, что снижает эффективность их применения [Prokop A., Jubel A., Helling H.J., Eibach Т., Peters С., Baldusc S.E., Rehm K.Е. Soft tissue reactions of different biodegradable polylactide implants (Реакция мягких тканей на введение биоразлагаемых имплантов из полилактида). Biomaterials, 2004. - V. 25. - Р. 259-267]. Недостаток существенно ограничивает область применения синтетических носителей - субстратов для культивирования клеток in vitro.
Наиболее доступными природными носителями для выращивания клеток человека и животных являются различные формы коллагена и гликозаминогликанов [Galois L., Freyria A.M., Grossin L., Hubert P., Mainard D., Herbage D., Stoltz J.F., Netter P., Dellacherie E., Payan E. Cartilage repair: surgical techniques and tissue engineering using polysaccharide and collagen-based biomaterials (Замена хряща: хирургические методы и тканевая инженерия с использованием биоматериалов на основе полисахарида и коллагена). Biorheology, 2004. - V. 41. - Р. 433-443].
Недостатком таких носителей является происходящее при биодеградации экзогеного коллагена (причем - при использовании коллагена любого типа и гликозаминогликанов) высоковероятное высвобождение мономерного глютаральдегида, оказывающего цитотоксическое действие на фибробласты (клетки соединительной ткани организма) и вызывающего развитие непредвиденных побочных эффектов при лабораторных исследованиях и осложнений при выполнении лечебных мероприятий (процедур).
Другим природным носителем-полимером для выращивания клеток является хитозан, обладающий бактериостатическими (противобактериальными), фунгицидными (противогрибковыми), гемостатическими (кровоостанавливающими) свойствами и высокой гигроскопичностью (способность поглощать влагу) - свойствами, позволяющими успешно применять его в качестве биологически активной пленки (носителя) при выращивании монослоя клеток человека и животных [Kumar M.N., Muzzarelli R.A., Muzzarelli С., Sashiwa Н., Domb A.J. Chitosan chemistry and pharmaceutical perspectives (Химические особенности хитозана и его применение в фармацевтике). Chemical Reviews, 2004. - V. 104. - P. 6017-6084].
Недостатком хитозана, как носителя, является частичный апоптоз (гибель) клеток фибробластов при их культивировании на хитозановой пленке [Wang Y.-C., Kao S.-H., Hsieh H.-J. A chemical surface modification of chitosan by glycoconjugates to enhance the cell-biomaterial interaction (Химическая модификация поверхности хитозана гликоконъюгатами для усиления взаимодействия клеток и биоматериалов). Biomacromolecules, 2003. - V. 4. - Р. 224-231]. Гибель клеток, вероятно, связана с особенностями химического строения хитозана. Полимерные цепи хитозана не обладают достаточной биологической инертностью для прикрепления к ним клеток, а не прикрепившиеся клетки погибают, т.к. они не способны жить без прикрепления к поверхности. Недостаток ограничивает область применения хитозана.
Таким образом, общим недостатком применения вышеописанных известных носителей является частичное разрушение носителей, что сопровождается высвобождением вредных химических веществ и приводит к гибели культивируемых клеток млекопитающих.
Недостатком применения вышеописанных известных носителей также является необходимость обязательной химической обработки исходного материала для создания носителя и его (материала) последующая стерилизация перед использованием. Кроме указанного, как натуральный, так и синтезированный белок (полимер) с трудом удается стерилизовать, т.к. белки при стерилизации автоклавированием или иными способами подвергаются деградации (разрушению), при этом, следует обратить внимание на то, что стабильность белка сложно поддерживать во время производства, хранения и транспортировки.
Интенсивные научно-технологические исследования с применением микроносителей показали ограниченность применения носителя одного типа к культивированию различных типов клеток животных, полученных от разных организмов [Souza M.C.d.O, Freire M.d.S, Castilho L.d.R. Influence of culture condition on Vero cell propagation on non-porous microcarriers (Влияние условий культивирования на пропагацию клеток Vero на непористых микроносителях). Brazilian Archives of Biology and Technology, 2005. - V. 48. - P. 71-77].
Недостатки существенно ограничивают область применения вышеуказанных природных носителей - субстратов для культивирования клеток in vitro.
В качестве природных носителей для культивирования клеток млекопитающих в лабораторных условиях используют органы и ткани высших растений. Известно применение носителя из децеллюлированного яблока для культивирования клеток млекопитающих [Modulevsky D.J., Lefebvre С., Haase K., Al-Rekabi Z., Pelling A.E. Apple derived cellulose scaffolds for 3D mammalian cell culture (Получение целлюлозного матрикса из яблока для создания 3D клеточных культур млекопитающих). PLoS One, 2014. - V. 9. - е97835]. Сущностью применяемого материала (децеллюлированного яблока) является его растительное происхождение и доступность для культивирования субстратзависимых клеток животных в условиях in vitro. Особенностью этого носителя является использование мертвого растительного материала - плодов яблок - в качестве основы для роста животных клеток. Это является недостатком носителя, так как мертвый растительный материал используется только для прикрепления и размножения клеток животных, но не может служить в качестве источника биологически активных веществ, необходимых для поддержания жизнеспособности клеток млекопитающих, что ограничивает область его применения.
Существенными недостатками органов и тканей высших растений в качестве носителей для культивирования клеток млекопитающих являются технически сложные и продолжительные этапы выращивания растений, выделения целевых органов и/или тканей растений, нерационально большой объем применяемых для культивирования материалов при промышленном производстве целых растений. Кроме того, носитель в больших объемах перед применением необходимо подвергать стерилизации загрязняющими окружающую природную среду веществами. Недостатки существенно ограничивают область применения известного технического решения.
Наиболее близким по наибольшему количеству совпадающих признаков и достигаемому техническому результату к заявленному техническому решению, выбранным заявителем в качестве прототипа является «Микроноситель для культивирования субстратзависимых клеток животных in vitro» по патенту РФ на изобретение №2328527. Сущность прототипа заключается в том, что микроноситель для культивирования субстратзависимых клеток животных в условиях in vitro представляет собой полимерную поверхность, отличающийся тем, что эта поверхность выполнена из природных полимеров клеточной стенки пыльцы. В качестве микроносителя в прототипе используют оболочки пыльцы растения - сосны (Pinus sylvestris L).
Существенными недостатками прототипа являются потребность длительного периода выращивания растений для получения исходного сырья пыльцы - до цветения (годы - для сосны, месяцы - для однолетних растений), необходимость сбора с них пыльцы и предварительной обработки пыльцы химическими веществами для получения целевого носителя - оболочек пыльцы. Полученный таким образом носитель из оболочек пыльцы в больших объемах перед применением необходимо подвергать стерилизации -автоклавированием при плюс 118-120°С (в течение 20 мин), 96% этанолом и воздействием жидким азотом. При этом в описании изобретения по патенту РФ на изобретение №2328527 информация о продолжительности воздействия этанолом и жидким азотом отсутствует. Это требует дополнительных исследований для промышленного применения прототипа.
При этом выполнение последовательности процессов для осуществления прототипа по патенту на изобретение №2328527 - продолжительное во времени, т.к. исходная пыльца собирается из предварительно выращенных растений, несет элементы неопределенности существенных показателей выполняемых действий при осуществлении стерилизации используемого сырья, что существенно осложняет производство и применение прототипа.
Заявленное техническое решение поясняется Фиг. 1-4.
На Фиг. 1 представлена оптическая световая микроскопия совместного культивирования (далее по тексту - со-культивирования) мха Physcomitrella patens с клетками животных (МСК кошки, МСК собаки, MCK GFP крысы) в течение 168 час (то есть 7 суток или одной недели), где:
1-1 - контроль: клетки МСК (Мезенхимальные Стволовые Клетки) кошки;
1-2 - со-культивирование МСК кошки и мха;
1-3 - контроль: клетки МСК собаки;
1-4 - со-культивирование МСК собаки и мха;
1-5 - контроль: клетки МСК GFP крысы;
1-6 - со-культивирование МСК GFP крысы и мха
На Фиг. 2 представлена оптическая световая микроскопия со-культивирования мха Physcomitrella patens с клетками человека (ДФЧ, А459, Hela) в течение 168 час (7 суток или одной недели), где:
2-1 - контроль: клетки ДФЧ (Дермальные Фибробласты Человека);
2-2 - со-культивирование ДФЧ и мха;
2-3 - контроль: клетки А459;
2-4 - со-культивирование А459 и мха;
2-5 - контроль: клетки Hela;
2-6 - со-культивирование Hela и мха
На Фиг. 3 представлена сканирующая электронная микроскопия со-культивирования мха Physcomitrella patens с ДФЧ в течение 504 час (21-х суток или 3-х недель), где:
3-1 - 1-я неделя со-культивирования;
3-2 - 2-я неделя со-культивирования;
3-3 - 3-я неделя со-культивирования;
На Фиг. 4 представлена адиподифференцировка ДФЧ (направленное перерождение клеток кожи в клетки жировой ткани) при со-культивировании со мхом Physcomitrella patens, где:
4-1 - отрицательный контроль: клетки ДФЧ на обычной (недифференцировочной) ростовой среде при микроскопировании в видимом свете;
4-2 - отрицательный контроль: клетки ДФЧ на обычной (недифференцировочной) ростовой среде при микроскопировании с флюоресцентным окрашиванием;
4-3 - положительный контроль: клетки ДФЧ на дифференцировочной ростовой среде при микроскопировании в видимом свете;
4-4 - положительный контроль: клетки ДФЧ на дифференцировочной ростовой среде при микроскопировании с флюоресцентным окрашиванием;
4-5 - со-культивирование ДФЧ и мха на дифференцировочной ростовой среде при микроскопировании в видимом свете;
4-6 - со-культивирование ДФЧ и мха на дифференцировочной ростовой среде при микроскопировании с флюоресцентным окрашиванием.
Стрелки на фото Фиг. 4 указывают на внутриклеточные жировые включения в клетках ДФЧ.
Целью (задачей) заявленного технического решения является устранение недостатков прототипа:
- повышение технологичности процесса получения носителя для клеток человека и/или животных путем совместного культивирования (со-культивирования) суспензии живого растительного материала мха, например - Physcomitrella patens, с клетками млекопитающих, в том числе человека;
- упрощение процесса подготовки растительного организма к функционированию в качестве носителя;
- повышение производительности труда при получении носителя для культивирования клеток;
- получение нового средства (носителя) для получения в последующем лекарственного средства для лечения животных in vivo, преимущественно - раневых поверхностей;
- получение нового средства (носителя) для культивирования клеток млекопитающих, в том числе человека, с целью клинической диагностики противоопухолевых препаратов.
Сущностью заявленного технического решения является применение живого мха в качестве носителя для культивирования клеток человека и животных.
Техническим результатом заявленного технического решения является применение живого мха в качестве носителя для культивирования клеток человека и животных, например - Physcomitrella patens, полученный с использованием стандартного оборудования культуральной лаборатории. Используемый мох не обладает цитотоксическим действием на различные линии клеток млекопитающих, в том числе - клетки организма человека. Заявленное техническое решение позволяет получить культуру клеток млекопитающих в виде монослоя с сохранением их (культуры клеток) функциональной активности в стандартных лабораторных условиях. Полученный продукт совместного культивирования растительных клеток с клетками млекопитающих применим в клинической медицине, например - для ускорения заживления ран; в фармацевтической промышленности, например - для производства перспективных лекарственных препаратов; в области лабораторных исследований опухолевых клеток, например - с целью выбора оптимального препарата или методики лечения для персонального больного с конкретным видом заболевания.
Цели достигают путем совместного культивирования живых клеток мха и живых клеток млекопитающих.
Осуществление предлагаемого изобретения поясняется примерами и иллюстрируется Фиг. 1-4, в которых приведены примеры реализации с применением различных линий клеток человека и животных, в качестве которых использованы, например:
- А459 (клеточная линия карциномы легких человека);
- Hela (клеточная линия раковой опухоли шейки матки человека);
- Дермальные Фибробласты Человека (ДФЧ);
- Мезенхимальные Стволовые Клетки кошки (МСК кошки);
- Мезенхимальные Стволовые Клетки собаки (МСК собаки);
- Мезенхимальные Стволовые Клетки крысы из костного мозга, геномодифицированные рекомбинантным лентивирусом, несущим ген зеленого флуоресцентного белка (Green Fluorescent Protein) (МСК GFP крысы).
Выбор клеточных линий объясняется необходимостью доказать биологическую совместимость живых клеток мха с различными клетками организма человека и клетками различных животных:
- дермальные фибробласты человека (ДФЧ) - это обычные клетки здоровой ткани кожи человека;
- А459 и Hela - это злокачественные клетки, полученные из образцов тканей раковых опухолей человека;
- мезенхимальные стволовые клетки (МСК) - это стволовые клетки, составляющие матрицу всех органов и тканей организма человека и животных.
Все выбранные заявителем в качестве примеров клеточные линии млекопитающих широко используются в лабораторно - клинической практике при разработке и получении препаратов медицинского назначения (лекарств, вакцин, тест-систем). Результаты, полученные для выбранных клеток, применимы для других клеточных линий, используемых в биологических и фармацевтических лабораториях при разработке препаратов медицинского назначения.
Описание растительного субстрата (составляющей основы) носителя.
Растительной основой являются живые клетки мха. В качестве носителя для клеток млекопитающих используют известную [14. Shakirov E.V., Perroud P.-F., Nelson A.D., Cannell M.E., Quatrano R.S., Shippen D.E. Protection of telomeres 1 is required for telomere integrity in the moss Physcomitrella patens (Защита теломер 1 необходима для целостности теломер мха Physcomitrella patens). Plant Cell, 2010. - V. 22. - P. 1838-1848] ткань (протонему) дикорастущего мха, например - штамма дикого типа.
Используемые в качестве сырья виды мха не ограничиваются использованным в примерах мхом рода Physcomitrella вида Physcomitrella patens изолят Gd. В качестве сырья для получения носителя для культивирования клеток млекопитающих могут быть использованы других группы мхов, включая печеночники, с видами родов, например - Funaria, Sphagnum и Ceratodon, а также Marchantia и Sphaerocarpos, которые описаны как особенно предпочтительные для использования, например в патенте РФ на изобретение №2250264.
По заявленному техническому решению штамм дикого типа мха культивируют (выращивают) при существующих в природе стандартных условиях (температура плюс 20-25°С, влажность 60-65%, период освещения 16 часов день / 8 часов ночь). Культивирование осуществляют на общедоступных известных питательных средах, например - в виде жидкой культуры на среде BCD [Roberts A.W., Dimos C.S., Budziszek M.J.Jr., Goss C.A., Lai V. Knocking out the wall: protocols for gene targeting in Physcomitrella patens (Нокаутирование клеточной стенки: протоколы таргетирования генов Physcomitrella patens). Methods in Molecular Biology, 2011. - V. 715. - P. 273-290]. Возможно также культивирование мха на твердой среде с 0,7% агаром (производства Plant Cell Culture Agar, Sigma-Aldrich, США).
Выполняют измельчение ткани мха, обеспечивающее гомогенность культуры, например - определяемую зрительно. Измельчение ткани мха проводят в стерильных условиях стандартным способом [Grimsley N.H., Ashton N.W., Cove D.J. The production of somatic hybrids by protoplast fusion in the moss, Physcomitrella patens (Производство соматических гибридов путем слияния протопластов в мох Physcomitrella patens). Ж-л Molecular and General Genetics MGG, 1977. - V. 154. - P. 97-100] и получают растительную основу (носитель) для культивирования клеток млекопитающих.
К вышеописанной растительной основе добавляют использованные в примерах следующие клеточные линии животного происхождения:
А459 - клеточная линия карциномы легких человека (из коллекции Казанского (Приволжского) федерального университета, далее по тексту - КФУ).
Hela - клеточная линия раковой опухоли шейки матки человека (из коллекции КФУ).
Дермальные фибробласты человека (ДФЧ) - первичную культуру из кожи человека выделяют по известной методике [Mukhamedyarov М.А., Rizvanov A.A., Yakupov E.Z., Zefirov A.L., Kiyasov А.Р., Reis H.J., Teixeira A.L., Vieira L.B., Lima L.M., Salafutdinov I.I., Petukhova E.O., Khaiboullina S.F., Schlauch K.A., Lombardi V.C., A. Transcriptional analysis of blood lymphocytes and skin fibroblasts, keratinocytes, and endothelial cells as a potential biomarker for Alzheimer's disease (Транскриптомный анализ лимфоцитов крови и фибробластов кожи, кератиноцитов и эндотелиальных клеток как потенциальных маркеров при болезни Альцгеймера). Journal of Alzheimer's Disease, 2016. - V. 54. - Р. 1373-1383].
Мезенхимальные стволовые клетки кошки (МСК кошки) и Мезенхимальные стволовые клетки собаки (МСК собаки) адипогенного происхождения (то есть из жировой ткани) получают по известной методике [Катина М.Н., Гайфуллина Р.Ф., Хаятова З.Г., Эмене Ч.Ч., Ризванов А.А. Выделение, культивирование и дифференцировка мультипотентных мезенхимальных стромальных клеток из жировой ткани крыс Rattus norvegicus и хомяков Mesocricetus auratus. Гены и клетки, 2012. - Т. 7. - №3. - С. 82-87].
Мезенхимальные стволовые клетки из костного мозга крысы, геномодифицированные рекомбинантным лентивирусом, несущим ген зеленого флюоресцентного белка (МСК GFP крысы) получают по известной методике [Solovyeva V.V., Kolobynina K.G., Gomzikova М.О., Tazetdinova L.G., Zhuravleva M.N., Slepak V.Z., Rizvanov A.A. Effect of tescalcin overexpression on osteogenic differentiation of human mesenchymal stem cells (Влияние сверхэкспресии тесколцина на остеогенную дифференцировку мезенхимальных стволовых клеток человека). Genes and Cells, 2015. - V. 10. - P. 90-93].
Все вышеуказанные клеточные культуры млекопитающих выращивают в одинаковых стерильных условиях in vitro в СО2-инкубаторе при плюс 37°С на ростовой среде αМЕМ (HyClone, США), содержащей: телячью сыворотку - 10% (HyClone, США); пенициллин, стрептомицин по 100000 ЕД (Биолот, Россия), глутамин - 0,3 г/л (Панэко, Россия).
Пролиферативную активность (скорость размножения) клеточных культур млекопитающих определяют по известному методу [Акиншина Г.Т., Белоконь B.C., Билько Н.М. и др. Животная клетка в культуре: (методы и применение в биотехнологии). - М.: Спутник+, 2009. - С. 652].
Определение жизнеспособности дермальных фибробластов человека (ДФЧ) проводят с помощью набора Annexin V Apoptosis Detection Kit (Santa Crus, sc-4252 AK, США) по инструкции фирмы-производителя при помощи проточного цитофлуориметра (Guava easyCyte 8НТ, США).
Наличие на мембране клеток ДФЧ маркеров CD90, CD73 (positive cocktail cat. 562245, Biosciences, США), CD44 (Biolegend, В 192258, США), CD34 (Santa Crus, №7324, США), CD45 (Сорбент, Россия) определяют по рекомендациям фирмы-производителя - при помощи проточного цитофлуориметра (Guava easyCyte 8НТ, США). Определение наличия маркеров на мембране ДФЧ используется в данной области техники с целью обеспечения возможности идентификации линии клеток ДФЧ, для доказательства отсутствия изменений свойств ДФЧ в процессе проведения экспериментов.
Способность ДФЧ дифференцироваться в адипогенном направлении, т.е. способность ДФЧ к перерождению в клетки жировой ткани, проводят по известной методике [Катина М.Н., Гайфуллина Р.Ф., Хаятова З.Г., Эмене Ч.Ч., Ризванов А.А. Выделение, культивирование и дифференцировка мультипотентных мезенхимальных стромальных клеток из жировой ткани крыс Rattus norvegicus и хомяков Mesocricetus auratus].
Заявленное техническое решение осуществляют в следующей последовательности.
Берут подготовленные вышеописанными способами культуры клеток животного происхождения и переносят их (клетки) в культуральные емкости, например - в емкости, наполненные вышеописанной ростовой питательной средой αМЕМ.
Далее берут основу - ткань живого мха, предварительно гомогенизированную в дистиллированной воде, и вносят ее в культуральную емкость с клетками животного происхождения в массовом соотношении 10:1.
Далее емкость с клетками животного происхождения с внесенной культурой мха помещают в СО2-инкубатор с температурой плюс 37°С и культивируют указанную смесь клеток, например, в течение от 168 до 672 час (от 7 до 28 суток, или от 1 до 4-х недель).
Продолжительность процесса культивирования зависит от исходной концентрации клеток, причем меньшую продолжительность процесса культивирования выдерживают при более высокой исходной концентрации клеток. Таким образом, животные и растительные клетки находятся в емкости для культивирования в виде суспензии в питательном растворе.
В течение первых суток со-культивирования в СО2-инкубаторе происходит оседание клеток мха естественным путем под действием силы тяжести на дно культуральной емкости, при этом одновременно происходит прикрепление животных клеток к осевшим на дно клеткам мха. По завершении данного процесса со-культивирования на дне культуральной емкости получают монослой животных клеток, прикрепленный к живому растительному основанию - слою мха (далее носителю).
Полученная масса клеток растительного и животного происхождения готова для дальнейшего использования, например - для нанесения на раневую поверхность тела человека и/или животных, для ускорения процесса заживления раны.
Далее заявителем приведены экспериментальные данные, доказывающие, что заявленное техническое решение позволяет проводить со-культивирование живого мха Physcomitrella patens и клетки млекопитающих, в том числе клетки человека, в условиях СО2-инкубатора без отрицательного влияния на жизнеспособность, пролиферацию (размножение) и биологическую активность культур клеток животных или клеток человека.
Указанная информация приведена в следующей последовательности:
В Примере 1 показана и доказана возможность со-культивирования мха и различающихся клеток (карциномы опухолевых клеток, клеток костной ткани, клеток жировой ткани, клеток кожной ткани) различных млекопитающих (кошки, собаки, крысы, человека). Приведены результаты со-культивирования мха с клетками животных (МСК кошки, МСК собаки, МСК GFP крысы) и человека (ДФЧ, А459, Hela) в течение 168 час (7 суток, или 1 недели).
В Примере 2 определена пролиферативная активность (скорость размножения) ДФЧ при длительном со-культивировании (в течение 672 час, или 28 суток, или 4 недель) со мхом.
В Примере 3 определена жизнеспособность ДФЧ при со-культивировании со мхом в течение 672 час (28 суток, или 4 недель).
В Примере 4 приведены результаты исследования маркеров мезенхимальных клеток ДФЧ до и после со-культивирования со мхом.
В Примере 5 приведена оценка динамики поверхностного взаимодействия клеток ДФЧ с клетками мха с течением времени - после одной недели, после двух недель и после трех недель со-культивирования.
В Примере 6 определено влияние видимого света на пролиферативную активность (скорость размножения) ДФЧ при со-культивировании со мхом в течение 672 час (28 суток, или 4 недель).
В Примере 7 исследовано влияние со-культивирования на биологическую активность ДФЧ, а именно, изучена способность ДФЧ к дифференцировке в адипогенном направлении в присутствии мха.
Заявленное техническое решение осуществляют, например, следующим путем в указанной выше последовательности (Примеры 1-7 соответственно).
Пример 1. Совместное культивирование мха и различающихся клеток млекопитающих.
1.1. Из млекопитающих выделяют следующие клеточные культуры: МСК кошки, МСК собаки, МСК GFP крысы, ДФЧ. Из криобанка рекриконсервируют (оживляют) и культивируют клеточные линии А459, и Hela соответственно.
1.2. Готовят суспензию из ткани мха Physcomitrella patens.
1.3. Рассевают клеточные культуры МСК кошки, МСК собаки, МСК GFP крысы, ДФЧ, А459, Hela в концентрации 5×103 кл/лунку (5000 клеток на 1 лунку) в 48-луночный культуральный пластиковый планшет, одновременно добавляя суспензию мха, и культивируют в течение 168 час (7 суток, или 1 недели) в условиях СО2-инкубатора. Ростовую среду не меняют. При этом контролем являются клетки млекопитающих, культивируемые в тех же условиях и в течение того же периода времени, но без внесения суспензии мха.
В эксперименте сравнили рост и размножение шести клеточных линий млекопитающих при со-культивировании со мхом и контрольный вариант - рост и размножение клеток млекопитающих без со-культивирования со мхом.
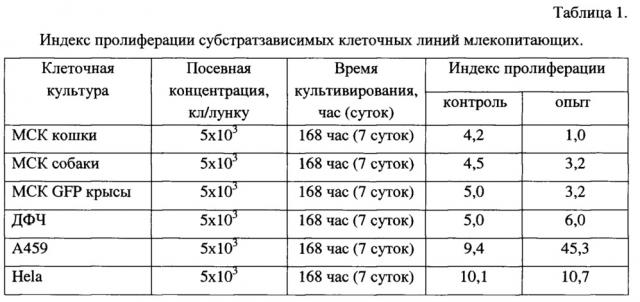
Экспериментальные данные представлены в Таблице 1, где посевная концентрация кл/лунку означает количество клеток (животных или человека), внесенных в одну лунку культурального планшета. Таблица 1 оставлена заявителем в тексте для удобства восприятия комментария к результатам опытов.
Из Таблицы 1 видно, что индекс пролиферации клеток млекопитающих ≥1 во всех случаях. Это означает, что количество клеток млекопитающих не уменьшилось в процессе кратковременного со-культивирования (168 час, или 7 суток, или 1 неделя) со мхом, то есть присутствие растительных клеток (мха) не оказывает токсического воздействия и не приводит к гибели клеток животного происхождения всех исследованных видов клеточных культур. Максимальный индекс пролиферации клеток в присутствии мха наблюдается у клеточной линии А459. Это клеточная линия карциномы легких человека, широко используемая в биологических лабораториях для клинической диагностики противоопухолевых препаратов.
Полученные результаты показали, что все исследованные клеточные линии млекопитающих успешно растут в присутствии живого мха. Со-культивирование клеток млекопитающих или предпочтительно клеток человека и суспензии мха не оказывает отрицательного влияния на адгезию (прикрепление) клеточных культур млекопитающих или предпочтительно клеток человека и способность их к пролиферации (размножению). Без подобного прикрепления к какой-либо поверхности клетки млекопитающих не способны к росту, развитию, размножению и выполнению своих биологических функций.
При ежедневном исследовании культур при помощи инвертированного микроскопа Axio Obzerver Z1 (Carl Zeiss, Германия) установлено, что ни в одной из культур клеток млекопитающих морфология (внешний вид) клеток не меняется на протяжении всего периода со-культивирования (Фиг. 1 и Фиг. 2). Неизменность внешнего вида исследованных культур клеток доказывает факт сохранения клеток как таковых и сохранение клетками способности к выполнению своих функций.
Пример 2. Определение пролиферативной активности (скорости размножения) ДФЧ при длительном со-культивировании со мхом.
2.1. Из донорской кожи человека выделяют ДФЧ.
2.2. Готовят суспензию из ткани мха.
2.3. Рассевают ДФЧ на культуральную чашку Петри в концентрации 1×103 кл/10 мл (1000 клеток на 10 мл питательной среды αМЕМ), одновременно добавляя суспензию мха, и культивируют в течение 672 час (28 суток, или 4 недель) в условиях СО2-инкубатора, меняя ростовую среду 2 раза в неделю. При этом контролем являются ДФЧ, культивируемые в тех же условиях и в течение того же периода времени, но без внесения суспензии мха.
В приведенном эксперименте сравнили рост и размножение клеток ДФЧ при длительном со-культивировании (в течение 672 час или 28 суток или 4 недель) со мхом и контрольный вариант - рост и размножение клеток ДФЧ в течение того же периода времени без со-культивирования со мхом. Экспериментальные данные представлены в Таблице 2, где кл/10 мл означает количество клеток (животных или человека), внесенных в 10 мл питательной среды. Таблица 2 оставлена заявителем в тексте для удобства восприятия комментария к результату опытов.
Из Таблицы 2 видно, что индекс пролиферации ДФЧ = 23, то есть >> 1. Это означает, что количество клеток 23-х кратно (23:1=23) увеличилось в процессе длительного (672 час или 28 суток или 4 недель) со-культивирования со мхом, то есть присутствие носителя в виде живых растительных клеток способствует размножению клеток ДФЧ (клеток животного происхождения).
Описанные в Таблице 2 данные также позволяют сделать вывод, что заявленное техническое решение возможно реализовать при промышленном производстве с использованием описанного выше способа со-культивирования мха и клеток млекопитающих или предпочтительно клеток человека в виде непрерывного технологического процесса при отъемно-доливных режимах культивирования.
Полученные результаты показали, что ДФЧ успешно растут и размножаются в течение 672 час (28 суток, или 4 недель) в присутствии мха. Совместное длительное культивирование ДФЧ и суспензии мха не оказывает отрицательного влияния на адгезию (прикрепление) ДФЧ к носителю (мху) и способность их (ДФЧ) к пролиферации (размножению). Без подобного прикрепления к какой-либо поверхности клетки млекопитающих не способны к росту, развитию, размножению и выполнению своих биологических функций.
Во время со-культивирования проводят ежедневное исследование культуры при помощи инвертированного микроскопа Axio Obzerver Z1 (Carl Zeiss, Германия). При этом установлено, что морфология (внешний вид) ДФЧ не меняется на протяжении всего периода со-культивирования. Неизменность внешнего вида исследованных культур клеток доказывает факт сохранения клеток как таковых и сохранение клетками способности к выполнению своих функций.
Пример 3. Определение жизнеспособности ДФЧ при со-культивировании со мхом.
Со-культивирование клеточных культур ДФЧ и мха проводят, как описано в п. 2.1.-2.3.
В эксперименте провели сравнение жизнеспособности клеток ДФЧ при их длительном со-культивировании (в течение 672 час, или 28 суток, или 4 недель) со мхом и контрольный вариант - жизнеспособность клеток ДФЧ в течение того же периода времени без со-культивирования со мхом. Экспериментальные данные представлены в Таблице 3. Таблица 3 оставлена заявителем в тексте для удобства восприятия комментария к результату опытов.
Из Таблицы 3 видно, что в опыте доля ДФЧ (в %), находящихся в стадии апоптоза (апоптоз - явление программируемой клеточной смерти) незначительна (не превышает 1,0%), так же, как и некротических клеток (некроз клеток является патологической формой клеточной смерти). Таким образом, со-культивирование со мхом не запускает механизмы апоптоза в ДФЧ и не вызывает их токсических поражений - некроза. Таким образом, принимая во внимание схожесть строения клеток ДФЧ и остальных исследуемых линий клеток животных и человека, представляется возможным экстраполировать полученные в указанном эксперименте данные и на остальные линии исследованных клеток.
Пример 4. Исследование маркеров мезенхимальных клеток ДФЧ до и после со-культивирования со мхом.
Со-культивирование клеточных культур ДФЧ и мха проводят, как описано в п. 2.1.-2.3.
Исследование маркеров мезенхимальных клеток ДФЧ позволяет оценить их (ДФЧ) антигенный профиль и выявлять эти клетки как in vivo (в живом организме), так и in vitro (в пробирке).
В приведенном эксперименте сравнили количество (в %) мембранных маркеров ДФЧ при длительном со-культивировании (в течение 672 час или 28 суток или 4 недель) со мхом и контрольный вариант - количество (в %) мембранных маркеров ДФЧ при выращивании в течение того же периода времени без мха. Экспериментальные данные представлены в Таблице 4. Таблица 4 оставлена заявителем в тексте для удобства восприятия комментария к результату опытов.
ДФЧ характеризуются присутствием на их клеточной мембране мезенхимных маркеров (таких как CD90, CD73, CD44) и отсутствием эпителиальных и гемопоэтических маркеров (таких как CD34, CD45) [Sorrell М., Caplan A.I. Fibroblasts - a diverse population at the center of it all (Фибробласты - разнообразие популяции в центре всего). International Review of Cell and Molecular Biology, 2009. - V. 276. - P. 161-214]. Маркеры CD90, CD73, CD44 являются мембранными маркерами мезенхимальных стволовых клеток, которые в процессе индивидуального развития организма преобразуются во многие виды клеток, в том числе и в ДФЧ. Присутствие этих маркеров на клеточной мембране подтверждает то, что клетки, выделенные из донорской кожи, являются ДФЧ, ведущими свое происхождение от мезенхимальных клеток. Количество маркеров CD90, CD73, CD44 на клеточной мембране может изменяться в ходе культивирования, что связано с процессами приспособления выделенных из живого организма клеток к лабораторным условиям их (клеток) выращивания. Изменение процентного содержания данных маркеров на клеточной мембране в пределах ±10% не влияет на функциональные свойства клеток. Экспериментальные данные в Таблице 4 показывают, что при со-культивировании со мхом изменения процентного содержания маркеров CD90, CD73, CD44 на мембране ДФЧ не превышают величину статистической ошибки (Р≤0,05).
Присутствие маркеров CD45, CD34 (маркеров клеток крови) на мембране клеток определяют для выявления примеси чужеродных клеток в культуре ДФЧ. Экспериментальные д