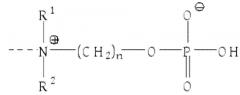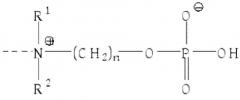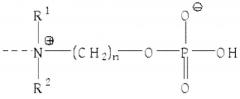Применение раствора цитрата для очистки crp с помощью аффинной хроматографии с использованием фосфохолина и его производных
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Предложено применение раствора цитрата для удаления С-реактивного белка (CRP) с помощью аффинной хроматографии из биологических жидкостей. CRP удаляют с помощью аффинной хроматографии с использованием материала колонки, функционализированного с помощью групп ω-фосфоноксиалкиламмония и/или с помощью ω-аммонийалкоксигидроксифосфорилоксигрупп. Изобретение обеспечивает селективное и Са2+-зависимое связывание CRP с материалом колонки и увеличивает связывающую способность заявляемых лигандов. Применение раствора цитрата подходит для экстракорпорального удаления CRP из крови или плазмы крови для реанимации после остановки сердца, а также для профилактики и/или лечения сердечно-сосудистых заболеваний. 10 з.п. ф-лы, 3 ил., 3 пр.
Реферат
Настоящее изобретение относится к применению раствора цитрата для удаления С-реактивного белка (CRP) с помощью аффинной хроматографии из биологических жидкостей, где удаление CRP с помощью аффинной хроматографии осуществляют путем (Са2+-зависимого) связывания CRP с материалом колонки, функционализированным с помощью групп ω-фосфонооксиалкиламмония и/или с помощью ω-аммонийалкоксигидроксифосфорилоксигрупп.
Уровень техники
По данным Всемирной организации здравоохранения (ВОЗ) около 17 миллионов людей умерли от сердечно-сосудистых заболеваний в 2008 году. Таким образом, сердечно-сосудистые заболевания являются наиболее частой причиной смерти среди неинфекционных заболеваний и несут ответственность за приблизительно одну треть всех случаев смерти во всем мире. По оценкам, это число возрастет до примерно 23 млн. человек в год к 2030 году.
Таким образом, сердечно-сосудистые заболевания являются не только основной причиной смерти во всем мире, но также вызывают огромные расходы на медицинское обслуживание для национальных систем здравоохранения и фондов медицинского страхования. Два из наиболее распространенных и наиболее пагубных проявлений сердечно-сосудистых заболеваний представляют собой возникновение атеросклероза и тромбоза, которые, в свою очередь, отвечают, среди прочего, за сердечные приступы и инсульты.
В последние годы были достигнуты значительные успехи в лечении сердечно-сосудистых заболеваний. Такой прогресс стал возможен не только благодаря новым знаниям относительно механизмов индукции заболевания, но и благодаря ранней идентификации пациентов риска. На самом деле, идентификация рисков заболеваний и их своевременное лечение являются важными характеристиками современной медицинской практики. За последние 25 лет было идентифицировано множество факторов и клинических параметров, которые коррелируют либо с текущим состоянием заболевания, или с вероятностью сердечно-сосудистых заболеваний в будущем. Такие факторы риска могут представлять собой измеряемые биохимические или физиологические параметры, такие как, уровень холестерина в сыворотке, уровень HDL, LDL и фибриногена, а также поведенческие модели, такие как избыточный вес и курение. В тех случаях, когда фактор риска является не только признаком заболевания или его развития, но фактически причинно вовлечен в его развитии, терапевтическое влияние на этот фактор риска может повлиять на течение заболевания или уменьшить риск его развития.
С-реактивный белок (CRP) в качестве белка острой фазы является частью врожденной иммунной системы и формируется в печени в процессе воспалительных реакций и высвобождается в кровь. Образование CRP в основном индуцируется цитокинами, которые экспрессируются в контексте острой или хронической воспалительной реакции. Самым мощным стимулом для формирования CRP является интерлейкин-6 (IL-6). Таким образом, уровни CRP, а также IL-6 в крови являются индикаторами локального или системного воспалительного ответа. Предполагается, что хроническое воспаление является одним из основных и вспомогательных патологических проявлений сердечно-сосудистых заболеваний. Все чаще считается, что CRP является не только фактором прогноза для сердечно-сосудистого заболевания, но также причинно вовлечен в его развитие или может влиять на его ход.
Yeh (Clin Cardiol., 2005, 28, 408-412) продемонстрировали, что уровень CRP может быть использован для прогнозирования риска сердечно-сосудистых заболеваний, CRP также является индикатором воспалительных реакций, и что воспаление стимулирует все стадии атеросклероза. Zoccali et al., (Semin. Nephrol. 2005, 25, 358-362), продемонстрировали, что уровень CRP является фактором прогноза риска сердечно-сосудистой смертности у пациентов с почечной недостаточностью в терминальной стадии. Согласно Nurmohamed et al., (Neth. J. Med. 2005, 63, 376-381), уровень CRP является фактором прогноза сердечно-сосудистого риска смертности у пациентов, находящихся на гемодиализе.
Sola et al. (J. Card. Fail. 2005, 11, 607-612) продемонстрировали, что терапия статинами может быть использована для уменьшения количества CRP и, тем самым, для снижения смертности и заболеваемости, вызванных сердечно-сосудистыми заболеваниями. Однако эта форма терапии не приводит к существенному снижению высокого уровня С-реактивного белка (до 1000-раз выше нормальных значений) в результате инфаркта миокарда или высоких уровней CRP в крови пациентов на диализе.
Нормальное значение для CRP в крови человека варьируется от человека к человеку, но в среднем составляет приблизительно 0,8 мг CRP на литр крови, но может доходить в случае острых или хронических воспалительных реакций (например, бактериальные инфекции, атеросклероз, после сердечного приступа) до уровня, по существу, выше 100 мг CRP на литр крови. Поскольку период полужизни CRP в крови (прибл. 19 часов) является постоянным и, таким образом, не зависит от состояния здоровья пациента, скорость синтеза CRP индивидуально отвечает за регуляцию уровня CRP в крови (Pepys & Hirschfield, J. Clin. Invest. 2003, 11, 1805-1812). Таким образом, значительно увеличивающийся синтез CRP при острых патологических состояниях предъявляет особые требования в отношении терапевтических подходов для удаления CRP пациентов (пациенты риска или экстренные пациенты), поскольку значительное количество CRP должно быть удалено для снижения уровня CRP до стандартного уровня в крови.
Следовательно, нарастает интерес к терапевтическим процедурам для снижения уровня CRP в крови пациентов. Благодаря клинической значимость CRP имеется также интерес к эффективным методам очистки CRP, для того, чтобы использовать очищенный CRP в дальнейших экспериментах, например, для дальнейшего исследования его молекулярной функции.
В WO 2004/076486 раскрыт способ ингибирования иммунологических, воспалительных и/или патофизиологических реакций путем введения CRP-связывающих молекул пациентам с повышенным уровнем CRP. Однако не раскрыта экстракорпоральная обработка биологических жидкостей для удаления CRP из указанных биологических жидкостей.
В WO 90/12632 раскрыт способ и устройство для экстракорпоральной обработки биологических жидкостей с целью удаления CRP, а также антитела к фосфохолину из этих биологических жидкостей для лечения злокачественного новообразования. Фосфохолин-содержащая матрица, используемая для этой цели, может состоять, например, из диоксида кремния, сефарозы, акриловых гранул или агарозы, где как CRP, так и антитела к фосфохолину связаны посредством содержащегося фосфохолина.
В US 2007/225226 А1 раскрыты специфические пептиды, которые связываются с CRP и, следовательно, могут быть использованы в качестве материала функциональной колонки в аферезе CRP. Это связывание происходит независимо от кальция. Кроме того, описаны некоторые экстракорпоральные устройства для очистки крови, использующие этот материал колонки для афереза CRP, включая системы для удаления эндотоксинов с использованием цитрата в качестве антикоагулянта. CRP представляет собой пентамер, где каждая из его субъединиц ассоциирована с двумя ионами Са2+, который связывается с лигандами, используемыми в данном изобретении. Так как цитрат связывает ионы Са2+ с высокой аффинностью, то до сих пор предполагали, что при использовании Са2+-зависимых лигандов цитрат оказывает негативное влияние на способность колонок связывать CRP. Однако авторы настоящей заявки продемонстрировали, что способность выше для используемых лигандов. CRP представляет собой опсонин и может активировать систему комплемента через C1q в связанной форме. Однако неожиданно было продемонстрировано, что цитрат предотвращает активацию комплемента, что еще больше увеличивает способность, так что цитрат дополнительно увеличивает способность используемых лигандов. Этот эффект, проявляющийся с Са2+-зависимыми лигандами, также оказался полностью неожиданным в свете US 2007/225226 A1.
В WO 2007/076844 раскрыт способ экстракорпорального удаления CRP из плазмы крови посредством афереза для уменьшения риска для пациента (вызванного повышенным уровнем CRP в крови). Согласно изобретению используют колонку, содержащую матрицу, с которой связываются производные фосфохолина для связывания CRP и удаления его из плазмы, таким образом, подвергая лечению и/или предотвращая аутоиммунные заболевания, сердечно-сосудистые заболевания, диабет и почечную недостаточность.
Slagman et al. (Blood Purif. 2011, 31, 9) продемонстрировали на модели свиньи успешное снижение уровня CRP в крови путем экстракорпорального афереза после сердечного приступа.
Проблема, которая возникает при экстракорпоральном использовании крови и плазмы крови, будь то аналитические или препаративные применения, а также диализ или аферез, является началом свертывания крови, которое препятствует или самому использованию, или делает его невозможным, но также закупоривает, а также загрязняет используемые устройства. По этой причине антикоагулирующие агенты (так называемые антикоагулянты) непосредственно добавляют в кровь или в плазму крови после удаления из организма человека или животного.
Одна из возможностей для ингибирования коагуляции крови представляет собой введение Ca2+-хелаторов, таких как ЭДТА (этилендиаминтетрауксусная кислота), щавелевая кислота и цитраты. Кальций необходим в качестве кофактора ряда факторов коагуляции в процессе свертывания крови. Са2+-хелаторы используются для удаления кальция из крови или плазмы крови, ингибируя таким образом коагуляцию. Однако это является серьезной проблемой для аффинных хроматографических методов для удаления CRP с помощью фосфохолина или фосфоэтаноламина или производных фосфохолина или фосфоэтаноламина. Поскольку для связывания CRP с фосфохолином или с его производными требуется Са2+ (Black et al., Journal of Biological Chemistry, 2004, 279: 48487, Thompson et al., Structure 1999, 7 (2), 169 -177), то единодушное мнение предшествующего уровня техники состояло в том, что следует абсолютно избегать введения Ca2+-хелаторов при связывании CRP с фосфохолином (см., например, WO 90/12632). Таким образом, согласно предшествующему уровню техники, использование цитрат-содержащих связывающих буферов во время аффинно-хроматографического связывания CRP с фосфохолином совершенно неприемлемо. Однако цитрат-содержащие растворы (сходные с введением ЭДТА) были пригодны в качестве элюирующих буферов, то есть, для удаления связанного CRP из фосфохолина.
Один из возможных вариантов для Са2+-независимой антикоагуляции заключаются во введении гепарина. Гепарин является эндогенным веществом, которое вырабатывается тучными клетками и оказывает ингибирующее действие на каскад коагуляции. Путем связывания гепарина с антитромбином II, ингибитор протеазы, циркулирующий в крови, который может инактивировать активированные факторы коагуляции крови, такие как тромбин и фактор Ха, инициирует конформационное изменение антитромбина II. Это ускоряет антитромбин II-опосредованную инактивацию факторов коагуляции крови в 2000 раз. Свертывание крови прекращается. Соответственно, в методах удаления CRP с помощью аффинной хроматографии из крови или плазмы крови с помощью фосфохолина и производных фосфохолина или фосфоэтаноламина и производных фосфоэтаноламина, исключительно гепарин до сих пор используется в качестве антикоагулянта.
Однако это имеет некоторые недостатки, так как гепарин, особенно в случае нефракционированного гепарина, может привести к иммунной реакции, гепарин-индуцированной тромбоцитопении (HIT) в дополнение к кровотечению. Таким образом, гепарин индуцирует венозные и артериальные тромбозы. У пациентов, перенесших инсульт, для которых использование CRP афереза также возможно, риск HIT при приеме нефракционированного гепарина составляет приблизительно 3%. Кроме того, гепарин не одобрен для использования с центрифужными сепараторами клеток, которые часто используются для разделения крови на клеточные компоненты и плазму крови.
Целью настоящего изобретения является создание антикоагулянта для удаления CRP с помощью аффинной хроматографии, что позволяет избежать проблем настоящего уровня техники, связанных с гепарином, и дополнительно не ухудшает Са2+-зависимое связывание CRP с фосфохолином или фосфоэтаноламином и их производными.
Эта цель достигается с помощью раскрытия независимых пунктов формулы изобретения. Другие предпочтительные воплощения очевидны из описания, примеров и зависимых пунктов формулы изобретения.
Неожиданно смогли установить, что применение раствора цитрата для удаления CRP с помощью аффинной хроматографии из биологических жидкостей с использованием материала колонки, функционализированного с помощью групп ω-фосфонооксиалкиламмония и/или с помощью ω-аммонийалкоксигидроксифосфорилоксигрупп не только неожиданно достигает эффективного удаления CRP из биологических жидкостей, но также решает проблемы предшествующего уровня техники.
Описание изобретения
Настоящее изобретение относится к применению раствора цитрата для удаления CRP с помощью аффинной хроматографии из биологических жидкостей с использованием материала колонки, функционализированного с помощью групп ω-фосфонооксиалкиламмония и/или с помощью ω-аммонийалкоксигидроксифосфорилоксигрупп.
Термин «CRP», используемый в настоящем документе, эквивалентен «С-реактивному белку». В данном документе он предпочтительно относится к человеческому С-реактивному белку.
Термин «удаление CRP с помощью аффинной хроматографии», используемый в настоящем документе, означает, что удаление CRP происходит через специфическое связывание между CRP и компонентами средств для удаления CRP. В этом контексте, это также можно отнести к «удалению CRP с помощью аффинной хроматографии» или «селективному удалению CRP». Такое специфическое связывание между CRP и функционализированным соответствующим образом материалом колонки основано на структурных свойствах белка CRP и может включать в себя, например, характерное связывание CRP с фосфохолином или связывание CRP с антителами, направленными против эпитопа CRP. Селективное или молекулярно-специфическое удаление CRP включает в себя, что CRP связывается с более высокой аффинностью с функционализированным материалом колонки, чем с другими компонентами биологических жидкостей. Таким образом, термин «селективный» в отношении удаления CRP, как используется в настоящем документе, означает, что отношение удаленного CRP к количеству CRP, содержащемуся в биологической жидкости, по меньшей мере, в три раза выше, чем соответствующее отношение других удаленных веществ к количеству вещества, содержащегося в биологической жидкости. Однако, термин «селективный» в отношении удаления CRP, как используется в настоящем документе, не означает, что удаляется только CRP. Здесь специалисту в данной области техники очевидно, что с использованием такого удаления CRP до некоторой степени с помощью аффинной хроматографии, другие вещества (непреднамеренно) могут неизбежно связываться с материалом колонки и, таким образом, также удаляются в определенной степени. Если существует структурное соответствие со структурой CRP, ответственной за специфическое связывание с группами ω-фосфонооксиалкиламмония, и/или с ω-аммонийалкоксигидроксифосфорилоксигруппами, как например, в белке, то этот структурно сходный белок также будет связываться в определенной степени. Примером могут служить антитела, направленные против фосфохолина и, следовательно, они также смогут связываться с материалом колонки, который был функционализирован с помощью фосфохолина. Другой возможностью является то, что невозможно полностью избежать неспецифического связывания компонентов биологической жидкости, например, с материалами субстрата матрицы.
Как уже упоминалось, связывание CRP с фосфохолином или с его производными или с фосфоэтаноламином или с его производными зависит от наличия Ca2+ и, таким образом, также связывание CRP с группами ω-фосфонооксиалкиламмония и/или с ω-аммонийалкоксигидроксифосфорилоксигруппами, которые были иммобилизованы внутри или на материале колонки, также зависит от присутствия Ca2+.
Таким образом, настоящее изобретение также относится к применению раствора цитрата для удаления CRP с помощью аффинной хроматографии из биологических жидкостей, где удаление CRP с помощью аффинной хроматографии осуществляют путем (Са2+-зависимого) связывания CRP с материалом колонки, функционализированным с помощью групп ω-фосфонооксиалкиламмония и/или с помощью ω-аммонийалкоксигидроксифосфорилоксигрупп.
Конечно, применение в соответствии с изобретением раствора цитрата для удаления CRP с помощью аффинной хроматографии из биологических жидкостей, где удаление CRP с помощью аффинной хроматографии осуществляют путем (Са2+-зависимого) связывания CRP с материалом колонки, функционализированным с помощью групп ω-фосфонооксиалкиламмония и/или с помощью ω-аммонийалкоксигидроксифосфорилоксигрупп, означает, что перед удалением CRP раствор цитрата смешивают с биологической жидкостью, из которой CRP должен быть удален. Раствор цитрата, таким образом, присутствует во время целевого связывания CRP с группами ω-фосфонооксиалкиламмония и/или с ω-аммонийалкоксигидроксифосфорилоксигруппами материала колонки. Следовательно, можно также утверждать на основе технических условий аффинной хроматографии, что раствор цитрата используют в качестве «связывающего буфера».
Однако это не означает, что раствор цитрата используют в качестве «элюирующего раствора» (или в качестве «элюирующего буфера») и, таким образом, используют для удаления CRP из материала колонки, функционализированного с помощью групп ω-фосфонооксиалкиламмония и/или ω-аммонийалкоксигидроксифосфорилоксигрупп, т.е. для регенерации материала колонки.
Термин «связывающий буфер» (также называемый «связывающим раствором»), при использовании в настоящем документе, в случае метода аффинной хроматографии для удаления вещества (в данном документе для селективного и Са2+-зависимого удаления CRP) из образца (здесь биологические жидкости, такие как кровь или плазма крови), относится к раствору, который добавляют к образцу, а затем наносят вместе с образцом на материал колонки (здесь материал колонки, функционализированный с помощью групп ω-фосфонооксиалкиламмония и/или ω-аммонийалкоксигидроксифосфорилоксигрупп) для удаления вещества. Связывающий буфер должен обеспечивать адекватные условия для специфического связывания удаляемого вещества с материалом колонки.
Термин «элюирующий буфер» (также называемый «элюирующий раствор»), при использовании в настоящем документе, в случае метода аффинной хроматографии для удаления вещества (здесь селективное и Са2+-зависимое удаление CRP) из образца (здесь биологические жидкости, такие как кровь или плазма крови), относится к раствору, который применяется после нанесения образца на материал колонки и после осуществления специфического связывания удаляемого вещества с материалом колонки для того, чтобы разорвать специфическое связывание снова и, таким образом, открепить удаляемое вещество от материала колонки (или элюировать). Следовательно, в отличие от связывающего буфера, в материале колонки должны быть созданы условия с помощью элюирующего буфера, которые не позволяют связывание удаляемого вещества, а наоборот предотвращают его.
Таким образом, настоящее изобретение также относится к применению раствора цитрата для удаления CRP с помощью аффинной хроматографии из биологических жидкостей, где удаление CRP с помощью аффинной хроматографии осуществляют путем (Са2+-зависимого) связывания CRP с материалом колонки, функционализированным с помощью групп ω-фосфонооксиалкиламмония, и/или с помощью ω-аммонийалкоксигидроксифосфорилоксигрупп, где раствор цитрата служит в качестве связывающего буфера (или связывающего раствора) для удаления CRP с помощью аффинной хроматографии из биологических жидкостей.
Термин «биологическая жидкость», используемый в данном документе, относится к водным растворам, которые встречаются у млекопитающих и человека, предпочтительно, такие как спинно-мозговая жидкость, перитонеальная жидкость, плевральная жидкость, асцитическая жидкость, кровь, плазмы крови, экстракты печень и межклеточная жидкость. Настоящее изобретение, конечно, относится к биологическим жидкостям, содержащим CRP.
Поэтому настоящее изобретение также относится к применению раствора цитрата для удаления CRP с помощью аффинной хроматографии из биологических жидкостей с помощью материала колонки, функционализированного с помощью групп ω-фосфонооксиалкиламмония и/или ω-аммонийалкоксигидроксифосфорилоксигрупп, где биологические жидкости представляют собой кровь или плазму крови.
Другими словами, настоящее изобретение также относится к применению раствора цитрата для удаления CRP с помощью аффинной хроматографии из крови и/или плазмы крови с помощью материала колонки, функционализированного с помощью групп ω-фосфонооксиалкиламмония и/или ω-аммонийалкоксигидроксифосфорилоксигрупп.
Растворы цитрата
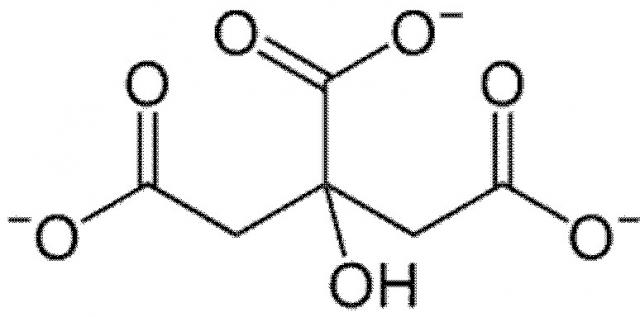
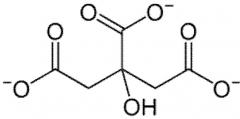
Термин «цитрат», используемый в настоящем документе, относится к цитрат-аниону или к соли лимонной кислоты или, другими словами, к органическому трикарбоксилату следующей химической формулы:
Цитрат может существовать в различных формах (или соединениях), как например, в виде лимонной кислоты (в однократно или трехкратно протонированной форме), в виде соли лимонной кислоты в комбинации с другими (кроме Н+) неорганическими катионами (как например, соль металла вместе с катионами металлов или как соли аммония вместе с ионами аммония), но также и в виде неполного сложного эфира лимонной кислоты. В этом контексте, термин «соединение цитрата» также используется в настоящем документе.
Если соль лимонной кислоты, т.е. цитрат-анион, образует комплекс с неорганическим катионом, то термин «соль цитрата» также упоминается в настоящем документе как специфическая форма соединения цитрата.
При использовании в настоящем документе, термин «раствор цитрата», таким образом, включает водные растворы, содержащие, по меньшей мере, одно соединение цитрата. Более подробная информация о составе раствора цитрата приведена ниже.
Однако согласно изобретению, предпочтительно, если концентрация цитрата в цитратном растворе составляет не менее чем 1 мМ, предпочтительно не менее чем 1,1 мМ, предпочтительно не менее чем 1,2 мМ, более предпочтительно не менее чем 1,3 мМ, еще более предпочтительно, не менее чем 1,4 мМ и наиболее предпочтительно не менее чем 1,5 мМ.
Кроме того, согласно настоящему изобретению, является предпочтительным, если цитратное соединение(соединения) является существенным компонентом раствора цитрата согласно изобретению. Здесь, «существенный компонент» означает, что сумма молярных концентраций всех цитратных соединения в растворе цитрата по сравнению с другими соединениями в пределах раствора цитрата, но за исключением воды, является одной из трех самых высоких концентраций, присутствующих в цитратном растворе.
Настоящее изобретение, таким образом, относится к применению раствора цитрата для удаления CRP с помощью аффинной хроматографии из биологических жидкостей с помощью материала колонки функционализированного с помощью групп ω-фосфонооксиалкиламмония и/или ω-аммонийалкоксигидроксифосфорилоксигрупп, где раствор цитрата содержит по меньшей мере одно из цитратных соединений из группы, содержащей или состоящей из лимонной кислоты, дигидроцитрата натрия, гидроцитрата натрия, цитрата натрия, дигидрата цитрата натрия, дигидроцитрата калия, гидроцитрата калия, цитрата калия, дигидроцитрата лития, гидроцитрата лития, цитрата лития, дигидроцитрата аммония, гидроцитрата аммония, цитрата аммония, цитрата кальция (цитрата кальция), цитрата магния (цитрата магния) и/или неполных сложных эфиров лимонной кислоты.
Согласно настоящему изобретению, также возможно, чтобы раствор цитрата содержал смесь нескольких соединений цитрата, перечисленных выше.
Термин «цитратное соединение», используемый в настоящем документе, включает в себя как лимонную кислоту, так и ее соли.
Если общий термин «цитрат натрия» используются в данной заявке, то этот термин включает в себя различные протонированные формы цитрата натрия, т.е. непротонированную (цитрат натрия), однократно протонированную (гидроцитрат натрия) или дважды протонированную форму (дигидроцитрат натрия).
Если в настоящей заявке используется общий термин «цитрат калия», то этот термин включает в себя различные протонированные формы цитрата калия, т.е. непротонированную форму (цитрат калия), однократно протонированную (гидроцитрат калия) или дважды протонированную форму (дигидроцитрат калия).
Если в настоящей заявке используется общий термин «цитрат лития», то этот термин включает в себя различные протонированные формы цитрата лития, т.е. непротонированную форму (цитрат лития), однократно протонированную (гидроцитрат лития) или дважды протонированную форму (дигидроцитрат лития).
Если в настоящей заявке используется общий термин «цитрат аммония», то этот термин включает в себя различные протонированные формы цитрата аммония, т.е. непротонированную форму (цитрат аммония), однократно протонированную (гидроцитрат аммония) или дважды протонированную форму (дигидроцитрат аммония).
Термин «неполный сложный эфир лимонной кислоты», используемый в настоящем документе, относится к сложному эфиру лимонной кислоты, однако, не все три карбоксильные групп (т.е. -СОО-) цитрата этерифицированы, (т.е. -COOR, где R представляет собой органический остаток), но не более чем две из трех карбоксильных групп цитрата, но предпочтительно не более чем одна из трех карбоксильных групп цитрата этерифицирована. В дополнении к одной или двум сложноэфирным группам, неполный эфир лимонной кислоты также содержит один или два физиологически приемлемых неорганических катиона (например, катионы металлов, такие как Na+, K+), которые образуют комплекс с одной или двумя неэтерифицированными карбоксильными группами цитрата.
Таким образом, предпочтительное воплощение настоящего изобретения относится к применению раствора цитрата для удаления CRP с помощью аффинной хроматографии из биологических жидкостей с помощью материала колонки, функционализированного с помощью групп ω-фосфонооксиалкиламмония и/или ω-аммонийалкоксигидроксифосфорилоксигрупп, где раствор цитрата содержит, по меньшей мере, одно из цитратных соединений из группы, содержащей или состоящей из лимонной кислоты, дигидроцитрата натрия, гидроцитрата натрия, цитрата натрия, дигидрата цитрата натрия, дигидроцитрата калия, гидроцитрата калия, цитрата калия, дигидроцитрата лития, гидроцитрата лития, цитрата лития, дигидроцитрата аммония, гидроцитрата аммония, цитрата аммония, цитрата кальция (цитрата кальция), цитрата магния (цитрата магния) и/или неполных сложных эфиров лимонной кислоты, где, по меньшей мере, одно цитратное соединение выбирают из лимонной кислоты и солей цитрата с катионами одновалентных металлов.
Согласно изобретению предпочтительно, если раствор цитрата не содержит цитрата железа (II). Более предпочтительно, раствор цитрата не содержит цитрата железа (III). Кроме того, предпочтительно, согласно изобретению, если раствор цитрата не содержит цитрата меди (II) (трикупрум дицитрат) и не содержит цитрата алюминия.
В других предпочтительных воплощениях настоящего изобретения, раствор цитрата не содержит цитрата кальция (также известного как трикальций дицитрат).
В другом предпочтительном воплощении настоящего изобретения, раствор цитрата не содержит цитрата магния (также известного как тримагний дицитрат) или цитрата магния в концентрации не более 1 мМ.
В другом предпочтительном воплощении настоящего изобретения, раствор цитрата не содержит цитрат кальция и цитрат магния или цитрат магния в концентрации не более 1 мМ.
Когда в настоящей заявке упоминается, что раствор не содержит определенное вещество, то это означает, что данный раствор не содержит вещество совсем или, по меньшей мере, не содержит более чем 0,01% по массе этого вещества, чтобы учесть возможные неизбежные примеси.
Поэтому особенно предпочтительное воплощение настоящего изобретения относится к применению раствора цитрата для удаления CRP с помощью аффинной хроматографии из биологических жидкостей с помощью материала колонки, функционализированного с помощью групп ω-фосфонооксиалкиламмония и/или ω-аммонийалкоксигидроксифосфорилоксигрупп, где раствор цитрата содержит, по меньшей мере, одно из цитратных соединений из группы, содержащей или состоящей из лимонной кислоты, дигидроцитрата натрия, гидроцитрата натрия, цитрата натрия, дигидрата цитрата натрия, дигидроцитрата калия, гидроцитрата калия, цитрата калия, дигидроцитрата лития, гидроцитрата лития, и/или цитрата лития. Однако еще более предпочтительными являются лимонная кислота, дигидроцитрат натрия, гидроцитрат натрия, цитрат натрия, дигидрат цитрата натрия, дигидроцитрат калия, гидроцитрат калия и/или цитрат калия. Однако наиболее предпочтительными являются лимонная кислота, дигидроцитрат натрия, гидроцитрат натрия, цитрат натрия и дигидрат цитрата натрия.
Кроме того, согласно изобретению предпочтительно, если раствор цитрата не содержит, помимо указанного цитратного соединения или указанных цитратных соединений цитрата, никаких дополнительных веществ, то есть дополнительных веществ не на основе цитрата, которые хелатируют Са2+ (так называемые Са2+-хелаторы).
Таким образом, предпочтительный вариант осуществления настоящего изобретения относится к применению раствора цитрата для удаления CRP с помощью аффинной хроматографии из биологических жидкостей с помощью материала колонки, функционализированного с помощью групп ω-фосфонооксиалкиламмония и/или ω-аммонийалкоксигидроксифосфорилоксигрупп, где раствор цитрата не содержит Ca2+-хелаторов, которые по химическим свойствам не относятся к цитратным соединениям. Возможные примеры Са2+-хелаторов, которые по своим химическим свойствам не относятся к соединениям цитрата и, таким образом, не являются предпочтительными, представляют собой ЭДТА (этилендиамин тетрауксусная кислота), EGTA (этиленгликоль-бис(аминоэтиловый эфир)-Ν,Ν,Ν',Ν'-этилендиаминтетрауксусная кислота), ВАРТА (1,2-бис(О-аминофенокси)этан-N,N,N',N'-этилендиаминтетрауксусная кислоту) и оксалаты.
Таким образом, предпочтительное воплощение настоящего изобретения относится к применению раствора цитрата для удаления CRP с помощью аффинной хроматографии из биологических жидкостей с помощью материала колонки, функционализированного с помощью групп ω-фосфонооксиалкиламмония и/или ω-аммонийалкоксигидроксифосфорилоксигрупп, где раствор цитрата содержит, по меньшей мере, одно из цитратных соединений из группы, содержащей или состоящей из лимонной кислоты, дигидроцитрата натрия, гидроцитрата натрия, цитрата натрия, дигидрата цитрата натрия, дигидроцитрата калия, гидроцитрата калия, цитрата калия, дигидроцитрата лития, гидроцитрата лития, цитрата лития, дигидроцитрата аммония, гидроцитрат аммония, цитрата аммония, цитрата кальция (цитрат кальция), цитрата магния (цитрат магния) и/или неполных сложных эфиров лимонной кислоты, где раствор цитрата не содержит дополнительных Ca2+-хелаторов помимо цитратного соединения(й).
Таким образом, согласно изобретению, еще более предпочтительно, если раствор цитрата не содержит EDTA (этилендиаминтетрауксусная кислота), EGTA (этиленгликоль-бис (аминоэтиловый эфир)-N,N,N',N'-этилендиаминтетрауксусной кислоты), ВАРТА (1,2-аминофенокси)этан-N,N,N',N'-этилендиаминтетрауксусная кислота) или оксалат.
В дополнение к цитратным соединениям, перечисленным выше, раствор цитрата может содержать дополнительные вещества, которые, однако, не имеют каких-либо хелатирующих свойств. Например, дополнительные вещества возможны в качестве добавок, способствующих тому, чтобы осмоляльность раствора цитрата была равна приблизительно осмоляльности биологической жидкости, то есть, например, крови или плазмы крови. Такие вещества для регуляции осмоляльности включают неорганические соли, такие как, например, хлорид натрия, хлорид калия, а также сахара, такие как глюкоза, декстроза (D-глюкоза), фруктоза и сахароза или гепарин. Термины декстроза и Д-глюкоза эквивалентны, и, следовательно, могут быть использованы как синонимы в настоящем документе.
Кроме того, другие вещества возможны в качестве добавок, которые служат для регуляции значения рН раствора цитрата до заданного значения, например, значения рН биологической жидкости (как например крови или плазмы крови). Так например, возможно, что дополнительное вещество, содержащееся вместе с соединением цитрата, образует буферную систему, с помощью которой значение рН раствора цитрата можно регулировать, и небольшие колебания значения рН могут быть компенсированы. Если раствор цитрата содержит буферную систему цитратного соединения и не-цитратного буферного вещества, то также используется термин «цитрат-содержащий буфер». Возможные примеры добавленных буферных веществ, которые не являются цитратными соединениями (т.е. не нецитратные буферные вещества), включают гидрофосфат натрия, дигидрофосфат натрия, гидрофосфат калия, дигидрофосфат калия, лактат и ацетат.
Возможные примеры буферных систем из цитратного соединения и не-цитратного буферного вещества, т.е. раствор цитрата согласно настоящему изобретению в виде цитрат-содержащего буфера, представляет собой комбинацию лимонной кислоты с гидрофосфатом натрия, дигидрофосфатом натрия, гидрофосфатом калия или дигидрофосфатом калия. Однако комбинация лимонной кислоты с гидрофосфатом натрия является особенно предпочтительной.
Однако если растворы цитрата содержат два различных цитратных соединения, которые вместе также образуют буферную систему, то также используется термин «цитратный буфер».
Возможные примеры буферных систем из двух различных цитратных соединений, т.е. раствор цитрата согласно настоящему изобретению в виде цитратного буфера, представляет собой комбинацию лимонной кислоты с цитратом натрия, гидроцитратом натрия, цитратом натрия, дигидроцитратом калия, гидроцитратом калия или цитратом калия;
комбинацию дигидроцитрата натрия с гидроцитратом натрия, цитратом натрия, гидроцитратом калия или цитратом калия;
комбинацию дигидроцитрата калия с гидроцитратом натрия, цитратом натрия, гидроцитратом калия или цитратом калия;
комбинацию гидроцитрата натрия с цитратом натрия или цитратом калия; комбинацию гидроцитрата калия с цитратом натрия или цитратом калия.
Однако комбинация лимонной кислоты с цитратом натрия в качестве раствора цитрата в форме цитратного буфера является особенно предпочтительной.
Конечно, также возможно добавление дополнительных веществ в раствор цитрата, содержащий два различных цитратных соединения (т.е. цитратный буфер) для регуляции осмоляльности.
Согласно изобретению, предпочтительно, если раствор цитрата состоит только из воды, одного или нескольких из указанных выше цитратных соединений, а также, необязательно, одного или нескольких из указанных выше соединений для регуляции осмоляльности (также называемых как «осмолитики») и/или, необязательно, одного или нескольких из указанных выше не-цитратных буферных веществ.
Еще одно воплощение настоящего изобретения, таким образом, относится к применению раствора цитрата для удаления CRP с помощью аффинной хроматографии из биологических жидкостей с помощью материала колонки, функционализированного с помощью групп ω-фосфонооксиалкиламмония и/или ω-аммонийалкоксигидроксифосфорилоксигрупп, где раствор цитрата состоит из воды и по меньшей мере одного из цитратных соединений из группы, содержащей или состоящей из лимонной кислоты, дигидроцитрата натрия, гидроцитрата натрия, цитрата натрия, дигидрата цитрата натрия, цитрата калия, гидроцитрата натрия, цитрата калия, дигидроцитрата лития, гидроцитрата лития, цитрата лития, дигидроцитрата аммония, гидроцитрата аммония, цитра