Способ тестирования эффективности рострегулирующего воздействия на растения
Иллюстрации
Показать всеИзобретение относится к сельскому хозяйству, а именно к способам тестирования эффективности регуляторов роста растений с помощью оптических характеристик, поскольку количество метаболитов, образующихся в процессе прорастания семян, характеризует степень их прорастания. Для этого водные растворы культивирования опытных и контрольных семян облучают излучением линии 514,53 нм аргонового лазера и регистрируют спектры комбинационного рассеяния света (КРС), состоящие из неизменяющегося спектра КРС воды и фотолюминесценции (ФЛ) метаболитов, зависящего от концентрации метаболитов в водном растворе культивирования. Площадь под кривой спектра ФЛ пропорциональна концентрации вещества в растворе, что позволяет определять увеличение или уменьшение концентрации метаболитов в опытном растворе по сравнению с контролем. Изобретение обеспечивает быстрый и экономичный первичный скрининг выбора стимуляторов роста растений. 1 табл., 2 пр.
Реферат
Изобретение относится к способам исследования материалов путем определения их химических или физических свойств, а именно к способам тестирования эффективности рострегулирующего воздействия на растения с помощью оптических средств.
Испытание новых регуляторов роста растений или физических факторов рострегулирующего воздействия обычно проводят при помощи морфологических тестов на различных стадиях развития растений, что является длительным и трудоемким процессом (Методические рекомендации по проведению лабораторных испытаний синтетических регуляторов роста растений. Под ред. А.А. Шаповалова. Черкассы: филиал НИИТЭХим, 1990. 35 с.; Методические рекомендации по проведению лабораторного скрининга синтетических регуляторов роста растений. Под ред. С.С. Кукаленко и А.А. Шаповалова. Черкассы: филиал НИИТЭХим, 1985. 29 с).
Тестирование эффективности стимулирования роста растений при помощи спектральных методов позволит существенно сократить временные и трудозатраты.
Известен способ тестирования активности регуляторов роста растений с использованием спектрофотометрического метода (Апашева Л.М., Мурза Л.И., Комиссаров Г.Г. Ранние стадии взаимодействия регуляторов роста и семени. // Тезисы II-го съезда Всесоюзного общества физиологов растений, Москва, 1992, с. 51 - прототип). Семена однодольных и двудольныхрастений, разделенные на контрольные и опытные, выдерживали в течение суток - опытные в растворе регулятора роста анфена (калиевая или натриевая соль 4-гидрокси-3,5-дитрет.бутил-бензиламиномалоновой кислоты - Буджиашвили Д.М., Апашева Л.М. Использование антиоксидантов для повышения ценных биолого-хозяйственных показателей сельскохозяйственных культур. // Тезисы 3-й Всесоюзной конференции «Биоантиоксидант», Москва, 1989, том I, с. 183), контрольные в дистиллированной воде, после чего семена промывали водой и культивировали в свежей дистиллированной воде в течение суток. Отбирали пробы полученных растворов (опытных и контрольных) и регистрировали спектры поглощения в УФ области в диапазоне 250-370 нм. При увлажнении семян происходит их пробуждение, что сопровождается началом синтеза метаболитов и выходом их в водную среду культивирования. Измерение оптической плотности растворов опытной и контрольной групп семян показало увеличение концентрации метаболитов в растворах опытной группы семян.
Недостатком способа-прототипа является недостаточная чувствительность.
Задачей предлагаемого изобретения является разработка быстрого и высокочувствительного способа тестирования эффективности рострегулирующего воздействия на растения при помощи метода спектроскопии комбинационного рассеяния света.
Решение поставленной задачи достигается предлагаемым способом тестирования эффективности рострегулирующего воздействия на растения путем измерения оптических характеристик водных растворов культивирования опытных и контрольных семян, содержащих метаболиты, образующиеся в процессе прорастания семян, в котором в качестве оптических характеристик используют спектры комбинационного рассеяния света (КРС) и фотолюминесценции (ФЛ), для чего водные растворы культивирования опытных и контрольных семян облучают излучением аргонового лазера при длине волны 514,53 нм и регистрируют спектры КРС, состоящие из неизменяющегося спектра КРС воды и спектра ФЛ метаболитов, зависящего от концентрации метаболитов в водном растворе культивирования, при этом площадь под кривой спектра ФЛ пропорциональна концентрации вещества в растворе, что позволяет количественно определять увеличение или уменьшение концентрации метаболитов в растворах опытной группы по сравнению с контролем.
Метод спектроскопии КРС относится к высокоизбирательным и чувствительным аналитическим методам.
Спектры КРС регистрировались на спектрометре U1000. Для возбуждения спектров КРС использовалась линия 514,53 нм излучения аргонового лазера. Наблюдаемые спектры КРС состоят из спектра КРС молекул воды и спектра ФЛ веществ (метаболитов), которые переходят в воду из семян при их прорастании. Линии КРС чистой воды (1640 см-1 и 2800-3800 см-1) не изменяются со временем, и по интенсивности последней производилась нормировка регистрируемых спектров, на которых ФЛ метаболитов проявляется широкой полосой от 300 см-1 до 4000 см-1. Количество метаболитов характеризует степень пробуждения (прорастания) семян. Анализ спектров ФЛ по интегральной интенсивности -площади под кривыми спектров контрольных и опытных растворов культивирования семян -позволяет количественно определять увеличение или уменьшение концентрации метаболитов в растворах опытной группы семян по сравнению с контролем. Площадь под кривой спектра ФЛ пропорциональна концентрации вещества в растворе, то есть количеству метаболитов, вышедших в раствор культивирования.
Следует отметить высокую наглядность и чувствительность регистрируемых спектров (см. рис. 1 и рис. 2) - разница в наблюдаемой интенсивности ФЛ опытных и контрольных водных растворов позволяет проводить первичный скрининг кандидатных соединений и новых способов стимулирования роста растений в экспресс-режиме с минимальным количеством семян - достаточно буквально одного семени растения.
Приводим примеры осуществления предлагаемого способа. В качестве рострегулирующего воздействия на растения использовали облучение электромагнитным излучением крайневысокой частоты (КВЧ) и обработку широко известным регулятором роста растений - пероксидом водорода (см., например, Апашева Л.М., Комиссаров Г.Г. Влияние пероксида водорода на развитие растений. Изв. РАН, сер. биол. 1996, №5, с. 621-623; Корзинников Ю.С.Экологически безопасные средства защиты растений. Вестник РАСХН. 1997, №2, с. 44-47; пат. США 1927988, 26.09.33, пат. США 1962996, 12.06.34; RU 2514444, A01G 1/00, A01N 59/00, 27.04.2014; Осипова З.А. С ума сойти, какие огурцы! Моя прекрасная дача, Санкт-Петербург.2017, №2, с. 30-32).
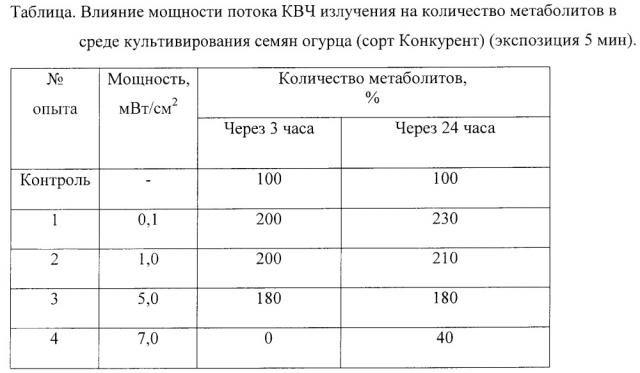
Способ стимулирования роста растений воздействием электромагнитного поля КВЧ при мощности потока излучения 0,1-5,0 мВт/см2 и экспозиции обработки 3-5 мин не был известен до настоящего времени и является предметом отдельной заявки, поданной одновременно с данной. При разработке заявляемого способа тестирования при помощи метода спектроскопии КРС были проведены исследования влияния мощности потока излучения КВЧ от 0,1 мВт/см2 до 7 мВт/см2 на эффективность воздействия. В таблице приведены данные анализа спектров ФЛ по интегральной интенсивности (площади под кривыми спектров), полученные при различной мощности потока КВЧ излучения. Площадь под кривой спектра ФЛ контрольного раствора культивирования семян принималась за 100%.
Как видно из полученных данных, стимуляция развития зародыша семени, сопровождаемая выходом метаболитов в среду культивирования, наблюдается уже при мощности потока излучения 0,1 мВт/см2, экспозиция 5 мин. При увеличении мощности излучения до 5 мВт/см2 (экспозиция 5 мин) эффект ростстимулирующего воздействия сохраняется, при дальнейшем увеличении мощности постепенно снижается, и при мощности потока излучения 7 мВт/см2 и выше (экспозиция 5 мин) наблюдается ингибирование процесса прорастания семян.
Оптимальные концентрации перекиси водорода для стимуляции развития растений лежат в диапазоне 1⋅10-5-1⋅10-3 М, концентрации 1⋅10-2 Ми выше приводят к торможению роста (RU 2423813, RU 2445759, RU 2514444, RU 2578531, RU 2584417).
Пример 1.
Семена огурца (сорт Конкурент) замачивали в дистиллированной воде в течение 3 часов при объемном соотношении семена : вода = 1:1. Затем от них отделяли контрольные семена, которые не подвергали обработке КВЧ излучением, а опытные обрабатывали полем КВЧ при мощности потока излучения 0,1 мВт/см2 и 7 мВт/см2 в течение 5 минут. Далее опытные и контрольные семена перекладывали для прорастания в свежую дистиллированную воду при объемном соотношении семена: вода=1:2 и через 3 часа регистрировали спектры КРС контрольных и опытных образцов водной среды культивирования семян. На рис. 1 приведены полученные спектры КРС: К - контроль, водная среда культивирования необлученных семян; 1 - водная среда культивирования семян, облученных при мощности потока КВЧ облучения 0,1 мВт/см2, экспозиция 5 мин (режим стимуляции прорастания); 2 - водная среда культивирования семян, облученных при мощности 7 мВт/см2, экспозиция 5 мин (режим торможения прорастания). Как видно из наблюдаемых спектров, спустя 3 часа после культивирования семян в воде видны существенные отличия спектров ФЛ опытных и контрольных растворов: количество метаболитов в среде культивирования облученных семян по варианту стимуляции значительно превосходит данные для контрольного раствора; выход метаболитов в опытном растворе с семенами, облученными по варианту торможения, наблюдается, но их количество меньше, чем в контроле.
Пример 2.
Семена огурца (сорт Конкурент) замачивали в течение 3 часов: контрольные в воде, опытные в растворе пероксида водорода при концентрации 1⋅10-3 М (3,4⋅10-2 г/л) (стимуляция прорастания) и при концентрации 5⋅10-2 М (1,7 г/л) (торможение прорастания) при объемном соотношении семена : вода = 1:1. Затем контрольные и опытные семена промывали водой, помещали для прорастания в свежую дистиллированную воду при объемном соотношении семена : вода = 1:2 и через 3 часа регистрировали спектры КРС контрольных и опытных образцов водной среды культивирования семян. На рис. 2 приведены полученные исходные и увеличенные в 10 раз спектры КРС: К - контроль; 1 - водная среда культивирования семян, обработанных пероксидом водорода при концентрации 1⋅10-3 М (3,4⋅10-2 г/л) (стимуляция прорастания); 2 - водная среда культивирования семян, обработанных пероксидом водорода при концентрации 5⋅10-2 М (1,7 г/л) (торможение прорастания). Как видно из рис. 2, спустя 3 часа после культивирования семян в воде видны существенные отличия спектров ФЛ опытных и контрольных растворов: кривые 1 и 2 заметно отличаются от контрольной кривой К.
Таким образом, из приведенных примеров видно, что тестирование эффективности рострегулирующего воздействия на растения при помощи метода спектроскопии КРС можно проводить уже в первые часы после обработки семян. Существенная разница в наблюдаемой интенсивности ФЛ опытных и контрольных водных растворов свидетельствует о высокой чувствительности предлагаемого способа.
Способ тестирования эффективности рострегулирующего воздействия на растения путем измерения оптических характеристик водных растворов культивирования опытных и контрольных семян, содержащих метаболиты, образующиеся в процессе прорастания семян, отличающийся тем, что в качестве оптических характеристик используют спектры комбинационного рассеяния света (КРС) и фотолюминесценции (ФЛ), для чего водные растворы культивирования опытных и контрольных семян облучают излучением аргонового лазера при длине волны 514,53 нм и регистрируют спектры КРС, состоящие из неизменяющегося спектра КРС воды и спектра ФЛ метаболитов, зависящего от концентрации метаболитов в водном растворе культивирования, при этом площадь под кривой спектра ФЛ пропорциональна концентрации вещества в растворе, что позволяет количественно определять увеличение или уменьшение концентрации метаболитов в растворах опытной группы по сравнению с контролем.