Средство, обладающее гемостимулирующей активностью, и способ его получения
Иллюстрации
Показать всеГруппа изобретений относится к фармацевтической промышленности, а именно к средству из ДНК молок рыб, обладающему гемостимулирующей активностью, и способу их получения. Средство из ДНК молок рыб, обладающее гемостимулирующей активностью, содержащее ДНК молок рыб не менее 95 %, белка не более 1 %, при этом длина фрагментов ДНК составляет от 200 до 600 пар нуклеотидных оснований, а гиперхромный эффект не менее 30 %, полученное путем приготовления водного раствора исходного сырья высокомолекулярной ДНК и водного раствора полимера, в водном растворе устойчивого к воздействию ионизирующего излучения, смешивания приготовленных растворов, облучение полученной смеси потоком ускоренных электронов, удаление образовавшихся низкомолекулярных фрагментов белка и ДНК из облученной смеси и высушивания целевого продукта. Способ получения средства, обладающего гемостимулирующей активностью, включающий приготовление водного раствора исходного сырья высокомолекулярной ДНК молоки рыб и приготовление водного раствора полимера, в водном растворе устойчивого к воздействию ионизирующего излучения, смешивание приготовленных растворов, облучение полученной смеси потоком ускоренных электронов, удаление образовавшихся низкомолекулярных фрагментов белка и ДНК из облученной смеси и высушивание целевого продукта (варианты). Вышеописанные способы получения позволяют получить средство, обладающее повышенной фармакологической активностью. 3 н. и 8 з.п. ф-лы, 2 табл., 4 пр.
Реферат
Область применения
Группа изобретений относится к средству, обладающему гемостимулирующей активностью, и способу его получения и может быть использована в медицине, а именно онкологии, для стимуляции лейкопоэза при миелосупрессиях, возникающих при проведении цитостатической терапии, а также в фармацевтической промышленности и биотехнологии.
Уровень техники
Для поддержания иммунитета при острых воспалительных заболеваниях, радиационном и токсическом воздействии на организм нагрузка на костный мозг существенно увеличивается, что приводит к угнетению гемопоэза, ярким примером которого является депрессия кроветворения при проведении химиолучевой терапии у онкологических больных. При проведении лучевой или цитостатической терапии страдают, прежде всего, функции быстро обновляющихся клеточных структур, к которым относится и костный мозг. Именно в костном мозге происходит образование ключевых клеток, отвечающих за иммунитет и защиту внутренней среды - лимфоцитов, нейтрофилов, макрофагов. Поэтому подавление функций костного мозга, истощение его резервов сказывается на всем организме. Согласно рекомендации ВОЗ по оценке токсичности химиотерапии, снижение уровня лейкоцитов и тромбоцитов в периферической крови до нижней пороговой границы (лейкоциты менее 3×109/л, гранулоциты менее 1,5×109/л, тромбоциты менее 75×109/л) является противопоказанием для дальнейшего проведения химиолучевой терапии. Арсенал средств, стимулирующих лейкопоэз, достаточно широк: в частности, известно использование с этой целью лекарственных препаратов на основе колоние-стимулирующего фактора, витаминов различных групп, препаратов тимуса крупного рогатого скота, препаратов ДНК. Однако вышеперечисленные препараты либо недостаточно эффективны, либо обладают побочными эффектами, а методы их получения многоступенчаты, трудозатратны и требуют дорогостоящих реактивов высокой степени чистоты [1]. В связи с этим поиск веществ, обладающих гемостимулирующей активностью, и способов их получения является по-прежнему актуальным.
Известно иммуностимулирующее и гемостимулирующее средство для перорального введения, представляющее собой фрагменты ДНК молекулярной массой от 500 до 700 кДа, высокоочищенные протеолитическими ферментами, полученные из экстракта молок лососевых и иммобилизованные на полиэтиленоксиде путем облучения 10% водного раствора полиэтиленоксида с молекулярной массой 1,5 кДа потоком ускоренных электронов в дозе 1,5 Мрад и внесения в облученный раствор олигонуклеотидов ДНК молок лососевых рыб до конечной концентрации 10 мг в 1 мл [2]. Данное средство проявляет иммуностимулирующую активность и гемостимулирующие свойства при введении per os, однако из-за нарушения оригинальных стереохимических свойств олигонуклеотидов в процессе иммобилизации на полиэтиленоксиде, не может обеспечить полноценный контакт с фармакологической мишенью (рецептором TLR-9), что может привести к снижению его фармакологической активности.
Наиболее близким к заявляемому средству по технической сущности является средство, описанное в способе для лечения нарушений гемопоэза, при котором пациенту вводят препарат высокоочищенной натриевой соли нативной ДНК с молекулярной массой от 270 до 500 кДа и гиперхромизмом не менее 37%, полученной из молок осетровых рыб [3]. Данный препарат, известный также под названием Деринат и Дезоксинат, в настоящее время рекомендован для клинического использования в качестве регенерирующего, ранозаживляющего, иммуномодулирующего и гемопоэтического средства, в том числе при лечении пациентов с онкологическими заболеваниями [4]. Основным недостатком применения данного препарата является необходимость парентерального введения, что при длительном курсе лечения продолжительностью до 6 месяцев вызывает затруднение у пациентов и не может удовлетворять требованиям комплаентности терапии. Помимо этого, системное введение сопряжено с характерными для него осложнениями - болезненностью в месте инъекции, повышением температуры тела, аллергическими и анафилактическими реакциями [5].
Наиболее близким к заявляемому способу получения является способ, описанный в патенте [2], содержащий приготовление 10% водного раствора полиэтиленгликоля с молекулярной массой 1,5 кДа, облучение раствора потоком ускоренных электронов в дозе 1,5 Мрад, внесения в облученный раствор олигонуклеотидов ДНК молок лососевых рыб до конечной концентрации 10 мг в 1 мл и перемешиванием смеси до получения целевого продукта. Недостатком данного способа является необходимость использовать в качестве сырья низкомолекулярную ДНК высокой степени чистоты, что существенно ограничивает возможности производства лекарственного препарата, ввиду отсутствия таких субстанций на рынке.
Технический результат, достигаемый данной группой изобретений, заключается в расширении арсенала иммуно- и гемостимулирующих лекарственных средств, при применении которых могут использоваться пути введения препарата, отличные от парентерального и повышающие комплаентность пациентов к проводимой терапии, а также способов их получения.
Сущность изобретения
Заявленный технический результат достигается в средстве, обладающем гемостимулирующей активностью, которое содержит не менее 95% ДНК животного происхождения и не более 1% белка, при этом длина фрагментов ДНК составляет от 200 до 600 пар нуклеотидных оснований (далее - п.н.о.), что соответствует молекулярной массе от 130 до 390 кДа, а гиперхромный эффект не менее 30%, при этом средство получают путем приготовления растворов ДНК и инертного нейтрального органического полимера, при низких концентрациях в водном растворе устойчивого к воздействию ионизирующего излучения (далее - полимер), смешивания приготовленных растворов, облучения полученной смеси ионизирующим излучением и последующей очистки и концентрирования целевого продукта.
Гранулоцитопоэзстимулирующие свойства заявляемого средства были обнаружены благодаря экспериментальным исследованиям. Для установления гранулоцитопоэзстимулирующей активности заявляемого средства было изучено его терапевтическое влияние при курсовом применении у мышей продолжительностью 5 дней при пероральном и внутрибрюшинном способе введения на фоне индуцированной введением цитостатика миелосупрессии.
Изучение гранулоцитопоэзстимулирующей активности проводилось согласно руководству по проведению доклинических исследований лекарственных средств [6]. Показатели периферической крови и костномозгового кроветворения определяли на 6 сутки после введения циклофосфана общепринятыми гематологическими методами [7]. Одновременно с набором крови готовили тонкие мазки крови для подсчета лейкоцитарной формулы на заранее обезжиренных предметных стеклах и высушивали их на воздухе. Зафиксированные (3-5 мин в метаноле) мазки окрашивали по методу Нохта-Максимова [8]. Подсчет лейкоцитарной формулы проводили с помощью иммерсионной системы микроскопа (объектив 90×, окуляр 10×). При этом сосчитывали не менее 100 лейкоцитов, а затем определяли процентное содержание сегментоядерных нейтрофилов и высчитывали их абсолютное содержание в одном литре крови [9]
Статистическая обработка результатов включала подсчет среднеарифметических значений (М) и их ошибки (m). Для выявления достоверности полученных значений применяли тест множественных сравнений Дункана (Duncan's test, ANOVA) с использованием пакета компьютерных программ Statistica 6.0. Отличия считали достоверными при p<0,05.
Далее рассчитывали гранулоцитопоэзстимулирующую активность препаратов относительно контрольной группы по формуле:
где X - гранулоцитопоэзстимулирующая активность, %;
а - количество сегментоядерных нейтрофилов в литре крови исследуемого препарата;
б - количество сегментоядерных нейтрофилов в литре крови контрольной группы.
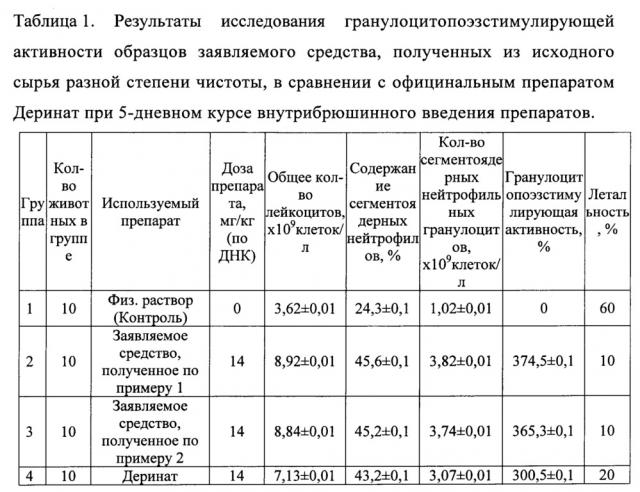
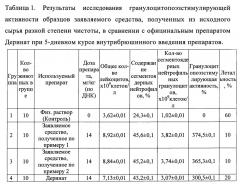
Экспериментальные данные по определению гранулоцитопоэзстимулирующей активности заявляемого препарата на 6 день после введения цитостатика при интраперитонеальном введении представлены в таблице 1. Значения гранулоцитопоэзстимулирующей активности для образцов заявляемого препарата, полученных из исходного сырья различной степени чистоты, составили 374,5% и 365,3% против 300,5% для Дерината. Кроме того, летальность при использовании образцов заявляемого средства была в 2 раза ниже по сравнению с Деринатом (10% против 20%) и в 6 раз ниже, чем в контрольной группе нелеченных животных. Таким образом, образцы заявляемого средства, полученные из исходного сырья ДНК разной степени чистоты, стимулировали гемопоэз у мышей на фоне вызванной миелосупрессии, что способствовало резкому снижению смертности среди исследуемых животных.
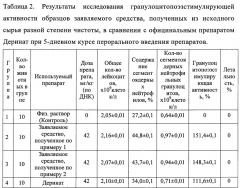
Экспериментальные данные по определению гранулоцитопоэзстимулирующей активности заявляемого препарата при пероральном введении представлены в таблице 2. Значения гранулоцитопоэзстимулирующей активности для образцов заявляемого препарата, полученных из исходного сырья различной степени чистоты, составили 151,4% и 148,3% против 111,6% для Дерината, что свидетельствует о большей эффективности заявляемого препарата при лечении миелосупрессии при пероральном введении по сравнению с Деринатом и возможности его применения и при таком пути введения.
Таким образом, основное отличие заявляемого средства от прототипа заключается в том, что обработка ДНК ионизирующим излучением в присутствии полимера изменяет свойства молекул ДНК таким образом, что повышается их устойчивость к воздействию ферментов, а это, в свою очередь, находит отражение в повышении фармакологической эффективности средства не только при парентеральном, но и при пероральном пути введения.
Заявленный технический результат достигается также в способе получения средства, обладающего гемостимулирующей активностью, включающий приготовление раствора ДНК, приготовление раствора полимера, облучение ионизирующим излучением и смешивание полученных растворов, отличающийся тем, что смешивание полученных растворов осуществляют до облучения ионизирующим излучением и кроме того, дополнительно проводят очистку исходного сырья ДНК от примесных белков, расщепление исходной ДНК на низкомолекулярные фрагменты и итоговую очистку и концентрирование целевого продукта, при этом при использовании исходного сырья ДНК с содержанием примесных белков менее 2% очистку исходного сырья ДНК от примесных белков проводят путем расщепления примесных белков одновременно с расщеплением исходной высокомолекулярной ДНК при облучении смеси растворов ДНК и полимера и последующим отделением образовавшихся низкомолекулярных фрагментов белка и ДНК размером до 100 кДа любым доступным способом, а при использовании исходного сырья ДНК с содержанием примесных белков от 2 до 40% предварительно проводят дополнительную очистку раствора исходного сырья ДНК от примесных белков путем протеолиза, включающего приготовление раствора исходного сырья ДНК в водном солевом или буферном растворе, обеспечивающим поддержание pH раствора в ходе ферментолиза в пределах, необходимых для оптимального действия используемых при протеолизе ферментов, обработку полученного раствора исходного сырья ДНК комплексом нейтральных и щелочных протеаз, инактивацию добавленных ферментов и отделение образовавшихся белковых фрагментов любым доступным способом.
В качестве исходного сырья ДНК используют ДНК животного происхождения, полученную любым известным способом, с содержанием ДНК не менее 60%, содержанием белка не более 40% и не содержащую в своем составе иных полимерных молекул природного или искусственного происхождения с молекулярным весом более 100 кДа, кроме белка и ДНК.
При использовании исходного сырья ДНК животного происхождения, которое содержит не менее 90% ДНК и не более 2% примесного белка, для приготовления раствора ДНК в качестве растворителя используют очищенную воду, процесс растворения проводят при температуре от 35 до 45°C в течение от 10 до 20 ч при постоянном перемешивании, а количество исходного сырья и растворителя подбирают таким образом, чтобы концентрация ДНК в полученном растворе составляла от 40 до 60 мг/мл.
При использовании исходного сырья ДНК животного происхождения с содержанием ДНК не менее 60% и примесных белков от 2 до 40% проводят предварительную очистку раствора исходного сырья ДНК от примесных белков путем ферментолиза. Для этого исходное сырье ДНК растворяют в водном солевом или буферном растворе, обеспечивающим pH раствора в процессе проведения ферментолиза в пределах от 6,0 до 9,0, например, водном растворе гидрокарбоната натрия концентрацией от 1,5 до 2,5 мас. %. Растворение исходного сырья ДНК проводят при температуре от 35 до 45°C в течение от 3 до 5 ч при постоянном перемешивании, при этом количество исходного сырья и водного солевого или буферного раствора подбирают таким образом, чтобы концентрация ДНК в полученном растворе составляла от 40 до 60 мг/мл. Приготовленный таким образом раствор исходного сырья ДНК нагревают до температуры от 55 до 65°C и добавляют комплекс нейтральных и щелочных протеаз до концентрации от 1 до 3 мас. %, полученную смесь инкубируют при температуре от 55 до 65°C в течение от 3 до 5 ч при постоянном перемешивании, затем проводят инактивацию добавленных ферментов нагреванием реакционной смеси при температуре от 70 до 90°C в течение от 1 до 3 ч и отделяют образовавшиеся белковые агрегаты любым доступным способом, например, центрифугированием при скорости вращения центрифуги от 6000 до 9000 об/мин в течение от 10 до 30 мин. В качестве комплекса нейтральных и щелочных протеаз может быть использован препарат протеолитического действия «Алкалаза 2,4 LFG» с рабочим температурным режимом от 40 до 60°C, разрешенный для использования в пищевой промышленности. Таким образом получают раствор ДНК, используемый в последующих манипуляциях.
После приготовления раствора ДНК готовят раствор полимера. В качестве полимера используют полиэтиленгликоль с молекулярной массой от 0,4 до 6,0 кДа, при этом также могут быть использованы триблоксополимеры полиоксиэтилена и полиоксипропилена с молекулярной массой от 0,4 до 5,6 кДа и соотношением полиэтиленоксидного и полипропиленоксидного компонентов в пределах от 3:8 до 6:3. Для приготовления раствора инертного нейтрального органического полимера используют очищенную воду, при этом процесс растворения проводят при температуре от 35 до 45°C в течение от 10 до 20 ч при постоянном перемешивании, а количество полимера и растворителя подбирают таким образом, чтобы концентрация полимера в полученном растворе составляла от 80 до 120 мг/мл.
После этого растворы ДНК и полимера смешивают в таких соотношениях, чтобы после их смешения концентрация ДНК в полученной смеси составила от 20 до 30 мг/мл, а концентрация полимера - от 45 до 55 мг/мл.
Далее проводят облучение полученной смеси ионизирующим излучением, при этом в качестве ионизирующего излучения может быть использован поток ускоренных электронов в дозе от 3 до 6 Мрад, а в качестве источника ускоренных электронов - импульсный линейный ускоритель ИЛУ-6 или ИЛУ-10. Во время облучения происходит расщепление молекул ДНК до низкомолекулярных фрагментов, а также разрушение и денатурация белков с образованием белковых агрегатов, которые впоследствии удаляют при проведении итоговой очистки любым доступным способом, например диафильтрацией через ультрафильтрационную систему с диаметром пор 100 кДа. При проведении диафильтрации происходит также концентрирование раствора целевого продукта с кратностью концентрирования от 10 до 30. Для удобства хранения целевой продукт может быть лиофильно высушен.
Отличие заявляемого способа от прототипа заключается в том, что по сравнению с прототипом в заявляемом способе:
- проведение предварительной очистки исходного сырья ДНК путем ферментолиза позволяет снижать содержание белковых примесей в конечном продукте до 1 мас. % и менее, что делает возможным использование дешевого и доступного исходного сырья ДНК разной степени чистоты (с содержанием ДНК не ниже 60% и содержанием примесного белка до 40%), а это в свою очередь благоприятно отражается на себестоимости конечного продукта;
- на стадии протеолиза может использоваться высокоактивный протеолитический комплекс "Алкалаза 2,4 LFG", разрешенный для использования в пищевой промышленности, что облегчает применение конечного продукта в медицинских целях. При этом достигается практически полный гидролиз примесных белков до коротких пептидов и аминокислот, а белки самого ферментного комплекса денатурируют с образованием легко удаляемого осадка;
- смешивание растворов ДНК и полимера до облучения позволяет защитить ДНК от неконтролируемого расщепления до фрагментов размером менее 200 п.н.о., а также обеспечивает устойчивость молекул ДНК к воздействию ферментов при пероральном введении заявляемого средства;
- облучение смеси растворов ДНК и полимера потоком ускоренных электронов в дозе 3-6 Мрад позволяет проводить одновременное фрагментирование высокомолекулярной ДНК и расщепление примесных белков, что позволяет исключить стадию предварительной очистки исходного сырья ДНК от белков при содержании в нем белка до 2 мас. % и сделать процесс производства более технологичным и легко масштабируемым;
- проведение итоговой очистки позволяет удалить низкомолекулярные примеси из конечного продукта, в том числе используемый для контролируемого расщепления ДНК полимер, что позволяет сохранить оригинальные стереохимические свойства низкомолекулярных фрагментов ДНК во всей массе препарата и обеспечить полноценный контакт с фармакологической мишенью (рецептором TLR-9) и, как следствие, высокую фармакологическую эффективность конечного продукта.
Осуществление изобретения
Сущность изобретения иллюстрируется следующими примерами.
Пример 1.
При использовании сырья с содержанием нуклеиновых кислот не менее 90% и примесных белков менее 2% осуществление заявляемого способа иллюстрируется следующим примером. 1 кг высокомолекулярной ДНК из молок лососевых рыб ("Сибирский центр фармакологии и биотехнологии", Новосибирск, Россия; содержание ДНК 95 мас. %, содержание белка 1,7 мас. %) растворяли в 20 кг очищенной воды при температуре 40°C в течение 15 ч при постоянном перемешивании.
Для приготовления 20 кг 10 мас. % водного раствора ПЭГ брали 2 кг ПЭГ-6000 ("Завод Синтанолов", Нижний Новогород, Россия) и приливали 18 кг очищенной воды, смесь перемешивали при 45°C в течение 20 ч После этого полученные растворы ДНК и ПЭГ объединяли и снова перемешивали в течение 30 минут при комнатной температуре. Полученный раствор охлаждали до температуры 25°C, разливали в полиэтиленовые пакеты по 1 л таким образом, чтобы высота слоя жидкости при горизонтальном положении пакета на ровной поверхности не превышала 2 см, и пакеты запаивали.
Упакованный в полиэтиленовые пакеты раствор подвергали воздействию потока ускоренных электронов в дозе 6 Мрад на ускорителе ИЛУ-10. После облучения пакеты вскрывали, и раствор подвергали диафильтрации через ультрафильтрационную систему, укомплектованную фильтрующим элементом с размером пор 100 кДа, при этом раствор концентрировали в 10 раз, полученный концентрат разбавляли очищенной водой в пять раз, и вновь концентрировали в пять раз. Полученный концентрат подвергали лиофильной сушке.
Содержание ДНК в конечном продукте и его выход рассчитывали по поглощению при длине волны λ=260 нм, учитывая, что водный раствор низкомолекулярной ДНК с концентрацией 40 мкг/мл поглощает 1 о.е. [10]. Содержание белка определяли по стандартному методу Бредфорда, используя в качестве стандарта раствор человеческого сывороточного альбумина [11]. Длину молекул ДНК определяли методом электрофореза в 1% агарозном [12] и 12% полиакриламидном геле [13]. Гиперхромный эффект ДНК определяли, сравнивая оптическую плотность при 260 нм раствора ДНК до и после гидролиза 5% хлорной кислотой при 100°C в течение 20 мин [14].
Характеристики полученного продукта: содержание ДНК 97,25%, содержание белка 0,072%, длина молекул ДНК от 200 до 600 п.н.о., гиперхромный эффект 37%, что соответствует заявляемому результату.
Пример 2
При использовании сырья с содержанием нуклеиновых кислот не менее 60% и белка от 2 до 40 мас. % осуществление заявляемого способа иллюстрируется следующим примером.
1,38 кг ДНК из молок лососевых рыб (ЗАО "Сибирский центр фармакологии и биотехнологии", Новосибирск, Россия; содержание ДНК 62%, содержание белка 7,4%) вносили в 9 л 2%-ного водного раствора гидрокарбоната натрия и перемешивали при температуре 40°C в течение 2 ч. Полученную смесь нагревали до 60°C, добавляли 208 г (2 мас. %) ферментного препарата "Алкалаза 2,4 LFG" (Novozymes A/S, Bagsvaerd, Дания) и смесь инкубировали при температуре от 55 до 65°C в течение 4 ч при постоянном перемешивании, исключающем вспенивание. После этого смесь нагревали до 80°C и выдерживали в течение 2 ч при температуре от 70 до 90°C, затем охлаждали до температуры 25°C и центрифугировали при 6500 об/мин в течение 15 мин. Полученный супернатант, представляющий собой раствор высокомолекулярной ДНК, собирали, его вес составил 9,85 кг, концентрация ДНК 86 мг/мл. Полученный раствор ДНК разбавляли очищенной водой в два раза. Таким образом получали раствор высокомолекулярной ДНК, используемый в дальнейших манипуляциях.
Для приготовления 19,7 кг 10 мас. % водного раствора ПЭГ брали 1,97 кг ПЭГ-400 ("Завод Синтанолов", Нижний Новогород, Россия) и 17,73 кг очищенной воды и перемешивали при 35°C в течении 10 часов.
Далее весь полученный раствор высокомолекулярной ДНК объединяли с приготовленным раствором ПЭГ-400 и перемешивали в течение 30 минут. После этого полученную смесь разливали в полиэтиленовые пакеты по 1 л таким образом, чтобы высота слоя жидкости при горизонтальном положении пакета на ровной поверхности не превышала 2 см, после чего пакеты запаивали.
Упакованный в полиэтиленовые пакеты раствор подвергали воздействию потока ускоренных электронов в дозе 3 Мрад на ускорителе ИЛУ-10. Последующие этапы проводили так же, как в примере 1.
Характеристики полученного продукта: содержание ДНК 95,07%, содержание белка 0,093%, длина молекул ДНК 200-600 п.н.о. и гиперхромный эффект 32%, что соответствует заявляемому результату.
Пример 3.
Исследование гранулоцитопоэзстимулирующей активности образцов заявляемого средства, полученных из исходного сырья разной степени чистоты, при внутрибрюшинном пути введения проводили на конвенциональных линейных мышах-самцах линии CBA/CaLac массой 18-20 г в возрасте 2 месяцев, полученных из сектора разведения экспериментальных животных ФГБНУ НИИФФМ (сертификат имеется). Содержание, питание, уход за животными и выведение их из эксперимента осуществляли в соответствии с требованиями «Правил проведения работ с использованием экспериментальных животных» (Приложение к приказу МЗ СССР от 12.08.1977 г. №755). В исследовании было использовано 40 животных 1 категории.
Животным вводили внутрибрюшинно однократно циклофосфан в максимально переносимой дозе 250 мг/кг в объеме 0,2 мл стерильного физиологического раствора. Через 24 часа после введения цитостатика мыши были разделены на четыре группы. Животные опытных групп получали внутрибрюшинно по 14 мг/кг (по ДНК) в 0,2 мл стерильного физиологического раствора 1 раз в сутки в течение 5 дней следующие препараты: заявляемое средство, полученное по примеру 1, заявляемое средство, полученное по примеру 2, и официнальный препарат Деринат. Животным контрольной группы в аналогичных условиях вводили физиологический раствор в эквивалентном объеме. Показатели периферической крови и костномозгового кроветворения определяли на 6 сутки после введения циклофосфана общепринятыми гематологическими методами [15]. Данные экспериментальных исследований представлены в таблице 1.
Пример 4.
Исследование гранулоцитопоэзстимулирующей активности образцов заявляемого средства, полученных из исходного сырья разной степени чистоты, при пероральном пути введения проводили так же, как в примере 3, при этом животные опытных групп получали перорально по 42 мг/кг (по ДНК) в 0,2 мл стерильного физиологического раствора 1 раз в сутки в течение 5 дней следующие препараты: заявляемое средство, полученное по примеру 1, заявляемое средство, полученное по примеру 2, и официнальный препарат Деринат. Контрольным животным в аналогичных условиях вводили физиологический раствор в эквивалентном объеме. Данные экспериментальных исследований представлены в таблице 2.
Источники
1. Машковский М.Д. Лекарственные средства (пособие для врачей). - М.: Медицина, 1995.
2. RU 2414223, МПК А61K 31/7088, опубл. 20.03.2011.
3. Патент RU 2063228, МПК А61K 31/70, С07Н 21/04, опубл. 10.07.1996.
4. Жаврид Э.А., Истомин Ю.П. Изучение противоопухолевых свойств комплекса адриамицин-деринат в экспериментах. - Минск, 1994.
5. Рыкова Е.Ю., Лактионов П.П., Власов В.В. Активирующее влияние ДНК на иммунную систему. Успехи современной биологии. - 2001. - №121. - С. 160-171.
6. Руководство по проведению доклинических исследований лекарственных средств. Часть первая. - М.: Гриф и К, 2012. - 944 с.
7. Атлас по гематологии. Харальд Тэмл, Хайнц Диам, Торстен Хаферлах; пер. с англ.; под общ. ред. проф. В.С. Камышникова. - 2-е изд. - М.: МЕДпресс-информ, 2014. - 208 с. 8
8. Гольдберг Е.Д. Справочник по гематологии с атласом микрофотограмм. - Томск: Изд-во Том. Ун-та, 1989. - 486 с.
9. Руководство к практическим занятиям по методам клинических лабораторных исследований: Учеб. Пособие - 4-е изд., перераб. и доп. - В.С. Ронин, Г.М. Старобинец - М.: Медицина, 1989.- 320 с.
10. Маниатис Т. Молекулярное клонирование. - М.: Мир, 1984. - 480 с.
11. Bradford М.М. A Rapid and Sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding. Anal. Biochem, 1976, V. 72, p. 248-254.
12. Остерман Л.А. Методы исследования белков и нуклеиновых кислот. Электрофорез и ультрацентрифугирование. - М.: Наука, 1981. - 286 с.
13. Maniatis Т., Jeffrey A. and deSande H.V. Chain length determination of small double-andsingle-stranded DNA molecules by polyacrylamide gel electrophoresis. Biochemistry. 1975, V. 14, P. 3787-3794.
14. Лазуркин Ю.С. Физические методы исследования белков нуклеиновых кислот. - М.: Наука, 1967. - 342 с.
1. Средство из ДНК молок рыб, обладающее гемостимулирующей активностью, содержащее ДНК не менее 95 %, белка не более 1 %, при этом длина фрагментов ДНК составляет от 200 до 600 пар нуклеотидных оснований, а гиперхромный эффект не менее 30 %, полученное путем приготовления водного раствора исходного сырья высокомолекулярной ДНК и водного раствора полимера, в водном растворе устойчивого к воздействию ионизирующего излучения и выбранного из полиэтиленгликоля с молекулярной массой от 400 до 6000 Да или триблоксополимеров полиоксиэтилена и полиоксипропилена с молекулярной массой от 400 до 5600 Да при соотношении компонентов в пределах от 3:8 до 6:3, смешивания приготовленных растворов в таком соотношении, что после смешивания растворов концентрация ДНК в полученной смеси составляет от 20 до 30 мг/мл, а концентрация полимера - от 45 до 55 мг/мл, облучения полученной смеси потоком ускоренных электронов в дозе от 3 до 6 Мрад, удаления образовавшихся низкомолекулярных фрагментов белка и ДНК размером до 100 кДа из облученной смеси и высушивания целевого продукта.
2. Способ получения средства по п. 1, обладающего гемостимулирующей активностью, включающий приготовление водного раствора исходного сырья высокомолекулярной ДНК, где в качестве исходного сырья используют молоки рыб, содержащие не менее 90 % ДНК и не более 2 % примесного белка, приготовление водного раствора полимера, в водном растворе устойчивого к воздействию ионизирующего излучения и выбранного из полиэтиленгликоля с молекулярной массой от 400 до 6 000 Да или триблок-сополимеров полиоксиэтилена и полиоксипропилена с молекулярной массой от 400 до 5 600 Да и соотношением полиэтиленоксидного и полипропиленоксидного компонентов в пределах от 3:8 до 6:3, смешивание приготовленных растворов в таком соотношении, что после смешивания растворов концентрация ДНК в полученной смеси составляет от 20 до 30 мг/мл, а концентрация полимера - от 45 до 55 мг/мл, облучение полученной смеси потоком ускоренных электронов в дозе от 3 до 6 Мрад, удаление образовавшихся низкомолекулярных фрагментов белка и ДНК размером до 100 кДа из облученной смеси и высушивание целевого продукта.
3. Способ получения средства по п. 1, обладающего гемостимулирующей активностью, включающий приготовление водного раствора ДНК из исходного сырья высокомолекулярной ДНК, где в качестве исходного сырья используют молоки рыб с содержанием ДНК не менее 60 % и содержанием белка не более 40 %, путем растворения исходного сырья высокомолекулярной ДНК в водном солевом или буферном растворе, обеспечивающем поддержание рН в интервале от 6,0 до 9,0, при этом количество исходного сырья подбирают таким образом, что концентрация высокомолекулярной ДНК в растворе составляет от 40 до 60 мг/мл, и очистки приготовленного раствора высокомолекулярной ДНК посредством нагревания раствора высокомолекулярной ДНК до температуры от 55 до 65°С, добавления к нагретому раствору высокомолекулярной ДНК комплекса нейтральных и щелочных протеаз до концентрации от 1 до 3 мас.%, инкубирования полученной смеси при температуре от 55 до 65°С в течение от 3 до 5 ч, последующего нагревания реакционной смеси до температуры от 70 до 90°С, инкубирования реакционной смеси при температуре от 70 до 90°С в течение от 1 до 3 ч и удаления образовавшихся агрегатов примесей из водного раствора высокомолекулярной ДНК, используемого в дальнейших манипуляциях, приготовление водного раствора полимера, в водном растворе устойчивого к воздействию ионизирующего излучения и выбранного из полиэтиленгликоля с молекулярной массой от 400 до 6 000 Да или триблок-сополимеров полиоксиэтилена и полиоксипропилена с молекулярной массой от 400 до 5 600 Да и соотношением полиэтиленоксидного и полипропиленоксидного компонентов в пределах от 3:8 до 6:3, смешивание приготовленных растворов ДНК и полимера в таком соотношении, что после смешивания растворов концентрация ДНК в полученной смеси составляет от 20 до 30 мг/мл, а концентрация полимера - от 45 до 55 мг/мл, облучение полученной смеси потоком ускоренных электронов в дозе от 3 до 6 Мрад, удаление образовавшихся низкомолекулярных фрагментов белка и ДНК размером до 100 кДа из облученной смеси и высушивание целевого продукта.
4. Способ по п. 2, отличающийся тем, что для приготовления раствора ДНК при использовании исходного сырья, содержащего не менее 90 % ДНК и не более 2 % примесного белка, в качестве растворителя используют очищенную воду, процесс растворения проводят при температуре от 35 до 45°С в течение от 10 до 20 ч при постоянном перемешивании, а количество исходного сырья ДНК и растворителя подбирают таким образом, чтобы концентрация ДНК в полученном растворе составляла от 40 до 60 мг/мл.
5. Способ по п. 3, отличающийся тем, что для приготовления раствора ДНК при использовании исходного сырья, содержащего не менее 60 % ДНК и не более 40 % примесного белка, в качестве растворителя используют водный раствор гидрокарбоната натрия концентрацией от 1,5 до 2,5 мас.%.
6. Способ по п. 3, отличающийся тем, что в качестве комплекса нейтральных и щелочных протеаз используют препарат протеолитического действия «Алкалаза 2,4 LFG», с рабочим температурным режимом от 40 до 60°С, разрешенный для использования в пищевой промышленности.
7. Способ по п. 3, отличающийся тем, что удаление агрегатов примесей, образовавшихся после инкубирования смеси растворов высокомолекулярной ДНК и комплекса нейтральных и щелочных протеаз при температуре от 70 до 90°С, проводят путем центрифугирования смеси при скорости вращения центрифуги от 6000 до 9000 об/мин в течение от 10 до 30 мин.
8. Способ по пп. 2 и 3, отличающийся тем, что для приготовления раствора полимера, в водном растворе устойчивого к воздействию ионизирующего излучения и выбранного из полиэтиленгликоля с молекулярной массой от 400 до 6000 Да или триблок-сополимеров полиоксиэтилена и полиоксипропилена с молекулярной массой от 400 до 5600 Да и соотношением полиэтиленоксидного и полипропиленоксидного компонентов в пределах от 3:8 до 6:3, используют очищенную воду, процесс растворения проводят при температуре от 35 до 45°С в течение от 10 до 20 ч при постоянном перемешивании, а количество полимера и растворителя подбирают таким образом, что концентрация полимера в полученном растворе составляет от 80 до 120 мг/мл.
9. Способ по пп. 2 и 3, отличающийся тем, что в качестве источника ускоренных электронов используют импульсный линейный ускоритель ИЛУ-6 или ИЛУ-10.
10. Способ по пп. 2 и 3, отличающийся тем, что удаление образовавшихся после облучения потоком ускоренных электронов низкомолекулярных фрагментов белка и ДНК размером до 100 кДа из облученной смеси проводят диафильтрацией через ультрафильтрационную систему с диаметром пор 100 кДа.
11. Способ по пп. 1-3, отличающийся тем, что высушивание целевого продукта проводят путем лиофильной сушки.