Препарат для магнитно-резонансной диагностики онкологических заболеваний, содержащий дейтерированную 2-амино-2-метилпропионовую кислоту и/или 2-(n-метиламино)-2-метилпропионовую кислоту, и способ диагностики с использованием этого препарата
Иллюстрации
Показать всеГруппа изобретение относится к химико-фармацевтической промышленности и представляет собой диагностический препарат, включающий дейтерированное производное 2-амино-2-метилпропионовой кислоты, и/или 2-(N-метиламино)-2-метилпропионовой кислоты, и/или его фармацевтически приемлемую соль, или смесь, по меньшей мере, двух дейтерированных производных 2-амино-2-метилпропионовой кислоты, и/или 2-(N-метиламино)-2-метилпропионовой кислоты, и/или ее фармацевтически приемлемой соли, для диагностики онкологических заболеваний методом магнитно-резонансной томографии и/или магнитно-резонансной спектроскопии на ядрах дейтерия, а также способ диагностики онкологического заболевания у субъекта, включающий этапы введения субъекту диагностического препарата, проведения магнитно-резонансной томографии и/или магнитно-резонансной спектроскопии на ядрах дейтерия после введения диагностического препарата и диагностирования наличия или отсутствия онкологического заболевания на основании наблюдаемой интенсивности сигнала ядер дейтерия, отражающей уровень накопления диагностического препарата. Группа изобретений позволяет создать новый и эффективный диагностический препарат, который может использоваться в диагностике онкологических заболеваний, в частности рака молочной железы, глиомы, а также разработать новый эффективный и информативный способ диагностики онкологического заболевания методом магнитно-резонансной томографии и/или магнитно-резонансной спектроскопии на ядрах дейтерия. 2 н. и 21 з.п. ф-лы, 12 ил., 3 пр.
Реферат
Препарат для магнитно-резонансной диагностики онкологических заболеваний, содержащий дейтерированную 2-амино-2-метилпропионовую кислоту и/или 2-(N-метиламино)-2-метилпропионовую кислоту, и способ диагностики с использованием этого препарата
Область техники
Изобретение относится к медицине, а именно к средствам для магнитно-резонансной диагностики онкологических заболеваний.
Уровень техники
Диагностика онкологических заболеваний, в том числе ранняя диагностика, является приоритетным направлением в здравоохранении. Одним из информативных методов диагностики таких заболеваний является магнитно-резонансная томография (МРТ).
Большинство разновидностей МРТ, применяемых в клинической практике, основано на регистрации сигнала магнитного резонанса протонов (ядер 1Н), входящих в состав воды в организме человека. 1Н МРТ обеспечивает высокую степень анатомической детализации и во многих случаях позволяет обнаружить области с аномальным сигналом, отвечающие новообразованиям. В то же время, из клинической практики известно, что МРТ не всегда в состоянии отличить злокачественные новообразования от доброкачественных, не требующих срочного лечения (низкая специфичность метода). В связи с этим также затруднена ранняя диагностика онкологических заболеваний, так как высок риск ложноположительного результата.
Основной метод повышения информативности 1Н МРТ - использование контрастных агентов, изменяющих параметры сигнала в своем окружении [Topics in Current Chemistry, Contrast Agents I, Magnetic Resonance Imaging, Editors: Krause, Werner, 2002]. Известен широкий круг контрастных препаратов, использующихся в МРТ диагностике, включая коммерчески доступные Omniscan®, Magnevist®, ProHance® и Clariscan®, представляющие собой комплексы гадолиния, а также Feridex® и Resovist®, представляющие собой водные суспензии стабилизированных магнитных наночастиц. Эти вещества вводятся в кровь пациента и позволяют оценивать степень кровоснабжения областей с подозрением на злокачественное образование.
Альтернативой проведения 1Н МРТ с контрастными агентами является регистрация сигнала других ядер, в частности, 31P, 13C, 19F, 2H, 23Na. Одним из таких ядер является дейтерий (2Н). Это нерадиоактивный изотоп водорода, природное содержание которого в биологических объектах составляет 0.0156%, а чувствительность в несколько раз ниже, чем у протона.
К настоящему моменту описано несколько случаев применения 2Н ЯМР и/или 2Н МРТ in vivo. В документе US 20030211036 A1 был предложен способ измерения перфузии опухолевых тканей с помощью изотопно меченных соединений, включая дейтерированные соединения.
В документе US 5042488 была показана возможность регистрации фонового сигнала дейтерия, а также сигнала дейтерия после инъекции D2O и 1-дейтероглюкозы in vivo (в печени крысы). Отмечается, что изобретение также может быть осуществлено с использованием других меченых дейтерием индикаторов кровотока.
В документе US 20100322865 A1 описывается применение метаболических прекурсоров воды для оценки скорости метаболизма путем проведения 2H МРТ. В качестве примера метаболического предшественника HOD приводится 1,2,3,4,5,6,6-дейтерированная глюкоза. В рамках описанного изобретения осуществляется регистрация только ЯМР сигналов на дейтерии метаболической воды и алифатической цепи жирных кислот, и отсутствуют ЯМР сигналы дейтерированной глюкозы.
Ни одна из приведенных выше методик не используется на практике для диагностики онкологических заболеваний, в том числе из-за необходимости использования очень больших доз маркерных соединений.
Несмотря на существующие методики проведения диагностики заболеваний с помощью МРТ, существует потребность в разработке новых более эффективных подходов для проведения МРТ-диагностики онкологических заболеваний.
Раскрытие изобретения
Задачей данного изобретения является разработка нового эффективного диагностического препарата для диагностики онкологических заболеваний посредством МРТ и/или МР-спектроскопии и способа диагностики, включающего использование указанного препарата.
Технический результат данного изобретения заключается в создании нового и эффективного диагностического препарата, который может использоваться в диагностике онкологических заболеваний, в частности, рака молочной железы, глиомы. Техническим результатом настоящего изобретения также является разработка нового эффективного и информативного способа диагностики онкологического заболевания методом магнитно-резонансной томографии и/или магнитно-резонансной спектроскопии на ядрах дейтерия, включающего введение диагностического препарата по изобретению, который способен накапливаться в опухолевой ткани в концентрации, достаточной для регистрации информативной дейтериевой томограммы или 2Н-ЯМР спектра in vivo.
Диагностический препарат по изобретению характеризуется тем, что в нем реализуется сочетание таких факторов как высокое содержание атомов дейтерия в препарате, его способности накапливаться в опухоли за приемлемое время в концентрации, достаточной для проведения диагностики, характеризующейся при этом низкой токсичности, практически полным выведением из организма в неизменном виде. Это позволяет проводить диагностику, в том числе многократную, с использованием безвредных для организма дозировок препарата.
Способ по изобретению также характеризуется тем, что осуществляется без вредного воздействия ионизирующего излучения (характерного, например, для методов КТ, ПЭТ, ОФЭКТ), что в свою очередь повышает безопасность исследований, делает возможным проведение более частых повторных исследований, в частности делает метод привлекательным для педиатрии. Изобретение также направлено на получение диагностической информации, сходной с методом позитронно-эмиссионной томографии, но, в отличие от последнего, позволяет устранить риски, связанные с ионизирующим излучением радиофармпрепаратов.
Данный технический результат обеспечивается за счет разработки диагностического препарата, включающего дейтерированное производное 2-амино-2-метилпропионовой кислоты и/или 2-(N-метиламино)-2-метилпропионовой кислоты и/или его фармацевтически приемлемую соль или смесь, по меньшей мере, двух разных дейтерированных производных 2-амино-2-метилпропионовой кислоты и/или 2-(N-метиламино)-2-метилпропионовой кислоты и/или его фармацевтически приемлемую соль, для диагностики онкологических заболеваний методом магнитно-резонансной томографии и/или магнитно-резонансной спектроскопии на ядрах дейтерия.
В частных вариантах воплощения изобретения диагностический препарат дополнительно включает, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество. В частных вариантах воплощения изобретения фармацевтически приемлемое вспомогательное вещество представляет собой носитель, наполнитель и/или растворитель.
В частных вариантах воплощения изобретения дейтерированное производное 2-амино-2-метилпропионовой кислоты представляет собой 2-амино-2-(CD3)-3,3,3-D3-пропионовую кислоту или 2-амино-2-(CD2H)-3,3,3-D3-пропионовую кислоту или 2-амино-2-(CDH2)-3,3,3-D3-пропионовую кислоту или 2-амино-2-метил-3,3,3-D3-пропионовую кислоту или 2-амино-2-(CD2H)-3,3-D2-пропионовую кислоту или 2-амино-2-(CDH2)-3,3-D2-пропионовую кислоту или 2-амино-2-метил-3,3-D2-пропионовую кислоту или 2-амино-2-(CDH2)-3-D-пропионовую кислоту или 2-амино-2-метил-3-D-пропионовую кислоту.
В частных вариантах воплощения изобретения дейтерированное производное 2-(N-метиламино)-2-метилпропионовой кислоты представляет собой 2-(N-метиламино)-2-(CD3)-3,3,3-D3-пропионовую кислоту или 2-(N-(CD3)амино)-2-метилпропионовую кислоту или 2-(N-(CD3)амино)-2-(CD3)-3,3,3-D3-пропионовую кислоту.
В частных вариантах воплощения изобретения диагностический препарат по изобретению включает смесь, по меньшей мере, двух разных дейтерированных производных 2-амино-2-метилпропионовой кислоты и/или 2-(N-метиламино)-2-метилпропионовой кислоты, выбранных из 2-амино-2-(CD3)-3,3,3-D3-пропионовой кислоты и/или 2-амино-2-(CD2H)-3,3,3-D3-пропионовой кислоты и/или 2-амино-2-(CD2H)-3,3,3-D3-пропионовой кислоты и/или 2-амино-2-метил-3,3,3-D3-пропионовой кислоты и/или 2-амино-2-(CD2H)-3,3-D2-пропионовой кислоты и/или 2-амино-2-(CDH2)-3,3-D2-пропионовой кислоты и/или 2-амино-2-метил-3,3-D2-пропионовой кислоты и/или 2-амино-2-(CDH2)-3-D-пропионовой кислоты или 2-амино-2-метил-3-D-пропионовой кислоты и/или 2-метиламино-2-(CD3)-3,3,3-D3-пропионовой кислоты и/или 2-(N-(CD3)амино)-2-метилпропионовой кислоты и/или 2-(N-(CD3)амино)-2-(CD3)-3,3,3-D3-пропионовой кислоты.
В частных вариантах воплощения изобретения диагностический препарат по изобретению дополнительно включает недейтерированную 2-амино-2-метилпропионовую кислоту или 2-(N-метиламино)-2-метилпропионовую кислоту.
В частных вариантах воплощения изобретения дейтерированное производное 2-амино-2-метилпропионовой кислоты или 2-(N-метиламино)-2-метилпропионовой кислоты наряду с атомами дейтерия, связанными с атомами углерода, содержат атомы дейтерия, частично или полностью замещающие подвижные атомы водорода, связанные с атомами кислорода и/или азота.
Изобретение также включает получение диагностического препарата по изобретению.
Достижение указанного технического результата обеспечивается при осуществлении способа диагностики онкологического заболевания у субъекта, включающего следующие этапы:
а) вводят субъекту диагностический препарат по изобретению;
б) проводят магнитно-резонансную томографию и/или магнитно-резонансную спектроскопию на ядрах дейтерия после введения диагностического препарата через время, достаточное для накопления дейтерированного производного 2-амино-2-метилпропионовой кислоты и/или 2-(N-метиламино)-2-метилпропионовой кислоты и/или его фармацевтически приемлемой соли или смеси, по меньшей мере, двух разных дейтерированных производных 2-амино-2-метилпропионовой кислоты и/или 2-(N-метиламино)-2-метилпропионовой кислоты и/или его фармацевтически приемлемой соли в опухолевой ткани, для получения, соответственно, дейтериевой томограммы и/или ЯМР спектра;
в) диагностируют наличие или отсутствие онкологического заболевания на основании наблюдаемой интенсивности сигнала ядер дейтерия, отражающей уровень накопления дейтерированного производного 2-амино-2-метилпропионовой кислоты и/или 2-(N-метиламино)-2-метилпропионовой кислоты и/или его фармацевтически приемлемой соли или смеси, по меньшей мере, двух разных дейтерированных производных 2-амино-2-метилпропионовой кислоты и/или 2-(N-метиламино)-2-метилпропионовой кислоты и/или его фармацевтически приемлемой соли.
В частных вариантах воплощения изобретения в случае отсутствия областей накопления диагностического препарата у субъекта диагностируют отсутствие онкологического заболевания.
В частных вариантах воплощения изобретения предварительно проводят, по меньшей мере, одно дополнительное медицинское исследование, выбранное из магнитно-резонансной томографии на ядрах, отличных от ядер дейтерия, ультразвукового исследования, компьютерной томографии, рентгенографии, пальпации, биопсии, анализа биологических жидкостей на онкомаркеры, радионуклидной диагностики и/или визуального наблюдения.
В частных вариантах воплощения изобретения диагностируют наличие или отсутствие онкологического заболевания на основании сравнения интенсивности сигнала ядер дейтерия с типичной интенсивностью сигнала, наблюдаемой у здоровых субъектов в соответствующей ткани или соответствующем органе.
В частных вариантах воплощения изобретения диагностируют наличие или отсутствие онкологического заболевания на основании сравнения интенсивности сигнала ядер дейтерия в областях, соответствующих нормальной и аномальной ткани по данным дополнительных медицинских методов исследования.
В частных вариантах воплощения изобретения диагностируют наличие или отсутствие онкологического заболевания на основании сравнения дейтериевой томограммы с изображением, полученным в результате МРТ на ядрах протия.
В частных вариантах воплощения изобретения на основании наблюдаемой интенсивности сигнала ядер дейтерия делается вывод о структуре, злокачественности, агрессивности или степени дифференциации опухоли.
В частном варианте воплощения изобретения диагностируемое онкологическое заболевание представляет собой рак молочной железы, глиому.
В частных вариантах воплощения изобретения при регистрации дейтериевой томограммы используется селективное возбуждение ядер дейтерия, входящих в состав дейтерированных производных 2-амино-2-метилпропионовой кислоты и/или 2-(N-метиламино)-2-метилпропионовой кислоты и/или его фармацевтически приемлемой соли, или смеси дейтерированных производных 2-амино-2-метилпропионовой кислоты и/или 2-(N-метиламино)-2-метилпропионовой кислоты и/или его фармацевтически приемлемой соли.
В частных вариантах воплощения изобретения при регистрации дейтериевой томограммы используется широкополосное возбуждение ядер дейтерия, входящих в состав дейтерированной производных 2-амино-2-метилпропионовой кислоты и/или 2-(N-метиламино)-2-метилпропионовой кислоты и/или его фармацевтически приемлемой соли, или смеси дейтерированных производных 2-амино-2-метилпропионовой кислоты и/или 2-(N-метиламино)-2-метилпропионовой кислоты и/или его фармацевтически приемлемой соли.
В частных вариантах воплощения изобретения диагностический препарат вводят субъекту перорально.
В других частных вариантах воплощения изобретения диагностический препарат вводят субъекту парентерально.
В частных вариантах воплощения изобретения магнитно-резонансную томографию и/или магнитно-резонансную спектроскопию на ядрах дейтерия проводят через 20-360 минут после введения диагностического препарата.
В частных вариантах воплощения изобретения диагностический препарат вводят субъекту в количестве, соответствующем 0.25-1 г дейтерированного производного 2-амино-2-метилпропионовой кислоты и/или 2-(N-метиламино)-2-метилпропионовой кислоты и/или его фармацевтически приемлемой соли, или смеси дейтерированных производных 2-амино-2-метилпропионовой кислоты и/или 2-(N-метиламино)-2-метилпропионовой кислоты и/или его фармацевтически приемлемой соли на 1 кг массы тела субъекта
Изобретение также включает применение диагностического препарата по изобретению для диагностики онкологического заболевания посредством магнитно-резонансной томографии и/или магнитно-резонансной спектроскопии на ядрах дейтерия.
Краткое описание чертежей
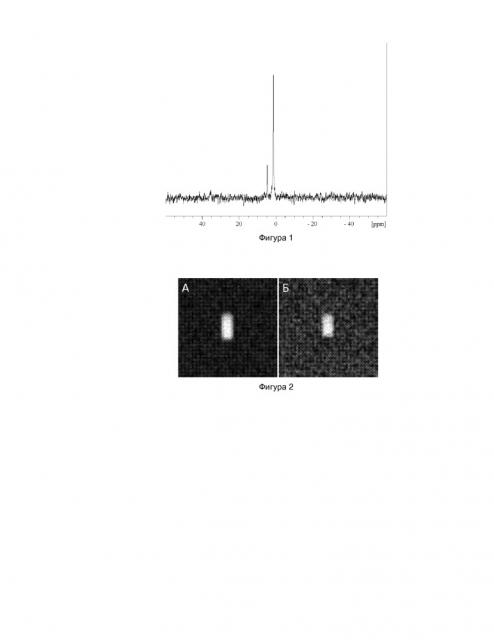
Фигура 1. 2Н спектр образца с 2-амино-2-(CD3)-3,3,3-D3-пропионовой кислотой;
Фигура 2. Дейтериевая томограмма образца, содержащего разбавленный раствор дейтерированного диагностического препарата: (а) широкополосное возбуждение; (б) селективное возбуждение на частоте 2-амино-2-(CD3)-3,3,3-D3-пропионовой кислотой;
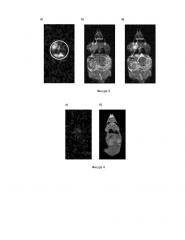
Фигура 3. Томограммы мыши №1 с карциномой молочной железы 4Т1 через 40 мин после введения 20 мг 2-амино-2-(CD3)-3,3,3-D3-пропионовой кислоты:
а) 2Н МРТ (положение поверхностной катушки показано белым контуром);
б) 1Н МРТ;
в) комбинированная томограмма.
Фигура 4. Томограммы мыши №2 без опухоли через 40 мин после введения 20 мг 2-амино-2-(CD3)-3,3,3-D3-пропионовой кислоты:
а) 2Н МРТ;
б) 1Н МРТ;
Фигура 5. Томограммы мыши №3 с карциномой молочной железы 4Т1 через 115 мин после введения 20 мг 2-амино-2-(CD3)-3,3,3-D3-пропионовой кислоты:
а) 2Н МРТ;
б) 1Н МРТ;
в) комбинированная томограмма.
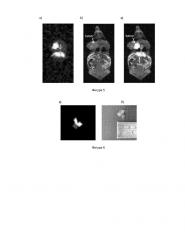
Фигура 6. 2Н томограмма (а) и фотография (б) опухоли, извлеченной из мыши №3 через 150 минут после введения 20 мг 2-амино-2-(CD3)-3,3,3-D3-пропионовой кислоты.
Фигура 7 . Томограммы мыши №4 с карциномой молочной железы 4Т1 через 20 мин после введения 20 мг 2-амино-2-(CD3)-3,3,3-D3-пропионовой кислоты:
а) 2Н МРТ;
б) 1Н МРТ;
в) комбинированная томограмма.
Фигура 8. Томограммы мыши №4 с карциномой молочной железы 4Т1 через 360 мин после введения 20 мг 2-амино-2-(CD3)-3,3,3-D3-пропионовой кислоты:
а) 2Н МРТ;
б) 1Н МРТ;
в) комбинированная томограмма.
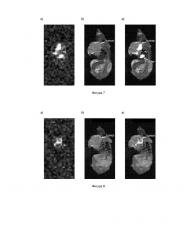
Фигура 9. Томограммы мыши №5 с карциномой молочной железы 4Т1 через 30 мин после введения 10 мг 2-амино-2-(CD3)-3,3,3-D3-пропионовой кислоты:
а) 2Н МРТ;
б) 1H МРТ;
в) комбинированная томограмма.
Фигура 10. Томограммы мыши №6 с карциномой молочной железы 4Т1 через 30 мин после введения 5 мг 2-амино-2-(CD3)-3,3,3-D3-пропионовой кислоты:
а) 2Н МРТ;
б) 1Н МРТ;
в) комбинированная томограмма.
Фигура 11. Томограммы крысы с глиомой С6 через 3 часа после введения 150 мг 2-амино-2-(CD3)-3,3,3-D3-пропионовой кислоты:
а) 2Н МРТ;
б) 1H МРТ;
в) комбинированная томограмма.
Фигура 12. Томограммы контрольной крысы без опухоли через 3 часа после введения 150 мг 2-амино-2-(CD3)-3,3,3-D3-пропионовой кислоты:
а) 2Н МРТ;
б) 1Н МРТ.
Определения и термины
Для лучшего понимания настоящего изобретения ниже приведены некоторые термины, использованные в настоящем описании изобретения.
В описании данного изобретения термины «включает» и «включающий» интерпретируются как означающие «включает, помимо всего прочего». Указанные термины не предназначены для того, чтобы их истолковывали как «состоит только из».
Под термином «дейтерированное производное» в данном документе понимается соединение, содержащее дейтерий, связанный с углеродом, в количестве, превышающем его природное содержание, по меньшей мере, в одном положении. В частных случаях воплощения изобретения содержание дейтерия, по меньшей мере, в одном положении, превышает 30%, в других частных случаях - 90%. Под «смесью, по меньшей мере, двух разных дейтерированных производных» понимается смесь соединений, содержащих дейтерий в разных положениях, или содержащих разное количество дейтерия в одном и том же положении. Символом «D» в данном документе обозначается атом водорода, представленный изотопом 2Н в доле, превышающей его природное содержание.
Под термином «воксел» в данном документе понимается произвольно выбираемый путем настройки параметров магнитного поля объем образца, в котором производится регистрация сигнала ядерного магнитного резонанса.
Используемый здесь термин «фармацевтически приемлемая соль» относится к таким солям, которые, в рамках проведенного медицинского заключения, пригодны для использования в контакте с тканями человека и животных без излишней токсичности, раздражения, аллергической реакции и т.д., и отвечают разумному соотношению пользы и риска. Фармацевтически приемлемые соли аминов, карбоновых кислот, фосфонатов и другие типы соединений хорошо известны в медицине. Соли могут быть получены in situ в процессе выделения или очистки соединений изобретения, а также могут быть получены отдельно, путем взаимодействия свободной кислоты или свободного основания соединения изобретения с подходящим основанием или кислотой, соответственно. Примером фармацевтически приемлемых, нетоксичных солей кислот могут служить соли аминогруппы, образованные неорганическими кислотами, такими как соляная, бромоводородная, фосфорная, серная и хлорная кислоты, или органическими кислотами, такими как уксусная, щавелевая, малеиновая, винная, янтарная или малоновая кислоты, или полученные другими методами, используемыми в данной области, например, с помощью ионного обмена. К другим фармацевтически приемлемым солям относятся адипинат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептанат, гексанат, гидройодид, 2-гидрокси-этансульфонат, лактобионат, лактат, лаурат, лаурил сульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканат, валериат и подобные. Типичные соли щелочных и щелочноземельных металлов содержат натрий, литий, калий, кальций, магний и другие. Кроме того, фармацевтически приемлемые соли могут содержать, если требуется, нетоксичные катионы аммония, четвертичного аммония и амина, полученные с использованием таких противоионов, как галогениды, гидроксиды, карбоксилаты, сульфаты, фосфаты, нитраты, низшие алкил сульфонаты и арил сульфонаты.
Диагностический препарат по изобретению может включать один или несколько любых фармацевтически приемлемых вспомогательных веществ, подходящих для конкретной формы дозирования, в частности, любых носителей, растворителей и/или наполнителей, таких, которые могут быть введены в организм пациента совместно с соединением, составляющем суть данного изобретения, и которые не разрушают эти соединения, и являются нетоксичными при введении.
Подробное раскрытие изобретения.
Для успешной реализации диагностики онкологического заболевания с помощью 2Н МРТ или 2Н ЯМР необходимо создание достаточно высокой концентрации дейтерия в опухолевой ткани. Чтобы удовлетворить этому критерию, диагностический препарат должен:
1) быстро и избирательно накапливаться в опухолевой ткани (в частности, необходимо наличие достаточно эффективного механизма мембранного транспорта);
2) характеризоваться достаточно медленным выведением (обеспечивает достаточное время для накопления больших количеств препарата в опухоли, а также для продолжительной регистрации 2Н томограмм;
3) не подвергаться существенному метаболизму (минимизирует возможные побочные эффекты, в том числе от включения дейтерия в биомолекулы и позволяет проводить повторную диагностику спустя несколько дней после введения препарата, без изменения фонового сигнала опухоли);
4) обладать низкой токсичностью в требуемой концентрации (делает возможным введение достаточно больших доз препарата);
5) содержать большое количество дейтерия (необходимо для достижения достаточной интенсивности сигнала).
Авторами данного изобретения было неожиданно обнаружено, что дейтерированное производное 2-амино-2-метилпропионовой кислоты и/или 2-(N-метиламино)-2-метилпропионовой кислоты по изобретению способно накапливаться в опухолевой ткани в концентрации, достаточной для визуализации опухолей in vivo методом 2Н МРТ или 2Н ЯМР, что в свою очередь позволяет осуществлять эффективную диагностику онкологических заболеваний посредством магнитно-резонансной томографии на ядрах дейтерия.
Благодаря низкому содержанию дейтерия в организме (0.015% атомов водорода), фоновые сигналы в 2Н МРТ на несколько порядков ниже, чем в 1Н МРТ. Таким образом, даже в низкой концентрации диагностического препарата его сигнал не накладывается на сигналы естественных фоновых компонентов. Разработка аналогичных методов с использованием недейтерированных диагностических препаратов на основе 1Н МРТ затруднена из-за существования большого количества фоновых сигналов естественных низкомолекулярных соединений с интенсивностью, сравнимой с максимальной достижимой интенсивностью сигнала недейтерированного диагностического препарата. В то же время, присутствие фонового сигнала дейтерия накладывает ограничения на минимальную приемлемую для 2Н МРТ концентрацию диагностического препарата в опухоли. Возможность практической реализации метода диагностики по изобретению зависит от фармакокинетики и фармакодинамики конкретного диагностического препарата.
Возможность регистрации сигнала дейтерия in vivo также определяется достаточным числом атомов дейтерия в структуре соединения. Так, диагностический препарат, включающий дейтерированное производное 2-амино-2-метилпропионовой кислоты и/или 2-(N-метиламино)-2-метилпропионовой кислоты, содержащее одну или более CD3 группы, является предпочтительным вариантом воплощения данного изобретения. Наличие таких групп позволяет проводить диагностику с использованием более низких доз диагностического препарата, что приводит к минимизации побочных эффектов.
Способ по изобретению позволяет диагностировать, в частности, наличие или отсутствие онкологического заболевания. Метод по изобретению основан на использовании дейтерированного диагностического препарата и регистрации томограмм и/или ЯМР спектров на частоте дейтерия.
Известно, что 1Н МРТ сама по себе во многих случаях обладает недостаточной диагностической точностью, в то время как способ по изобретению предоставляет данные о молекулярном транспорте 2-амино-2-метилпропионовой кислоты и/или 2-(N-метиламино)-2-метилпропионовой кислоты, недоступные в традиционных способах воплощения 1Н МРТ, и таким образом, потенциально позволяет получить более точную диагностическую информацию.
В одном из вариантов воплощения изобретения процесс диагностики включает проведение МРТ и осуществляется следующим образом:
а) в некоторых вариантах воплощения изобретения проводится МРТ на ядрах протия (1Н). Регистрация 1Н МРТ позволяет, во-первых, осуществить анатомическую привязку дейтериевого сигнала, во-вторых, идентифицировать области с подозрением на злокачественное образование (в других вариантах воплощения изобретения определение области проведения 2Н МРТ может быть осуществлено другими способами, в частности, посредством ультразвукового исследования, компьютерной томографии, рентгенографии, пальпации, биопсии, анализа биологических жидкостей на онкомаркеры, радионуклидной диагностики и/или визуального наблюдения);
б) вводится диагностический препарат;
в) через время, достаточное для накопления диагностического препарата в опухолевой ткани субъекта проводится регистрация томограммы на частоте прецессии ядер дейтерия диагностического препарата;
г) полученные дейтериевые томограммы анализируется с целью нахождения участков с аномально высокой интенсивностью и, следовательно, отвечающих накоплению диагностического препарата. В частности, возможно сравнение томограмм, полученных на 1Н и на 2Н: если аномальные участки на 1Н и 2Н совпадают, можно говорить о большей вероятности наличия злокачественного образования. Тем не менее, наличие аномалии на 1Н томограмме не является обязательным условием: могут существовать ситуации, когда новообразование не проявляется на томограмме, полученной посредством 1Н МРТ, в то время как наблюдается накопление диагностического препарата на томограмме, полученной посредством 2Н МРТ. В последнем случае 1Н МРТ служит только для анатомической привязки подозрительного участка.
В другом варианте воплощения изобретения процесс диагностики включает проведение ЯМР спектроскопии на ядрах дейтерия и осуществляется следующим образом:
а) проводится 1Н МРТ, в результате чего идентифицируются области с подозрением на злокачественное образование (в других вариантах воплощения изобретения определение области проведения 2Н МРТ может быть осуществлено другими способами, в частности, посредством ультразвукового исследования, компьютерной томографии, рентгенографии, пальпации, биопсии, анализа биологических жидкостей на онкомаркеры, радионуклидной диагностики и/или визуального наблюдения);
б) вводится диагностический препарат;
в) через время, достаточное для накопления диагностического препарата в опухолевой ткани субъекта в вокселах, соответствующих области с подозрением на злокачественное образование (например, по результатам 1Н МРТ), проводится регистрация спектра дейтерия (в частности, с использованием локальной спектроскопии); опционально проводится регистрация спектра в соседних вокселях для сравнения интенсивности сигнала; в частных вариантах воплощения спектроскопия может проводиться с использованием передающих, приемо-передающих, объемных, имплантных, поверхностных катушек;
г) интенсивность сигнала в вокселах, соответствующих области с подозрением на злокачественное образование, сравнивается, в частности, с: (i) типичными значениями для данной ткани (которые должны быть определены предварительно на здоровых субъектах) и/или (ii) интенсивностью в соседних вокселах, соответствующих тому же органу или ткани и свободных от аномалий по данным 1Н МРТ. Повышенная интенсивность сигнала позволяет говорить о накоплении диагностического препарата и, как следствие, о наличии злокачественного новообразования.
Порядок этапов а), б), в) в обоих вышеуказанных вариантах воплощения изобретения может быть другим, например, можно ввести диагностический препарат, провести 1Н МРТ, затем провести 2Н МРТ или 2Н ЯМР спектроскопию; или провести 1Н МРТ после проведения 2Н МРТ или 2Н ЯМР спектроскопии.
В частных случаях воплощения изобретения после идентификации области с подозрением на злокачественное образование выбираются отдельные вокселы, лежащие как в пределах, так и за пределами подозрительной области (в частности, может быть выбрана серия соседних вокселов, лежащих на одной линии, пересекающей границу подозрительной области). Регистрация интегрального сигнала 2Н или 2Н спектров в выбранных вокселах с последующим сравнением их интенсивности позволяет быстро и с большей чувствительностью обнаруживать области накопления диагностического препарата.
МРТ изображения и МР спектры могут быть получены на любом магнитно-резонансном томографе, оснащенном оборудованием для регистрации сигнала дейтерия.
В частных случаях воплощения изобретения использование диагностического препарата, дающего сигнал в области, свободной от фонового сигнала HOD, позволяет проводить МРТ с применением селективного возбуждающего импульса, настроенного на частоту диагностического препарата. Это позволяет избавиться от фонового сигнала HOD на томограмме.
Благодаря использованию молекулярных механизмов транспорта и накопления диагностического препарата по изобретению в клетках, способ по изобретению позволяет производить оценку метаболической активности исследуемой ткани, и, как следствие, оценивать злокачественность или агрессивность опухолевой ткани. Таким образом увеличивается диагностический потенциал метода по сравнению с традиционной 1Н магнитно-резонансной томографией, а также методами МРТ, основанными на оценке перфузии (в том числе, с контрастными агентами).
Сигнал диагностического препарата по изобретению может регистрироваться до 6 часов после введения, причем распределение препарата в опухоли и других органах меняется на протяжении всего этого времени. Так, сигнал диагностического препарата в первую очередь проявляется в печени и почках, затем в отдельных областях опухоли, вероятно, соответствующих областям наиболее активного роста и с наилучшим кровоснабжением. Максимум сигнала дейтерия во всем объеме опухоли при внутрибрюшинном введении наблюдается спустя два часа, в дальнейшем характер распределения диагностического препарата продолжает меняться. Благодаря такому поведению, повторное проведение томографии на протяжении нескольких часов после введения диагностического препарата по изобретению позволяет получать информацию как о скорости его мембранного транспорта, так и об уровне перфузии в разных частях опухоли, что, в свою очередь, дает информацию о строении и типе опухоли.
Проведенные исследования свидетельствуют о селективности накопления препарата по изобретению в опухолевой ткани по сравнению с мозгом, скелетными мышцами и другими органами и тканями в приемлемых для 2Н МРТ дозах.
Известно, что 2-амино-2-метилпропионовая кислота и 2-(N-метиламино)-2-метилпропионовая кислота являются непротеиногенными аминокислотами, таким образом, ихиспользование не приводит к долгосрочной фиксации дейтерия в составе белков. 2-Амино-2-метилпропионовая кислота и 2-(N-метиламино)-2-метилпропионовая кислота не метаболизируются с образованием дейтерированных кофакторов или других метаболитов, участвующих в базовых биохимических процессах. Из уровня техники известно, что присутствие дейтерия может существенно изменять скорости энзиматических реакций, что, в свою очередь, может приводить к накоплению токсичных интермедиатов и к другим нежелательным изменениям метаболизма. Таким образом, отсутствие метаболизма диагностического препарата по изобретению является фактором, снижающим вероятность развития побочных эффектов. Проведенные эксперименты показали отсутствие метаболических превращений диагностического препарата (отсутствие новых сигналов в 2Н ЯМР спектре крови, мочи, а также in vivo) по изобретению независимо от способа введения. Таким образом, наблюдаемая динамика накопления в опухоли и последующего выведения диагностического препарата по изобретению зависит только от скоростей транспорта между различными тканями и кровью и не осложняется метаболическими процессами.
Исследования, проведенные авторами изобретения, свидетельствуют о хорошей переносимости диагностического препарата животными, отсутствии видимых побочных эффектов при использовании в указанных дозах и полном выведении дейтерийсодержащих соединений из организма в течение нескольких дней. Так, при внутрибрюшинном введении препаратов по изобретению мышам дозировкой 8 г/кг не наблюдалась гибель животных, а через 72 часа после введения, препарат не наблюдался в опухоли по данным 2H магнитно-резонансной томографии. Фоновая концентрация дейтерия в опухоли и других тканях при этом оставалась прежней, что свидетельствует об отсутствии долгосрочного накопления препарата по изобретению в организме. Полное выведение дейтерия из опухолевых тканей позволяет проводить повторную диагностику через 72 часа и следить за динамикой развития опухоли в ходе лечения.
В результате проведенных исследований также показано, что результаты визуализации опухоли существенно зависят от дозы диагностического препарата в пределах допустимого диапазона. Меньшие дозы позволяют избирательно визуализировать участки опухоли, характеризующиеся наиболее интенсивным поглощением, в то время как увеличение дозы приводит к более полному заполнению границ опухоли сигналом дейтерия. Благодаря такому свойству диагностического препарата по изобретению возможно проведение динамических исследований (множественная регистрация томограмм) с постепенно возрастающей во времени концентрацией препарата в крови (например, в результате медленной внутривенной инфузии или серии последовательных инъекций малых доз препарата). Такие исследования могут предоставлять информацию одновременно о метаболической активности разных участков опухоли и о степени распространения опухолевого заболевания.
Способ по изобретению осуществляется без вредного воздействия ионизирующего излучения (характерного, например, для методов КТ, ПЭТ, ОФЭКТ), что в свою очередь повышает безопасность исследований, делает возможным проведение более частых повторных исследований, в частности делает метод привлекательным для педиатрии.
Способ диагностики по изобретению может применяться, в частности, для ранней диагностики опухолей различной локализации, метастатических поражений, оценки ответа опухоли на лечение и заключения об эффективности проводимой терапии, для уточнения диагноза, составленного на основании результатов 1Н МРТ и/или других методов диагностики.
Способ по изобретению может применяться для диагностики различных опухолей, в частности опухоли молочной железы и глиомы.
Способ по изобретению расширяет существующие методики диагностики онкологических заболеваний и позволяет осуществлять эффективную диагностику.
Осуществлен