Способ получения лакказ гриба myrothecium verrucaria вкм f-3851, трансформирующие фенольные соединения в нейтрально - щелочных условиях среды
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Способ получения лакказ штамма бактерий Myrothecium verrucaria ВКМ F-3851 предусматривает погруженное культивирование Myrothecium verrucaria ВКМ F-3851 на минеральной среде, содержащей в качестве натурального источника углерода и энергии по меньшей мере один компонент, выбранный из картофеля, ржи, пшеницы, гречихи, овса, ячменя, кукурузы, гороха, фасоли, а также NH4NO3, KH2PO4, K2HPO4, MgSO4x7H2O в заданных соотношениях компонентов. Штамм культивируют при перемешивании в течение 2-10 суток и температуре 29°С до получения максимальной активности лакказ в культуральной жидкости с последующим отделением мицелия от культуральной жидкости. Изобретение позволяет получить лакказы, способные трансформировать фенилпропаноиды. 4 з.п. ф-лы, 2 табл., 2 ил., 13 пр.
Реферат
Способ получения лакказ гриба Myrothecium verrucaria F-3851, трансформирующих фенольные соединения в нейтрально-щелочных условиях среды
Область техники, к которой относится изобретение.
Изобретение относится к биотехнологии, в частности к способу получения лакказ гриба Myrothecium verrucaria F-3851, показана способность культуральной жидкости указанного штамма трансформировать (в том числе полимеризовать) фенилпропаноиды и другие ароматические соединения в нейтрально-щелочных условиях среды.
Возможно применение лакказ, продуцируемых штаммом гриба предлагаемым способом, как в клеточных технологиях, осуществляемых в нейтрально-щелочных условиях среды, так и in vitro для модификации фенольных соединений и получения с их помощью ряда ценных биологически активных соединений, таких как биополимеры, антиоксиданты, противоопухолевые препараты, антибиотики, стероиды.
Уровень техники.
Лакказы (ЕС 1.10.3.2) - полифенолоксидазы из семейства медьсодержащих оксидаз, осуществляющих окисление широкого ряда фенольных и нефенольных соединений с сопутствующим восстановлением молекулярного кислорода до молекулы воды. Они обнаружены у растений, бактерий и грибов. Однако среди всех организмов большинство известных лакказ найдено у базидиомицетов - грибов белой гнили (1).
Наиболее изученные лакказы базидиомицетов, как правило, активны в кислой области рН (1-2), что препятствует их применению в ряде биотехнологических процессов, идущих в нейтрально-щелочной среде.
Для ряда аскомицетов показана способность продуцировать лакказы, активные в нейтрально-щелочных условиях рН: лакказы из Melanocarpus albomyces (3) и Myceliophthora thermophile (4) были активны с сирингалдазином при рН 6.0-7.0, лакказа из Acremonium murorum проявляла максимальную активность с сирингалдазином при рН 8.5-9.0 (5), а лакказа из Myrothecium verrucaria 24G-4 осуществляла реакцию полимеризации 4-аминоантипирина с фенолом оптимально при рН 9.0 (6).
Для грибов рода Myrothecium ранее была показана способность проявлять лакказную активность на примере штаммов М. verrucaria 24G-4 и NF-05 (6-8). В работе, описывающей лакказу М. verrucaria 24G-4 показана лишь способность фермента катализировать реакцию димеризации 4-аминоантипирина с фенолом (6), однако рН-оптимум и субстратная специфичность лакказы с другими соединениями фенольной структуры (2,6-диметоксифенолом, сирингалдазином и фенилпропаноидами - феруловой кислотой, n-кумаровым и конифериловым спиртами) не были исследованы. Также не была проведена оптимизация условий погруженного культивирования с целью повышения лакказной активности штамма (6). Лакказа из М. verrucaria NF-05 была получена в ходе погруженного культивирования на глюкозо-картофельной среде с добавлением на 4 сут роста сульфата меди в конечной концентрации 1 мМ: выход лакказы составил 40.2 ед/мл на 13 сут культивирования (7). Последующая оптимизация условий культивирования гриба М. verrucaria NF-05 посредством добавления индуктора (10 мкМ 3,3'-диметилбензидина) в среду культивирования позволило увеличить выход лакказы до 258.1 ед/мл, (8), что в 3.6 раза ниже уровня лакказной активности штамма М. verrucaria F-3851, полученного (в настоящей работе) в ходе погруженного культивирования в оптимальных условиях - в присутствии 150 г/л картофеля в качестве единственного источника углерода и энергии. У лакказы гриба М. verrucaria NF-05 также не были исследованы рН-оптимум и субстратная специфичность по отношению к фенольным соединениям (фенилпропаноидам и типичным субстратам лакказ - 2,6-диметоксифенолу и сирингалдазину). Для других видов рода Myrothecium и вовсе отсутствует информация о способности продуцировать лакказы.
Фенилпропаноиды являются структурными компонентами ряда полимерных соединений растительного происхождения, некоторые из которых (лигнаны - димеры монолигнолов) имеют фармакологическую ценность в связи с их биологической активностью (9).
Использование лакказ в биосинтезе фармакологически ценных полимеров в клеточных и других технологиях требует сохранение на высоком уровне лакказной активности в нейтрально-щелочных условиях в процессе реакции (10).
Исследования в области активности лакказ с фенилпропаноидами - относительно новое направление в биотехнологии. На данный момент имеется сообщение об успешном использовании грибных лакказ в гетеромолекулярной полимеризации с использованием предшественников монолигнолов (ферруловой, синаповой, кумаровой и сиреневой кислот) и других ароматических соединений с образованием красителей (11). Второе сообщение описывает возможность использования лакказ на примере растительной лакказы из Rhus vernicifera и базидиальных лакказ из Pycnoporus coccineus и Trametes sp.в гомомолекулярной полимеризации фенилпропаноидов с получением различных ди-, тетра- и олигополимеров (12-13). Показано, что продукты реакции (16 вариантов) отличаются при использовании грибных и растительной лакказ в качестве биокатализатора. Гомомолекулярная димеризация ферруловой кислоты также показана на примере лакказы из базидиального гриба Trametes versicolor (14). На данный момент отсутствует какая-либо информация об использовании алкалофильных лакказ аскомицетов в качестве катализаторов реакции полимеризации фенилпропаноидов.
Сущность изобретения
Технической задачей, на решение которой направлено предлагаемое изобретение, является разработка способа получения лакказ штамма гриба Myrothecium verrucaria F- 3851, способных трансформировать (в том числе полимеризовать) фенилпропаноиды и другие ароматические соединения в нейтрально-щелочных условиях.
Предложен способ получения лакказ штамма гриба Myrothecium verrucaria F-3851, активных в нейтрально-щелочных условиях среды, характеризующийся тем, что погруженное культивирование штамма гриба проводят в минеральной среде, с добавлением в качестве натурального источника углерода и энергии, по крайней мере, одного компонента, выбранного из ряда природных источников: картофель, рожь, пшеница, овес, гречиха, рис, ячмень, кукуруза, горох, фасоль, до получения максимальной активности лакказ в культуральной жидкости, полученную культуральную жидкость гриба отделяют от мицелия.
Натуральные источника углерода и энергии берут в следующих концентрациях (г/л): рожь - 10-40; картофель - 10-200; пшеница, овес, ячмень, рис, кукуруза, гречиха, горох или фасоль - 10.
Причем преимущественно в качестве натурального источника углерода и энергии применяют рожь или картофель.
При этом культивирование мицелия гриба осуществляют в минеральной среде следующего состава (г/л): NH4NO3 - 0,2; KH2PO4 - 0,2; K2HPO4 - 0,02; MgSO4 × 7Н2О - 0,12.
Культуральную жидкость гриба отделяют от мицелия центрифугированием.
Используемый в качестве продуцента лакказы штамм гриба Myrothecium verrucaria F- 3851 получен из коллекции ВКМ ИБФМ РАН.
Контроль за ходом культивирования штамма осуществляют по лакказной активности культуральной жидкости, которую определяют по степени окисления 1 мкМ АБТК (ε436=29300 M-1см-1) в 20 мМ Na-ацетатном буфере, рН 5.0 (15).
Измерения проводят в кварцевой кювете (1 см) при 25°С на спектрофотометре Shimadzu UV-160 (Япония) при 436 нм. За единицу активности лакказы принимают скорость превращения 1 мкМ субстрата 1 мл культуральной жидкости за 1 мин.
В частности, культивирование проводят в 100 мл минеральной среды в медицинских колбах объемом 750 мл при 29°С и перемешивании (200 об/мин) в течение 2-3 суток с конечным выходом лакказной активности в культуральной жидкости гриба 170.0±12.0 ед/мл в среде, содержащей 20 г/л ржи (Фиг. 1А), или 942.0±51.0 ед/мл в среде, содержащей 150 г/л картофеля (Фиг. 1Б) в качестве единственных источников углерода и энергии.
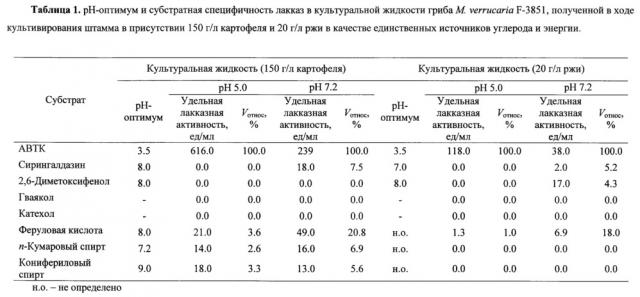
В ходе погруженного культивирования в оптимальных условиях гриб М. verrucaria F-3851 продуцирует лакказы с нейтрально-щелочным рН-оптимумом реакции окисления большинства протестированных субстратов (Таблица 1): сирингальдазина, 2,6-диметоксифенола, феруловой кислоты, кониферилового и n-кумарового спирта. Исключение составляет рН-оптимум окисления АБТК лакказами культуральной жидкости гриба, находящийся, как и у большинства типичных лакказ, в кислой области рН, что связано с природой самого субстрата (16-17).
Алкалофильные свойства продуцируемых грибом лакказ подтверждены исследованием избирательности лакказ культуральной жидкости штамма М. verrucaria F-3851 в реакции окисления типичных лакказных субстратов (Таблица 1). Большинство протестированных субстратов (сирингалдазин, 2,6-диметоксифенол, феруловая кислота, n-кумаровый и конифериловый спирты) более активно окисляются культуральной жидкостью гриба при рН 7.2, чем при рН 5.0, за исключением реакции с АБТК, что типично для всех лакказ и связано с природой субстрата (16-17).
В отличие от большинства известных лакказ (1) продуцируемые штаммом лакказы не активны с катехолом и гваяколом (Таблица 1).
Лакказы культуральных жидкостей гриба М. verrucaria F-3851, полученных в разных условиях культивирования (в присутствии 150 г/л картофеля или 20 г/л ржи в среде), имеют отличающуюся субстратную избирательность, что может свидетельствовать о продукции различных форм лакказ (Таблица 1).
Гриб М. verrucaria F-3851 также способен продуцировать алкалофильные лакказы с максимумом активности на 2-3 и 10-16 сут погруженного культивирования мицелия в минеральной среде, содержащей один из природных источников углерода и энергии в концентрации 10 г/л (Фиг. 2): размельченные зерна культур гречихи, ячменя, овса, пшеницы, ржи, риса, кукурузы, фасоли или гороха.
Проведенная в настоящей работе оптимизация условий погруженного культивирования М. verrucaria F-3851 в присутствии натуральных источников углерода и энергии (семян зерновых и бобовых культур, картофеля) позволила добиться максимальной продукции лакказ (942.0±51.0 ед/мл), превышающей ранее достигнутый выход (258.1 ед/мл) для других представителей рода Myrothecium (6-8). В описании известных способов (6-8) нет прямых совпадений со способом, предлагаемым авторами изобретения, в том числе используются и иные штаммы грибов.
В настоящей работе впервые показана продукция лакказ представителем рода Myrothecium, активно окисляющих фенилпропаноиды и другие фенольные соединения в нейтрально-щелочных условиях среды.
Лакказы культуральной жидкости гриба М. verrucaria F-3851 (0.4 ед/мл активности в реакции с АБТК) способны полностью разлагать 0.2 мМ феруловую кислоту или конифериловый спирт через 1,5-4 часа инкубирования в реакционной смеси при нейтральном рН. В то же время 0.2 мМ n-кумаровый спирт не полностью разлагается в тех же условиях за исследуемое время.
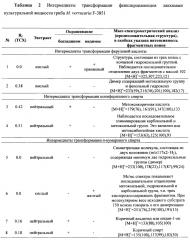
В результате трансформации феруловой кислоты лакказами культуральной жидкости гриба М. verrucaria F-3851 образуются 2 соединения с полимерной структурой: с [М+Н]+=325 и [М+Н]+=233 (Таблица 2). В ходе трансформации n-кумарового спирта лакказами культуральной жидкости гриба также образуется 2 интермедиата с полимерной структурой: с [М+Н]+=233 и [М+Н]+=251 (Таблица 2).
Лакказы культуральной жидкости гриба М. verrucaria F-3851 способны также катализировать реакции дегидроксилирования и изомеризации n-кумарового спирта с образованием коричного спирта с [М+Н]+=135 и коричного альдегида (или индан 1-она) с [М+Н]+=133.
В ходе трансформации кониферилового спирта лакказами культуральной жидкости гриба М. verrucaria F-3851 образуются продукты разложения исходного соединения: метоксикоричная кислота с [М+Н]+=179 - продукт дегидроксилирования и удаления кето-группы молекулы кониферилового спирта и продукт последовательного элиминирования карбонильной и метоксильной групп (ванилин или метоксибензойная кислота) с [М+Н]+=153. Других продуктов трансформации кониферилового спирта, имеющих полимерную структуру не найдено.
Таким образом, лакказы, продуцирующиеся в ходе погруженного культивирования гриба М. verrucaria F-3851, способны в нейтрально-щелочных условиях среды осуществлять широкий спектр реакций трансформации фенилпропаноидов: дегидроксилирования, окисления, расщепления и полимеризации исходных соединений и их производных.
Впервые показанная в ходе настоящей работы способность лакказ представителя аскомицетов - М. verrucaria F-3851 трансформировать фенилпропаноиды с образованием полимерных соединений дает возможность применения этих ферментов в клеточной биотехнологии получения фармакологически ценных лигнанов - димеров монолигнолов и их аналогов, осуществляемой в нейтрально-щелочных условиях. Способность лакказ гриба М. verrucaria F-3851 продуцировать лакказы, наиболее активные с большинством лакказных субстратов в нейтрально-щелочных условиях среды в отличие от типичных лакказ базидиальных грибов, дает возможность использовать подобные лакказы в ряде других биотехнологических процессов, идущих при рН>7.0.
Работа поддержана Министерством образования и науки РФ (Субсидия №14.616.21.0001, RFMEFI61614X0001).
Перечень фигур.
Фиг. 1 Динамика лакказной активности штамма М. verrucaria F-3851 в ходе погруженного культивирования в присутствии различных концентраций размельченных семян ржи (А) и свежих мелко-натертых клубней картофеля (Б).
Фиг. 2 Динамика лакказной активности гриба М. verrucaria F-3851 в ходе погруженного культивирования в присутствии различных источников углерода и энергии (10 г/л).
Сведения, подтверждающие возможность осуществления изобретения.
Пример 1. Культивирование штамма Myrothecium verrucaria F- 3851 с использованием с использованием семян ржи в различных концентрациях в качестве источника углерода и энергии с целью повышения лакказной активности гриба.
С целью хранения культуру гриба поддерживают при 29°С в пробирках со скошенным глюкозо-картофельным агаром (глюкоза - 10 г/л, свежий мелко-натертый картофель 200 г/л, агар - 20 г/л) и хранят при 4°С.
Инокулят грибной культуры выращивают в колбах объемом 750 мл, содержащих 100 мл стерильной среды (г/л: NH4NO3 - 0.2; KH2PO4 - 0.2; K2HPO4 - 0.02; MgSO4 × 7H2O - 0.12, мальт-экстракт -20). 4 Сут мицелий (3 кусочка диаметром 0.7 см), выращенный на глюкозо-картофельном агаре, вносят в колбы и инкубируют при 29°С в течение 5 сут при перемешивании (200 об/мин). Полученный инокулят гомогенизируют фарфоровыми бусами. Инокулят вносят из расчета 10 мл гомогенизированного мицелия на 100 мл жидкой минеральной среды. Погруженное культивирование гриба осуществляют при активном перемешивании (200 об/мин) и 29°С с добавлением размельченных семян ржи в различных концентрациях:
1) в присутствии 10 г/л - 2 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 86,0 ед/мл (Фиг. 1А);
2) в присутствии 20 г/л - 3 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 170,0 ед/мл (Фиг. 1А);
3) в присутствии 40 г/л - 2 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 7,5 ед/мл (Фиг. 1А).
Пример 2. Культивирование штамма Myrothecium verrucaria F- 3851 с использованием свежих мелко-натертых клубней картофеля в различных концентрациях в качестве источника углерода и энергии с целью повышения лакказной активности гриба.
Погруженное культивирование грибного мицелия штамма М. verrucaria F-3851 осуществляли в минеральной среде, как описано в Примере 1, с добавлением свежих мелко-натертых клубней картофеля в различных концентрациях:
1) в присутствии 10 г/л - 3 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 60,0 ед/мл (Фиг. 1Б);
2) в присутствии 20 г/л - 3 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 101,0 ед/мл (Фиг. 1Б);
3) в присутствии 40 г/л - 3 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 183,0 ед/мл (Фиг. 1Б);
4) в присутствии 80 г/л - 3 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 452,0 ед/мл (Фиг. 1Б);
5) в присутствии 150 г/л - 3 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 942,0 ед/мл (Фиг. 1Б);
6) в присутствии 200 г/л - 3 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 836,0 ед/мл (Фиг. 1Б).
Пример 3. Культивирование штамма Myrothecium verrucaria F- 3851 с использованием размельченных семян гречихи в качестве источника углерода и энергии с целью повышения лакказной активности гриба.
Культивирование гриба проводят, как описано в примере 1, в присутствии 10 г/л размельченных семян гречихи в течение 2 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 20,0 ед/мл (Фиг. 2).
Пример 4. Культивирование штамма Myrothecium verrucaria F- 3851 с использованием размельченных семян пшеницы в качестве источника углерода и энергии с целью повышения лакказной активности гриба.
Культивирование гриба проводят, как описано в примере 1, в присутствии 10 г/л размельченных семян пшеницы в течение 2 или 14 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 80,0 ед/мл или 93,0 ед/мл соответственно (Фиг. 2).
Пример 5. Культивирование штамма Myrothecium verrucaria F- 3851 с использованием размельченных семян ячменя в качестве источника углерода и энергии с целью повышения лакказной активности гриба.
Культивирование гриба проводят, как описано в примере 1, в присутствии 10 г/л размельченных семян ячменя в течение 2 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 55,0 ед/мл (Фиг. 2).
Пример 6. Культивирование штамма Myrothecium verrucaria F- 3851 с использованием размельченных семян кукурузы в качестве источника углерода и энергии с целью повышения лакказной активности гриба.
Культивирование гриба проводят, как описано в примере 1, в присутствии 10 г/л размельченных семян кукурузы в течение 2 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 17,0 ед/мл (Фиг. 2).
Пример 7. Культивирование штамма Myrothecium verrucaria F- 3851 с использованием размельченных семян риса в качестве источника углерода и энергии с целью повышения лакказной активности гриба.
Культивирование гриба проводят, как описано в примере 1, в присутствии 10 г/л размельченных семян риса в течение 3 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 25,0 ед/мл (Фиг. 2).
Пример 8. Культивирование штамма Myrothecium verrucaria F- 3851 с использованием размельченных семян овса в качестве источника углерода и энергии с целью повышения лакказной активности гриба.
Культивирование гриба проводят, как описано в примере 1, в присутствии 10 г/л размельченных семян овса в течение 10 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 40,0 ед/мл (Фиг. 2).
Пример 9. Культивирование штамма Myrothecium verrucaria F- 3851 с использованием размельченных зерен гороха в качестве источника углерода и энергии с целью повышения лакказной активности гриба.
Культивирование гриба проводят, как описано в примере 1, в присутствии 10 г/л размельченных зерен гороха в течение 2 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 60,0 ед/мл (Фиг. 2).
Пример 10. Культивирование штамма Myrothecium verrucaria F- 3851 с использованием размельченных семян фасоли в качестве источника углерода и энергии с целью повышения лакказной активности гриба.
Культивирование гриба проводят, как описано в примере 1, в присутствии 10 г/л размельченных семян фасоли в течение 10 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 20,0 ед/мл (Фиг. 2).
Пример 11. Определение рН-оптимума лакказ культуральной жидкости гриба Myrothecium verrucaria F- 3851.
Измеряют спектрофотометрически на спектрофотометре UV-160 («Shimadzu», Япония) рН-оптимум культуральной жидкости штамма гриба в кварцевой кювете с длиной оптического пути 10 мм при 25°С в универсальном Бриттон-Робинсон буфере (18) в интервале рН от 2,5 до 9,0. Бриттон-Робинсон буфер был получен смешиванием 0,1 М борной, 0,1 М ортофосфорной и 0,1 М уксусной кислот.
В качестве субстратов используют АБТК, сирингалдазин, n-кумаровый спирт, конифериловый спирт, феруловую кислоту.
Активность культуральной жидкости гриба с субстратами определяют по скорости образования продуктов с использованием коэффициентов молярной экстинкции (для АБТК - ε436=29300 М-1см-1 (15), для 2,6-диметоксифенола - ε470=35645 М-1см-1 (19), гваякола - ε436=6400 М-1см-1 (19); сирингалдазина - ε525=65000 М-1см-1 (20), катехола - ε392=14560 М-1см-1 (21)) или по скорости окисления субстрата (n-кумаровый спирт - ε259=13210 М-1см-1 (22); конифериловый спирт - ε263=13400 M-1см-1 (23); феруловая кислота - ε287=12483 M-1см-1 (22)).
За единицу активности лакказы принимают среднюю скорость превращения 1 мкМ субстрата в минуту 1 мл культуральной жидкости.
Реакцию начинают добавлением в реакционную смесь культуральной жидкости штамма гриба М. verrucaria F- 3851.
Для исследования рН-оптимума лакказ используют культуральные жидкости гриба М. verrucaria F- 3851, полученные при погруженном культивировании мицелия в присутствии 150 г/л картофеля или 20 г/л размельченных семян ржи в качестве единственного источника углерода и энергии в минеральной среде (Таблица 1):
- рН-оптимум окисления АБТК лакказами гриба М. verrucaria F- 3851 находится в области 3.5 для всех культуральных жидкостей штамма;
- максимальная активность лакказ штамма с 2,6-диметоксифенолом зарегистрирована при рН 8.0 для всех культуральных жидкостей штамма;
- с сирингалдазином лакказы культуральной жидкости штамма, полученной в ходе погруженного культивирования с 150 г/л картофеля, наиболее активны при рН 8.0, для лакказ культуральной жидкости, полученной в присутствии 20 г/л размельченных семян ржи рН-оптимум окисления находится при рН7.0;
- максимальное окисление кониферилового спирта лакказами культуральной жидкости штамма, полученной в ходе погруженного культивирования с 150 г/л картофеля, осуществляется при рН 9.0;
- рН-оптимум окисления n-кумарового спирта лакказами культуральной жидкости штамма, полученной в ходе погруженного культивирования с 150 г/л картофеля, находится в районе 7.2;
- оптимальное окисление феруловой кислоты лакказами культуральной жидкости штамма, полученной в ходе погруженного культивирования с 150 г/л картофеля, осуществляется при рН 8.0.
Пример 12. Определение субстратной избирательности лакказ культуральной жидкости штамма в зависимости от рН среды.
Субстратную избирательность культуральной жидкости измеряют спектрофотометрически на спектрофотометре UV-160 («Shimadzu», Япония) в кварцевой кювете с длиной оптического пути 10 мм при 25°С в двух буферах: 20 мМ Na-ацетатном буфере с рН 5.0 и 50 мМ трис-HCl с рН 7.2. В качестве субстратов используют АБТК, 2,6-диметоксифенол, сирингалдазин, гваякол, катехол, n-кумаровый спирт, конифериловый спирт и феруловую кислоту в концентрации 0.1 мМ в кювете.
Активность культуральной жидкости гриба с субстратами определяют по скорости образования продуктов или окисления субстратов (Пример 11). Реакцию начинают добавлением в реакционную смесь культуральной жидкости гриба. Измерение проводят как минимум в трех повторностях. За единицу активности лакказы принимают среднюю скорость превращения 1 мкМ субстрата в минуту 1 мл культуральной жидкости.
Субстратную избирательность оценивают по скорости окисления того или иного субстрата лакказами гриба М. verrucaria F- 3851, выраженную в процентах от скорости окисления АБТК при рН 5.0 и рН 7.2.
Лакказы культуральных жидкостей штамма гриба М. verrucaria F- 3851, полученные по предлагаемому способу, проявляют максимальную активность с замещенными фенолами, в том числе фенилпропаноидами (феруловая кислота, конифериловый и n-кумаровый спирты), за исключением АБТК, при рН 7.2 по сравнению с рН 5.0 (Таблица 1). Однако в разных условиях культивирования продуцируются лкказы с отличающейся субстратной избирательностью. Так, при рН 7.2 лакказы культуральной жидкости, полученной при погруженном культивировании мицелия с 150 г/л картофеля, были активны с АБТК (100%), сирингалдазином (7.5%), феруловой кислотой (20.8%), n-кумаровым спиртом (6.9%) и конифериловым спиртом (5.6%), в то время как лакказы культуральной жидкости гриба, полученные в ходе культивирования с 20 г/л семян ржи, окисляли в тех же условиях только АБТК (100%), сирингалдазин (5.2%), 2,6-диметоксифенол (4.3%) и феруловую кислоту (18.0%).
Из всех протестированных фенилпропаноидов полученные вышеуказанными способами лакказы гриба М. verrucaria F- 3851 были наиболее активны с феруловой кислотой (до 49.0 ед/мл при рН7.2).
В настоящей работе впервые для представителей рода аскомицетов Myrothecium представлены данные о возможности окисления фенилпропаноидов (феруловой кислоты, n-кумарового и кониферилового спиртов) лакказами культуральной жидкости гриба М. verrucaria F- 3851. Также в настоящей работе впервые для представителей рода Myrothecium была подробно исследована субстратная избирательность полученной по предлагаемому способу культуральной жидкости М. verrucaria F- 3851 в отношении фенилпропаноидов. Из всех известных в мире лакказ только для лакказ штамма М. verrucaria F- 3851 измерена субстратная избирательность при рН>7.0.
Пример 13. Осуществление трансформации фенилпропаноидов лакказами культуральной жидкости штамма Myrothecium verrucaria F- 3851.
Для исследования способности лакказ культуральной жидкости гриба трансформировать фенилпропаноиды используют 3 сут культуральную жидкость гриба М. verrucaria F-3851, полученную на пике лакказной активности при погруженном культивировании в минеральной среде в присутствии 150 г/л картофеля в качестве единственного источника углерода и энергии. Реакционная смесь содержит 0.2 мМ фенилпропаноид (феруловая кислота, конифериловый или n-кумаровый спирты), культуральную жидкость (0.4 ед/мл в реакции с АБТК) и 50 мМ трис-HCl буфер с рН 7.2. Реакцию начинают добавлением ферментного препарата, инкубируют при 29°С. Реакцию останавливают через 30 мин, 1 час, 2 часа, 4 часа и 24 часа путем добавления в реакционную смесь этилацетата.
Интермедиаты трансформации экстрагируют из культуральной жидкости этилацетатом. Нейтральные экстракты получают непосредственно из культуральной жидкости, кислые экстракты - после предварительного подкисления культуральной жидкости соляной кислотой до рН 2.0.
Идентификацию и препаративное выделение интермедиатов трансформации фенилпропаноидов проводят методом тонкослойной хроматографии (ТСХ) экстрактов на пластинках 60 F254 с силикагелем ("Merck", Германия). Для идентификации интермедиатов на старт наносят по 10 мкл полученных экстрактов. Экстракты разгоняют на расстояние 5.5 см в системе растворителей бензол - диоксан - уксусная кислота в соотношении 90:9:1. Для идентификации соединений используют УФ-свет и бензидиновый реактив (0.5 г бензидина растворяют в 1.4 мл концентрированной HCl и выдерживают 15 минут при комнатной температуре, затем доводят до 100 мл дистиллированной водой). Перед окрашиванием бензидиновый реактив смешивают с 10% раствором NaNO3 в соотношении 1:1. Идентификация метаболитов проводится с помощью величины Rf соединения, равной отношению расстояния, пройденного веществом в данной системе растворителей, к расстоянию, пройденному фронтом растворителя.
Для препаративного выделения метаболитов на старт наносят экстракт полоской в 4 см и элюируют в той же системе растворителей при длине фронта 11 см. Носитель с пятном интермедиата счищают с пластинки и дважды ресуспендируют в 2 мл метанола, центрифугируют при 4000 g в течение 15 мин. Надосадочную жидкость отбирают, переносят в колбу и упаривают на роторном испарителе.
Очищенные препараты интермедиатов анализируют методом масс-спектрометрии на приборе низкого разрешения LCQ Advantage MAX (Thermo Finnigan), используя одноканальный шприцевой насос для прямой инфузии метанольного раствора образца в область химической ионизации при атмосферном давлении (APCI). В ходе анализа используют различные условия работы источника ионов: нормализованная энергия столкновений - от 10 до 40% при скорости высушивающего газа 65 мл/мин и температуре капилляра 170°С. Сбор и обработку масс-спектрометрических данных проводят с помощью программного обеспечения Xcalibur™. Детекцию проводят как в положительных, так и в отрицательных ионах. МС/МС спектры получают, используя в качестве предшественников как протонированные [М+Н]+, так и депротонированные молекулы [М-Н]-. Идентификацию метаболитов осуществляют с использованием стандартных образцов исследуемых соединений, а также с привлечением данных библиотеки масс-спектров и опубликованных исследований.
Лакказы штамма гриба М. verrucaria F-3851, полученные при погруженном культивировании в минеральной среде в присутствии 150 г/л картофеля в качестве единственного источника углерода и энергии, способны трансформировать фенилпропаноиды при рН7.2 (Таблица 2):
- феруловую кислоту до полимера с [М+Н]+=325 и димера с [М+Н]+=233;
- конифериловый спирт до метоксикоричной кислоты ([М+Н]+=179) и до ванилина или метоксибензойной кислоты ([М+Н]+=153);
- n-кумаровый спирт до двух димеров ([М+Н]+=233 и [М+Н]+=251), а также до коричного альдегида или индан-1-он ([М+Н]+=133) и коричного спирта ([М+Н]+=135).
Способность лакказ М. verrucaria F-3851 трансформировать фенилпропаноиды с образованием полимерных соединений, показанная в настоящей работе впервые для представителей аскомицетов, делает подобные лакказы перспективными для клеточных биотехнологий получения фармакологически ценных полимеров, осуществляемых в нейтрально-щелочных условиях.
В тексте использованы следующие сокращения:
АБТК - 2,2-Азино-бис(3-этилбензотиазолин 6-сульфоновая кислота)
Использованная литература
1 Baldrian P. Fungal laccases-occurrence and properties. FEMS Microbiol. Rev. 2006, Vol. 30, P. 215-242.
2 Riva S. Laccases: blue enzymes for green chemistry. Trends Biotechnol. 2006, Vol. 24, P. 219-226.
3 Kiiskinen L.-L., Viikari L., Kruus K. Purification and characterisation of a novel laccase from the ascomycete Melanocarpus albomyces. Appl. Microbiol. Biotechnol. 2002, Vol. 59, P. 198-204.
4 Berka R.M., Schneider P., Golightly E.J., Brown S.H., Madden M., Brown K.M., Halkier Т., Mondorf K., Xu F. Characterization of the gene encoding an extracellular laccase of Myceliophthora thermophila and analysis of the recombinant enzyme expressed in Aspergillus oryzae. Appl. Environ. Microbiol. 1997, Vol. 63, P. 3151-3157.
5 Gouka R.J., van der Heiden M., Swarthoff Т., Verrips C.T. Cloning of a phenol oxidase gene from Acremonium murorum and its expression in Aspergillus awamori. Appl. Environ. Microbiol. 2001, Vol. 67, P. 2610-2616.
6 Sulistyaningdyah W.T., Ogawa J., Tanaka H., Maeda C., Shimizu S. Characterization of alkaliphilic laccase activity in the culture supernatant of Myrothecium verrucaria 24G-4 in comparison with bilirubin oxidase. FEMS Microbiol. Lett. 2004, Vol. 230, P. 209-214.
7 Zhao D., Zhang X., Cui D., Zhao M. Characterisation of a novel white laccase from the deuteromycete fungus Myrothecium verrucaria NF-05 and its decolorization of dyes. PlosOne. 2012, Vol. 7, e38817.
8 Zhao D., Cui D.Z., Mu J.S., Zhang X., Wang Y., Zhao M. Induction of a white laccase from the deuteromycete Myrothecium verrucaria NF-05 and its potential in decolorization of dyes. Biocatal. Biotransform. 2014, Vol. 32, P. 214-221.
9 Cunha W.R., Andrade e Silva M.L., Sola Veneziani R.C., S.R., Bastos J.K. Lignans: chemical and biological properties. Phytochemicals - a global perspective of their role in nutrition and health. Dr Venketeshwer Rao (Ed.), 2012, ISBN: 978-953-51-0296-0.
10 Witayakran S., Ragauskas A.J. Synthetic applications of laccase in green chemistry. Adv. Synth. Catal. 2009, Vol. 351, P. 1187-1209.
11 Polak J., Jarosz-Wilkolazka A. Fungal laccases as green catalysts for dye synthesis. Process. Biochem. 2012, Vol. 47, P. 1295-1307.
12 Wan Y.-Y., Due Y.-M., Miyakoshi T. Catalysis of monolignols and preparation of bioactive compounds by Rhus Laccases in organic/water system. 2008, www.paper.edu.cn/en_releasepaper/downPaper/200804-898.
13 Wan Y.-Y., Miyakoshi Т., Du Y.-M., Chen L.-J., Hao J.-M., Kennedy J.F. Mechanism of monolignol biotransformation by Rhus laccases in water-miscible organic solutions. Int. J. Biol. Macromol. 2012, Vol. 50, P. 530-533.
14 Constantin M.-A., Conrad J., Beifuss U. Laccase-catalyzed oxidative phenolic coupling of vanillidene derivatives. Green. Chem. 2012, Vol. 14, P. 2375-2379.
15 Perez J., Jeffries T.W. Mineralization of C-ring-labeled synthetic lignin correlates with the production of lignin peroxidase, not of manganese peroxidase or laccase. Appl. Environ. Microbiol. 1990, Vol. 56, P. 1806-1812.
16 Scott S.L., Chen W.J., Bakac A., Espenson J.H. Spectroscopic parameters, electrode potentials, acid ionization constants, and electron exchange rates of the 2,2'-azinobis(3-ethylbenzothiazoline-6-sulfonate)radicals and ions. J. Phys. Chem. 1993, Vol. 97, P. 6710-6714.
17 Branchi В., Galli C, Gentili P. Kinetics of oxidation of benzyl alcohols by the dication and radical cation of ABTS. Comparison with laccase-ABTS oxidations: an apparent paradox. Org. Biomol. Chem. 2005, Vol. 3, P. 2604-2614.
18 Xu F. Oxidation of phenols, anilines, and benzenethiols by fungal laccases: correlation between activity and redox potentials as well as halide inhibition. Biochemistry, 1996, Vol. 35, P. 7608-7614.
19 Eggert C., Temp U., Eriksson K.E. The ligninolytic system of the white rot fungus Pycnoporus cinnabarinus: purification and characterization of the laccase. Appl. Environ. Microbiol. 1996, Vol. 62, P. 1151-1158.
20 Leonowicz A., Grzywnowicz K. Quantitative estimation of laccase forms in some white-rot fungi using syringaldazine as a substrate. Enz. Microb. Technol. 1981, Vol. 3, P. 55-58.
21 Quaratino D., Federici F., Petruccioli M., Fenice M., D'Annibale A. Production, purification and partial characterisation of a novel laccase from the white-rot fungus Panus tigrinus CBS 577.79. Ant. Van Leeuwen. 2007, Vol. 91, P. 57-69.
22 Sterjiades R., Dean J.F.D., Eriksson K.-E.L. Laccase from Sycamore maple (Acer pseudoplatanus) polymerizes monolignols. Plant Physiol. 1992, Vol. 99, P. 1162-1168.
23 A., Huynh V.-B., Crawford R. Comparison of ligninase-I and peroxidase-M2 from the white-rot fungus Phanerochaete chrysosporium. Arch. Biochem. Biophys. 1986, Vol. 244, P. 750-765.
1. Способ получения лакказ штамма гриба Myrothecium verrucaria ВКМ F-3851, активных с фенольными соединениями, в частности фенилпропаноидами, в нейтрально-щелочных условиях среды, характеризующийся тем, что погруженное культивирование гриба Myrothecium verrucaria ВКМ F-3851 проводят в минеральной среде с добавлением в качестве натурального источника углерода и энергии по крайней мере одного компонента, выбранного из ряда: картофель, рожь, пшеница, овес, гречиха, рис, ячмень, кукуруза, горох, фасоль, до получения максимальной активности лакказ в культуральной жидкости, полученную культуральную жидкость гриба отделяют от мицелия.
2. Способ по п. 1, отличающийся тем, что натуральный источник углерода и энергии применяют в следующих концентрациях (г/л): картофель 10-150, рожь 10-40, пшеница 10, овес 10, гречиха 10, рис 10, ячмень 10, кукуруза 10, горох 10, фасоль 10.
3. Способ по п. 2, отличающийся тем, что применяют в качестве натурального источника углерода и энергии преимущественно картофель или рожь.
4. Способ по п. 1, отличающийся тем, что погруженное культивирование мицелия гриба Myrothecium verrucaria ВКМ F-3851 проводят в минеральной среде следующего состава (г/л): NH4NO3 - 0,2; KH2PO4 - 0,2; K2HPO4 - 0,02; MgSO4×7Н2О - 0,12.
5. Способ по п. 1, отличающийся тем, что культуральную жидкость гриба отделяют от мицелия центрифугированием.