Антитело против с5 и способ предупреждения и лечения обусловленных комплементом заболеваний
Иллюстрации
Показать всеИзобретение относится к биохимии. Описано антитело или его антигенсвязывающий фрагмент, которые специфически связываются с доменом MG4 в бета-цепи белка компонента 5 комплемента (C5), где антитело содержит определяющую комплементарность область 1 тяжелой цепи (CDR1), выбранную из группы, состоящей из SEQ ID NOs: 1, 11, 21, 31, 41 и 51, CDR2 тяжелой цепи, выбранную из группы, состоящей из SEQ ID NOs: 2, 12, 22, 32, 42 и 52, CDR3 тяжелой цепи SEQ ID NO: 3, CDR1 легкой цепи SEQ ID NO: 4, CDR2 легкой цепи SEQ ID NO: 5 и CDR3 легкой цепи SEQ ID NO: 6. Также описано моноклональное антитело, связывающееся с белком C5 человека, или его антигенсвязывающий фрагмент, содержащие вариабельную область тяжелой цепи, обладающую по меньшей мере 95% идентичностью последовательности с SEQ ID NO: 7, 17, 27, 37, 47 или 57; и вариабельную область легкой цепи, обладающую по меньшей мере 95% идентичностью последовательности с SEQ ID NO: 8. Кроме того, описано моноклональное антитело, связывающееся с белком C5 человека, или его антигенсвязывающий фрагмент, содержащие тяжелую цепь, обладающую по меньшей мере 95% идентичностью последовательности с SEQ ID NO: 9, 19, 29, 39, 49 или 59; и легкую цепь, обладающую по меньшей мере 95% идентичностью последовательности с SEQ ID NO: 10. Представлена фармацевтическая композиция для лечения заболеваний, обусловленных компонентом 5 комплемента, содержащая любой из указанных антител и соответствующий способ лечения. Описана нуклеиновая кислота, кодирующая моноклональное антитело, связывающееся с белком C5 человека, или его антигенсвязывающий фрагмент, содержащие вариабельную область тяжелой цепи, обладающую по меньшей мере 95% идентичностью последовательности с SEQ ID NO: 7, 17, 27, 37, 47 или 57; и вариабельную область легкой цепи, обладающую по меньшей мере 95% идентичностью последовательности с SEQ ID NO: 8. Также описаны соответствующий вектор экспрессии и клетка-хозяин. 12 н. и 16 з.п. ф-лы, 19 ил., 14 табл., 11 пр.
Реферат
[Область техники]
Настоящее изобретение относится к антителу против компонента 5 комплемента (C5) и к способу предупреждения и лечения обусловленных комплементом заболеваний с использованием антитела.
[Уровень техники]
Система комплемента является первой стадией врожденного иммунитета для наиболее быстрого распознавания и уничтожения источника инфекции. Кроме того, система комплемента играет важную роль в объединении врожденного иммунитета и адаптивного иммунитета путем взаимодействия с иммунными клетками. Система комплемента активируется классическим каскадом, альтернативным каскадом или лектиновым каскадом, а затем активируются различные типы белков комплемента. Белки системы комплемента активируют секрецию воспалительных веществ, контролируют воспалительный ответ посредством взаимодействия с иммунными клетками и эффективно элиминируют внешние источники инфекции путем образования веществ, атакующих источник инфекции и т.п. Известно, что, поскольку система комплемента ингибирует избыточное увеличение активности комплемента различными типами комплемент-регулирующих белков, поддерживает гомеостаз и играет критическую роль посредством различных стадий воспалительного ответа и иммунного ответа, когда белок комплемента и комплемент-регулирующий белок не контролируются надлежащим образом, возникают различные заболевания.
Когда система комплемента активируется по классическому пути, альтернативному пути и лектиновому пути, конвертаза компонента 5 комплемента (C5) расщепляет C5 на C5a и C5b.
C5 экспрессируется внутриклеточно в качестве единичного про-C5-пептида из 1676 аминокислот, состоящего из сигнальных последовательностей из 18 остатков и Arg-богатой линкерной последовательности (RPRR) между зрелой N-концевой β-цепью и C-концевой α-цепью. Зрелый C5 имеет молекулярную массу приблизительно 190 кДа и состоит из двух полипептидных цепей (α 115 кДа и β 75 кДа), которые соединены дисульфидными связями. C5-конвертаза расщепляет остатки C5 между остатками 74 и 75 альфа-цепи, высвобождая C5a-пептид из 74 аминокислот и фрагмент C5b, который впоследствии включается в мембраноатакующий комплекс (MAC).
C5a, который представляет собой анафилатоксин, прямо активирует лейкоциты и тромбоциты и функционирует в качестве фактора хемотаксиса нейтрофилов. C5b образует мембраноатакующий комплекс вместе с C6, C7, C8 и C9 на конечной стадии активации комплемента, индуцируя гемолиз.
Когда система комплемента чрезмерно активируется вследствие аномального иммунного ответа и происходит повреждение нормальных клеток, аномальная активность системы комплемента обуславливает аутоиммунные заболевания, опосредуемые комплементом заболевания и т.п. Гемолитическое заболевание крови представляет собой обусловленное комплементом заболевание, когда клетки крови не защищены от атаки белков комплемента вследствие генетических дефектов. Было описано, что активация комплемента также связана с интенсивным иммунным ответом и разрушающей ткани реакцией, которая происходит при ревматоидном артрите, трансплантации и т.п., и при повреждении тканей, также как и при иммунной реакции вследствие активации комплемента высвобождаются такие материалы, как VEGF, вызывая ангиогенез, что приводит к связанной с возрастом дегенерации желтого пятна и диабетической ретинопатии.
Таким образом, система комплемента играет важную роль в поддержании здоровья; однако она потенциально вызывает заболевания или вносит вклад в возникновение заболеваний. Таким образом, является предпочтительной разработка нового антитела и т.п. против системы комплемента для применения для лечения и диагностики обусловленных комплементом заболеваний.
Предусматриваются композиция, содержащая ингибитор комплемента, способ лечения или предупреждения обусловленных комплементом заболеваний, и их применение.
[Сущность изобретения]
[Техническая проблема]
Настоящее изобретение было осуществлено в попытках предоставить молекулу, связывающую компонент C5 комплемента (например, связывающее C5 антитело или его антигенсвязывающий фрагмент), фармацевтическую композицию, содержащую эту молекулу, способ получения молекулы и композиции, и способ применения молекулы и композиции, и применение молекулы и композиции.
Кроме того, настоящее изобретение было осуществлено в попытках предоставить антитело, специфически связывающееся с белком C5, или его антигенсвязывающий фрагмент.
Кроме того, настоящее изобретение было осуществлено в попытках предоставить нуклеиновую кислоту, содержащую нуклеотидную последовательность, кодирующую полипептид, содержащий вариабельную область тяжелой цепи, обладающую по меньшей мере 90%, 95%, 97%, 98% или по меньшей мере 99% идентичностью последовательности с последовательностью, выбранной из SEQ ID NO: 7, 17, 27, 37, 47 или 57.
Кроме того, настоящее изобретение было осуществлено в попытках предоставить нуклеиновую кислоту, содержащую нуклеотидную последовательность, кодирующую полипептид, содержащий вариабельную область легкой цепи, имеющую по меньшей мере 90, 95%, 97%, 98% или по меньшей мере 99% идентичность последовательности с любой из последовательностей, выбранных из SEQ ID NO: 8, 18, 28, 38, 48 или 58.
Кроме того, настоящее изобретение было осуществлено в попытках предоставить вектор и клетку-хозяина, содержащую нуклеиновую кислоту, как описано выше.
Кроме того, настоящее изобретение было осуществлено в попытках предоставить фармацевтическую композицию, содержащую: по меньшей мере одну связывающую C5 молекулу (например, связывающее C5 антитело или его антигенсвязывающий фрагмент).
Кроме того, настоящее изобретение было осуществлено в попытках предоставить способ лечения или диагностики обусловленных комплементом заболеваний с использованием связывающей C5 молекулы.
Кроме того, настоящее изобретение было осуществлено в попытках предоставить набор для диагностики обусловленных комплементом заболеваний, содержащий связывающую C5 молекулу и контейнер.
Кроме того, настоящее изобретение было осуществлено в попытках обеспечить применение связывающей C5 молекулы для получения лекарственного средства для лечения обусловленных комплементом заболеваний.
Кроме того, настоящее изобретение было осуществлено в попытках обеспечить применение связывающей C5 молекулы для лечения обусловленных комплементом заболеваний.
[Решение проблемы]
Иллюстративный вариант осуществления настоящего изобретения относится к антителу, специфически связывающемуся с белком C5, или к его антигенсвязывающему фрагменту. Антитело по настоящему изобретению или его антигенсвязывающий фрагмент могут предупреждать или лечить обусловленные комплементом заболевания путем ингибирования активации комплемента посредством специфического связывания с белком C5.
"Антитело" по настоящему изобретению включает целые антитела и любую их антигенсвязывающую часть или их отдельные цепи. Встречающееся в природе "антитело" представляет собой гликопротеин, содержащий по меньшей мере две тяжелых (H) цепи и две легких (L) цепи, связанных между собой дисульфидными связями. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (VH) и константной области тяжелой цепи (CH). Константная область тяжелой цепи состоит из трех доменов: CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (VL) и константной области легкой цепи (CL). Константная область легкой цепи состоит из одного домена CL. Области VH и VL могут быть дополнительно подразделены на области гипервариабельности, обозначаемые как определяющие комплементарность области (CDR), между которыми распределены области, которые являются более консервативными, которые называют каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от N-конца к C-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном.
В некоторых иллюстративных вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые специфически связываются с белком C5, в соответствии с настоящим изобретением специфически связываются с бета-цепью (β-цепь) C5, более конкретно с доменом MG4 бета-цепи C5 и более конкретно, исходя из аминокислотных последовательностей бета-цепи (номера аминокислот следует считать от первой аминокислоты зрелого белка C5, Gln), с последовательностями аминокислотных остатков с 332 по 398, предпочтительно последовательностями аминокислотных остатков с 332 по 378 и более предпочтительно последовательностями аминокислотных остатков с 332 по 364, более предпочтительно последовательностями аминокислотных остатков с 332 по 348 и/или последовательностями аминокислотных остатков с 350 по 420, предпочтительно с 369 по 409, более предпочтительно с 379 по 398 и более предпочтительно с 386 по 392. Например, что касается связываемого белка C5, аминокислотные последовательности белка C5 человека представлены в SEQ ID NO: 61, аминокислотные последовательности бета-цепи белка C5 человека представлены в SEQ ID NO: 62, и аминокислотные последовательности домена MG4 бета-цепи белка C5 человека представлены в SEQ ID NO: 63. Также предусматривается межвидовая перекрестная реактивность с другими видами, такими как кролики, крысы, обезьяны и т.п.
В некоторых иллюстративных вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые специфически связываются с белком C5 в соответствии с настоящим изобретением, имеют константу аффинности (KA) по меньшей мере 1×107 M-1, 1×108 M-1, 1×109 M-1, 1×1010 M-1 или 1×1011 M-1.
В некоторых иллюстративных вариантах осуществления антитело или его антигенсвязывающий фрагмент в соответствии с настоящим изобретением представляют собой антитела, связывающиеся с тем же эпитопом, с которым связываются антитела, представленные в таблицах 1-6 ниже, или их антигенсвязывающие фрагменты, и они обладают по меньшей мере 90%, 95%, 97%, 98% или по меньшей мере 99% идентичностью последовательности с соответствующими последовательностями. Кроме того, также в объем настоящего изобретения входят антитела, обладающие активностью ингибирования комплемента. Кроме того, в случае некоторых модификаций в константных областях тяжелых и легких цепей, которые являются очевидными, в объем настоящего изобретения входят модификации в пределах, в которых обеспечивается та же или сходная активность ингибирования комплемента. Кроме того, поскольку каждое из этих антител способно связываться с C5, нуклеотидные последовательности, которые кодируют VH, VL, полноразмерные последовательности тяжелой цепи и полноразмерные последовательности легкой цепи (аминокислотные последовательности и нуклеотидные последовательности, которые кодируют аминокислотные последовательности) можно "смешивать и подбирать" для получения связывающих C5 антител по настоящему изобретению.
| Таблица 1Антитело против C5 (HRA-06-H2-1) | |
| HRA-06-H2-1 | SEQ ID NO и последовательность |
| CDRH1CDR1 тяжелой цепи | 1.GFSFSGRYWIQ |
| CDRH2CDR2 тяжелой цепи | 2.SVWPGITGDTNYANWAKG |
| CDRH3CDR3 тяжелой цепи | 3.EPVAWGGGLDL |
| CDRL1CDR1 легкой цепи | 4.QASQSINNQLS |
| CDRL2CDR2 легкой цепи | 5.YASTLAS |
| CDRL3CDR1 легкой цепи | 6.QGSYYSGGWDYG |
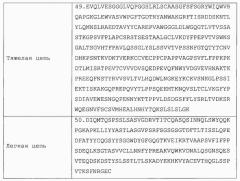
| VHВариабельная область тяжелой цепи | 7.EVQLVESGGGLVQPGGSLRLSCAASGFSFSGRYWIQWVRQAPGKGLEWVASVWPGITGDTNYANWAKGRFTISRDDSKNTLYLQMNSLRAEDTAVYYCAREPVAWGGGLDLWGQGTLVTVSS |
| VLВариабельная область легкой цепи | 8.DIQMTQSPSSLSASVGDRVTITCQASQSINNQLSWYQQKPGKAPKLLIYYASTLASGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQGSYYSGGWDYGFGQGTKVEIK |
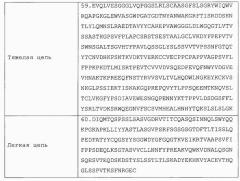
| Тяжелая цепь | 9.EVQLVESGGGLVQPGGSLRLSCAASGFSFSGRYWIQWVRQAPGKGLEWVASVWPGITGDTNYANWAKGRFTISRDDSKNTLYLQMNSLRAEDTAVYYCAREPVAWGGGLDLWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKCCVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK |
| Легкая цепь | 10.DIQMTQSPSSLSASVGDRVTITCQASQSINNQLSWYQQKPGKAPKLLIYYASTLASGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQGSYYSGGWDYGFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC |
| Таблица 2Антитело против C5 (HRA-06-H2-7) | |
| HRA-06-H2-7 | SEQ ID NO и последовательность |
| CDRH1 | 11.GFSFSGRYWIQ |
| CDRH2 | 12.SGWPGATGDTNYANWAKG |
| CDRH3 | 13.EPVAWGGGLDL |
| CDRL1 | 14.QASQSINNQLS |
| CDRL2 | 15.YASTLAS |
| CDRL3 | 16.QGSYYSGGWDYG |
| VH | 17.EVQLVESGGGLVQPGGSLRLSCAASGFSFSGRYWIQWVRQAPGKGLEWVASGWPGATGDTNYANWAKGRFTISRDDSKNTLYLQMNSLRAEDTAVYYCAREPVAWGGGLDLWGQGTLVTVSS |
| VL | 18.DIQMTQSPSSLSASVGDRVTITCQASQSINNQLSWYQQKPGKAPKLLIYYASTLASGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQGSYYSGGWDYGFGQGTKVEIK |
| Тяжелая цепь | 19.EVQLVESGGGLVQPGGSLRLSCAASGFSFSGRYWIQWVRQAPGKGLEWVASGWPGATGDTNYANWAKGRFTISRDDSKNTLYLQMNSLRAEDTAVYYCAREPVAWGGGLDLWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKCCVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK |
| Легкая цепь | 20.DIQMTQSPSSLSASVGDRVTITCQASQSINNQLSWYQQKPGKAPKLLIYYASTLASGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQGSYYSGGWDYGFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC |
| Таблица 3Антитело против C5 (HRA-06-H2-18) | |
| HRA-06-H2-18 | SEQ ID NO и последовательность |
| CDRH1 | 21.GFSFSGRYWIQ |
| CDRH2 | 22.SSSLRGTGDTNYANWAKG |
| CDRH3 | 23.EPVAWGGGLDL |
| CDRL1 | 24.QASQSINNQLS |
| CDRL2 | 25.YASTLAS |
| CDRL3 | 26.QGSYYSGGWDYG |
| VH | 27.EVQLVESGGGLVQPGGSLRLSCAASGFSFSGRYWIQWVRQAPGKGLEWVASSSLRGTGDTNYANWAKGRFTISRDDSKNTLYLQMNSLRAEDTAVYYCAREPVAWGGGLDLWGQGTLVTVSS |
| VL | 28.DIQMTQSPSSLSASVGDRVTITCQASQSINNQLSWYQQKPGKAPKLLIYYASTLASGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQGSYYSGGWDYGFGQGTKVEIK |
| Тяжелая цепь | 29.EVQLVESGGGLVQPGGSLRLSCAASGFSFSGRYWIQWVRQAPGKGLEWVASSSLRGTGDTNYANWAKGRFTISRDDSKNTLYLQMNSLRAEDTAVYYCAREPVAWGGGLDLWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKCCVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK |
| Легкая цепь | 30.DIQMTQSPSSLSASVGDRVTITCQASQSINNQLSWYQQKPGKAPKLLIYYASTLASGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQGSYYSGGWDYGFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC |
| Таблица 4Антитело против C5 (HRA-06-H2-24) | |
| HRA-06-H2-24 | SEQ ID NO и последовательность |
| CDRH1 | 31.GFSFSGRYWIQ |
| CDRH2 | 32.SVWPGFTGDTNYANWAKG |
| CDRH3 | 33.EPVAWGGGLDL |
| CDRL1 | 34.QASQSINNQLS |
| CDRL2 | 35.YASTLAS |
| CDRL3 | 36.QGSYYSGGWDYG |
| VH | 37.EVQLVESGGGLVQPGGSLRLSCAASGFSFSGRYWIQWVRQAPGKGLEWVASVWPGFTGDTNYANWAKGRFTISRDDSKNTLYLQMNSLRAEDTAVYYCAREPVAWGGGLDLWGQGTLVTVSS |
| VL | 38.DIQMTQSPSSLSASVGDRVTITCQASQSINNQLSWYQQKPGKAPKLLIYYASTLASGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQGSYYSGGWDYGFGQGTKVEIK |
Антитело по настоящему изобретению получают с использованием всех антител, содержащих аминокислоты, которые идентичны антителам, представленным в таблицах 1-6; антител, имеющих вариабельные области тяжелой цепи, содержащие последовательности CDR1, CDR2 и CDR3, и вариабельные области легкой цепи, содержащие последовательности CDR1, CDR2 и CDR3, где по меньшей мере одна из последовательностей CDR имеет последовательность антитела, описанного в рамках настоящего изобретения, или конкретные аминокислотные последовательности на основе его консервативных модификаций; антител, имеющих функциональные свойства связывающего С5 антитела по настоящему изобретению; антител, связывающихся с тем же эпитопом, что и антитела, представленные в таблицах 1-6; антител, имеющих по меньшей мере одну из последовательностей VH и/или VL, описанных в рамках настоящего изобретения, в качестве исходного материала для конструирования модифицированного антитела, и оно включает все антитела, имеющие свойства, которые частично модифицированы относительно исходного антитела, включая описанные выше
антитела.
Кроме того, антитело по настоящему изобретению включает антитела, в которых в каркасные остатки VH и/или VL внесены модификации для улучшения свойств антитела.
Кроме того, антитело по настоящему изобретению может представлять собой полностью человеческое антитело, специфически связывающееся с белком C5. По сравнению с химерными антителами и т.п., антитело по настоящему изобретению может иметь дополнительно сниженную антигенность при введении человеку. Антитело человека включает вариабельные области тяжелой и легкой цепей или полноразмерные тяжелые или легкие цепи, которые являются продуктами или происходят из конкретной последовательности эмбрионального типа, если вариабельные области или полноразмерные цепи антитела получены из системы, в которой используются гены иммуноглобулинов человека эмбрионального типа. Такие системы включают иммунизацию трансгенной мыши, содержащей гены иммуноглобулинов человека, представляющим интерес антигеном или скрининг библиотеки генов иммуноглобулинов человека, экспонированных на фаге, с представляющим интерес антигеном. Антитело человека, которое является "продуктом" или "происходит из" последовательности иммуноглобулина человека эмбрионального типа, можно идентифицировать по существу путем сравнения аминокислотной последовательности антитела человека с аминокислотными последовательности иммуноглобулинов человека эмбрионального типа и отбора последовательностей иммуноглобулинов человека эмбрионального типа, которые являются наиболее сходными с последовательностью антитела человека.
Кроме того, антитело по настоящему изобретению может представлять собой биспецифическое или полиспецифическое антитело. Антитело по настоящему изобретению или его антигенсвязывающий фрагмент могут представлять собой биспецифические молекулы, которые связываются более чем с двумя различными участками связывания или молекулами-мишенями.
В некоторых иллюстративных вариантах осуществления антитело по настоящему изобретению может представлять собой моноклональное антитело, специфически связывающееся с белком C5. Например, антитело по настоящему изобретению может представлять собой моноклональное антитело человека или гуманизированное моноклональное антитело или химерное антитело, которое специфически связывается с белком C5, и оно включает константную область тяжелой цепи человека и константную область легкой цепи человека. Кроме того, антитело по настоящему изобретению может представлять собой одноцепочечное антитело, и оно может представлять собой Fab-фрагмент, одноцепочечный вариабельный фрагмент (scFv) и IgG-изотип. Предпочтительные изотипы IgG включают IgG2, IgG4 и/или IgG2/4. В некоторых иллюстративных вариантах осуществления IgG-изотип по настоящему изобретению представляет собой IgG2/4. Гибридная константная область IgG2/4 может иметь форму, в которой CH1 и шарнирная область IgG2 слиты с областями CH2 и CH3 из IgG4.
Моноклональное антитело можно получать общими способами получения моноклональных антител, и их можно экспрессировать и очищать путем встраивания синтезированного гена антитела в вектор для экспрессии антитела, предпочтительно, pcDNA, pCI, pCMV, pCEP4 и т.п. Кроме того, моноклональное антитело можно получать с использованием вирусной или канцерогенной трансформации B-лимфоцитов или на основе последовательности моноклонального антитела мыши, продуцированной с использованием системы мыши. Например, ДНК, кодирующую иммуноглобулин тяжелой цепи и легкой цепи, можно получать стандартными способами из гибридомы мыши, и, кроме того, она вместе с тем может содержать не являющиеся мышиными последовательности иммуноглобулинов. Кроме того, моноклональное антитело человека против C5 можно получать с использованием трансгенных или трансхромосомных мышей, имеющих часть иммунной системы человека вместо иммунной системы мыши.
В некоторых иллюстративных вариантах осуществления настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, содержащим каркасную область, где в соответствующие последовательности VH или VL человека эмбрионального типа внесены замены аминокислот.
В некоторых иллюстративных вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые специфически связываются с белком C5 в соответствии с настоящим изобретением, включают по меньшей мере одну последовательность определяющей комплементарность области (CDR), имеющую по меньшей мере 95% идентичность последовательности с SEQ ID NO: 1, 2, 3, 4, 5, 6, 11, 12, 21, 22, 31, 32, 41, 42, 51 или 52.
В некоторых иллюстративных вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые специфически связываются с белком C5 в соответствии с настоящим изобретением, включают по меньшей мере одну последовательность определяющей комплементарность области тяжелой цепи, являющуюся такой же, как и SEQ ID NO: 1, 2, 3, 11, 12, 21, 22, 31, 32, 41, 42, 51 или 52.
В некоторых иллюстративных вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые специфически связываются с белком C5 в соответствии с настоящим изобретением, включают по меньшей мере одну последовательность определяющей комплементарность области легкой цепи, являющуюся такой же, как и SEQ ID NO: 4, 5 или 6.
В некоторых иллюстративных вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые специфически связываются с белком C5 в соответствии с настоящим изобретением, включают любую определяющую комплементарность область 1 (CDR1) тяжелой цепи, выбранную из SEQ ID NO: 1, 11, 21, 31, 41 или 51, любую определяющую комплементарность область 2 (CDR2) тяжелой цепи, выбранную из SEQ ID NO: 2, 12, 22, 32, 42 или 52, и/или любую CDR3 тяжелой цепи, выбранную из SEQ ID NO: 3, 13, 23, 33, 43 или 53.
В некоторых иллюстративных вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые специфически связываются с белком C5 в соответствии с настоящим изобретением, включает CDR1 легкой цепи SEQ ID NO: 4, CDR2 легкой цепи SEQ ID NO: 5 и/или CDR3 легкой цепи SEQ ID NO: 6.
В некоторых иллюстративных вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые специфически связываются с белком C5 в соответствии с настоящим изобретением, включают любую вариабельную область тяжелой цепи, выбранную из SEQ ID NO: 7, 17, 27, 37, 47 или 57, или включает вариабельную область тяжелой цепи, обладающую по меньшей мере 90%, 95%, 97% или по меньшей мере 99% идентичностью последовательности с любой вариабельной областью тяжелой цепи, выбранной из SEQ ID NO: 7, 17, 27, 37, 47 или 57.
В некоторых иллюстративных вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые специфически связываются с белком C5 в соответствии с настоящим изобретением, включают вариабельную область легкой цепи SEQ ID NO: 8 или включают вариабельную область легкой цепи, обладающую по меньшей мере 90%, 95%, 97% или по меньшей мере 99% идентичностью последовательности с вариабельной областью легкой цепи SEQ ID NO: 8.
В некоторых иллюстративных вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые специфически связываются с белком C5 в соответствии с настоящим изобретением, включают любую тяжелую цепь, выбранную из SEQ ID NO: 9, 19, 29, 39, 49 или 59, или включают вариабельную область тяжелой цепи, обладающую по меньшей мере 90%, 95%, 97% или по меньшей мере 99% идентичностью последовательности с любой тяжелой цепью, выбранной из SEQ ID NO: 9, 19, 29, 39, 49 или 59.
В некоторых иллюстративных вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые специфически связываются с белком C5 в соответствии с настоящим изобретением, включают легкую цепь SEQ ID NO: 10, или включают легкую цепь, обладающую по меньшей мере 90%, 95%, 97% или по меньшей мере 99% идентичностью последовательности с легкой цепью SEQ ID NO: 10.
В некоторых иллюстративных вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые специфически связываются с белком C5 в соответствии с настоящим изобретением, включают антитело или его антигенсвязывающий фрагмент, которые связываются с эпитопом в бета-цепи белка C5 SEQ ID NO: 62. В деталях, эпитоп может соответствовать последовательностям аминокислотных остатков с 332 по 398, предпочтительно с последовательностями аминокислотных остатков с 332 по 378, более предпочтительно с 332 по 364 и еще более предпочтительно с 332 по 348, и/или с 350 по 420, предпочтительно с 369 по 409, более предпочтительно с 379 по 398 и еще более предпочтительно с 386 по 392, на основе аминокислотной последовательности бета-цепи белка C5 (номера аминокислот следует считать от первой аминокислоты зрелого белка C5, Gln).
Кроме того, настоящее изобретение относится к нуклеиновой кислоте, содержащей нуклеотидную последовательность, кодирующую полипептид, содержащий вариабельную область тяжелой цепи, обладающую по меньшей мере 90%, 95%, 97%, 98% или по меньшей мере 99% идентичностью последовательности с любой последовательностью, выбранной из SEQ ID NO: 7, 17, 27, 37, 47 или 57.
В некоторых иллюстративных вариантах осуществления нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую полипептид, содержащий вариабельную область тяжелой цепи по настоящему изобретению, имеет последовательности, представленные в таблице 7 ниже, или обладает по меньшей мере 90%, 95%, 97%, 98% или по меньшей мере 99% идентичностью последовательности с любой представленной в ней последовательностью.
| Таблица 7Нуклеотидная последовательность, кодирующая вариабельную область тяжелой цепи | |
| Вариабельная область тяжелой цепи | SEQ ID NO и последовательность |
| HRA-06-H2-1 | 64. GAG GTG CAG CTG GTG GAG TCT GGC GGC GGA CTG GTG CAG CCT GGC GGA AGC TTG CGG CTG TCC TGC GCC GCC TCC GGA TTC TCC TTC AGT GGC AGG TAC TGG ATA CAA TGG GTG CGG CAG GCC CCT GGC AAG GGC CTC GAG TGG GTG GCC TCT GTG TGG CCT GGT ATT ACT GGT GAC ACT AAC TAC GCG AAC TGG GCG AAA GGC CGG TTC ACC ATC TCC CGG GAC GAC TCC AAG AAC ACC CTG TAC CTG CAG ATG AAC TCC CTG CGG GCC GAG GAC ACC GCC GTG TAC TAC TGC GCC AGA GAA CCT GTT GCC TGG GGT GGC GGC TTG GAC TTG TGG GGC CAG GGC ACA CTA GTG ACC GTG TCC TCC |
| HRA-06-H2-7 | 65. GAG GTG CAG CTG GTG GAG TCT GGC GGC GGA CTG GTG CAG CCT GGC GGA AGC TTG CGG CTG TCC TGC GCC GCC TCC GGA TTC TCC TTC AGT GGC AGG TAC TGG ATA CAA TGG GTG CGG CAG GCC CCT GGC AAG GGC CTC GAG TGG GTG GCC AGT GGT TGG CCG GGG GCG ACT GGT GAC ACT AAC TAC GCG AAC TGG GCG AAA GGC CGG TTC ACC ATC TCC CGG GAC GAC TCC AAG AAC ACC CTG TAC CTG CAG ATG AAC TCC CTG CGG GCC GAG GAC ACC GCC GTG TAC TAC TGC GCC AGA GAA CCT GTT GCC TGG GGT GGC GGC TTG GAC TTG TGG GGC CAG GGC ACA CTA GTG ACC GTG TCC TCC |
| HRA-06-H2-18 | 66. GAG GTG CAG CTG GTG GAG TCT GGC GGC GGA CTG GTG CAG CCT GGC GGA AGC TTG CGG CTG TCC TGC GCC GCC TCC GGA TTC TCC TTC AGT GGC AGG TAC TGG ATA CAA TGG GTG CGG CAG GCC CCT GGC AAG GGC CTC GAG TGG GTG GCC AGT TCT AGT TTG CGG GGG ACT GGT GAC ACT AAC TAC GCG AAC TGG GCG AAA GGC CGG TTC ACC ATC TCC CGG GAC GAC TCC AAG AAC ACC CTG TAC CTG CAG ATG AAC TCC CTG CGG GCC GAG GAC ACC GCC GTG TAC TAC TGC GCC AGA GAA CCT GTT GCC TGG GGT GGC GGC TTG GAC TTG TGG GGC CAG GGC ACA CTA GTG ACC GTG TCC TCC |
| HRA-06-H2-24 | 67. GAG GTG CAG CTG GTG GAG TCT GGC GGC GGA CTG GTG CAG CCT GGC GGA AGC TTG CGG CTG TCC TGC GCC GCC TCC GGA TTC TCC TTC AGT GGC AGG TAC TGG ATA CAA TGG GTG CGG CAG GCC CCT GGC AAG GGC CTC GAG TGG GTG GCC TCG GTG TGG CCG GGG TTT ACT GGT GAC ACT AAC TAC GCG AAC TGG GCG AAA GGC CGG TTC ACC ATC TCC CGG GAC GAC TCC AAG AAC ACC CTG TAC CTG CAG ATG AAC TCC CTG CGG GCC GAG GAC ACC GCC GTG TAC TAC TGC GCC AGA GAA CCT GTT GCC TGG GGT GGC GGC TTG GAC TTG TGG GGC CAG GGC ACA CTA GTG ACC GTG TCC TCC |
| HRA-06-H1-9-H2-7 | 68. GAG GTG CAG CTG GTG GAG TCT GGC GGC GGA CTG GTG CAG CCT GGC GGA AGC TTG CGG CTG TCC TGC GCC GCC TCC GGA TTC TCC CTC AGT GGC AGG TAC TGG ATA CAA TGG GTG CGG CAG GCC CCT GGC AAG GGC CTC GAG TGG GTG GCC AGT GGT TGG CCG GGG GCG ACT GGT GAC ACT AAC TAC GCG AAC TGG GCG AAA GGC CGG TTC ACC ATC TCC CGG GAC GAC TCC AAG AAC ACC CTG TAC CTG CAG ATG AAC TCC CTG CGG GCC GAG GAC ACC GCC GTG TAC TAC TGC GCC AGA GAA CCT GTT GCC TGG GGT GGC GGC TTG GAC TTG TGG GGC CAG GGC ACA CTA GTG ACC GTG TCC TCC |
| HRA-06-H1-9-H2-24 | 69. GAG GTG CAG CTG GTG GAG TCT GGC GGC GGA CTG GTG CAG CCT GGC GGA AGC TTG CGG CTG TCC TGC GCC GCC TCC GGA TTC TCC CTC AGT GGC AGG TAC TGG ATA CAA TGG GTG CGG CAG GCC CCT GGC AAG GGC CTC GAG TGG GTG GCC TCG GTG TGG CCG GGG TTT ACT GGT GAC ACT AAC TAC GCG AAC TGG GCG AAA GGC CGG TTC ACC ATC TCC CGG GAC GAC TCC AAG AAC ACC CTG TAC CTG CAG ATG AAC TCC CTG CGG GCC GAG GAC ACC GCC GTG TAC TAC TGC GCC AGA GAA CCT GTT GCC TGG GGT GGC GGC TTG GAC TTG TGG GGC CAG GGC ACA CTA GTG ACC GTG TCC TCC |
Кроме того, настоящее изобретение относится к нуклеиновой кислоте, содержащей нуклеотидную последовательность, кодирующую полипептид, содержащий вариабельную область легкой цепи, обладающую по меньшей мере 90%, 95%, 97%, 98% или по меньшей мере 99% идентичностью последовательности с SEQ ID NO: 8. В некоторых иллюстративных вариантах осуществления нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую полипептид, содержащий вариабельную область легкой цепи по настоящему изобретению, имеет последовательности, представленные в таблице 8 ниже, или обладает по меньшей мере 90%, 95%, 97%, 98% или по меньшей мере 99% идентичностью последовательности с любой представленной в ней последовательностью.
| Таблица 8Нуклеотидная последовательность, кодирующая вариабельную область легкой цепи | |
| Вариабельная область легкой цепи | SEQ ID NO и последовательность |
| 70. GAC ATC CAG ATG ACC CAG TCC CCC TCC TCG CTG AGC GCC TCC GTG GGC GAC CGG GTG ACC ATC ACC TGC CAG GCC AGT CAG AGC ATT AAC AAC CAA CTA TCC TGG TAT CAG CAG AAG CCT GGC AAG GCG CCT AAG CTG CTG ATC TAC TAT GCA TCC ACT CTG GCA TCT GGC GTG CCT TCC CGG TTC TCC GGA TCC GGC TCC GGC ACC GAC TTC ACC CTG ACC ATC TCC TCC CTG CAA CCT GAG GAC TTC GCC ACC TAC TAC TGC CAA GGC AGT TAT TAT AGT GGT GGT TGG GAC TAT GGT TTC GGC CAG GGT ACC AAG GTG GAG ATC AAG |
Кроме того, настоящее изобретение относится к вектору и клетке-хозяину, содержащим нуклеиновую кислоту, как описано выше. В одном иллюстративном варианте осуществления настоящее изобретение относится к клетке-хозяину, содержащим (1) рекомбинантный сегмент ДНК, кодирующий тяжелую цепь антитела по настоящему изобретению, и (2) второй рекомбинантный сегмент ДНК, кодирующий легкую цепь антитела по настоящему изобретению. В другом иллюстративном варианте осуществления настоящее изобретение относится к клетке-хозяину, содержащей рекомбинантный сегмент ДНК, кодирующий каждую из тяжелой цепи и легкой цепи антитела по настоящему изобретению. В некоторых иллюстративных вариантах осуществления антитело или его антигенсвязывающий фрагмент представляют собой моноклональное антитело человека или его антигенсвязывающий фрагмент.
Для экспрессии полинуклеотида, кодирующего связывающее C5 антитело, цепь или их связывающий фрагмент, можно использовать различные экспрессирующие векторы, и, чтобы продуцировать антитела в клетках-хозяевах млекопитающих, можно использовать как вирусные, так и невирусные экспрессирующие векторы. Можно использовать векторы, такие как pcDNA, pCI, pCMV, pCEP4 и т.п., и клетки-хозяева, такие как HEK293, CHO, CHO-DG44 и т.п.
Клетка-хозяин, в которой содержится и экспрессируется связывающее C5 антитело, может представлять собой эукариотическую клетку или прокариотическую клетку, такую как E.Coli, предпочтительно, E.coli ER2738. В качестве примеров могут быть включены HB2151, BL21 и т.п., которые представляют собой эукариотические клетки-хозяева, пригодные для клонирования и экспрессии полинуклеотида по настоящему изобретению. Другие микробные клетки-хозяева, пригодные для включения, включают палочковидные бактерии, такие как Bacillus subtilis, и другие кишечные бактерии, такие как Salmonella, Serratia и различные виды Pseudomonas. Для экспрессии связывающего C5 полипептида по настоящему изобретению можно использовать другие микроорганизмы, такие как дрожжи, и также можно использовать клетки насекомых в комбинации с бакуловирусными векторами.
В некоторых иллюстративных предпочтительных вариантах осуществления используют клетки-хозяева млекопитающих для экспрессии и продуцирования связывающего C5 полипептида по настоящему изобретению. Например, они могут представлять собой либо гибридомную клеточную линию, экспрессирующую эндогенные гены иммуноглобулинов, либо клеточную линию млекопитающих, содержащую экзогенный экспрессирующий вектор. Кроме того, например, в качестве клетки животного или человека можно использовать ряд подходящих клеточных линий, способных секретировать иммуноглобулины, включая клеточные линии CHO, клеточные линии Cos, клетки HeLa, миеломные клеточные линии, клеточные линии HEK, трансформированные B-клетки и гибридомы, предпочтительно, HEK293, CHO, CHO-DG44.
Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей: по меньшей мере одну связывающую C5 молекулу (например, связывающее C5 антитело или его антигенсвязывающий фрагмент).
Фармацевтическая композиция по настоящему изобретению является эффективной для лечения обусловленных комплементом заболеваний. Обусловленные комплементом заболевания включают все заболевания и патологические состояния, при которых возникновение заболеваний связано с аномалией активации системы комплемента, например, с дефицитом комплемента. Например, обусловленные комплементом заболевания включают воспалительные заболевания и аутоиммунные заболевания, такие как ревматоидный артрит (RA), остеоартрит, острый респираторный дистресс-синдром (ARDS), отдаленное повреждение тканей после ишемии и реперфузии, активацию комплемента в ходе хирургической операции с искусственным кровообращением, дерматомиозит, пемфигус, волчаночный нефрит, гломерулонефрит, почечный васкулит, сердечно-легочное шунтирование, индуцированная сердечной н