Пептиды ube2t и содержащие их вакцины
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к иммуногенным эпитопам UBE2T, и может быть использовано в медицине для лечения пациента, страдающего раком. Получают модифицированные эпитопные пептиды UBE2T, которые связываются с HLA-A*2402 или HLA-A*0201 и обладают более высокой способностью индуцирования цитотоксических T-лимфоцитов (ЦТЛ), чем эпитопный пептид UBE2T дикого типа. 12 н.п. ф-лы, 8 ил., 3 табл., 1 пр.
Реферат
Область техники, к которой относится изобретение
[0001] Настоящее изобретение относится к области биологической науки, более конкретно, к области терапии злокачественных опухолей. В частности, настоящее изобретение относится к новым пептидам, которые являются эффективными в качестве противораковых вакцин, а также к лекарственным средствам для лечения или профилактики опухолей или для того и другого.
[0002] Приоритет
По настоящей заявке испрашивается приоритет предварительной заявки США №61/699550, зарегистрированной 11 сентября 2012 года, полное содержание которой включено в настоящее описание посредством ссылки.
Предшествующий уровень техники
[0003] Было продемонстрировано, что CD8-положительные цитотоксические Т-лимфоциты (CTL) распознают пептиды-эпитопы, получаемые из опухолеассоциированных антигенов (TAA) на молекуле главного комплекса гистосовместимости (MHC) класса I, а затем вызывают цитолиз этих опухолевых клеток. Со времени открытия семейства антигенов меланомы (MAGE) в качестве первого примера TAA, были обнаружены многие другие TAA, преимущественно посредством иммунологических подходов (NPL 1-2). В настоящее время некоторые из TAA находятся в клинической разработке в качестве иммунотерапевтических мишеней.
[0004] Для пролиферации и выживания злокачественных клеток необходимыми являются подходящие TAA. Использование таких TAA в качестве мишеней для иммунотерапии может минимизировать хорошо описанный риск ускользания от иммунологического надзора злокачественных клеток, свойственный для делеции, мутации и/или подавления ТАА, такой как последствие терапевтически запускаемой иммунной селекции. Таким образом, необходимо дальнейшее развитие идентификации новых TAA, способных индуцировать сильный и специфический противоопухолевый иммунный ответ, и, таким образом, продолжается клиническое применение стратегий пептидной вакцинации для различных типов злокачественных опухолей (NPL 3-10). К настоящему времени существует несколько публикаций о клинических исследованиях с использованием этих получаемых из ТАА пептидов. К сожалению, в этих испытаниях вакцин для злокачественных опухолей наблюдали только низкую частоту объективных ответов (NPL 11-13). Таким образом, остается необходимость в новых TAA в качестве иммунотерапевтических мишеней.
[0005] UBE2T (конъюгированный с убиквитином фермент E2T: типичная аминокислотная последовательность представлена в SEQ ID NO: 65; типичная нуклеотидная последовательность представлена в SEQ ID NO: 64 (номер доступа GeneBank NM_014176)) представляет собой один из конъюгированных с убиквитином ферментов (E2). Опубликовано, что UBE2T является одним из генов, экспрессия которого повышается при стимуляции фибробластов человека сывороткой (NPL 14). В метаболическом пути анемии Фанкони UBE2T связывает FANCL и необходим для индуцированного повреждением ДНК моноубиквитинирования FANCD2 (NPL 15-16). В недавних исследованиях выявлено, что UBE2T часто активирован при раке молочной железы и взаимодействует и солокализуется с комплексом BRCA1/ассоциированный с BRCA1 домен белка RING (BARD1) (PTL 1, NPL 17). Анализ "нозерн"-блот в этих исследованиях выявил, что в линиях злокачественных клеток молочной железы транскрипт UBE2T детектировали на очень высоком уровне, но его почти не детектируют в жизненно важных органах. Кроме того, показано, что нокдаун эндогенного UBE2T в линиях злокачественных клеток посредством миРНК значимо подавляет рост этих линий клеток (PTL 1-2, NPL 17).
Список цитированных документов
Патентная литература
[PTL 1] W02005/029067
[PTL 2] W02009/001562
Непатентная литература
[NPL 1] Boon T, Int J Cancer 1993, 54(2): 177-80
[NPL 2] Boon T & van der Bruggen P, J Exp Med 1996, 183(3): 725-9
[NPL 3] Harris CC, J Natl Cancer Inst 1996, 88(20): 1442-55
[NPL 4] Butterfield LH et al., Cancer Res 1999, 59(13): 3134-42
[NPL 5] Vissers JL et al., Cancer Res 1999, 59(21): 5554-9
[NPL 6] van der Burg SH et al., J Immunol 1996, 156(9): 3308-14
[NPL 7] Tanaka F et al., Cancer Res 1997, 57(20): 4465-8
[NPL 8] Fujie T et al., Int J Cancer 1999, 80(2): 169-72
[NPL 9] Kikuchi M et al., Int J Cancer 1999, 81(3): 459-66
[NPL 10] Oiso M et al., Int J Cancer 1999, 81(3): 387-94
[NPL 11] Belli F et al., J Clin Oncol 2002, 20(20): 4169-80
[NPL 12] Coulie PG et al., Immunol Rev 2002, 188: 33-42
[NPL 13] Rosenberg SA et al., Nat Med 2004, 10(9): 909-15
[NPL 14] Iyer VR et al., Science 1999, 283: 83-7
[NPL 15] Machida YJ et al., Mol Cell 2006, 23: 589-96
[NPL 16] Alpi A et al., Mol Cell Biol 2007, 27: 8421-30
[NPL 17] Ueki T et.al., Cancer Res. 2009, 69: 8752-60
Сущность изобретения
[0008] Настоящее изобретение основано, по меньшей мере частично, на открытии новых пептидов, которые могут служить в качестве подходящих мишеней иммунотерапии. Поскольку ТАА, как правило, воспринимаются иммунной системой как "свое" и, таким образом, часто не имеют врожденной иммуногенности, обнаружение подходящих мишеней все еще является важным.
В связи с этим настоящее изобретение, по меньшей мере частично, относится к идентификации среди пептидов, полученных из UBE2T, специфических пептидов-эпитопов, которые способны индуцировать CTL, специфичные к UBE2T.
[0009] Результаты, описанные в настоящем описании, демонстрируют, что идентифицированные пептиды являются рестриктированными по HLA-A24- или HLA-A2 пептидами-эпитопами, которые могут индуцировать сильный и специфический иммунный ответ против экспрессирующих UBE2T клеток.
[0010] Таким образом, задачей настоящего изобретения является предоставление получаемых из UBE2T пептидов, которые можно использовать для индукции CTL in vitro, ex vivo или in vivo, или вводить индивидууму для индукции иммунного ответа против злокачественных опухолей, примеры которых включают, но не ограничиваются ими, рак мочевого пузыря, рак молочной железы, рак шейки матки, холангиоцеллюлярную карциному, CML, колоректальный рак, рак пищевода, рак желудка, рак желудка диффузного типа, NSCLC, лимфому, остеосаркому, рак яичника, рак поджелудочной железы, рак предстательной железы, SCLC, опухоль мягких тканей и опухоль семенников. Предпочтительные пептиды являются нонапептидами и декапептидами, более предпочтительно нонапептидами и декапептидами, содержащими аминокислотную последовательность, выбранную из SEQ ID NO: 1, 2, 4, 6, 11, 12, 13, 15, 17, 19, 20, 21, 22, 23, 24, 25, 27, 29, 30, 32, 36, 38, 41, 48, 49, 51, 52, 53, 55, 56 и 58. Из них особенно предпочтительными являются пептиды, содержащие аминокислотную последовательность, выбранную из SEQ ID NO: 1, 2, 4, 6, 11, 12, 13, 15, 17, 19, 20, 21, 22, 23, 24, 25, 27, 29, 30, 32, 36, 38, 41, 48, 49, 51, 52, 53, 55, 56 и 58.
[0011] Настоящее изобретение также относится к модифицированным пептидам, содержащим аминокислотную последовательность, выбранную из SEQ ID NO: 1, 2, 4, 6, 11, 12, 13, 15, 17, 19, 20, 21, 22, 23, 24, 25, 27, 29, 30, 32, 36, 38, 41, 48, 49, 51, 52, 53, 55, 56 и 58, в которых заменены, удалены, вставлены и/или добавлены одна, две или более аминокислот при условии, что получаемые модифицированные пептиды сохраняют необходимую способность к индукции CTL исходного немодифицированного пептида. В одном из вариантов осуществления, когда исходные пептиды представляют собой 9-мер (SEQ ID NO: 1, 2, 4, 6, 11, 12, 13, 15, 29, 30, 32, 36, 38 и 41), размер модифицированного пептида предпочтительно находится в диапазоне от 9 до 40 аминокислот, например, в диапазоне от 9 до 20 аминокислоты, например, в диапазоне от 9 до 15 аминокислот. Подобным образом, когда исходные пептиды представляют собой 10-мер (SEQ ID NO: 17, 19, 20, 21, 22, 23, 24, 25, 27, 48, 49, 51, 52, 53, 55, 56 и 58), размер модифицированного пептида предпочтительно находится в диапазоне от 10 до 40 аминокислот, например, в диапазоне от 10 до 20 аминокислот, например, в диапазоне от 10 до 15 аминокислот.
[0012] Настоящее изобретение дополнительно включает выделенные полинуклеотиды, кодирующие любой из пептидов по настоящему изобретению. Эти полинуклеотиды можно использовать для индукции или получения антигенпрезентирующих клеток (APC), обладающих способностью к индукции CTL. Также как пептиды по настоящему изобретению, такие АРС можно вводить индивидууму для индукции иммунного ответа против злокачественной опухоли.
[0013] При введении индивидууму пептиды по настоящему изобретению могут презентироваться на поверхности APC таким образом, чтобы индуцировать нацеливание CTL на соответствующие пептиды. Таким образом, одной из задач настоящего изобретения является предоставление средств или композиций, включающих один или более пептидов по настоящему изобретению или полинуклеотидов, кодирующих такие пептиды. Средство или композицию можно использовать для индукции CTL. Такие средства или композиции можно использовать для лечения и/или профилактики злокачественной опухоли и/или предотвращении метастазирования или послеоперационного рецидива рака. Примеры злокачественных опухолей, предусматриваемых в настоящем изобретении, включают, но не ограничиваются ими, рак мочевого пузыря, рак молочной железы, рак шейки матки, холангиоцеллюлярную карциному, CML, колоректальный рак, рак пищевода, рак желудка, рак желудка диффузного типа, NSCLC, лимфому, остеосаркому, рак яичника, рак поджелудочной железы, рак предстательной железы, SCLC, опухоль мягких тканей и опухоль семенников.
[0014] Настоящее изобретение дополнительно предусматривает фармацевтические композиции или средства, которые содержат один или более пептидов или полинуклеотидов по настоящему изобретению. Фармацевтическую композицию предпочтительно формулируют для применения в лечении и/или профилактике злокачественной опухоли и/или предотвращении ее метастазирования или послеоперационного рецидива. Наряду или в дополнение к пептидам или полинуклеотидам по настоящему изобретению фармацевтические средства и/или композиции по настоящему изобретению могут содержать в качестве активных ингредиентов APC и/или экзосомы, которые предоставляют любой из пептидов по настоящему изобретению.
[0015] Пептиды или полинуклеотиды по настоящему изобретению можно использовать для индукции APC, которые презентируют на поверхности комплекс лейкоцитарного антигена человека (HLA) и пептида по настоящему изобретению, например, приведением APC, получаемых у индивидуума, в контакт с пептидом по настоящему изобретению или введением полинуклеотида, кодирующего пептид по настоящему изобретению, в APC. Такие APC имеют способность к индукции CTL, которые специфически распознают клетки, которые презентируют на поверхности пептиды-мишени и являются пригодными для иммунотерапии злокачественных опухолей. Таким образом, настоящее изобретение относится к способам индукции APC со способностью к индукции CTL, а также APC, полученным такими способами.
Кроме того, настоящее изобретение также относится к средствам или композициям для индукции APC со способностью индуцировать CTL, где такие средства или композиции включают любые пептиды или полинуклеотиды по настоящему изобретению.
[0016] Дополнительной задачей настоящего изобретения является обеспечение способов индукции CTL, где такие способы предусматривают стадию совместного культивирования CD8-положительных Т-клеток с APC, которые презентируют на своей поверхности комплекс HLA-антигена и пептида по настоящему изобретению, стадию совместного культивирования CD8-положительных Т-клеток с экзосомами, презентирующими на их поверхности комплекс HLA-антигена и пептида по настоящему изобретению, или стадию введения полинуклеотида, кодирующего субъединицы Т-клеточного рецептора (TCR), или полинуклеотидов, кодирующих каждую из субъединиц TCR, где TCR может связываться с комплексом пептида по настоящему изобретению и антигена HLA, презентированным на клеточной поверхности. CTL, получаемые такими способами, могут находить применение при лечении и/или профилактике злокачественных опухолей, примеры которых могут включать, но не ограничиваться ими, рак мочевого пузыря, рак молочной железы, рак шейки матки, холангиоцеллюлярную карциному, CML, колоректальный рак, рак пищевода, рак желудка, рак желудка диффузного типа, NSCLC, лимфому, остеосаркому, рак яичника, рак поджелудочной железы, рак предстательной железы, SCLC, опухоль мягких тканей и опухоль семенников. Таким образом, настоящее изобретение также относится к CTL, получаемым описанными выше способами.
[0017] Еще одной задачей настоящего изобретения является предоставление выделенных APC, которые презентируют на поверхности комплекс HLA-антигена и пептида по настоящему изобретению. Кроме того, настоящее изобретение относится к выделенным CTL, которые направлены на пептиды по настоящему изобретению. Такие АРС и CTL можно использовать для иммунотерапии злокачественных опухолей. Такие CTL также можно определить как CTL, которые могут распознавать (или связываться) комплекс пептида по настоящему изобретению и антигена HLA на клеточной поверхности. Эти APC и CTL можно использовать для иммунотерапии злокачественных опухолей.
[0018] Еще одной задачей настоящего изобретения является предоставление способов индукции иммунного ответа против злокачественной опухоли у нуждающегося в этом индивидуума, где такие способы включают стадию введения индивидууму средства или композиции, содержащих по меньшей мере один компонент, выбранный из пептида по настоящему изобретению или полинуклеотида, кодирующего его, APC или экзосомы, презентирующей его и CTL, которая может распознавать клетку, презентирующую пептид по настоящему изобретению на поверхности.
[0019] Один из аспектов настоящего изобретения относится к пептиду по настоящему изобретению или композиции, содержащей пептид по настоящему изобретению, для применения в качестве лекарственного средства.
Применимость настоящего изобретения распространяется на любое из ряда заболеваний, связанных со сверхэкспрессией UBE2T или возникающих в результате сверхэкспрессии UBE2T, такое как злокачественная опухоль, примеры которой включают, но не ограничиваются ими, рак мочевого пузыря, рак молочной железы, рак шейки матки, холангиоцеллюлярную карциному, CML, колоректальный рак, рак пищевода, рак желудка, рак желудка диффузного типа, NSCLC, лимфому, остеосаркому, рак яичника, рак поджелудочной железы, рак предстательной железы, SCLC, опухоль мягких тканей и опухоль семенников.
[0020] Более конкретно, настоящее изобретение относится к следующему:
[1] Выделенный пептид, обладающий способностью к индукции цитотоксических T-лимфоцитов (CTL), где пептид содержит аминокислотную последовательность (a) или (b), ниже:
(a) аминокислотная последовательность иммунологически активного фрагмента UBE2T;
(b) аминокислотная последовательность, в которой в аминокислотной последовательности иммунологически активного фрагмента UBE2T заменены, введены, удалены и/или добавлены 1, 2 или более аминокислот,
где CTL, индуцируемые пептидом, обладают специфической цитотоксической активностью против клеток, которые презентируют фрагмент, получаемый из UBE2T.
[2] Пептид по [1], где пептид содержит аминокислотную последовательность (a) или (b), ниже:
(a) аминокислотная последовательность, выбранная из группы, состоящей из SEQ ID NO: 1, 2, 4, 6, 11, 12, 13, 15, 17, 19, 20, 21, 22, 23, 24, 25, 27, 29, 30, 32, 36, 38, 41, 48, 49, 51, 52, 53, 55, 56 и 58;
(b) аминокислотная последовательность, в которой в аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 4, 6, 11, 12, 13, 15, 17, 19, 20, 21, 22, 23, 24, 25, 27, 29, 30, 32, 36, 38, 41, 48, 49, 51, 52, 53, 55, 56 и 58, заменены, введены, удалены и/или добавлены 1, 2 или более аминокислот; размер модифицированного пептида предпочтительно находится в диапазоне от 9 до 40 аминокислот, например, в диапазоне от 9 до 20 аминокислот, например, в диапазоне от 9 до 15 аминокислот.
[3] Пептид по [2], где пептид представляет собой следующий олигопептид (i) или (ii):
(i) пептид, обладающий одной или обеими из следующих характеристик:
(a) вторая аминокислота от N-конца аминокислотной последовательности SEQ ID NO: 1, 2, 4, 6, 11, 12, 13, 15, 17, 19, 20, 21, 22, 23, 24, 25 или 27 заменена на фенилаланин, тирозин, метионин или триптофан; и
(b) C-концевая аминокислота аминокислотной последовательности SEQ ID NO: 1, 2, 4, 6, 11, 12, 13, 15, 17, 19, 20, 21, 22, 23, 24, 25 или 27 заменена на фенилаланин, лейцин, изолейцин, триптофан или метионин;
(ii) пептид, обладающий одной или обеими из следующих характеристик:
(a) вторая аминокислота от N-конца аминокислотной последовательности SEQ ID NO: 29, 30, 32, 36, 38, 41, 48, 49, 51, 52, 53, 55, 56 или 58 заменена на лейцин или метионин; и
(b) C-концевая аминокислота аминокислотной последовательности SEQ ID NO: 29, 30, 32, 36, 38, 41, 48, 49, 51, 52, 53, 55, 56 или 58 заменена на валин или лейцин.
[4] Пептид по любому из [1]-[3], где пептид представляет собой нонапептид или декапептид.
[5] Пептид по [4], где пептид состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 4, 6, 11, 12, 13, 15, 17, 19, 20, 21, 22, 23, 24, 25, 27, 29, 30, 32, 36, 38, 41, 48, 49, 51, 52, 53, 55, 56 и 58.
[6] Выделенный полинуклеотид, кодирующий пептид по любому из [1]-[5].
[7] Композиция для индукции CTL, где композиция содержит по меньшей мере один активный ингредиент, выбранный из группы, состоящей из:
(a) пептида по любому из [1]-[5];
(b) полинуклеотида по [6];
(c) APC, которая презентирует на своей поверхности пептид по любому из [1]-[5]; и
(d) экзосомы, которая презентирует на своей поверхности пептид по любому из [1]-[5].
[8] Фармацевтическая композиция для лечения и/или профилактики злокачественной опухоли и/или профилактики ее послеоперационного рецидива, где композиция содержит по меньшей мере один активный ингредиент, выбранный из группы, состоящей из:
(a) пептида по любому из [1]-[5];
(b) полинуклеотида по [6];
(c) APC, которая презентирует на своей поверхности пептид по любому из [1]-[5];
(d) экзосомы, которая презентирует на своей поверхности пептид по любому из [1]-[5]; и
(e) CTL, который может распознавать клетку, презентирующую пептид по любому из [1]-[5].
[9] Фармацевтическая композиция по [8], где фармацевтическую композицию формулируют для введения индивидууму, антиген HLA которого представляет собой HLA-A24 или HLA-A2.
[10] Способ индукции APC со способностью к индукции CTL, где способ включает стадию, выбранную из группы, состоящей из:
(a) приведения APC в контакт с пептидом по любому из [1]-[5], и
(b) введения полинуклеотида, кодирующего пептид по любому из [1]-[5], в APC.
[11] Способ индукции CTL, где способ включает стадию, выбранную из группы, состоящей из:
(a) совместного культивирования CD8-положительной T-клетки с APC, которая презентирует на своей поверхности комплекс антигена HLA и пептида по любому из [1]-[5];
(b) совместного культивирования CD8-положительной T-клетки с экзосомой, которая презентирует на своей поверхности комплекс антигена HLA и пептида по любому из [1]-[5]; и
(c) введения в CD8-положительную T-клетку полинуклеотида, кодирующего обе субъединицы TCR, или полинуклеотидов, кодирующих каждую из субъединиц TCR, где TCR, сформированный указанными субъединицами, способен связываться с комплексом пептида по любому из [1]-[5] и антигена HLA на клеточной поверхности.
[12] Выделенная APC, которая презентирует на своей поверхности комплекс антигена HLA и пептида по любому из [1]-[5].
[13] APC по [12], которую индуцируют способом по [10].
[14] Выделенный CTL, который нацелен на пептид по любому из [1]-[5].
[15] CTL по [14], который индуцируют способом по [11].
[16] Способ индукции иммунного ответа против злокачественной опухоли у индивидуума, где способ включает стадию введения индивидууму композиции, содержащей пептид по любому из [1]-[5] или полинуклеотид, кодирующий этот пептид.
[17] Антитело или его иммунологически активный фрагмент против пептида по любому из [1]-[5].
[18] Вектор, содержащий нуклеотидную последовательность, кодирующую пептид по любому из [1]-[5]; предпочтительно вектор адаптирован для экспрессии указанного пептида (обозначаемый как экспрессирующий вектор), например, кодирующая нуклеотидная последовательность встроена в вектор ниже промоторной последовательности и функционально связана с указанной промоторной последовательностью. Термин "функционально связан" предназначен для обозначения того, что нуклеотидная последовательность связана с промоторной последовательностью (регуляторной последовательностью) так, что это обеспечивает экспрессию нуклеотидной последовательности in vitro или в клетке-хозяин, в которую введен вектор.
[19] Клетка-хозяин, трансформированная или трансфицированная вектором по [18] или экспрессирующим вектором, описываемым в настоящем документе.
[20] Диагностический набор, содержащий пептид по любому из [1]-[5], полинуклеотид по [6] или антитело или иммунологически активный фрагмент по [17]; и
[21] способ скрининга пептида, обладающего способностью к индукции CTL, которые обладают специфической цитотоксической активностью против клеток, которые презентируют фрагмент, получаемый из UBE2T, где способ включает стадии:
(i) предоставления последовательности-кандидата, состоящей из аминокислотной последовательности, модифицированной заменой, удалением, встраиванием и/или добавлением одного, двух или более аминокислотных остатков к исходной аминокислотной последовательности, где исходная аминокислотная последовательность выбрана из группы, состоящей из SEQ ID NO: 1, 2, 4, 6, 11, 12, 13, 15, 17, 19, 20, 21, 22, 23, 24, 25, 27, 29, 30, 32, 36, 38, 41, 48, 49, 51, 52, 53, 55, 56 и 58;
(ii) отбора последовательности-кандидата, которая не обладает по существу значимой гомологией (или идентичностью последовательности) с пептидами, получаемыми из любых известных продуктов генов человека, отличных от UBE2T;
(iii) приведения пептида, состоящего из последовательности-кандидата, отобранной на стадии (ii), в контакт с антигенпрезентирующей клеткой
(iv) приведения антигенпрезентирующей клетки после стадии (iii) в контакт с CD8-положительной T-клеткой, и
(v) идентификации пептида, способность к индукции CTL которого является такой же, как у пептида, состоящего из исходной аминокислотной последовательности, или более высокой.
[22] Фармацевтическая композиция, содержащая пептид по любому из [1]-[5].
[23] Пептид по любому из [1]-[5] для применения в качестве лекарственного средства.
[24] Полинуклеотид по [6] или вектор по [18] для применения в качестве лекарственного средства.
[0021] В дополнение к указанному выше, другие задачи и признаки изобретения станут более понятными при чтении приведенного ниже подробного описания совместно с сопровождающими фигурами и примерами. Однако следует понимать, что как предыдущий раздел "Сущность настоящего изобретения", так и следующее ниже подробное описание являются только иллюстративными вариантами осуществления и не являются ограничивающими изобретение или другие альтернативные варианты осуществления изобретения.
[0022] В частности, хотя изобретение описано в настоящем описании со ссылкой на ряд конкретных вариантов осуществления, следует понимать, что описание является иллюстративным описанием изобретения, и его не следует понимать как ограничивающее изобретение. Специалисты в данной области могут находить различные модификации и применения, не выходя за рамки сущности и объема изобретения, как описано в прилагаемой формуле изобретения. Подобным образом, другие задачи, признаки, эффекты и преимущества будут очевидными из описанных ниже сущности изобретения и определенных вариантов осуществления, и специалист в данной области легко поймет их. Такие задачи, признаки, эффекты и преимущества изобретения станут понятны из указанного выше совместно с сопровождающими примерами, данными, фигурами и разумными выводами, извлеченными из них, отдельно или с рассмотрением включенных в настоящее описание ссылок.
Краткое описание чертежей
[0023] Различные аспекты и применения настоящего изобретения станут очевидными специалисту в данной области после рассмотрения краткого описания фигур и подробного описания настоящего изобретения и его предпочтительных вариантов осуществления, которые следуют далее.
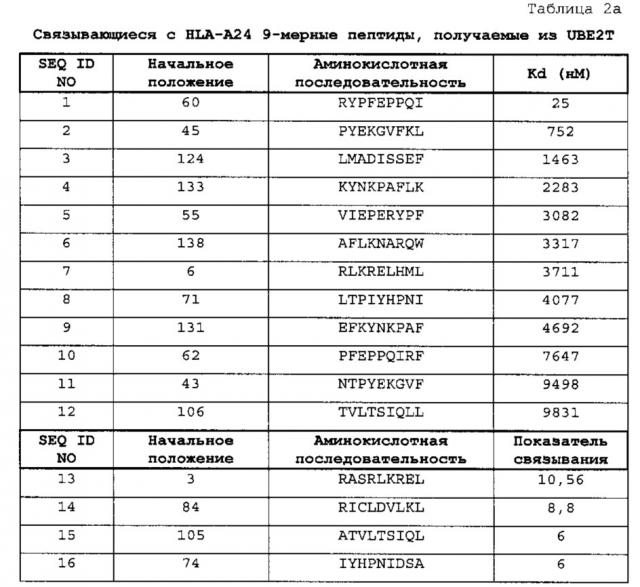
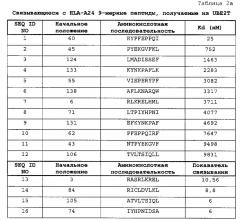
[0024] [фиг. 1a-l] Фигура 1a-l состоит из ряда фотографий, (a)-(l), отображающих результаты анализа иммуноферментных пятен (ELISPOT) (IFN)-гамма на CTL, которые индуцировали пептидами, получаемыми из UBE2T. CTL в лунке №8, стимулируемые UBE2T-A24-9-60 (SEQ ID NO: 1) (a), №1, стимулируемые UBE2T-A24-9-45 (SEQ ID NO: 2) (b), №6, стимулируемые UBE2T-A24-9-133 (SEQ ID NO: 4) (c), №6, стимулируемые UBE2T-A24-9-138 (SEQ ID NO: 6) (d), №4, стимулируемые UBE2T-A24-9-43 (SEQ ID NO: 11) (e), №2, стимулируемые UBE2T-A24-9-106 (SEQ ID NO: 12) (f), №6, стимулируемые UBE2T-A24-9-3 (SEQ ID NO: 13) (g), №3, стимулируемые UBE2T-A24-9-105 (SEQ ID NO: 15) (h), №2, стимулируемые UBE2T-A24-10-130 (SEQ ID NO: 17) (i), №1, стимулируемые UBE2T-A24-10-131 (SEQ ID NO: 19) (j), №3, стимулируемые UBE2T-A24-10-133 (SEQ ID NO: 20) (k), и №6, стимулируемые UBE2T-A24-10-99 (SEQ ID NO: 21) (l), показали эффективную продукцию IFN-гамма по сравнению с контролем, соответственно. Квадрат на лунке на этих изображениях означает, что клетки из соответствующей лунки размножали для получения линий CTL. В противоположность этому, в качестве характерного случая отрицательных данных, специфической продукции IFN-гамма CTL, стимулированными UBE2T-A24-9-124 (SEQ ID NO: 3) (r), не наблюдали. На фигурах "+" означает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и "-" означает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных какими-либо пептидами.
[0025] [фиг. 1m-r] Фигура 1m-r состоит из ряда фотографий, (m)-(r), отображающих результаты анализа иммуноферментных пятен (ELISPOT) (IFN)-гамма на CTL, которые индуцировали пептидами, получаемыми из UBE2T. CTL в лунке №7, стимулируемые UBE2T-A24-10-154 (SEQ ID NO: 22) (m), №8, стимулируемые UBE2T-A24-10-105 (SEQ ID NO: 23) (n), №1, стимулируемые UBE2T-A24-10-115 (SEQ ID NO: 24) (o), №4, стимулируемые UBE2T-A24-10-177 (SEQ ID NO: 25) (p) и №7, стимулируемые UBE2T-A24-10-44 (SEQ ID NO: 27) (q), показали эффективную продукцию IFN-гамма по сравнению с контролем, соответственно. Квадрат на лунке на этих изображениях означает, что клетки из соответствующей лунки размножали для получения линий CTL. В противоположность этому, в качестве характерного случая отрицательных данных, специфической продукции IFN-гамма CTL, стимулированными UBE2T-A24-9-124 (SEQ ID NO: 3) (r), не наблюдали. На фигурах "+" означает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и "-" означает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных какими-либо пептидами.
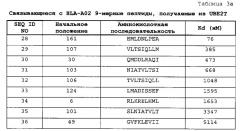
[0026] [фиг. 2a-l] Фигура 2a-l состоит из ряда фотографий, (a)-(l), отображающих результаты анализа ELISPOT на CTL, которые индуцировали пептидами, получаемыми из UBE2T. CTL в лунке №4, стимулируемые UBE2T-A02-9-107 (SEQ ID NO: 29) (a), №5, стимулируемые UBE2T-A02-9-30 (SEQ ID NO: 30) (b), №7, стимулируемые UBE2T-A02-9-106 (SEQ ID NO: 32) (c), №5, стимулируемые UBE2T-A02-9-49 (SEQ ID NO: 36) (d), №3, стимулируемые UBE2T-A02-9-13 (SEQ ID NO: 38) (e), №4, стимулируемые UBE2T-A02-9-132 (SEQ ID NO: 41) (f), №6, стимулируемые UBE2T-A02-10-70 (SEQ ID NO: 48) (g), №7, стимулируемые UBE2T-A02-10-6 (SEQ ID NO: 49) (h), №8, стимулируемые UBE2T-A02-10-106 (SEQ ID NO: 51) (i), №2, стимулируемые UBE2T-A02-10-102 (SEQ ID NO: 52) (j), №1, стимулируемые UBE2T-A02-10-30 (SEQ ID NO: 53) (k), и №8, стимулируемые UBE2T-A02-10-101 (SEQ ID NO: 55) (l), показали эффективную продукцию IFN-гамма по сравнению с контролем, соответственно. Квадрат на лунке на этих изображениях означает, что клетки из соответствующей лунки размножали для получения линий CTL. В противоположность этому, в качестве характерного случая отрицательных данных, специфической продукции IFN-гамма CTL, стимулированными UBE2T-A02-9-161 (SEQ ID NO: 28) (o), не наблюдали. На фигурах "+" означает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и "-" означает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных какими-либо пептидами.
[0027] [фиг. 2m-o] Фигура 2m-o состоит из ряда фотографий, (m)-(o), отображающих результаты анализа ELISPOT на CTL, которые индуцировали пептидами, получаемыми из UBE2T. CTL в лунке №5, стимулируемые UBE2T-A02-10-29 (SEQ ID NO: 56) (m) и №3, стимулируемые UBE2T-A02-10-38 (SEQ ID NO: 58) (n), показали эффективную продукцию IFN-гамма по сравнению с контролем, соответственно. Квадрат на лунке на этих изображениях означает, что клетки из соответствующей лунки размножали для получения линий CTL. В противоположность этому, в качестве характерного случая отрицательных данных, специфической продукции IFN-гамма CTL, стимулированными UBE2T-A02-9-161 (SEQ ID NO: 28) (o), не наблюдали. На фигурах "+" означает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и "-" означает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных какими-либо пептидами.
[0028] [фиг. 3] Фигура 3 состоит из ряда линейных графиков, (a)-(d), отображающих продукцию IFN-гамма линиями CTL, стимулируемыми UBE2T-A24-9-60 (SEQ ID NO: 1) (a), UBE2T-A24-9-45 (SEQ ID NO: 2) (b), UBE2T-A24-9-3 (SEQ ID NO: 13) (c) и UBE2T-A24-10-44 (SEQ ID NO: 27) (d). Количество IFN-гамма, который продуцировали CTL, измеряли твердофазным иммуноферментным анализом (ELISA) для IFN-гамма. Результаты демонстрируют, что линии CTL, получаемые стимуляцией каждым пептидом, демонстрируют эффективную продукцию IFN-гамма по сравнению с контролем. На фигурах "+" означает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и "-" означает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных какими-либо пептидами. Отношение R/S означает отношение числа иммунокомпетентных клеток (линии CTL) к клеткам-стимуляторам.
[0029] [фиг. 4] Фигура 4 состоит из ряда линейных графиков, (a)-(c), отображающих продукцию IFN-гамма клонами CTL, получаемыми лимитирующим разведением из линий CTL, стимулированных UBE2T-A24-9-60 (SEQ ID NO: 1) (a), UBE2T-A24-9-45 (SEQ ID NO: 2) (b) и UBE2T-A24-9-3 (SEQ ID NO: 13) (c). Результаты демонстрируют, что клоны CTL, получаемые стимуляцией каждым пептидом, демонстрируют эффективную продукцию IFN-гамма по сравнению с контролем. На фигурах "+" означает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и "-" означает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных какими-либо пептидами. Отношение R/S означает отношение числа иммунокомпетентных клеток (клона CTL) к клеткам-стимуляторам.
[0030] [фиг. 5] Фигура 5 состоит из ряда линейных графиков, (a)-(e), отображающих продукцию IFN-гамма линиями CTL, стимулируемыми UBE2T-A02-9-107 (SEQ ID NO: 29) (a), UBE2T-A02-9-13 (SEQ ID NO: 38) (b), UBE2T-A02-10-70 (SEQ ID NO: 48) (c), UBE2T-A02-10-102 (SEQ ID NO: 52) (d) и UBE2T-A02-10-101 (SEQ ID NO: 55) (e). Количество IFN-гамма, который продуцировали CTL, измеряли посредством ELISA для IFN-гамма. Результаты демонстрируют, что линии CTL, получаемые стимуляцией каждым пептидом, демонстрируют эффективную продукцию IFN-гамма по сравнению с контролем. На фигурах "+" означает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и "-" означает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных какими-либо пептидами. Отношение R/S означает отношение числа иммунокомпетентных клеток (линии CTL) к клеткам-стимуляторам.
[0031] [фиг. 6] Фигура 6 состоит из ряда линейных графиков, (a)-(e), отображающих продукцию IFN-гамма клонами CTL, получаемыми лимитирующим разведением из линий CTL, стимулированных UBE2T-A02-9-107 (SEQ ID NO: 29) (a), UBE2T-A02-9-13 (SEQ ID NO: 38) (b), UBE2T-A02-10-70 (SEQ ID NO: 48) (c), UBE2T-A02-10-102 (SEQ ID NO: 52) (d) и UBE2T-A02-10-101 (SEQ ID NO: 55) (e). Результаты демонстрируют, что клоны CTL, получаемые стимуляцией каждым пептидом, демонстрируют эффективную продукцию IFN-гамма по сравнению с контролем. На фигурах "+" означает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и "-" означает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных какими-либо пептидами. Отношение R/S означает отношение числа иммунокомпетентных клеток (клона CTL) к клеткам-стимуляторам.
[0032] [фиг. 7] Фигура 7 представляет собой линейный график, изображающий специфическую активность CTL против клеток-мишеней, которые экспрессируют UBE2T и HLA-A*2402. В качестве контроля получали клетки COS7, трансфицированные HLA-A*2402 или полноразмерным геном UBE2T. Клон CTL, получаемый с использованием UBE2T-A24-9-60 (SEQ ID NO: 1), демонстрировал специфическую активность CTL против клеток COS7, трансфицированных UBE2T и HLA-A*2402 (черный ромб). С другой стороны, не детектировали значимой специфической активности CTL против клеток COS7, трансфицированных HLA-A*2402 (треугольник) или UBE2T (круг).
[0033] [фиг. 8] Фигура 8 представляет собой линейный график, изображающий специфическую активность CTL против клеток-мишеней, которые экспрессируют UBE2T и HLA-A*0201. В качестве контроля получали клетки COS7, трансфицированные HLA-A*0201 или полноразмерным геном UBE2T. Линия CTL, получаемая с использованием UBE2T-A02-10-70 (SEQ ID NO: 48), демонстрировала специфическую активность CTL против клеток COS7, трансфицированных UBE2T и HLA-A*0201 (черный ромб). С другой стороны, не детектировали значимой специфической активности CTL против клеток COS7, трансфицированных HLA-A*0201 (треугольник) или UBE2T (круг).
Описание вариантов осуществления
[0034] Хотя любые способы и материалы, подобные или эквивалентные способам и материалам, описанным в настоящем описании, можно использовать в практике или тестировании вариантов осуществления настоящего изобретения, теперь описываются предпочтительные способы, устройства и материалы. Однако перед описанием этих материалов и способов следует понимать, что эти описания являются лишь иллюстративными и не предназначены для ограничения. Также следует понимать, что настоящее изобретение не ограничивается описанными в настоящем описании конкретными размерами, формами, размерностями, методологиями, протоколами и т.д., так как они могут варьироваться в соответствии с рутинным экспериментированием и оптимизацией. Также следует понимать, что терминология, используемая в описании, предназначена только для цели описания конкретных версий или вариантов осуществления и не предназначена для ограничения объема настоящего изобретения, который будет ограничиваться только прилагаемой формулой изобретения.
Описание каждой публикации, патента или заявки на патент, указанные в этом описании изобретения, конкретно полностью включено в настоящем описании посредством ссылки. Однако ничто в настоящем описании не следует понимать как признание того, что это изобретение не дает права на датирование задним числом такого раскрытия на основании предыдущего изобретения.
[0035] Если нет другого определения, все технические и научные термины, используемые в настоящем описании, имеют то же самое значение, что и значение, как правило, понимаемое специалистом в области, к которой принадлежит настоящее изобретение. В случае противоречия, данное описание изобретения, в том числе определения, будет служить контролем. Кроме того, эти материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения.
[0036] I. Определения
Как используют в настоящем описании, если конкретно не указано иное, термины в форме единственного числа означают "по меньшей мере один".
Термины "выделенный" и "очищенный", используемые в отношении вещества (например, пептида, антитела, полинуклеотида и т.д.), указывают, что вещество является по существу свободным от по меньшей мере одного вещества, которое может еще содержаться в природном источнике. Таким образом, выделенным или очищенным пептидом называют пептид, который по существу не содержит клеточный материал, такой как углевод, липид или другие загрязняющие белки из источника клеток или ткани, из которого получен пептид, или по существу не содержит химических предшественников или других химических веществ при химическом синтезе. Термин "по существу не содержит клеточный материал" включает препараты пептида, в которых пептид отделен от клеточных компонентов тех клеток, из которых он изолирован или рекомбинантно получен. Таким образом, пептид, который по существу не содержит клеточный материал, включает препараты полипептида, содержащие менее чем приблизительно 30%, 20%, 10% или 5% (в расчете на сухую массу) гетерологичного белка (также называемого "загрязняющим белком"). При рекомбинантно получаемом пептиде, он также предпочтительно по существу не содержит культуральной среды, которая включает препараты пептида с культуральной средой в количестве приблизительно 20%, 10% или 5% объема этого пептидного препарата. При получении пептида химическим синтезом, он предпочтительно по существу не содержит химических предшественников или других химических веществ, включающих препараты пептида с химическими предшественниками или другими химическими веществами, участвующими в синтезе этого пептида, в количестве менее чем приблизительно 30%, 20%, 10%, 5% (в расчете на сухую массу) объема этого пептидного препарата. То, что конкретный пептидный препарат содержит выделенный или очищенный пептид, может быть показано, например, появлением единственной полосы после электрофореза препарата белка в (ДСН)-полиакриламидном геле и окрашиванием Кумасси бриллиантовым синим или т.п. этого геля. В одном предпочтительном варианте осуществления пептиды и полинуклеотиды по настоящему изобретению являются выделенными или очищенными.
[0037] Термины "полипептид", "пептид" и "белок" используются в настоящем описании взаимозаменяемо для ссылки на полимер аминокислотных остатков. Термины применяют к аминокислотным полимерам, в которых один или более аминокислотных остатков могут представлять собой модифицированный остаток(и) или не встречающийся в природе остаток, такой как искусственный химический миметик(и) соответствующей встречающейся в природе аминокислоты(от), а также к в