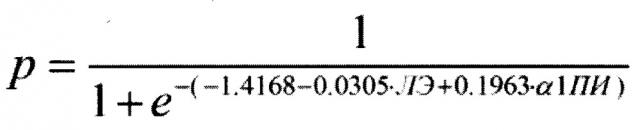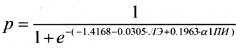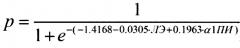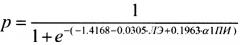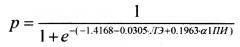Способ прогнозирования вероятности развития болезни альцгеймера (ба)
Иллюстрации
Показать всеИзобретение относится к медицине и касается способа прогнозирования вероятности развития болезни Альцгеймера (БА), включающего измерение в плазме крови человека энзиматической активности лейкоцитарной эластазы (ЛЭ) и функциональной активности α1-протеиназного ингибитора (α1-ПИ) и определение вероятности развития болезни Альцгеймера. Изобретение обеспечивает предсказания вероятности БА у пациентов с мягким когнитивным снижением амнестического типа (МКС). 2 пр.
Реферат
Изобретение относится к области медицины, а именно к области методов клинико-лабораторной диагностики и касается способа прогнозирования болезни Альцгеймера (БА).
Проблема деменции, обусловленная болезнью Альцгеймера (БА), является одним из главных вызовов современного мира. Несмотря на достижения в изучении патогенетических механизмов этого нейродегенеративного заболевания и создание ряда лекарственных средств, направленных на их коррекцию, до сих пор не удалось достичь серьезных результатов. Одной из главных причин является поздняя диагностика БА в связи с тем, что это заболевание развивается бессимптомно или с минимальными клиническими проявлениями в течение 15-20 лет. В качестве преддементной стадии БА рассматривается синдром мягкого когнитивного снижения амнестического типа (amnestic Mild cognitive impairment - aMCI). Критерии синдрома мягкого когнитивного снижения (МКС) разработаны Национальным институтом старения и Американской альцгеймеровской ассоциацией. Они включают подтвержденные при клиническом обследовании признаков когнитивного снижения в сравнении с предыдущим уровнем когнитивного функционирования, объективные признаки ухудшения в одной или более областей когнитивного функционирования, сохранность самостоятельности и независимости в повседневной активности, отсутствие признаков деменции, исключение возможных сосудистых, травматических, соматических причин когнитивного снижения, наличие в анамнезе релевантных генетических факторов БА [Albert MS, DeKosky ST, Dickson D, Dubois B, Feldman HH, Fox NC, Gamst A, Holtzman DM, Jagust WJ, Petersen RC, Snyder PJ, Carrillo MC, Thies B, Phelps CH. The diagnosis of mild cognitive impairment due to Alzheimer's disease: recommendations from the National Institute on Aging - Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease Alzheimers Dement 2011: 7:270-279. doi: 10.1016/j.jalz.2011.03.008.].
Предполагается, что на этой ранней стадии БА терапия может быть наиболее эффективной как в плане улучшения состояния и качества жизни пациентов, так и в плане возможности замедления прогрессирования нейродегенерации и когнитивного снижения.
В связи с этим, чрезвычайно актуальным является поиск биомаркеров для ранней диагностики БА. Среди множества факторов, предрасполагающих к развитию болезни Альцгеймера (оксидативный стресс и свободно-радикальное повреждение, снижение гормонального уровня, эндотелиальная дисфункция, резистентность к инсулину, неправильное питание, обедненное социальное общение и т.д.) значительное место отводится хроническому воспалению.
Воспалительные реакции являются многокомпонентными, в их развертывании принимают участие разнообразные молекулы. Это, прежде всего, медиаторные молекулы - провоспалительные цитокины, такие как IL-1β, IL-6, IL-18 и TNF-α. [Licastro F, Pedrini S, Caputo L, Annoni G, Davis LJ, Ferri C, Casadei V, Grimaldi LM. Increased plasma levels of interleukin-1, interleukin-6 and alpha-1-antichymotrypsin in patients with Alzheimer's disease: peripheral inflammation or signals from the brain? J. Neuroimmunol. 2000 Feb 1; 103(1):97-102.], роль которых заключается в передаче сигналов между клетками. В воспалении также принимают участие острофазные белки, к которым относится C-реактивный белок (СРБ), а так же транспортные белки - альбумин, церулоплазмин, трансферрин. Ряд белков острой фазы обладает антипротеазной активностью. Это α1-антитрипсин, антихимотрипсин, α2- макроглобулин [Varma VR, Varma S, An Y, Hohman TJ, Seddighi S, Casanova R, Beri A, Dammer EB, Seyfried NT, Pletnikova O, Moghekar A, Wilson MR, Lah JJ, O'Brien RJ, Levey AI, Troncoso JC, Albert MS, Thambisetty M. Alpha-2 macroglobulin in Alzheimer's disease: a marker of neuronal injurythrough the RCAN1 pathway. Mol Psychiatry. 2017; 22(1): 13-23. doi:10.1038/mp.2016.206.]. Их важная функция состоит в ингибировании активности протеаз, поступающих из гранулоцитов в воспалительные экссудаты. Эти протеазы, среди которых - лейкоцитарная эластаза (ЛЭ), могут быть отнесены к эффекторным молекулам воспаления. Их роль заключается в увеличении проницаемости сосудистой стенки (в случае заболеваний мозга - сосудов гематоэнцефалического барьера) для проникновения фагоцитов в очаг воспаления.
По мнению ряда авторов [Schram МТ, Euser SM, de Craen AJ, Witteman JC, M, Hofman A, Jolles J, Breteler MM, Westendorp RG. Systemic markers of inflammation and cognitive decline in old age. J Am Geriatr Soc. 2007; 55(5):708-716. doi:10.1111/j.1532-5415.2007.01159.x.] повышение активности ИЛ-6 и СРБ позволяет рассматривать их в качестве молекулярных маркеров когнитивного снижения и БА. Вместе с тем, неожиданными оказались результаты наших предыдущих исследований, выявивших, наряду с повышением уровня медиаторных и острофазных молекул (ИЛ-6, СРБ и α1-ПИ), не повышение, а достоверное снижение активности ЛЭ в крови пациентов с болезнью Альцгеймера по сравнению с контролем; снижение активности этой протеазы коррелировало со степенью снижения когнитивных функций [Андросова Л.В., Михайлова Н.М., Зозуля С.А., Дупин A.M., Рассадина Г.А., Лаврентьева Н.В., Клюшник Т.П. Маркеры воспаления при болезни Альцгеймера и сосудистой деменции. Ж. Неврологии и психиатрии им. С.С.Корсакова. 2013; 113: 2: 49-53; Клюшник Т.П., Андросова Л.В.. Михайлова Н.М., Соколов А.В., Костевич В.А., Захарова Е.Т., Васильев В.Б. Потенциальные маркеры болезни Альцгеймера, ассоциированные с воспалением. Психиатрия (Научно-практический журнал), 2014; 61(01):26-32. Androsova L, Mikhaylova N, Zozulya S, Dupin A, Klyushnik T. A comparative study of innate immunity markers in Alzheimer's disease, Mixed dementia and Vascular dementia. International Journal of Clinical Neurosciences and Mental Health 2016; 3(Suppl. 1): S03 Published: 23 December 2016 doi:10.21035/ijcnmh.2016.3(Suppl.1).S03.].
Следует отметить, что при других неинфекционных хронических заболеваниях мозга, ассоциированных с воспалением, таких как расстройства шизофренического спектра, аутистические и аффективные расстройства, выявлено повышение активности ЛЭ, как и других маркеров воспаления. В настоящее время причина снижения активности ЛЭ у пациентов с БА остается неизвестной, однако эта особенность спектра маркеров воспаления, предположительно, может служить основой иммуно-биохимической тест-системы для ранней диагностики БА и использоваться в мониторинге пациентов с когнитивным снижением.
В связи с вышесказанным представляет значительный научный интерес проблема определения роли иммунологических показателей и их вклад в оценку вероятности наличия у человека БА.
Технической проблемой настоящего изобретения является возможность определение количественной оценки взаимосвязи БА с такими маркерами воспаления как энзиматическая активность лейкоцитарной эластазы (ЛЭ) и функциональная активность α1-протеиназного ингибитора (α1-ПИ) и использование полученной модели для предсказания вероятности БА у пациентов с мягким когнитивным снижением амнестического типа (МКС).
Технический результат изобретения состоит в получении количественной информацию в виде величины вероятности БА. Далеко не всегда клинические и клинико-психологические исследования позволяют надежно установить диагноз БА, дополнительное определение активности ЛЭ и α1-ПИ в крови пациентов позволяет не только сделать вывод о вероятном наличии у пациента БА, но также вычислить численное значение вероятности этого заболевания, что увеличивает степень уверенности клинициста в постановке диагноза оптимизации терапии.
Исследование когнитивных функций у пациентов с интеллектуально-мнестическими нарушениями различного генеза - один из основных способов диагностики. Большинство методик изначально валидизированы только для диагностики БА. С данной целью широко применяются: батарея тестов для оценки лобной дисфункции (FAB), тесты на речевую активность - литеральные и категориальные ассоциации (Dubois В., Slachevsky A., Litvan I. et al. The FAB: A frontal assessment battery at bedside // Neurology. - 2000. - Vol.55, №11. - P. 1621-1626; Kazdin A.E. Single-case research designs: methods for clinical and applied settings. - New York, NY: Oxford University Press, 1982. - 55 p.), методики оценки вербального запоминания, такие как тест 10 слов (Лурия А.Р. Высшие корковые функции человека и их нарушения при локальных поражениях мозга. - 2-е доп.изд. - М.: Изд-во МГУ, 1969. - 504 с), тест 5 слов (Grober Е., Buschke Н.; Crystal Н. et al. Screening for dementia by memory testing // Neurology. - 1988. - Vol.38, №6. - P. 900-903). В то же время такие комплексные оценочные шкалы не позволяют уточнять генез когнитивных расстройств и лишь определяют их степень тяжести. Недостатками всех перечисленных выше способов диагностики является их малая информативность в определении клинической формы заболевания.
Известен способ дифференциальной диагностики деменций с применением высокоточного метода нейровизуализации - позитронно-эмиссионной томографии (ПЭТ) с 18-флюородезоксиглюкозой (18-ФДГ). Снижение метаболизма глюкозы в теменно-височных, лобных отделах и заднем отделе поясной извилины является высокоспецифичным признаком болезни Альцгеймера. ПЭТ с 18-ФДГ достигает 90% чувствительности в идентификации болезни Альцгеймера, хотя ее специфичность в дифференциации этой нозологической формы от других форм деменции несколько ниже (84-88%). Визуализация уровня церебрального метаболизма глюкозы с помощью 18F-ФДГ ПЭТ является высокочувствительным и специфичным методом именно для дифференциальной диагностики различных форм когнитивных нарушений. ПЭТ с флюородезоксиглюкозой позволяет диагностировать гипометаболизм в определенных отделах коры головного мозга за 10-15 лет до появления первых симптомов болезни (Mosconi L, Berti V, Glodzik L., et al. Pre-clinical detection of Alzheimer's disease using FDG-PET with or without amyloid ligand // J Alzheimers Dis. - 2010. - Vol.20, №3. - P. 843-854). Однако обладая высокой чувствительностью, ПЭТ не получила широкого применения в клинической практике в нашей стране из-за высокой стоимости исследования и необходимости синтеза короткоживущих радиоизотопов.
Известен способ дифференциальной диагностики болезни Альцгеймера, сосудистой и смешанной деменции на основании клинико-нейропсихологических и ликворологических данных, причем в ликворе определяют уровень амилоидного белка αβ-42 (Х7, пг/мл) и уровень общего тау-протеина (Х8, пг/мл), дополнительно определяют наличие атеросклероза (X1), оценивая 1 баллом - наличие, 0 - отсутствие атеросклероза; нейропсихологические данные оценивают по тестам «Батарея тестов для оценки лобной дисфункции», определяя общий балл (Х2), «5 слов», определяя отсроченное воспроизведение (Х3, балл), «рисования часов», определяя общий балл (Х4), «тест слежения», определяя время выполнения в части «В» (Х5, с), «клиническая рейтинговая шкала деменции», определяя степень тяжести деменции (Х6, балл), и рассчитывают линейно-дискриминантные функции (ЛДФ) по формулам:
ЛДФ1=-114,4+10,7×Х1+6,3×Х2+(-2,1×Х3)+10,1×Х4+0,162×Х5+28,9×Х6+0,013×Х7+0,002×Х8;
ЛДФ2=-129,4+13,6×Х1+5,8×Х2+(-0,46×Х3)+10,4×Х4+0,181×Х5+30,3×Х6+0,033×Х7+0,0003×Х8;
ЛДФ3=-146,7+13,9×Х1+7,0×Х2+(-1,8×Х3)+11,4×Х4+0,183×Х5+32,9×Х6+0,008×Х7+0,003×Х8; и при ЛДФ1>ЛДФ2, ЛДФ3 у больных диагностируют болезнь Альцгеймера; при ЛДФ2>ЛДФ1, ЛДФ3 у больных диагностируют сосудистую деменцию; при ЛДФ3>ЛДФ1, ЛДФ2 у больных диагностируют смешанную деменцию. [патент РФ №2578188, 2015 г].
Основные недостатки известного способа состоят в следующем:
- для ликворологического исследования необходим забор цереброспинальной жидкости при выполнении люмбальной пункции, что налагает огромную нагрузку на пациента;
- при исследовании используют 8 специфических признаков (предикторов), что требует привлечения дополнительных методик;
- используемая в исследованиях линейная дискриминантная функция позволяет дать только качественный ответ и не дает количественной оценки уверенности диагноза.
Для решения вышеуказанной технической проблемы и преодоления вышеуказанных недостатков авторами предложен способ прогнозирования вероятности развития болезни Альцгеймера (БА), включающий измерение в плазме крови человека энзиматической активности лейкоцитарной эластазы (ЛЭ) и функциональной активности α1-протеиназного ингибитора (α1-ПИ) и определение вероятности развития болезни Альцгеймера в соответствии с формулой:
где, р - вероятность развития БА, е - основание натурального логарифма, число -1.4168 - константа, число -0.0305 - коэффициент при ЛЭ, число 0.1963 - коэффициент при α1-ПИ, ЛЭ - измеренное в плазме крови человека значение энзиматической активности лейкоцитарной эластазы, α1-ПИ - значение функциональной активности α1-протеиназного ингибитора, при этом, если значение р больше 0,65 (р>0.65), то вероятно развитие БА, а если значение р меньше 0,65 (р<0.65), то развитие БА маловероятно.
Предложенный авторами способ был апробирован в лаборатории доказательной медицины и биостатистики ФГБНУ НЦПЗ. Была использована база данных, включающая результаты определения иммунологических показателей (энзиматическая активность ЛЭ и функциональная активность α1-ПИ.) в плазме крови 91 пациента с верифицированным диагнозом БА, находящихся на стационарном или амбулаторном лечении в клинике ФГБНУ НЦПЗ и 37 человек аналогичного возраста без клинических признаков соматической и психической патологии (здоровых).
База данных по МКС включала 74 пациента, находящихся на амбулаторном лечении в клинике ФГБНУ НЦПЗ.
Статистическую обработку данных проводили с использованием программ R (R version 3.2.4) и STATA (version 12.1). Уровень статистической значимости был выбран при р<0,05.
Эмпирическим путем авторами была получена следующая формула:
где р - вероятность наличия у человека БА,
ЛЭ - энзиматическая активность лейкоцитарной эластазы,
α1-ПИ - функциональная активность протеиназного ингибитора.
Полученная формула была проверена на ее адекватность наблюдаемым данным в целом. Адекватность в целом оценивается величиной удвоенной разности логарифмов функций максимального правдоподобия для формулы со всеми независимыми переменными (LL(model)) и формулы без независимых переменных (LL(null)). Эта величина имеет распределение Хи-квадрат Пирсона и показывает уровень согласованности модели со всеми независимыми переменными.
Результаты компьютерного анализа адекватности формулы экспериментальным данным, показывают, что удвоенная разность логарифма максимального правдоподобия между формулой с включением обоих предикторов (ЛЭ и α1-ПИ) и моделью без этих предикторов составила 64.31, что соответствует достигнутому уровню статистической значимости критерия хи-квадрат с 2-мя степенями свободы p-значение <0.05. Это свидетельствует о том, что формула хорошо описывает наблюдаемые экспериментальные данные.
Таким образом, полученная формула, связывающая вероятность БА с иммунологическими показателями ЛЭ и a1-ПИ, адекватно описывает экспериментальные данные, и может быть использована для предсказания наличия у пациентов БА по их индивидуальным лабораторным показателям уровня ЛЭ и a1-ПИ.
Способ реализуют следующим образом:
На основании данных клинического обследования пациента, клинико-психологической оценки его когнитивных функций и инструментальных данных (МРТ) устанавливают диагноз вероятной болезни Альцгеймера (согласно критериям ICD-10 и NINCDS-ADRDA) [McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM. Clinical diagnosis of Alzheimer's disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease. Neurology. 1984; 34(7): 939-944].
Для иммуно-биохимического исследования используют плазму крови пациента, которую получают стандартным методом в вакутейнеры с напылением ЭДТА (К3Е, К3EDTA). Согласно предложенному способу оценки вероятности БА в полученной плазме определяют энзиматическую активность ЛЭ и функциональную активность a1-ПИ.
Энзиматическую активность ЛЭ определяют ферментативным спектрофотометрическим методом с использованием специфического субстрата N-терт-бутокси-карбонил-аланин-β-нитрофенилового эфира (BOC-Ala-ONp), и оценивают в нмоль/мин*мл (чувствительность метода 40 нмоль/мин*мл) [Доценко В.Л., Нешкова Е.А., Яровая Г.А.]
Функциональную активность α1-ПИ определяют спектрофотометрическим методом и оценивают в ИЕ/мл (ингибиторные единицы/мл) (чувствительность метода 5 ИЕ/мл) [Нартикова В.Ф., Пасхина Т.С. Унифицированный метод определения активности α1-антитрипсина и α2-макроглобулина активности в сыворотке крови человека (плазмы). Вопр. Мед. Хим. 1979; 25(4): 494-499].
Полученные данные по активности ЛЭ и α1-ПИ вставляют в формулу и вычисляют вероятность БА.
Как показали исследования авторов, если полученное по этой формуле значение вероятности больше порога отсечения 0.65 (р>0.65), то у данного пациента высокий риск БА, а если р<0.65, то у данного пациента наблюдаемые когнитивные расстройства могут быть отнесены к деменциям иной природы (сосудистая, лобно-височная и т.д.).
Важно заметить, что полученная по формуле величина вероятности дает возможность клиницисту не только дифференцировать больных, но и оценить степень уверенности в постановки первоначального диагноза. Помимо этого, измерения активности ЛЭ и α1-ПИ и, соответственно, вычисление вероятности БА в динамике развития заболевания или в ходе проводимой терапии, позволяют проводить мониторинг состояния пациента и оценивать эффективность терапии.
Пример 1. Пациентка К.О.А. 08.03.1953 г. р.
Наследственность - мать страдает деменцией при болезни Альцгеймера с поздним началом.
Впервые обратилась в Альцгеймеровский центр НЦПЗ в возрасте 51 года с жалобами на рассеянность, ухудшение памяти на недавние события, трудности запоминания новой информации, тревожные опасения развития деменции в связи с наследственной отягощенностью. Ухудшение внимания и памяти отмечает с 50 лет. Сообщает, что забывает авторов прочитанных книг, не может сразу вспомнить хорошо знакомые имена, перепроверяет, выключены ли электроприборы, стала обидчивой, плаксивой. Полностью справляется с различными домашними нагрузками. При исследовании когнитивных функций мини-тест психического состояния (MMSE) 29 баллов, тест рисования часов 10 баллов, запоминание слов - 8 из 10, отсроченное воспроизведение - 4. Обнаруживает критическое отношение к своему состоянию.
По данным МРТ головного мозга - слабо выраженная наружная и внутренняя сообщающаяся гидроцефалия. Боковые желудочки мозга слабо расширены в телах, субарахноидальные пространства борозд полушарий лобных, височных и теменных долей слабо расширены.
С диагнозом «Мягкое когнитивное снижение амнестического типа» постоянно наблюдается в Альцгеймеровском центре НЦПЗ. Состояние относительно стабильное. Сохраняются жалобы на трудности концентрации внимания, легкую забывчивость, утомляемость. При повторной оценке когнитивного функционирования мини-тест (MMSE) в пределах 27-30 баллов, тест рисования часов выполняет на 9 баллов. Оценка степени выраженности когнитивного снижения по CDR 0,5. Сохраняет привычную активность в повседневной деятельности. Состояние устойчивое, прогрессирования расстройств не отмечается.
Иммунологическое исследование крови:
Иммунологическое исследование от 04.07.2013 - активность ЛЭ 213,8 нмоль/мин×мл), α1-ПИ - 43,3 ИЕ/мл.
Вероятность БА, рассчитанная по формуле - 0,639
Повторно в динамике (17.04.15) - активность ЛЭ - 203,0 нмоль/мин×мл; α1-ПИ - 38,9 ИЕ/мл;
Вероятность БА, рассчитанная по формуле - 0,295
На протяжении длительного периода наблюдения и обследования состояние пациентки отвечает критериям клинической диагностики мягкого когнитивного снижения без существенных признаков прогрессирования расстройств, что в совокупности с данными нейровизуализации и положительной динамикой иммунологических показателей не подтверждает прогностический риск болезни Альцгеймера.
Пример 2. Пациентка П.Т.В., 21.08.1949 г.р.
Наследственность отягощена сенильной деменцией альцгеймеровского типа у матери. Пациентка впервые обратилась в возрасте 54-х лет в Альцгеймеровский центр НЦПЗ с жалобами на снижение памяти на текущие события, трудности припоминания фамилий знакомых лиц, ослабление концентрации внимания, забывание места, куда положила ключи, очки с последующим их поиском. Ухудшение памяти замечает с 52-х лет, стала пользоваться записями для памяти. Полностью справляется с повседневной деятельностью. Правильно ориентирована в месте и времени. Мини-тест психического состояния (MMSE) 28 баллов. Допускает ошибки в счете (по Крепелину). После интерференции не воспроизводит одно слово из трех. Нарушений речи, письма, пространственного праксиса не обнаруживает. Тест рисования часов выполняет правильно. С критикой относится к ухудшению памяти.
По данным МРТ головного мозга - желудочки мозга не расширены, слабо расширена парагиппокампальная извилина слева, борозды больших полушарий умеренно расширены в лобно-теменной области, мелкие очаги в белом веществе сосудистого генеза.
С диагнозом «Мягкое когнитивное снижение амнестического типа» пациентка находилась под постоянным наблюдением с динамической оценкой состояния когнитивных функций. Мини-тест (MMSE) при повторных оценках в пределах 28-29 баллов. Тест рисования часов 10 баллов. Тест запоминания слов - 8 из 10, отсроченно - 7. Оценка 0,5 по клинической шкале тяжести деменции (CDR) оставалась неизменной на протяжении всего периода наблюдения.
Иммунологическое исследование от 08.04.2013 - активность ЛЭ 169,8 нмоль/мин×мл, α1-ПИ - 62,1 ИЕ/мл.
Вероятность БА, рассчитанная по формуле - 0,996
Повторно в динамике (30.06.15) - активность ЛЭ - 193,5 нмоль/мин×мл; α1-ПИ - 60,5 ИЕ/мл.
Вероятность БА, рассчитанная по формуле - 0,990
Отсутствие прогрессирования когнитивного снижения, стабильность клинического состояния и результатов тестовой оценки когнитивных функций при сохранении жалоб на ослабление памяти и постоянное выявление нарушения отсроченного припоминания отвечает критериям R. Petersen для диагноза «Мягкое когнитивное снижение амнестического типа». Вместе с тем, наследственная отягощенность деменцией альцгеймеровского типа у матери, результаты нейровизуализации и иммунологического исследования позволяют отнести случай в группу высокого риска развития болезни Альцгеймера.
Приведенные примеры свидетельствуют, что при первичном обследовании обе пациентки предъявляли сходные жалобы, имели примерно одинаковые оценки когнитивных функций по соответствующим тестам и обе отвечали критериям для диагноза «Мягкое когнитивное снижение». Однако, эти пациентки различались по результатам иммунологического обследования и соответственно, вероятности болезни Альцгеймера, вычисляемой по предложенной формуле: для первой пациентки р=0,639, что ниже порога отсечения (0,65), и соответствует низкой вероятности БА; для второй пациентки р=0,996, что соответствует высокой вероятности БА. Динамическое наблюдение за пациентками в ходе развития заболевания и повторное иммунологическое обследования выявило существенное снижение вероятности БА у первой пациентки (р=0,295) и, по-прежнему, высокую вероятность БА у второй пациентки (р=0,990), что служит дополнительным обоснованием для высокой вероятности диагноза БА у этой пациентки и подтверждением эффективности предложенного авторами способа.
Таким образом, предложенный способ дает клиницисту количественную информацию в виде величины вероятности БА. Далеко не всегда клинические и клинико-психологические исследования позволяют надежно установить диагноз БА, дополнительное определение активности ЛЭ и α1-ПИ в крови пациентов позволяет не только сделать вывод о вероятном наличии у пациента БА, но также вычислить численное значение вероятности этого заболевания, что увеличивает степень уверенности клинициста в постановке диагноза оптимизации терапии.
Способ прогнозирования вероятности развития болезни Альцгеймера (БА), включающий измерение в плазме крови человека энзиматической активности лейкоцитарной эластазы (ЛЭ) и функциональной активности α1-протеиназного ингибитора (α1-ПИ) и определение вероятности развития болезни Альцгеймера в соответствии с формулой
где р - вероятность развития БА, е - основание натурального логарифма, число -1.4168 - константа, число -0.0305 - коэффициент при ЛЭ, число 0.1963 - коэффициент при α1-ПИ, результат измерения энзиматической активности ЛЭ выражают в единицах [нмоль/мин×мл] и результат измерения функциональной активности α1-ПИ выражают в единицах [ИЕ/мл],
при этом если значение р больше 0,65 (р>0.65), то вероятно развитие БА, а если значение р меньше 0,65 (р<0.65), то развитие БА маловероятно.