Способ получения 6α-метилгидрокортизона или его эфиров из 21-ацетата гидрокортизона
Иллюстрации
Показать всеИзобретение относится к способу получения 6α-метилгидрокортизона (11β, 17α, 21-тригидрокси-6α-метилпрегн-4-ен-3,20-диона) или его эфиров общей формулы I
в которой R=COCF3 или Н; R1=СОСН3 или Н, из 21-ацетата гидрокортизона формулы II, последовательностью превращений, включающей защиту 11β-гидроксильной группы этерификацией производным трифторуксусной кислоты в среде апротонного растворителя в условиях основного катализа с образованием 21-ацетокси-17α-гидрокси-11β-трифторацетилоксипрегн-4-ен-3,20-диона формулы III, енолэтерификацию Δ4-3-кетосистемы полученного соединения действием триалкилортоформиата в присутствии кислого катализатора с образованием 3-алкоксиэфира Δ3,5-3-гидроксипроизводного общей формулы IV, конденсацию его с реагентом Манниха в присутствии кислого катализатора с образованием смеси 6α- и 6β-изомеров 6-(N-метил-N-фенил)-аминометилпроизводного общей формулы V, расщепление полученной смеси стероидных оснований Манниха по связи C-N действием минеральной кислоты в присутствии солей галогеноводородной кислоты с образованием 6-метиленпроизводного формулы VI, изомеризацию 6-экзометиленовой связи в 6,7-эндометиленовую с образованием соединения VII; каталитическое гидрирование 6,7-эндометиленовой связи с образованием смеси 6α-метил- и 6β-метил-изомеров и последующей изомеризацией 6β-метил-изомера в 6α-метилпроизводное формулы VIII, удаление защитных группировок 11β- и 21-гидроксильных групп полностью или частично. Технический результат: разработан простой способ получения соединения формулы I из 21-ацетата гидрокортизона с выходом целевых продуктов не менее 80%. 22 з.п. ф-лы, 12 пр.
Реферат
Область техники
Настоящее изобретение относится к области органического синтеза, конкретно касается получения стероидных соединений (кортикостероидов), таких как 6α-метилгидрокортизон или его эфиры, и может быть использовано в химической и фармацевтической отраслях промышленности, а также в промышленной биотехнологии для производства стероидных медицинских препаратов.
Уровень техники
6α-Метилгидрокортизон (CAS №1625-39-4) является промежуточным соединением в синтезе 6α-метилпреднизолона (СAS №83-43-2) из гидрокортизона (СAS №50-23-7) или 21-ацетата гидрокортизона (CAS №50-03-3).
Полученный в соответствии с предлагаемым способом 6α-метилгидрокортизон не только служит исходным субстратом для дальнейшего превращения в 6α-метилпреднизолон химическим или биотехнологическим способами, но может быть использован для получения его 21-эфиров, например, 21-гемисукцината 6α-метилгидрокортизона (СAS №119657-85-1) и 21-ацетата 6α-метилгидрокортизона (СAS №1625-11-2).
Полученные в соответствии с предлагаемым способом 11-трифторацетат 6α-метилгидрокортизона и 11-трифторацетат 21-ацетата 6α-метилгидрокортизона могут быть использованы для получения 17α-моно- или 17α,21-диэтерифицированных производных 6α-метилгидрокортизона, которые представляют интерес как возможные активные ингредиенты в противовоспалительных фармацевтических препаратах [US 4912098, 1990].
Известные способы введения С6-метильного заместителя в молекулу гидрокортизона или 21-ацетата гидрокортизона в качестве ключевой стадии включают введение метиленовой группы в положение С6 с последующим ее превращением в 6α-метильную группу.
Введение С6-метиленовой группы осуществляют различными методами, используя формальдегид или его производные как метиленирующие агенты. Однако все способы предусматривают обязательную предварительную енолизацию α,β-ненасыщенного кетона кольца А, необходимую для поляризации системы двойных связей с образованием нуклеофильного атома углерода С6, с последующим замещением атома водорода при С6 на формильную или метиленовую группу и различаются тем, что в одних случаях образованный промежуточный 3,5-диенол выделяют в виде эфира [D.Burn et al., Tetrahedron, 1965, 21(6), 1619-1624] или 3,5-диенамина [F. Schneider et al., Helv. Chim. Acta, 1973, 56(7), 2396-2404], в других же случаях енолизация проводится in situ без выделения промежуточного продукта.
Наиболее привлекательными являются методы так называемой прямой конденсации с формальдегидом или его производными. Это метод прямого γ-метиленирования, предложенный Анненом и соавт. [US 4322349, 1982; Synthesis, 1982, №1, p. 34-40; ЕР 0100874, 1984; ЕР 0149222, 1985], и метод конденсации с реагентом Манниха [R. Bohlmann et al, DE 4121484, 1993].
Метод прямого γ-метиленирования заключается во взаимодействии стероида с производными формальдегида (такими как диметилацеталь, диэтилацеталь формальдегида или метоксиметилацетат) в хлорсодержащих растворителях при температуре кипения в присутствии избытка хлорокиси фосфора и ацетата натрия. Однако этот метод непригоден для метиленирования соединений, содержащих незащищенную 11β-гидроксильную группу. Так, при прямом γ-метиленировании 21-ацетата гидрокортизона выход 6-метиленпроизводного составляет всего лишь 18% [Synthesis, 1982, №1, р. 34-40, Таблица 1, соединение 6n].
Известно также, что енолэтерификация Δ4-3-кетосистемы кольца А стероидов, катализируемая п-толуолсульфокислотой (п-ТСК), в присутствии незащищенной 11β-гидроксильной группы может сопровождаться нежелательной реакцией ее элиминирования с образованием Δ9(11)-связи [Zhao Q. et al. Synth. Commun., 1993, 23(10), 1473-1478]. Поэтому для сохранения 11β-гидроксильной группы необходима ее защита.
Известно, что для защиты 11β-гидроксигруппы ее обычно этерифицируют, превращая в тригалогенацетат (в частности трифторацетат) или триметилсилиловый эфир. Эти защиты считаются наиболее приемлемыми, так как не только легко образуются, но и легко удаляются. Применение для защиты 11β-гидроксигруппы метода этерификации ангидридами низших кислот возможно, однако ограничено из-за проблем, возникающих при их последующем удалении химическими методами сольволиза.
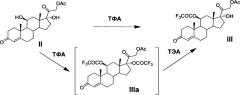
Способы применения трифторацетатной защиты 11β-гидроксильной группы молекулы 21-ацетата гидрокортизона (II) известны. Это способ, описанный в патенте [US 4330541, 1982, пример 1], который заключается в том, что реакцию этерификации 5 г 21-ацетата гидрокортизона проводят в среде пиридина действием трифторуксусного ангидрида при температуре минус 15°С. Далее смесь выливают в водный раствор хлорида натрия, отфильтрованный осадок растворяют в дихлорметане, органический раствор промывают водой, осушают сульфатом натрия и упаривают досуха. Получают 5.1 г (82,4%) остатка, содержащего 11-трифторацетат 21-ацетата гидрокортизона (III). Однако это соединение не было охарактеризовано, так как содержащий его остаток без очистки и выделения кристаллического продукта был использован авторами патента на следующей стадии химического синтеза.
Другие патенты [DE 1112511, 1961 (пример 16) и DE 1125422, 1962 (пример 15)] описывают способ получения 11-трифторацетата 21-ацетата гидрокортизона (III) из 21-ацетата гидрокортизона (II) действием трифторуксусного ангидрида в среде абсолютного диоксана. После 18 ч выдержки при комнатной температуре реакционную смесь выливают на ледяную воду. Далее продукт экстрагируют, экстракт промывают водой, упаривают досуха в вакууме. После кристаллизации остатка в эфире и хроматографирования на окиси алюминия получают 11-трифторацетат 21-ацетата гидрокортизона (III), выход которого не указан. Продукт охарактеризован: т.пл. 206-207°С, [α]D+165,7° (хлф); λmax 238-240 mμ. Спектральная характеристика отсутствует.
Получение метилового 3,5-диенолэфира 11-трифторацетата 21-ацетата гидрокортизона (IVa) в литературных источниках не описано.
Получение этилового 3,5-диенолэфира 11-трифторацетата 21-ацетата гидрокортизона (IVb) описано в патентах [DE 1112511, 1961 (пример 16) и DE 1125422, 1962 (пример 15)] и заключается в реакции соединения III с этилортоформиатом в среде диоксана в присутствии п-ТСК при комнатной температуре. После окончания реакции смесь выливают в воду и экстрагируют дихлорметаном. Экстракт промывают водой, осушают сульфатом натрия и упаривают досуха. Маслянистый остаток, содержащий соединение IVb, выход которого не указан, охарактеризован: [α]D±0° (хлф); λmax 240-242 mμ, log ε 4,15. Соединение IVb не было выделено авторами в кристаллическом виде. Спектральная характеристика, отсутствует, температура плавления не определена.
6-Аминометильные производные общей формулы V являются новыми соединениями, в литературе не описаны.
6-Метилен-производное 11-трифторацетата 21-ацетата гидрокортизона VI является новым соединением, в литературе не описано.
6,7-Дегидро-6-метил-производное 11-трифторацетата 21-ацетата гидрокортизона VII является новым соединением, в литературе не описано.
Соединение VIII - 21-ацетокси-17α-гидрокси-11β-трифторацетилокси-6α-метилпрегн-4-ен-3,20-дион (11-трифторацетат 21-ацетата 6α-метилгидрокортизона) - известно. Однако в литературе описано его получение из других соединений. Так, известен способ получения 11-трифторацетата 21-ацетата 6α-метилгидрокортизона из 21-ацетата 6α-метилгидрокортизона трифторацетилированием его 11β-гидроксильной группы [US 4912098, 1990], согласно которому 5 г 21-ацетата 6α-метилгидрокортизона обрабатывают трифторуксусным ангидридом в растворе пиридина при температуре минус 15°С. Затем реакционную массу выливают на водный раствор хлорида натрия, отфильтрованный осадок растворяют в дихлорметане, органический раствор промывают водой, осушают сульфатом натрия и упаривают досуха. Получают 5,1 г (83%) остатка, содержащего 11-трифторацетат 21-ацетата 6α-метилгидрокортизона (VIII), который без кристаллизации используют на следующей стадии химического синтеза.
Также известен метод получения соединения VIII, исходя из 21-ацетокси-11β,17α-бис-(трифторацетилокси)-6-метиленгидрокортизона [RU 2297423, 2007], согласно которому соединение VIII получают восстановлением 6-метиленовой группы 21-ацетокси-11β,17α-бис-(трифторацетилокси)-6-метиленгидрокортизона в 6-метильную кипячением в течение 24 ч в среде этанола в присутствии циклогексена и катализатора PdO/C. При этом имеет место одновременное удаление трифторацетильной защиты 17α-гидроксильной группы.
Известен способ получения 11-трифторацетата 6α-метилгидрокортизона (IX), описанный в патенте [RU 2337918, 2008, пример 17]. Однако соединение IX в варианте 1 примера 17 указанного патента получено другим способом, а именно из 11β-трифторацетилокси-17α,20;20,21-бисметилендиокси-6α-метилпрегн-4-ен-3,20-диона удалением бисметиленовой защиты диоксиацетоновой боковой цепи в среде уксусной кислоты при температуре 0-2°С действием концентрированной соляной кислоты (на 5 г стероида используют 20 мл уксусной кислоты и 75 мл соляной кислоты). В варианте 2 примера 17 этого же патента соединение IX получено из 11-трифторацетата 6-метиленгидрокортизона каталитическим гидрированием (Pd/C 5,4%) в присутствии циклогексена в среде смеси этанола и уксусной кислоты.
Известен способ получения 21-ацетата 6α-метилгидрокортизона [DE 4121484, 1993, пример 2], который заключается во введении метиленовой группы в положение С6 молекулы 21-ацетата гидрокортизона и последующем каталитическом восстановлении С6-метиленовой группы в 6α-метильную. Согласно описанию этого способа 5 г 21-ацетата гидрокортизона (II) суспендируют в смеси 50 мл тетрагидрофурана, 15 мл триэтилортоформиата и 15 мл этанола, добавляют 500 мг тозилата пиридиния и перемешивают в течение 1 ч при температуре 40°С в бане. Затем добавляют 5,5 мл N-метиланилина и 6,5 мл 40% раствора формальдегида и перемешивают не менее часа при температуре 40°С. После этого реакционную массу обрабатывают ледяной водой, содержащей винную кислоту и хлорид натрия, экстрагируют дихлорметаном, промывают раствором бикарбоната натрия и хлорида натрия, осушают сульфатом натрия и упаривают в вакууме досуха. Полученный остаток (5,8 г) хроматографируют на 600 г кизельгеля смесью гексан-этилацетат и получают 2,1 г (40,8%) 6-метилен-производного 21-ацетата гидрокортизона, который далее помещают в смесь 9 мл циклогексена и 124 мл этанола, добавляют 170 мг катализатора 10% Pd/C и кипятят в течение 8 ч. После охлаждения катализатор отфильтровывают и промывают этанолом, добавляют к фильтрату 2 капли соляной кислоты и концентрируют в вакууме до 1/3 первоначального объема, остаток разбавляют ледяным рассолом, осадок отфильтровывают, промывают водой до нейтральной реакции, сушат в вакууме при 70°С. После перекристаллизации неочищенного продукта из смеси ацетона и гексана получают 1,78 г чистого 21-ацетокси-11β,17α-дигидрокси-6а-метилпрегн-4-ен-3,20-диона с т.пл. 208-209°С и [α]D=+137° (в пиридине). Таким образом, выход 21-ацетата 6α-метилгидрокортизона по способу [DE 4121484, 1993] из 21-ацетата гидрокортизона (II) составляет 34,4%.
Недостатками описанного в [DE 4121484, 1993] процесса являются:
- применение для очистки 21-ацетата 6-метилен-гидрокортизона хроматографии, существенно усложняющей технологический процесс.
- низкий выход продукта 21-ацетата 6-метилен-гидрокортизона (40,8%) на стадии метиленирования, который можно объяснить, во-первых, наличием побочных реакций с участием незащищенной гидроксильной группы при С11, и, во-вторых, низкой регионаправленностью реакции расщепления стероидного основания Манниха. Вероятно, что в описанных условиях реакции дезаминирования (расщепление по связи C-N) сопутствует побочный процесс дезаминометилирования (расщепление по связи С-С) с регенерацией 21-ацетата гидрокортизона. Поэтому хроматографическая очистка продукта становится необходимой.
Наиболее близким по сущности к предложенному является способ [RU 2297423, 2007, примеры 3 (вариант 2) и 4], который заключается во введении метиленовой группы в положение С6 молекулы 11β,17α,21-триалканоилокси-прегн-4-ен-3,20-диона и последующем каталитическом восстановлении С6-метиленовой группы в 6α-метильную. Согласно описанию этого способа (пример 3, вариант 2) к раствору 10 г 11,17,21-триацетата гидрокортизона в 75 мл тетрагидрофурана добавляют 10 мл этанола, 10 мл триэтилортоформиата, 130 мг п-ТСК и нагревают до 40°С. Реакционную массу выдерживают в течение 1 ч и добавляют дополнительно 130 мг п-ТСК. После перемешивания в течение еще 1 ч при температуре 40°С добавляют 4,3 мл N-метиланилина и 3-6 мл водного 37% раствора формальдегида. Реакционную массу выдерживают в течение 2 ч, затем охлаждают до комнатной температуры, добавляют 25 мл концентрированной соляной кислоты и перемешивают 30 мин. Смесь экстрагируют хлористым метиленом, органический слой промывают водой до нейтральной реакции, растворитель упаривают. После кристаллизации получают 9,4 г 11β,17α,21-триацетокси-6-метиленпрегн-4-ен-3,20-диона с выходом 92%. По примеру 4 этого способа в аналогичных условиях из 1 г 21-ацетокси-11β,17α-бис(трифторацетилокси)-прегн-4-ен-3,20-диона получают 0,93 г 6-метилен-производного с выходом 91%.
Основным недостатком указанного способа является необходимость обязательной защиты всех гидроксильных групп, имеющихся в структуре молекулы гидрокортизона с последующим удалением защит. Так, при применении для защиты метода исчерпывающего ацетилирования, несмотря на высокие постадийные выходы при получении 11β,17α,21-триацетокси-6α-метилпрегн-4-ен-3,20-диона, эффективное удаление ацетильной группы с регенерацией 11β-гидроксильной группы возможно только с применением биотехнологического метода, а именно микробиологической трансформацией клетками бактерий Arthrobacter mediolanus ВКМ-1388, который осуществляется в 2 этапа (энзиматическое удаление защиты 11β-гидроксильной группы и гидролиз 17α-ацетоксигруппы действием 10% раствора гидроксида натрия) с общей продолжительностью процесса дезацетилирования 72 ч. Это существенно усложняет способ.
Раскрытие изобретения
Технической задачей в заявленном изобретении является разработка более простого способа получения 6α-метилгидрокортизона или его эфиров из 21-ацетата гидрокортизона при обеспечении выхода целевых продуктов не менее чем 80%.
Упрощение способа обеспечивается 1) за счет проведения последовательных реакций функционализации положения С6 молекулы 11-трифторацетата 21-ацетата гидрокортизона (III) с образованием 21-ацетокси-11-трифторацетилокси-6-метилен-гидрокортизона (VI) при температуре окружающей среды (т.е. при комнатной температуре) без применения нагрева реакционных масс; 2) за счет проведения непрерывного технологического процесса функционализации положения С6 молекулы 11-трифторацетата 21-ацетата гидрокортизона (III) без выделения интермедиатов IV и V целевого продукта (VI) на ключевых стадиях синтеза и исключения тем самым не только потерь указанных интермедиатов IV и V в маточных растворах, но и механических потерь, которые обычно имеют место на технологических операциях экстракции, фильтрации, сушки и т.п.; 3) за счет достижения практически полной конверсии исходных продуктов и высокой селективности реакций образования интермедиатов IV и V и целевого продукта VI в процессе функционализации положения С6 молекулы 11-трифторацетата 21-ацетата гидрокортизона (III) и тем самым снижения вероятности протекания побочных реакций; 4) за счет практически полного исключения образования побочных продуктов и осмоления реакционной массы на стадиях удаления защитных группировок. В результате достигается высокий выход конечных продуктов I, VIII и IX (от 80 до 94), считая из 21-ацетата гидрокортизона (II).
Техническая задача решается способом получения 6α-метилгидрокортизона или его эфиров общей формулы (I)
где R=СОСF3 или Н, R1=СОСН3 или Н
из 21-ацетата гидрокортизона формулы (II),
включающим предварительную защиту 11β-гидроксильной группы молекулы 21-ацетата гидрокортизона методом этерификации ангидридом трифторуксусной кислоты в условиях основного катализа с использованием каталитических количеств катализатора, последующее С6-метиленирование образовавшегося 21-ацетокси-17α-гидрокси-11β-трифторацетилокси-прегн-4-ен-3,20-диона, каталитическую изомеризацию 6-экзометиленовой связи полученного 6-метиленпроизводного в эндометиленовую с образованием 21-ацетокси-17α-гидрокси-11β-трифторацетилокси-6-метилпрегна-4,6-диен-3,20-диона, гидрирование 6,7-двойной связи последнего с образованием 21-ацетокси-17α-гидрокси-11β-трифторацетилокси-6α-метилпрегн-4-ен-3,20-диона, одновременное, поэтапное или последовательное удаление защиты 11β- и 21-гидроксильных групп методами химического сольволиза.
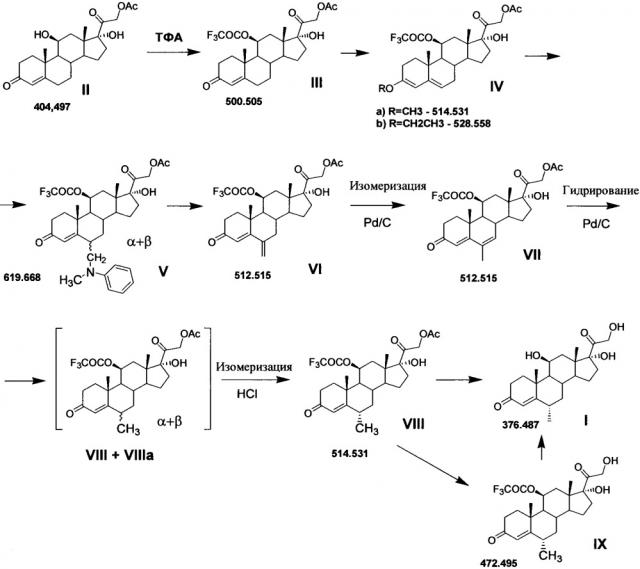
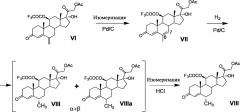
Ниже представлена предлагаемая схема синтеза 6α-метилгидрокортизона (I) или его сложных эфиров (VIII и IX) из 21-ацетата гидрокортизона (II).
Схема включает 7 (для VIII) или 8 (для I и IX) химических реакций, которые могут быть проведены в 3 или 4 технологических стадии соответственно. Химическая схема синтеза включает: 1) защиту 11β-гидроксильной группы молекулы 21-ацетата гидрокортизона (II) образованием 11β-трифторацетилокси-производного (III); 2) енолизацию α,β-ненасыщенного кетона кольца А соединения III с образованием 3,5-диенолэфира (IV); 3) реакцию трехкомпонентной конденсации по типу реакции Манниха с образованием смеси С6-аминометильных производных (V); 4) расщепление аминометильных производных (V) по связи C-N с образованием С6-метилен-производного (VI); 5) реакцию каталитической изомеризации 6-экзометиленовой связи в 6,7-эндометиленовую с образованием соединения VII; 6) реакцию каталитического гидрирования 6,7-двойной связи с образованием смеси 6α- и 6β-метил-диастереомеров (VIII и VIIIa соответственно); 7) каталитическую изомеризацию 6β-метильной группы соединения VIIIa до 6α-метильной с образованием соединения VIII; 8) удаление защитных группировок молекулы соединения VIII полностью с образованием 6α-метилгидрокортизона (I) или частично по гидроксильной группе С21 с образованием соединения IX.
Для этерификации 11β-гидроксильной группы соединения II в качестве производного трифторуксусной кислоты может быть использован ангидрид трифторуксусной кислоты.
Этерификацию 11β-гидроксильной группы соединения II проводят в среде апротонного растворителя, в качестве которого используют диалкилкетоны, или циклические эфиры, или диметилсульфоксид в условиях основного катализа с использованием катализатора в количестве, необходимом для полного превращения исходного соединения. При этом диалкилкетон выбирают из группы ацетон, метилэтилкетон; иклические эфиры выбирают из группы тетрагидрофуран, диоксан.
В качестве катализатора этерификации используют диметиламинопиридин.
Енолизацию Δ4-3-кетосистемы соединения III для этерификации с образованием 3-алкоксиэфира Δ3,5-3-гидроксипроизводного общей формулы IV проводят действием протонных кислот.
В качестве органических кислот для енолизации Δ4-3-кетосистемы соединения III используют сульфокислоты.
Сульфокислоты выбирают из группы, включающей сульфосалициловую кислоту, п-толуолсульфокислота.
Триалкилортоформиат для образования 3-алкоксиэфира Δ3,5-3-гидроксипроизводного общей формулы IV берут в количестве, достаточном для проведения реакции с получением формулы IV и V.
Образование 3-алкоксиэфира Δ3,5-3-гидроксипроизводного общей формулы IV проводят в среде протонного или апротонного растворителя, в качестве которого используют алифатические спирты, циклические эфиры, ароматические углеводороды ряда бензола или их смеси.
В качестве алифатических спиртов используют метанол или этанол.
В качестве циклических эфиров используют диоксан или тетрагидрофуран.
В качестве ароматических углеводородов используют бензол или толуол.
В качестве триалкилортоформиата используют триметилортоформиат или триэтилортоформиат.
6-аминометилирование соединения общей формулы IV проводят в среде протонного или апротонного растворителя, в качестве которого используют алифатические спирты (например, метанол, этанол), циклические эфиры (диоксан, тетрагидрофуран), ароматические углеводороды ряда бензола (бензол, толуол) или их смеси.
6-аминометилирование соединения общей формулы IV проводят в среде триалкилортоформиата или в смеси триалкилортоформиата и органического растворителя без выделения соединения общей формулы IV из реакционной массы.
Дезаминирование смеси соединений общей формулы V проводят в среде апротонного растворителя или смеси апротонных растворителей действием разбавленной серной кислоты с использованием эффективного ее количества.
В качестве солей галогеноводородной кислоты используют соли щелочных или щелочноземельных металлов, или аммония, а в качестве галогенводородной кислоты используют хлористоводородную или бромистоводородную кислоты.
Изомеризацию 6-экзометиленовой связи соединения формулы VI с образованием 6,7-эндометиленовой связи соединения VII проводят с использованием в качестве катализатора палладия или оксида палладия, адсорбированных на угле.
Гидрирование 6,7-эндометиленовой связи соединения VII проводят с использованием в качестве катализатора палладия или оксида палладия, адсорбированных на угле.
Удаление защитной группировки 21-гидроксильной группы осуществляют методом кислого сольволиза как с выделением, так и без выделения продукта гидрирования формулы VIII из реакционной массы с образованием 11β-трифторацетата 6α-метилгидрокортизона IX (R=COCF3, R1=Н).
Дезаминирование смеси соединений общей формулы V проводят без их выделения из реакционной массы.
Сущность заявленного изобретения, касающегося получения 6α-метилгидрокортизона или его эфиров, заключается в том, что с целью повышения выхода и упрощения процесса 21-ацетат гидрокортизона сначала подвергают предварительной защите 11β-гидроксильной группы, затем метиленированию положения С6, изомеризации экзометиленовой группы при С6 в 6,7-эндометиленовую, восстановлению 6,7-метиленовой связи 6-метил-Δ6-группы с образованием 6α-метил-производного, удалению защитных группировок.
Преимущества заявляемого способа состоят в следующем:
- проведение трифторацетатной защиты 11β-гидроксильной группы 21-ацетата гидрокортизона и селективной деэтерификации побочного продукта реакции этерификации 11,17-бис(трифторацетата) 21-ацетата гидрокортизона с регенерацией 17α-гидроксильной группы осуществляется в одну химическую стадию без выделения целевого продукта;
- проведение конденсации с реагентом Манниха в присутствии свободного гидроксила при С17 в мягких условиях (при комнатной температуре) исключает появление нежелательных продуктов (дегидратации 17α-гидроксигруппы с образованием Δ16-связи и D-гомоаннелирования с образованием 6-членного кольца D), что подтверждается данными ЯМР-спектроскопии;
- региоселективность расщепления стероидного основания Манниха минеральной кислотой исключительно по связи C-N обеспечивается присутствием в реакционной среде соли галогенводородной кислоты и щелочного, или щелочноземельного металла, или аммония;
- отсутствие необходимости использования многократной кристаллизации 6α-метилгидрокортизона или хроматографирования с целью его очистки, так как удаление защитных групп приводит к незначительному появлению побочных соединений; при этом содержание основного вещества в продукте составляет 90-95% (ВЭЖХ), что соответствует требованиям, например, последующего процесса введения 1,2-двойной связи (химическим или биотехнологическим методом);
- реакции трифторацетилирования, енолэтерификации, конденсации с реагентом Манниха, дезаминирования стероидного основания Манниха проводятся при комнатной температуре;
- значительное сокращение потерь основного продукта на стадиях, что обеспечивается высокой селективностью химических реакций и возможностью совмещения химических стадий в один технологический процесс без выделения интермедиатов, позволяет существенно увеличить достигаемый общий выход 6α-метилгидрокортизона и его эфиров из 21-ацетата гидрокортизона до 80,1% и 82,9-93,6% соответственно.
Осуществление изобретения
Способ получения 6-метилгидрокортизона или его эфиров общей формулы (I) осуществляется по следующей схеме (Рисунок 1).
21-Ацетат гидрокортизона (21-ацетокси-11β,17α-дигидроксипрегн-4-ен-3,20-дион) формулы (II),
подвергают защите 11β-гидроксильной группы методом этерификации действием ангидрида трифторуксусной кислоты в среде апротонного растворителя в условиях основного катализа в присутствии каталитического количества диметиламинопиридина. Для этого на 1 моль 21-ацетата гидрокортизона (21-ацетокси-11β,17α-дигидроксипрегн-4-ен-3,20-диона) используют 1-1.5 моля ангидрида трифторуксусной кислоты и не более 0.1 моля диметиламинопиридина. Полученный с выходом до 99,95% 21-ацетокси-17α-гидрокси-11β-трифторацетилокси-прегн-4-ен-3,20-дион (III) подвергают енолэтерификации Δ4-3-кетосистемы кольца А действием алкилортоформиата в присутствии сульфоароматической кислоты (сульфосалициловой или п-ТСК), в количестве, необходимом для енолизации Δ4-3-кетогруппы. Затем полученный 3,5-диенолэфир (IV) подвергают каталитической конденсации с реагентом Манниха, образованным из формальдегида и N-метиланилина in situ, с образованием 6-(N,N-дизамещенного)-аминометилпроизводного (V) с последующим его дезаминированием и превращением полученного 6-метилен-производного (VI) в 21-ацетокси-17α-гидрокси-11β-трифторацетилокси-6α-метилпрегн-4-ен-3,20-дион (VIII) через образование 6-метил-6,7-дегидро-изомера (VII), причем конденсация с реагентом Манниха может быть проведена как с предварительным выделением, так и без выделения 3,5-диенолэфира (IV), а так же как с выделением, так и без выделения продукта конденсации (V) из реакционной массы, а восстановление 6-метиленовой группы соединения VI до 6α-метильной группы соединения VIII - как с выделением, так и без выделения 6-метил-6,7-дегидро-интермедиата VII. После этого химическим сольволизом 21-ацетокси-17α-гидрокси-11β-трифторацетилокси-6α-метилпрегн-4-ен-3,20-диона (VIII) получают 6α-метилгидрокортизон (I) или его эфир (IX). При этом удаление защитных групп соединения VIII с образованием соединения I может быть реализовано одновременно в условиях основного катализа или поэтапно через образование соединения IX сольволизом в условиях кислого катализа и последующим сольволизом 11-трифторацетоксигруппы соединения IX в условиях основного катализа.
Общий достигаемый выход 21-ацетокси-17α-гидрокси-11β-трифторацетилокси-6α-метилпрегн-4-ен-3,20-диона (VIII) из 21-ацетата гидрокортизона (II) составляет 93,6%.
Общий достигаемый выход 11-трифторацетата 6-метилгидрокортизона (IX) из 21-ацетата гидрокортизона (II) составляет 82,9%.
Общий достигаемый выход 6α-метилгидрокортизона (I) из 21-ацетата гидрокортизона (II) составляет 80,1%.
Защиту 11β-гидроксильной группы молекулы 21-ацетата гидрокортизона (II) осуществляют образованием эфира трифторуксусной кислоты в среде органического растворителя в условиях основного катализа. Этот вариант защиты наиболее оптимален, так как реакция этерификации протекает в мягких условиях с практически количественным выходом. Кроме этого, трифторацетатная защитная группа, устойчивая в кислой среде, легко удаляется при необходимости гидролизом в условиях основного катализа. Ацилирование проводят с использованием минимально необходимого количества ангидрида трифторуксусной кислоты в безводных условиях в среде органического апротонного растворителя. Специалисту в области органической химии, а также из уровня техники, известно, что вместо ангидрида трифторуксусной кислоты в этом процессе может быть использован хлорангидрид трифторуксусной кислоты, а в качестве апротонного растворителя при осуществлении изобретения - способа получения 6α-метилгидрокортизона или его эфиров - могут быть использованы любые апротонные (неполярные, малополярные и полярные) растворители, пригодные для проведения реакции и инертные по отношению к ацилирующему реагенту и катализатору, такие как диалкилкетоны (например, ацетон, метилэтилкетон), циклические простые эфиры (например, диоксан, тетрагидрофуран) и другие, известные из уровня техники, обеспечивающие полноту проведения реакции. В качестве основного катализатора могут быть использованы гетероарильные соединения (например, пиридин или его производные), или алкиламины (например, триэтиламин), или другие органические основания, или их смеси, обычно используемые для катализа реакций ацилирования гидроксильных групп, известные из уровня техники.
Реакция трифторацетилирования соединения II протекает регионаправленно, этерифицируя предпочтительно вторичную гидроксильную группу при атоме С11 соединения II. Для обеспечения протекания реакции необходимым минимальным количеством ангидрида трифторуксусной кислоты является 1 моль на 1 моль стероида. Для более полного и быстрого протекания реакции используется небольшой избыток ацилирующего агента (~1,2-1,5 моль ТФА на 1 моль стероида). Однако это условие не является обязательным. Применение избыточного количества реагента приводит к частичному трифторацетилированию третичной гидроксильной группы при С17 продукта реакции III с образованием 10-20% примеси 11β,17α-дитрифторацетилокси-производного (IIIа).
Однако в условиях предлагаемого нами способа эфир трифторуксусной кислоты по С17 удаляется легко и селективно с регенерацией 17α-гидроксильной группы и с сохранением трифторацетатной защиты 11β-гидроксильной группы, что достигается обработкой реакционной массы триэтиламином в минимальном необходимом количестве. Выход 21-ацетокси-17α-гидрокси-11β-трифторацетилокси-прегн-4-ен-3,20-диона (III) на стадии составляет от 96 до 99,95%.
Синтез 21-ацетокси-17α-гидрокси-11β-трифторацетилокси-6-метиленпрегн-4-ен-3,20-диона (VI) из 21-ацетокси-17α-гидрокси-11β-трифторацетилокси-прегн-4-ен-3,20-диона (III) включает три последовательных химических процесса, которые могут быть проведены с выделением любого из интермедиатов общей формулы IV и V или без выделения по следующим вариантам химической схемы синтеза:
Вариант схемы 1: III-IV-V-VI; или
Вариант схемы 2: III-IV-[V]-VI; или
Вариант схемы 3: III-[IV]-V-VI; или
Вариант схемы 4: III-[IV]-[V]-VI.
Наиболее оптимальным и предпочтительным является вариант схемы 4.
Для повышения нуклеофильности атома С6 и тем самым уменьшения вероятности протекания побочных процессов конденсации по другим реакционным центрам (например, по атому С2) на первом этапе синтеза проводится реакция енолизации Δ4-3-кетосистемы кольца А соединения III с образованием 3,5-диенолэфира общей формулы IV. Реакция енолэтерификации Δ4-3-кетосистемы кольца А как с выделением енолэфира IV (варианты 1 и 2), так и без выделения енолэфира IV (варианты 3 и 4) из реакционной массы, может быть проведена с применением или без применения растворителя. Реакцию енолэтерификации Δ4-3-кетосистемы с применением растворителя проводят действием триалкилортоэфира муравьиной кислоты (например, триметилортоформиата или триэтилортоформиата) с использованием минимального количества триалкилортоформиата, необходимого для обеспечения протекания реакции (не менее 1 моля на 1 моль стероида). Для более полного и быстрого протекания реакции (15-30 мин, но не более 2 ч) используется избыток алкилортоформиата (от 2,5 до 9 моль на 1 моль стероида). Однако это условие не является обязательным. Реакция проводится в безводных условиях в соответствующем протонном растворителе - алифатическом спирте (в метаноле или этаноле) или в апротонном растворителе, выбранном из группы циклических эфиров (например, диоксан или тетрагидрофуран) или ароматических углеводородов группы бензола (например, бензол или толуол). Реакция енолэтерификации Δ4-3-кетосистемы без применения растворителя проводится в среде реагента триалкилортоформиата.
В качестве катализатора енолизации могут быть использованы любые протонные кислоты, обеспечивающие енолизацию Δ4-3-кетосистемы кольца А соединения III с образованием 3,5-диенола, известные из уровня техники специалисту. Предпочтительно использовать органические кислоты, например сульфоароматические (сульфосалициловую кислоту, п-ТСК или т.п.) как безводные, так и в виде кристаллогидрата. При проведении реакции без выделения енолэфира IV (вариант 3 и 4) из реакционной массы предпочтительно использовать п-ТСК, которая является также катализатором последующей реакции аминометилирования.
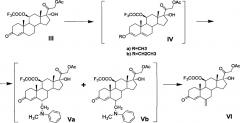
В синтезе соединений общей формулы V введение заместителя в положение С6 осуществляют методом трехкомпонентной конденсации по типу реакции Манниха с применением реагента Манниха, образованного in situ взаимодействием формальдегида и N-метиланилина или других вторичных аминов, применимых для целей настоящего изобретения, пригодных для образования 6-(N,N-дизамещенных)-аминометил-соединений и известных из уровня техники, например, N-этиланилин, дифениламин, N-метил- п-толуидин и т.п. [GB 1280570, 1972].
По настоящему изобретению реакция Манниха с образованием соединений общей формулы V может быть проведена как с выделением продукта IV из реакционной массы (варианты 1 и 3), так и без выделения (варианты 2 и 4). Однако предпочтительно проведение реакции Манниха без выделения енолэфира IV (варианты 3 и 4) в среде триалкилортоформиата без применения растворителей и на стадии получения енолэфира, и на стадии аминометилирования. Оба процесса проводятся при комнатной температуре. По окончании реакции получения енолэфира IV в реакционную массу добавляют N-метиланилин и 30-40% водный раствор формальдегида.
Реакция аминометилирования нестереоселективна: образуется смесь 6α- и 6β-диастереомерных стероидных оснований Манниха (Va и Vb соответственно). Реакция аминометилирования может быть проведена в среде, содержащей циклический эфир (например, диоксан или тетрагидрофуран) или ароматический углеводород группы бензола (например, бензол или толуол) причем указанные растворители или их смеси могут быть добавлены в реакционную массу, содержащую соединения общей формулы V, после окончания реакции аминометилирования. Раствор соединения общей формулы V в ароматическом углеводороде промывают 1-5% водным раствором аммиака для удаления п-ТСК и далее водой. Этот раствор в ароматическом углеводороде может быть использован на следующей стадии дезаминирования без извлечения смеси изомеров общей формулы V (варианты 2 и 4) или указанная смесь изомерных стероидных оснований Манниха может быть извлечена из раствора (варианты 1 и 3). Однако последнее нецелесообразно, так как оба изомера могут быть подвергнуты последующей реакции дезаминирования с образованием 21-ацетокси-17α-гидрокси-11β-трифторацетилокси-6-метиленпрегн-4-ен-3,20-диона (VI) без выделения и разделения.
Реакцию регионаправленного расщепления стероидного основания Манниха общей формулы V по связи C-N проводят действием концентрированных или разбавленных минеральных кислот, например, 30-35% соляной кислоты или 50-70% серной кислоты (предпочтительно 55-60% серной кислоты) в среде ароматического углеводорода ряда бензола (толуола или бензола) с добавлением апротонного растворителя, смешивающегося с водой, например, диалкилкетона (ацетона или метилэтилкетона) или циклического эфира (диоксана или тетрагидрофурана). Добавление протонного растворителя, в частности низшего алифатического спирта (метилового, или этилового, или др.) может привести, во-первых, к частичному расщеплению стероидного основания Манниха общей формулы V по связи С-С с регенерацией исходного соединения III, а во-вторых, к снятию (удалению) сложноэфирной группы при атоме С21 как у образующегося побочного продукта III, так и у целевого продукта VI. Реакция регионаправленного расщепления стероидного основания Манниха общей формулы V по связи C-N может быть проведена в присутствии минеральных солей, например, галогенидов щелочных или щелочноземельных металлов, или галогенидов аммония.
Для проведения реакции дезаминирования без выделения смеси изомеров Va и Vb (варианты 2 и 4) раствор смеси стероидных оснований Манниха (V) в ароматическом углеводороде разбавляют минимально необходимым количеством диа