Способы определения восприимчивости пациента к внутрибольничной инфекции и составления прогноза развития септического синдрома
Иллюстрации
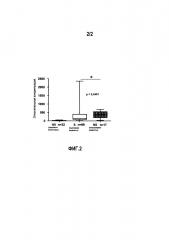
Показать всеИзобретение относится к биотехнологии, конкретно к определению прогноза развития септического синдрома у пациента, и может быть использовано в медицине. Получают биологический образец, выбранный из образца крови, сыворотки, слюны, ткани или циркулирующих клеток пациента, и экстрагируют биологический материал: нуклеиновую кислоту или белок из биологического образца. С использованием специфического реагента в отношении продукта экспрессии гена-мишени S100A9, выбранного из праймера амплификации, зонда гибридизации и/или антитела, определяют экспрессию гена-мишени S100A9. Изобретение позволяет по сверхэкспрессии гена-мишени S100A9 по отношению к определенной пороговой величине определить прогноз развития септического синдрома у пациента. 2 н. и 7 з.п. ф-лы, 2 ил., 3 табл., 5 пр.
Реферат
Настоящее изобретение относится к способу определения восприимчивости пациента к внутрибольничной инфекции. Объектом настоящего изобретения также является способ составления прогноза развития септического шока у пациента.
Внутрибольничные инфекции представляют собой реальную проблему здравоохранения. Во Франции число пациентов, которые подвергаются каждый год внутрибольничной инфекции, оценивают как составляющее от 500000 до 800000. Появление внутрибольничных инфекций связано с различными факторами, такими, как используемые терапевтические методы, однако, также с восприимчивостью пациента к такой внутрибольничной инфекции. Так, пациенты с иммунодефицитной системой, пациенты с гипотрофией, новорожденные, люди пожилого возраста, люди с септическом синдромом, получившие серьезные ожоги люди, люди в травматическом состоянии могут быть более предрасположены, чем другие, к внутрибольничной инфекции.
Септический синдром, системный ответ на инфекцию, представляет собой одну из первых причин смертности в реанимационных отделениях. Он может проистекать от бактериальной, вирусной, микотической или паразитарной инфекции. Эти септические синдромы могут быть классифицированы в зависимости от их тяжести. В возрастающем порядке тяжести различают SIRS (cиндром системного воспалительного ответа), сепсис, тяжелый сепсис и септический шок. Группой экспертов в 2001 г. также предложены критерии определений этих четырех клинических синдромов[1]:
- SIRS представляет собой воспалительный системный ответ, вызываемый многообразием инфекционных или нет причин. Из состояний SIRS, вызываемых неинфекционными причинами, можно назвать травматические состояния, ожоги, панкреатиты, острые респираторные синдромы. Воспалительный системный ответ обнаруживается по меньшей мере по двум из следующих признаков: а) температура выше 38°С или ниже 36°С; b) сердечный ритм выше 90 пульсаций в минуту; с) респираторный ритм выше 20 дыханий в минуту; d) число лейкоцитов выше 12000/мм2 или ниже 4000/мм2;
- сепсис представляет собой синдром воспалительного системного ответа в связи с инфекцией;
- тяжелый сепсис представляет собой сепсис, ассоциированный с артериальной гипотензией, и/или гипоперфузией, и/или дисфункцией по меньшей мере одного органа;
- септический шок представляет собой тяжелый сепсис, ассоциированный с устойчивой гипотензией, и может быть квалифицирован по:
- наличию идентифицированного инфекционного участка,
- устойчивой гипотензии несмотря на адекватные меры повышения давления и лечения повышающими кровяное давление лекарственными средствами.
Как правило, признаки сепсиса, тяжелого сепсиса и септического шока являются близкими, и различие между этими тремя состояниями заключается, главным образом, в значительности пертурбации всех витальных функций. Во время септического шока наблюдают, главным образом, снижение артериального давления, тахикардию, полипноэ, мраморировки кожи, гипо- или гипертермию, ознобы. Эти признаки также сопровождаются дисфункцией органов-«мишеней» с ухудшением функции органов на расстоянии от очага инфекции (почки, легкие, центральная нервная система, пищеварительная система и системы коагуляции крови), выражающимся в олигурии (<0,5 мл/кг/час), почечной недостаточности, гипоксемии, тромбопении, ажитации, дезориентации во времени и пространстве.
Пациенты с септическим синдромом также более или менее восприимчивы к внутрибольничным инфекциям, то есть, инфекциям в связи с пребыванием в лечебном учреждении. Эта восприимчивость оказывает большое воздействие на выживание и полное выздоровление этих пациентов.
Развитие септического синдрома, начиная от стадии сепсиса к стадии тяжелого сепсиса, затем септического шока, не является систематическим, так как примерно у 64% пациентов с сепсисом развивается тяжелый сепсис, и у 23% пациентов с тяжелым сепсисом проявляется септический шок. Перед этой последней стадией септического шока пациенту должны быть предписаны лечения с целью прекращения и реверсирования физиопатологического процесса. Также необходимо восстанавливать удовлетворительное гемодинамическое состояние и обеспечивать эффективную вентиляцию. Также необходимо проводить одновременно симптоматическое лечение шока и антибиотическое лечение, адаптированное, насколько возможно, в зависимости от бактериологических данных.
Оказывается, что, если в случае некоторых пациентов развивается септический синдром, и, в особенности, септический шок, они могут быть реанимированы путем принятия стандартных мер, таких, как лечение антибиотиком широкого спектра, проводимое до результатов бактериологических анализов, указывающих источник инфекции; в случае других пациентов, у которых развивается намного более тяжелый септический синдром, требуется проведение «тяжелых» терапий, как использование активированного белка С. Сверх очень высокой стоимости, этот вид терапии подвергает пациентов рискам очень значительных нежелательных эффектов (нарушения коагуляции…). Следовательно, очень важным является нацеливание эффективным образом восприимчивых пациентов к получению пользы от такого лечения.
В связи с этим, знание этиологии воспалительного системного ответа и определение восприимчивости пациента с воспалительным системным ответом к внутрибольничной инфекции являются существенными для назначения пациенту адаптированного лечения. Другим важным параметрам для пациента является наличие возможности составления по возможности наиболее раннего прогноза развития септического шока.
На сегодняшний день не существует теста, который позволял бы определять восприимчивость пациента к развитию внутрибольничной инфекции, в особенности, пациента с воспалительным системным ответом, связанным или нет с инфекцией. Авторами настоящего изобретения неожиданно выявлено, что анализ экспрессии генов S100A9 и/или S100A8 особенно адаптирован для определения такой восприимчивости и что, к тому же, он применим для составления прогноза развития септического шока.
В соответствии с вышеприведенным и нижеприводимым контекстом, для лучшего понимания изобретения приводятся нижеследующие определения.
Под септическим синдромом понимают системный ответ на инфекцию. Этот септический синдром может быть на стадии SIRS, сепсиса, тяжелого сепсиса или септического шока. Предпочтительно, септическим синдромом является септический шок.
Под внутрибольничной инфекцией понимают любую инфекцию, «приобретаемую» в лечебном учреждении спустя 48 часов после госпитализации и которой не было до попадания пациента в это учреждение.
Под генами-мишенями, геном S100A9 и геном S100A8, понимают, в частности, ген S100A9, обозначенный в банке генов под номером доступа NM_002965.3, и ген S100A8, обозначенный в банке генов под номером доступа NM_002964.3.
Под продуктом экспрессии гена S100A9 и гена S100A8 понимают матричную РНК (мРНК) или фрагмент мРНК, кДНК или фрагмент кДНК, белок или фрагмент белка.
Под биологическим образцом понимают любой материал, происходящий от пациента, который может содержать биологический материал, позволяющий детектировать экспрессию гена. Это может быть, в частности, образец крови, сыворотки, слюны или ткани или циркулирующих клеток пациента. Получают этот биологический образец любым типом отбора, известным специалисту в данной области, таким, как, в частности, взятие пробы крови.
Под биологическим материалом понимают любой материал, позволяющий детектировать экспрессию гена, как, в частности, нуклеиновая кислота или белок или его кодирующая последовательность. Нуклеиновой кислотой может быть, в особенности, РНК (рибонуклеиновая кислота), такая как мРНК (матричная РНК). Согласно предпочтительному варианту осуществления данного изобретения биологическим материалом является нуклеиновая кислота и еще более предпочтительно мРНК.
Экстракция биологического материала из биологического образца может быть осуществлена согласно любому из протоколов экстракции нуклеиновых кислот или белков, хорошо известных специалисту в данной области.
Для сведения, экстракция нуклеиновых кислот, в частности, может быть осуществлена за счет:
- стадии лизиса клеток, присутствующих в биологическом образце, в целях высвобождения нуклеиновых кислот, содержащихся в белковых и/или липидных оболочках микроорганизмов (как клеточные дебрисы, которые пертурбируют дальнейшие реакции). В качестве примера, можно использовать способы лизиса, такие, как описываемые в заявках на патенты:
- WO-A-00/05338, способ смешанного магнитного и механического лизиса,
- WO-A-99/53304, способ электрического лизиса, и
- WO-A-99/15321, способ механического лизиса.
Специалист в данной области может использовать другие, хорошо известные, способы лизиса, такие, как тепловые или осмотические удары или химические лизисы за счет хаотропных агентов, таких как гуанидиевые соли (заявка на патент США 5234809);
- стадии очистки, позволяющей осуществлять разделение между нуклеиновыми кислотами и другими клеточными компонентами, высаленными на стадии лизиса. Эта стадия обычно позволяет концентрировать нуклеиновые кислоты. В качестве примера, можно использовать магнитные частицы, необязательно покрытые олигонуклеотидами, за счет адсорбции или ковалентной связи (см. на этот предмет заявки на патенты США А-4672040 и А-5750338), и таким образом очищать нуклеиновые кислоты, которые фиксировались на этих магнитных частицах, за счет стадии промывки. Эта стадия очистки нуклеиновых кислот особенно представляет интерес, если в дальнейшем желают амплифицировать вышеуказанные нуклеиновые кислоты. Особенно представляющий интерес способ реализации этих магнитных частиц описывается в Международных заявках на патенты: WO-A-97/45202 и WO-A-99/35500. Другим, представляющим интерес, примером способа очистки нуклеиновых кислот является использование диоксида кремния либо в колоночной форме, либо в форме инертных[2] или магнитных частиц (Merck: MagPrep® Silica; Promega: MagneSilTM, парамагнитные частицы). Другие, очень широко распространенные, способы базируются на использовании ионообменных смол в колонке или в особом парамагнитном формате (Whatman: DEAE-Magarose) (Levison P.R. и др., J. Chromatography, 337-344 (1998)). Другим, очень подходящим, но не исключительным, для изобретения способом является способ адсорбции на носителе из оксида металла (фирма Xtrana: матрица Xtra-BindTM). Такая стадия экстракции может быть осуществлена в автоматах. Особенно адаптированным является автомат easyMAG®.
Под специфическим реагентом понимают реагент, который реагирует с биологическим материалом для выявления, прямо или непрямо, экспрессии гена-мишени, которая может быть определена путем анализа мРНК, происходящих от этого гена, или путем анализа кодируемого этим геном белка.
Для сведения, когда желают определить экспрессию гена-мишени путем анализа кодируемого этим геном белка, этот специфический реагент включает по меньшей мере одно антитело, специфичное к белку, кодируемому этим геном-мишенью.
Для сведения, когда желают определить экспрессию гена-мишени путем анализа мРНК-транскриптов, исходя из этого гена, этот специфический реагент включает по меньшей мере один специфический праймер амплификации комплементарной ДНК этой мРНК (тогда речь идет о специфическом праймере амплификации гена-мишени). Комплементарная ДНК матричной РНК может быть получена согласно протоколу, хорошо известному специалисту в данной области. Для сведения, экстрагируют все РНК (включающие рибосомальные РНК, транспортные РНК, мРНК) из биологического образца. Затем проводят реакцию обратной транскрипции с помощью фермента обратная транскриптаза, которая позволяет получать, исходя из фрагмента РНК, комплементарный фрагмент ДНК (кДНК). Осуществление такой стадии хорошо известно специалисту в данной области. Когда желают, более конкретно, получать только комплементарные ДНК матричных РНК, эту ферментативную стадию осуществляют в присутствии нуклеотидных фрагментов, включающих только тиминовые основания (polyT), которые гибридизируются за счет комплементарности с последовательностью polyT различных мРНК с образованием комплекса polyT-polyA, который служит тогда исходной точкой для реакции обратной транскрипции, осуществляемой с помощью фермента обратная транскриптаза. Тогда получают различные комплементарные ДНК различных матричных РНК, первоначально присутствующих в биологическом образце. В дальнейшем контексте обозначением кДНК называют комплементарную ДНК матричной РНК.
Под праймером амплификации понимают нуклеотидный фрагмент, включающий 5-100 нуклеотидных мотивов, предпочтительно, 15-20 нуклеотидных мотивов, и обладающий специфичностью гибридизации в определенных условиях для инициации ферментативной полимеризации, например, в случае ферментативной реакции амплификации.
Под ферментативной реакцией амплификации понимают процесс, генерирующий множественные копии нуклеотидного фрагмента-мишени с помощью специфических праймеров амплификации за счет воздействия по меньшей мере одного фермента. Такие реакции амплификации хорошо известны специалисту в данной области и можно назвать, в частности, следующие способы: ПЦР (полимеразная цепная реакция), LCR (лигазная цепная реакция), RCR (репаративная цепная реакция), 3SR (самоподдерживаемая репликация последовательности), в соответствии с Международной заявкой на патент WO-A-90/06995), NASBA (базирующаяся на полинуклеотидной последовательности амплификация) и ТМА (опосредуемая транскрипцией амплификация), в соответствии с заявкой на патент США А-5399491.
Тогда речь идет о ампликонах для обозначения полинуклеотидов, генерируемых по способу ферментативной амплификации. Предпочтительно, когда ферментативной амплификацией является ПЦР, специфический реагент включает по меньшей мере 2 специфических праймера амплификации, чтобы амплифицировать конкретную область комплементарной ДНК матричной РНК, происходящей от гена-мишени. Когда ферментативной амплификацией является ПЦР, осуществляемая после реакции обратной транскрипции, речь идет о RT-PCR (полимеразная цепная реакция с обратной транскриптазой).
Под зондом гибридизации понимают нуклеотидный фрагмент, включающий 5-100 нуклеотидных мотивов, особенно, 6-35 нуклеотидных мотивов, обладающий специфичностью гибридизации в определенных условиях для образования гибридного комплекса с нуклеотидным фрагментом-мишенью. Согласно настоящему изобретению, нуклеотидным фрагментом-мишенью может быть нуклеотидная последовательность, включенная в матричную РНК, или нуклеотидная последовательность, включенная в комплементарную ДНК, полученную путем обратной транскрипции вышеуказанной матричной РНК.
Под гибридизацией понимают процесс, во время которого, в соответствующих условиях, два нуклеотидных фрагмента, таких, как, например, зонд гибридизации и нуклеотидный фрагмент-мишень, имеющие достаточно комплементарные последовательности, способны образовывать двойную нить со стабильными и специфическими водородными связями. Нуклеотидным фрагментом, «способным гибридизироваться» с полинуклеотидом, является фрагмент, который может гибридизироваться с вышеуказанным полинуклеотидом в условиях гибридизации, которые могут быть определены известным образом в каждом случае. Условия гибридизации определяют путем строгого контроля, то есть, точного соблюдения рабочих условий. Гибридизация является тем более специфической, когда она осуществляется при более сильном строгом контроле. Строгий контроль определяется, в частности, с точки зрения состава оснований дуплекса зонд/мишень, а также степенью мезоконъюгации между двумя нуклеиновыми кислотами. Строгий контроль также может быть функцией параметров реакции, таких, как концентрация и тип ионов, присутствующих в растворе для гибридизации, природа и концентрация денатурирующих агентов и/или температура гибридизации. Строгий контроль в отношении условий, при которых должна быть реализована реакция гибридизации, главным образом зависит от используемых зондов гибридизации. Все эти данные хорошо известны и соответствующие условия могут быть определены специалистом в данной области. Как правило, в зависимости от длины используемых зондов гибридизации, температура реакции гибридизации составляет от примерно 20°С до 70°С, в частности, от 35°С до 65°С, в солевом растворе с концентрацией около 0,5-1 М. Затем осуществляют стадию детекции реакции гибридизации.
Под детекцией понимают либо прямую детекцию физическим методом, либо способ детекции с помощью маркера. Для детекции нуклеиновых кислот существуют многочисленные способы детекции[4,5].
Под маркером понимают меченое вещество, способное давать сигнал. Неисчерпывающий перечень этих меченых веществ включает ферменты, которые продуцируют сигнал, детектируемый, например, путем калориметрии, флуоресценции или люминесценции, как пероксидаза хрена, щелочная фосфатаза, бета-галактозидаза, глюкозо-6-фосфатдегидрогеназа; хромофоры, как флуоресцентные, люминесцентные или окрашивающие соединения; группы с электронной плотностью, детектируемые с помощью электронного микроскопа или за счет их электрических свойств, как удельная проводимость, методами амперометрии или вольтаметрии, или путем измерений импеданса; группы, детектируемые оптическими методами, как дифракция, резонанс поверхностного плазмона, изменение угла контакта, или физическими методами, как спектроскопия атомных сил, туннельный эффект и т.д.; радиоактивные молекулы, как 32Р, 35S или 125I. Так, полинуклеотид может быть маркирован во время стадии ферментативной амплификации, например, используя маркированный нуклеотидтрифосфат для реакции амплификации. Маркированным нуклеотидом является дезоксирибонуклеотид в системах амплификации, генерирующих ДНК, как ПЦР, или рибонуклеотид в способах амплификации, генерирующих РНК, как способы ТМА или NASBA. Полинуклеотид также может быть маркирован после стадии амплификации, например, гибридизируя маркированный зонд по способу гибридизации сэндвич-типа, описанному в документе WO-А-91/19812.
Согласно настоящему изобретению, зондом гибридизации может быть так называемый зонд-ловушка. В этом случае, нуклеотидный фрагмент-мишень может быть предварительно маркирован с помощью маркера. Так называемый зонд-ловушка является имммобилизированным или иммобилизируемым на твердом носителе с помощью любого соответствующего способа, то есть, прямо или непрямо, например, за счет ковалентной связи или адсорбции. Тогда осуществляют реакцию гибридизации между вышеуказанным зондом-ловушкой и маркированным нуклеотидным фрагментом-мишенью.
Зондом гибридизации также может быть так называемый зонд детекции. В этом случае, зонд гибридизации может быть маркирован с помощью маркера. Тогда осуществляют реакцию гибридизации между вышеуказанным зондом детекции и нуклеотидным фрагментом-мишенью.
Когда используют так называемый зонд-ловушку или так называемый зонд детекции, реакция гибридизации может быть осуществлена на твердом носителе, который включает все материалы, на которых может быть иммобилизирована нуклеиновая кислота. В качестве твердого носителя могут быть использованы синтетические материалы или природные материалы, необязательно химически модифицированные, в частности, полисахариды, такие, как материалы на основе целлюлозы, такие как, например, бумага, производные целлюлозы, такие, как ацетат целлюлозы и нитроцеллюлоза или декстран; полимеры, сополимеры, в частности, на основе мономеров стирольного типа, натуральные волокна, такие, как хлопок, и синтетические волокна, такие, как нейлон; минеральные материалы, такие, как диоксид кремния, кварц, стекла, керамика; латекс; магнитные частицы; металлические производные, гели и т.д. Твердый носитель может быть в форме титрационного микропланшета, мембраны, как описано в Международной заявке WO-A-94/12670, частицы или биочипа.
Согласно настоящему изобретению, определение экспрессии гена S100A9 и гена S100A8 может быть проанализировано путем экспрессии матричных РНК, которые в данное время являются транскриптами. В этом случае, биологическим материалом является нуклеиновая кислота и специфическим реагентом может быть безразлично праймер амплификации или зонд гибридизации, такие, как указанные выше.
Экспрессию гена-мишени можно определять следующим образом:
1) после экстракции всех РНК из биологического образца, осуществляют стадию обратной транскрипции, такую, как указанная выше, чтобы получить различные комплементарные ДНК различных матричных РНК, первоначально присутствующих в биологическом образце (или кДНК);
2) специфически амплифицируют кДНК. В этом случае, используемый специфический реагент включает по меньшей мере один специфический праймер амплификации гена-мишени, такой, как указанный выше. Эта стадия может быть осуществлена, в частности, путем реакции амплификации типа ПЦР или любым другим способом соответствующей амплификации;
3) определяют экспрессию гена-мишени, определяя количество кДНК. кДНК могут быть количественно определены, в частности, путем использования диапазона квантификации, получаемого путем реакции амплификации, доводимой вплоть до насыщения. Для учета вариабельности ферментативной эффективности, которая может наблюдаться во время различных стадий (обратная транскрипция, ПЦР…), можно нормировать экспрессию гена-мишени различных групп пациентов путем одновременного определения экспрессии так называемого гена «домашнего хозяйства», экспрессия которого является подобной у различных групп пациентов. Реализуя соотношение между экспрессией гена-мишени и экспрессией гена «домашнего хозяйства», таким образом корректируют любую вариабельность между различными экспериментированиями. Специалист в данной области может, в частности, полагаться на следующие публикации[6,7].
Экспрессию гена-мишени также можно определять следующим образом:
1) после экстракции всех РНК из биологического образца, осуществляют стадию обратной транскрипции, такую, как указанная выше, чтобы получить различные комплементарные ДНК различных матричных РНК, первоначально присутствующих в биологическом образце (или кДНК);
2) иммобилизируют комплементарные ДНК на мембране;
3) определяют экспрессию гена-мишени, гибридизируя кДНК со специфическими, предварительно маркированными, зондами гибридизации гена-мишени. Такие способы гибридизации хорошо известны специалисту в данной области, и можно назвать, в частности, способ нозерн-блоттинга. Эта реакция гибридизации может быть реализована после стадии специфической амплификации комплементарных ДНК матричных РНК гена-мишени, когда, в частности, ген является слабо экспрессируемым.
Экспрессия гена-мишени также может быть проанализирована путем экспрессии белков, кодируемых геном-мишенью. В этом случае, биологическим материалом является белок, и могут быть использованы несколько способов детекции с лигандом или без него. Масс-спектрометрия может быть использована в качестве способа детекции без лиганда. Специфическим реагентом может быть антитело, специфичное к белку, кодируемому геном мишенью, для системы детекции с лигандом.
Рекомбинантные антитела, специфичные к белку, продуцируемому геном-мишенью, могут быть получены согласно классическим, известным специалисту в данной области, способам, исходя из прокариот, таких, как бактерии, или исходя из эукариот, таких, как дрожжи, клетки млекопитающих, растений, насекомых или животных, или за счет систем внеклеточного продуцирования.
Моноклональные антитела могут быть получены согласно классическим, известным специалисту в данной области, способам, таким, как гибридомный способ, основной принцип которого приводится ниже.
Во-первых, с помощью представляющего интерес антигена-мишени иммунизируют животное, обычно мышь, (или культивируемые клетки в рамках иммунизаций in vitro), лимфоциты В которого тогда способны продуцировать антитела к вышеуказанному антигену. Эти лимфоциты, продуценты антител, затем гибридизируют с «бессмертными» миеломатозными клетками (в примере, мышиными) с целью образования гибридом. Исходя из гетерогенной смеси таким образом полученных клеток, тогда осуществляют отбор клеток, способных продуцировать конкретное антитело и бесконечно размножаться. Каждая гибридома размножается в форме клона, причем каждый приводит к продуцированию моноклонального антитела, свойства распознавания которого по отношению к представляющему интерес антигену могут быть тестированы, например, при использовании твердофазного иммуноферментного анализа (ELISA), путем иммуноблоттинга по одному или двум параметрам, путем иммунофлуоресценции или с помощью биоловушки. Таким образом селекционированные моноклональные антитела затем очищают, в частности, согласно способу аффинной хроматографии.
Фрагменты антитела могут быть получены, например, путем протеолиза. Так, они могут быть получены путем ферментативного расщепления, приводящего в результате к фрагментам типа Fab (обработка папаином[8]) или типа F(ab)’2 (обработка пепсином[9]). Они также могут быть получены рекомбинантным путем[10]. Другой фрагмент антитела, который соответствует целям настоящего изобретения, включает фрагмент Fv, который представляет собой димер, образованный нековалентной ассоциацией «легкого» изменяемого домена (VL) и «тяжелого» изменяемого домена (VH) фрагмента Fab, следовательно, ассоциацией двух полипептидных цепей. В целях улучшения стабильности фрагмента Fv, возникающей вследствие диссоциации двух полипептидных цепей, этот фрагмент Fv может быть модифицирован путем генной инженерии за счет введения адаптированной пептидной связи между доменом VL и доменом VH[11]. Тогда речь идет о фрагменте scFv («изменяемый одноцепочечный фрагмент»), так как он образован одной полипептидной цепью. Использование пептидной связи, предпочтительно состоящей из 15-25 аминокислот, позволяет связывать С-конец одного домена с N-концом другого домена с образованием, таким образом, мономерной молекулы, снабженной свойствами связывания, подобными свойствам связывания антитела в его полной форме. Две ориентации доменов VL и VH допускаются (VL-связь-VH и VH-связь-VL), так как они обладают идентичными функциональными свойствами. Разумеется, любой фрагмент, известный специалисту в данной области и обладающий вышеопределенными иммунологическими характеристиками, пригоден в целях изобретения.
Когда биологическим материалом является белок, происходящий из экспрессии гена, экспрессию этого последнего можно определять, детектируя и квантифицируя упомянутый белок путем вестерн-блоттинга или ELISA или любым другим методом, известным специалисту в данной области, таким, как метод хемилюминесценции, исходя из биологического материала.
Метод ELISA («твердофазный иммуноферментный анализ») представляет собой иммуноферментативное количественное определение на твердом носителе. Этот анализ входит в более общие рамки EIA («иммуноферментный анализ»), в случае которого количественное определение связано с катализируемой ферментом реакцией. В методе используют одно или два антитела. Антитело для детекции образования иммунных комплексов (антиген/антитело) связано с ферментом и может генерировать эмиссию сигнала за счет хромогенного или флуорогенного субстрата.
Метод вестерн-блоттинга представляет собой тест для детекции специфического белка в образце с помощью специфичного к этому белку антитела, включающий следующие стадии, такие, как описанные ниже.
Первая стадия представляет собой электрофорез в геле, который позволяет разделять белки образца по их размеру.
Белки в геле тогда переносят на мембрану (нитроцеллюлоза, PVDF…) под давлением или за счет использования электрического тока, причем белки фиксируются на мембране благодаря гидрофобным и ионным взаимодействиям.
После насыщения сайтов неспецифического взаимодействия, первое антитело, специфичное к исследуемому белку, (первичное антитело) инкубируют с мембраной.
Мембрану затем промывают в целях удаления несвязанных первичных антител, затем инкубируют с так называемыми вторичными антителами, которые связываются с первичными антителами. Это вторичное антитело обычно связано с ферментом, который позволяет осуществлять визуальную идентификацию исследуемого белка на мембране. Добавление меченого субстрата фермента вызывает цветную реакцию, которая видима на мембране.
Анализ экспрессии гена S100A9 и/или гена S100A8 позволяет определять восприимчивость пациента к внутрибольничной инфекции, в особенности пациента с воспалительным системным ответом, и составлять прогноз развития септического синдрома. Можно, например, анализировать экспрессию по меньшей мере одного гена-мишени у пациента, в случае которого не было известно о восприимчивости к внутрибольничной инфекции, и путем сравнения с известными величинами обычной экспрессии гена-мишени у восприимчивых пациентов и известными величинами обычной экспрессии гена-мишени у невосприимчивых пациентов определять, восприимчив ли пациент к внутрибольничной инфекции. Таким же образом можно, например, анализировать экспрессию по меньшей мере одного гена-мишени и путем сравнения с обычными величинами известной экспрессии гена-мишени составлять прогноз развития септического синдрома, включая прогноз в отношении выживания или смерти.
Следовательно, объектом настоящего изобретения является способ определения восприимчивости пациента к внутрибольничной инфекции, согласно которому:
а) получают биологический образец пациента и экстрагируют биологический материал из биологического образца;
b) получают по меньшей мере один специфический реагент в отношении продукта экспрессии по меньшей мере одного гена-мишени, выбираемого среди генов-мишеней S100A9 и S100A8;
c) определяют экспрессию по меньшей мере одного из генов-мишеней S100A9 и S100A8, причем сверхэкспрессия по отношению к определенной пороговой величине является указанием на восприимчивость к внутрибольничной инфекции.
На стадии с) можно определять экспрессию гена-мишени S100A9 и гена-мишени S100A8, причем сверхэкспрессия гена-мишени S100A9 по отношению к определенной пороговой величине и сверхэкспрессия гена-мишени S100A8 по отношению к определенной пороговой величине являются указанием на восприимчивость к внутрибольничной инфекции.
Специалист в данной области обладает различными возможностями для определения пороговой величины. Можно назвать, например, определение показателя Youden.
Показатель Youden соответствует определению общего процента без погрешности. Он изменяется от 0, для теста, не позволяющего осуществлять распознавание двух популяций, до 1, для теста, позволяющего осуществлять полное распознавание двух популяций. Максимум показателя Youden соответствует пороговой величине, для которой количество ложных результатов (отрицательный ложный и положительный ложный) является наиболее незначительным. Чем ближе показатель Youden к 1, тем более хорошими являются диагностические данные[12].
В особенности, биологический образец берут у пациента с воспалительным системным ответом, ассоциированным или нет с инфекцией. Биологическим образцом может быть образец крови и экстрагированным биологическим материалом может быть, кроме того, нуклеиновая кислота. Предпочтительно из биологического образца экстрагируют все РНК, и определение экспрессии гена-мишени осуществляют путем анализа экспрессии мРНК.
Согласно предпочтительному варианту осуществления способа в соответствии с данным изобретением, специфический реагент включает по меньшей мере один праймер амплификации или по меньшей мере один специфический зонд гибридизации в отношении продукта экспрессии гена-мишени S100A9 и/или гена-мишени S100A8; или по меньшей мере одно антитело, специфичное к продукту экспрессии гена-мишени S100A9 и/или гена-мишени S100A8.
Способ, в частности, применим для определения восприимчивости к внутрибольничной инфекции пациента с септическим синдромом, то есть, с воспалительным системным ответом на инфекцию, как например SIRS, сепсис, тяжелый сепсис и септический шок.
Специфический реагент в отношении продукта экспрессии гена S100A9 и/или гена S100A8, следовательно, используют для определения восприимчивости пациента к внутрибольничной инфекции, в особенности пациента с воспалительным системным ответом, ассоциированным или нет с инфекцией. Реагент может включать по меньшей мере один специфический зонд гибридизации в отношении гена-мишени S100A9 по меньшей мере один специфический зонд гибридизации в отношении гена-мишени S100A8 по меньшей мере один специфический праймер амплификации гена-мишени S100A9 по меньшей мере один специфический праймер амплификации гена-мишени S100A8 по меньшей мере одно антитело, специфичное к молекуле S100A9, или по меньшей мере одно антитело, специфичное к молекуле S100A8.
Анализ экспрессии гена S100A9 и/или S100A8 также позволяет составлять прогноз развития септического синдрома (прогноз, включающий выживание или смерть).
Объектом настоящего изобретения также является способ составления прогноза развития септического синдрома у пациента, согласно которому:
а) получают биологический образец пациента и экстрагируют биологический материал из биологического образца;
b) получают по меньшей мере один специфический реагент в отношении продукта экспрессии по меньшей мере одного гена-мишени, выбираемого среди генов-мишеней S100A9 и S100A8;
c) определяют экспрессию по меньшей мере одного из генов-мишеней S100A9 и S100A8, причем субэкспрессия по отношению к определенной пороговой величине является указанием на хороший прогноз в отношении развития септического синдрома, и сверхэкспрессия по отношению к определенной пороговой величине является указанием на плохой прогноз в отношении развития септического синдрома.
На стадии с) можно определять экспрессию гена-мишени S100A9 и гена-мишени S100A8, причем субэкспрессия гена-мишени S100A9 по отношению к определенной пороговой величине и субэкспрессия гена-мишени S100A8 по отношению к определенной пороговой величине являются указанием на хороший прогноз в отношении развития септического синдрома;
сверхэкспрессия гена-мишени S100A9 по отношению к определенной пороговой величине и сверхэкспрессия гена-мишени S100A8 по отношению к определенной пороговой величине являются указанием на плохой прогноз в отношении развития септического синдрома.
Определение пороговой величины является доступным пониманию специалиста в данной области. Можно назвать, например, определение показателя Youden. Показатель Youden соответствует определению общего процента без погрешности. Он варьирует от 0, для теста, не позволяющего осуществлять распознавание двух популяций, до 1, для теста, позволяющего осуществлять полное распознавание двух популяций. Максимум показателя Youden соответствует пороговой величине, для которой количество ложных результатов (отрицательный ложный и положительный ложный) является наиболее незначительным. Чем ближе показатель Youden к 1, тем более хорошими являются диагностические данные[12].
Биологическим образцом может быть образец крови, и экстрагированным биологическим материалом может быть, кроме того, нуклеиновая кислота. Предпочтительно, из биологического образца экстрагируют все РНК, и определение экспрессии гена-мишени осуществляют путем анализа экспрессии мРНК.
Согласно предпочтительному варианту осуществления способа в соответствии с изобретением, специфический реагент включает по меньшей мере один праймер амплификации или по меньшей мере один специфический зонд гибридизации в отношении продукта экспрессии гена-мишени S100A9 и/или гена-мишени S100A8; или по меньшей мере одно антитело, специфичное к продукту экспрессии гена-мишени S100A9 и/или гена-мишени S100A8.
Специфический реагент в отношении продукта экспрессии гена S100A9 и/или гена S100A8, следовательно, используют для составления прогноза развития септического синдрома у пациента (включая прогноз выживания или смерти). Реагент может включать по меньшей мере один специфический зон