Многоцепочечный химерный антигенный рецептор и его применения
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению химерных антигенных рецепторов (CAR), называемых многоцепочечными CAR, и может быть применено в медицине для противоопухолевой терапии. Многоцепочечный CAR направлен против маркера клеточной поверхности, представленного на целевой клетке и содержит два нековалентно связанных трансмембранных полипептида. Предложенная структура CAR обеспечивает оптимальную передачу сигнала. Первый трансмембранный полипептид содержит трансмембранный домен и одноцепочечный фрагмент антитела (scFv), который способен связываться с маркером клеточной поверхности, представленным на целевой клетке. Второй трансмембранный полипептид содержит трансмембранный домен и передающий сигнал домен. Изобретение позволяет получить CAR, перенаправляющий специфичность и реактивность иммунных клеток в направлении выбранной мишени с использованием свойств лигандсвязывающего домена. 6 н. и 16 з.п. ф-лы, 26 ил., 15 табл., 6 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к химерным антигенным рецепторам (CAR). CAR способны перенаправлять специфичность и реактивность иммунной клетки в направлении выбранной мишени с помощью свойств лигандсвязывающего домена. В частности, настоящее изобретение относится к многоцепочечному химерному антигенному рецептору, в котором внеклеточные лигандсвязывающие и сигнальные домены разделены по различным трансмембранным полипептидам для улучшения их функций. Различные трансмембранные полипептиды, составляющие многоцепочечный CAR по настоящему изобретению, когда собраны вместе, могут специфически связываться с одним или несколькими лигандами в мишени и индуцировать активацию иммунных клеток, в которых они экспрессируются, и иммунный ответ. Настоящее изобретение также относится к полинуклеотидам, векторам, кодирующим такие трансмембранные полипептиды, и выделенным клеткам, экспрессирующим указанный многоцепочечный CAR на своей поверхности, для иммунотерапии. Настоящее изобретение также относится к способам получения иммунных клеток способами генной инженерии, экспрессирующих многоцепочечный CAR на своей поверхности. Изобретение открывает путь эффективным стратегиям адоптивной иммунотерапии для лечения злокачественной опухоли и вирусных инфекций.
Уровень техники изобретения
Адоптивная иммунотерапия, которая включает перенос аутологичных антиген-специфических Т-клеток, полученных ex vivo, является многообещающей стратегией для лечения вирусных инфекций и злокачественных опухолей. T-клетки, используемые для адоптивной иммунотерапии, могут быть получены или путем размножения антиген-специфических T-клеток, или путем перенаправления T-клеток посредством генной инженерии (Park, Rosenberg et al., 2011). Перенос специфичных к вирусному антигену T-клеток является хорошо отлаженной процедурой, используемой для лечения связанных с трансплантатами вирусных инфекций и редких связанных с вирусами злокачественных опухолей. Кроме того, было показано, что выделение и перенос специфичных к опухоли T-клеток являются успешными при лечении меланомы.
Новые специфичности T-клеток были успешно созданы посредством генетического переноса трансгенных Т-клеточных рецепторов или химерных антигенных рецепторов (CAR) (Jena, Dotti et al., 2010). CAR представляют собой синтетические рецепторы, состоящие из направляющего участка, который связан с одним или несколькими сигнальными доменами в одной молекуле слияния. Обычно связывающий участок CAR состоит из антигенсвязывающего домена одноцепочечного антитела (scFv), содержащего легкие и вариабельные фрагменты моноклонального антитела, присоединенные посредством гибкого линкера. Также успешно применялись связывающие участки, основанные на доменах рецептора или лиганда. Сигнальные домены для первого поколения CAR получают из цитоплазматического участка цепей CD3-дзета или Fc-рецептора-гамма. Было показано, что CAR первого поколения успешно перенаправляют цитотоксичность T-клеток, однако они не могли обеспечивать продолжительное размножение и противоопухолевую активность in vivo. Для повышения выживаемости и улучшения пролиферации модифицированных CAR T-клеток присоединяли сигнальные домены из костимулирующих молекул, включая CD28, OX-40 (CD134) и 4-1BB (CD137), по отдельности (второе поколение) или в комбинации (третье поколение). CAR успешно позволяли перенаправление T-клеток против антигенов, экспрессированных на поверхности опухолевых клеток из различных злокачественных опухолей, включая лимфомы и солидные опухоли (Jena, Dotti et al., 2010).
Современные архитектуры CAR построены на конструкции, в которой все нужные домены содержатся в одном полипептиде (US 7741465). Такая конструкция требует последовательного присоединения сигнальных доменов, что требует переместить некоторые домены из их природных околомембранных положений, удаленных от плазматической мембраны. Тем не менее, архитектуры, в которых лиганды и сигнальные домены отделены в своих нормальных околомембранных положениях (т.е. поблизости от клеточной мембраны на ее внутренней стороне), были бы более желательными, и считается, что они позволят улучшенное функционирование костимулирующих доменов. Высокоаффинный рецептор для IgE (FcεRI) мог бы обеспечивать такую архитектуру. В самом деле, FcεRI, который присутствует на тучных клетках и базофилах, представляет собой тетрамерный комплекс, состоящий из лигандсвязывающей альфа-субъединицы, бета-субъединицы и гомодимера двух передающих сигнал гамма-субъединиц (Metzger, Alcaraz et al., 1986). FcεRI-альфа домен состоит из внеклеточного домена, содержащего два Ig-подобных домена, которые связывают IgE, трансмембранный домен и короткий цитоплазматический хвост. Бета-субъединица содержит четыре трансмембранных сегмента, разделяющих амино- и карбоксиконцевые цитоплазматические хвосты. Гамма-цепь состоит по существу из трансмембранного участка и цитоплазматического хвоста, содержащего один иммунорецепторный тирозиновый активирующий мотив (ITAM) (Cambier, 1995).
Современный протокол для лечения пациентов с помощью адоптивной иммунотерапии основан на переносе аутологичных клеток. При таком подходе T-лимфоциты получают от пациентов, генетически модифицируют или отбирают ex vivo, культивируют in vitro, для того чтобы увеличить количество клеток, если необходимо, и, наконец, вводят в пациента. В дополнение к введению лимфоцитов на хозяина можно воздействовать другими способами, которые поддерживают приживление Т-клеток или их участие в иммунном ответе, например, посредством предварительного кондиционирования (с помощью излучения или химиотерапии) и введения факторов роста лимфоцитов (таких как IL-2). Каждый пациент получает индивидуально подобранное лечение с использованием собственных лимфоцитов пациента (т.е. аутологическую терапию).
Аутологические терапии сталкиваются со значительными техническими и логистическими препятствиями для практического применения, их создание требует дорогостоящих специализированных технических средств и высококвалифицированного персонала, они должны быть созданы в течение короткого времени после диагностики пациента, и, во многих случаях, предварительная обработка пациента приводит к ухудшению иммунной функции, так что лимфоциты пациента могут становиться малофункциональными и присутствовать в очень малых количествах. Из-за этих препятствий каждый препарат аутологичных клеток пациента является по существу эффективным новым продуктом, что ведет к существенной вариативности в эффективности и безопасности. В идеале, хотелось бы использовать стандартизированную терапию, в которой аллогенные терапевтические клетки можно было бы создавать заранее, подробно характеризовать и делать доступными для немедленного введения пациентам. Под аллогенными подразумевается, что клетки получают от индивидуумов, принадлежащих к одному и тому же виду, но генетически разнородных. Однако, использование аллогенных клеток имеет в настоящее время много недостатков. В иммунокомпетентных хозяевах аллогенные клетки быстро отторгаются, процесс называется отторжением хозяин против трансплантата (HvG), и это существенно ограничивает эффективность перенесенных клеток. В иммунонекомпетентных хозяевах аллогенные клетки могут приживаться, но их эндогенные специфичности TCR распознают ткань хозяина как чужие, что приводит к заболеванию трансплантат против хозяина (GvHD), которое может приводить к серьезному повреждению тканей и смерти. Для того, чтобы эффективно использовать аллогенные клетки, нужно преодолеть обе эти проблемы.
В иммунокомпетентных хозяевах аллогенные клетки быстро отторгаются иммунной системой хозяина. Было продемонстрировано, что аллогенные лейкоциты, присутствующие в необлученных продуктах крови, сохраняются в течение не больше чем от 5 до 6 дней. (Boni, Muranski et al., 2008). Таким образом, чтобы предотвратить отторжение аллогенных клеток, иммунная система хозяина должна быть эффективно подавлена. Глюкокортикостероиды широко используются терапевтически для иммуносупрессии (Coutinho and Chapman, 2011). Этот класс стероидных гормонов связывается с глюкокортикоидным рецептором (GR), присутствующим в цитозоле T-клеток, что ведет к транслокации в ядро и связыванию специфических мотивов ДНК, которые регулируют экспрессию ряда генов, участвующих в иммунологическом процессе. Обработка T-клеток с помощью глюкокортикоидных стероидов приводит к пониженному уровню производства цитокинов, что ведет к Т-клеточной анергии и препятствию к активации Т-клеток. Алемтузумаб, также известный как CAMPATH1-H, представляет собой гуманизированное моноклональное антитело, направленное на CD52, 12-аминокислотный гликопротеин, соединенный с гликозилфосфатидилинозитолом (GPI) (Waldmann and Hale, 2005). CD52 экспрессируется в больших количествах на T и B-лимфоцитах и в малых количествах на моноцитах, при этом отсутствуя на гранулоцитах и предшественниках костного мозга. Было показано, что лечение с помощью алемтузумаба, гуманизированного моноклонального антитела, направленного против CD52, индуцирует быстрое истощение циркулирующих лимфоцитов и моноцитов. Его часто используют при лечении Т-клеточных лимфом и в некоторых случаях как часть режима кондиционирования для трансплантации. Однако, в случае адоптивной иммунотерапии использование иммуносупрессивных препаратов также будет иметь отрицательное воздействие на введенные терапевтические T-клетки. Следовательно, для эффективного использования подхода адоптивной иммунотерапии в данных условиях введенные клетки должны быть резистенстными к иммуносупрессивной обработке.
С другой стороны, T-клеточные рецепторы (TCR) представляют собой рецепторы клеточной поверхности, которые участвуют в активации Т-клеток в ответ на презентацию антигена. TCR, как правило, состоит из двух цепей, альфа и бета, которые собираются с образованием гетеродимера и связываются с передающими субъединицами CD3 с образованием комплекса T-клеточного рецептора, присутствующего на клеточной поверхности. Каждая альфа и бета-цепь TCR состоит из иммуноглобулин-подобного N-концевого вариабельного (V) и константного (C) участка, гидрофобного трансмембранного домена и короткого цитоплазматического участка. Что касается молекул иммуноглобулина, вариабельный участок альфа и бета-цепей создается посредством V(D)J-рекомбинации, создающей большое разнообразие антиген-специфичностей в популяции T-клеток. Однако, в отличие от иммуноглобулинов, которые распознают интактный антиген, T-клетки активируются процессированными пептидными фрагментами, связанными с молекулой MHC, что вводит дополнительное измерение в распознавание антигена T-клетками, известное как MHC-рестрикция. Распознавание несовместимостей MHC между донором и реципиентом посредством T-клеточного рецептора приводит к пролиферации T-клеток и потенциальному развитию GVHD. Было показано, что нормальная поверхностная экспрессия TCR зависит от согласованного синтеза и сборки всех семи компонентов комплекса (Ashwell and Klusner, 1990). Инактивация TCR-альфа или TCR-бета может приводить к элиминации TCR с поверхности T-клеток, что предотвращает распознавание аллоантигена и, следовательно, GVHD. Однако, разрушение TCR приводит к элиминации сигнального компонента CD3 и изменяет способы дальнейшего размножения T-клеток.
Опосредованный T-клетками иммунитет включает несколько последовательных стадий, регулируемых равновесием между костимулирующими и ингибирующими сигналами, которые точно настраивают иммунный ответ. Ингибирующие сигналы, называемые иммунными контрольными точками, являются существенными для поддержания аутотолерантности, а также для ограничения иммунно-опосредованного сопутствующего повреждения ткани. Экспрессия белка иммунных контрольных точек может быть дерегулирована опухолями. Способность опухолей присваивать данные ингибирующие пути представляет собой важный механизм в иммуннорезистентности и ограничивает успех иммунотерапии. Одним из перспективных подходов к активации терапевтического T-клеточного иммунного ответа является блокада этих иммунных контрольных точек (Pardoll, 2012). Иммунные контрольные точки представляют значительные препятствия для активации функционального клеточного иммунитета при раке, и антагонистические антитела, специфичные для ингибирующих лигандов на T-клетках, включая CTLA4 и белок программируемой смерти-1 (PD-1), являются примерами направленных средств, исследуемых в клиниках.
Антиген 4 цитотоксических T-лимфоцитов (CTLA-4; также известный как CD152) снижает амплитуду активации T-клеток, и было показано, что лечение с помощью антагониста антител к CTLA4 (ипилимумаба) дает эффект выживаемости пациентов с меланомой (Robert and Mateus, 2011). Белок программируемой клеточной смерти 1 (PD1 или PDCD1, также известный как CD279) представляет собой другую очень перспективную мишень для иммунотерапии (Pardoll and Drake, 2012; Pardoll, 2012). В отличие от CTLA-4, PD1 ограничивает T-клеточные эффекторные функции в периферической ткани в момент воспалительного ответа на инфекцию и для ограничения аутоиммунитета. Первое клиническое испытание антитела PD1 продемонстрировало несколько случаев регрессии опухоли (Brahmer, Drake et al., 2010). Многие дополнительные белки иммунных контрольных точек, судя по недавним исследованиям, представляют собой перспективные мишени для терапевтической блокады.
В нормальных T-клетках T-клеточные рецепторы получаются из рецепторов пре-T-клеток (pTCR), которые экспрессируются незрелыми тимоцитами и имеют решающее значение для развития Т-клеток из двойной отрицательной (CD4- CD8-) в двойную положительную (CD4+ CD8+) стадии. Пре-T-клетки, которые успешно прошли продуктивные реаранжировки локуса TCR-бета, экспрессируют функциональную цепь TCR-бета, которая образует пару с инвариантной цепью preT-альфа и сигнальными компонентами CD3 с образованием комплекса пре-TCR. Экспрессия пре-TCR на клеточной поверхности является необходимой для запуска бета-селекции, процесса, который индуцирует размножение развивающихся T-клеток, обеспечивает аллельное исключение локуса TCR-бета и приводит к индукции реаранжировок в локусе TCR-альфа (von Boehmer, 2005). После продуктивных реаранжировок TCR-альфа и замещения pT-альфа на TCR-альфа с образованием зрелых TCR, тимоциты подвергаются второй стадии селекции, называемой положительной или TCR-альфа/бета селекцией при связывании комплексов аутопептида и MHC, экспрессированных на эпителиальных клетках тимуса. Таким образом, зрелые T-клетки распознают и отвечают на комплекс антиген/MHC посредством своих TCR. Наиболее непосредственным следствием активации TCR является инициирование сигнальных путей посредством связанных CD3-субъединиц, которые приводят к нескольким событиям, включая клональное размножение T-клеток, повышающую регуляцию активации маркеров на клеточной поверхности и индукцию цитотоксичности или секрецию цитокинов.
Благодаря характеру селекции цепей TCR-бета посредством образования пары с preT-альфа во время развития в тимусе в T-клетках, в которых TCR-альфа была инактивирована, гетерологичное введение трансгена pT-альфа может приводить к образованию пре-TCR. Этот pTCR может служить в качестве средства активации или стимуляции Т-клеток таким образом, который не является зависимым от MHC, тем самым позволяя, например, непрерывное размножение альфа/бета T-клеток после инактивации TCR-альфа. Важно отметить, что комплекс pTCR демонстрирует такой же биохимический состав, что и TCR, в отношении связанных CD3-субъединиц (Carrasco, Ramiro et al., 2001). Кроме того, в отличие от TCR, сигнализация пре-TCR может происходить частично в связи с независимыми от лигандов событиями. Кристаллическая структура внеклеточного домена pTCR обеспечивает структурную основу для возможной независимости сигнализации pTCR от лигандов. Было показано, что pTCR образует димер голова к хвосту, в котором связаны два гетеродимера pT-альфа-TCR-бета (Pang, Berry et al., 2010).
В контексте разработки сконструированных иммунных клеток терапевтического качества, которые могут быть направлены на злокачественные или инфицированные клетки, изобретатели стремились к улучшенным архитектурам CAR, который были бы близки к природным и, вероятно, вели бы себя соответственно, используя любые внеклеточные моно- или мультиспецифические лигандсвязывающие домены.
В результате, авторы разработали новое поколение CAR, использующих отдельные полипептидные субъединицы в соответствии с настоящим изобретением, именуемых "многоцепочечные CAR".
Сущность изобретения
Химерные антигенные рецепторы (CAR) в предшествующем уровне техники присутствуют в виде одиночных молекул слияния, которые требуют последовательного присоединения сигнальных доменов. Однако, удаление сигнальных доменов из их природного околомембранного положения препятствует их функции. Таким образом, чтобы преодолеть этот недостаток, изобретатели смогли сконструировать так называемые многоцепочечные CAR, которые делают возможным околомембранное положение всех соответствующих сигнальных доменов. В многоцепочечных CAR сигнальные домены помещены на различных полипептидных цепях, так что они размещены в околомембранных положениях. Например, многоцепочечный CAR может быть получен из FcεRI посредством замены высокоаффинного IgE-связывающего домена альфа-цепи FcεRI на внеклеточный лигандсвязывающий домен, такой как scFv, в то время как N- и/или C-концевые хвосты бета- и/или гамма-цепи FcεRI используются для помещения передающего сигнал домена в нормальные околомембранные положения. Внеклеточный лигандсвязывающий домен выполняет задачу перенаправления специфичности T-клеток в направлении клеток-мишеней, тогда как передающие сигнал домены, оставленные в околомембранных положениях, активируют иммунный клеточный ответ.
Тот факт, что сигнальные домены в околомембранном положении присутствуют на полипептиде(ах), отличающемся от несущего внеклеточный лигандсвязывающий домен, обеспечивает более гибкую архитектуру для CAR. Соответственно, дополнительные сигнальные домены или костимулирующие домены могут быть присоединены или отсоединены от CAR в зависимости от интенсивности взаимодействия, наблюдаемого между лигандсвязывающим доменом CAR и его рецептором. Такая гибкость в архитектуре CAR также позволяет вводить дополнительный внеклеточный лигандсвязывающий домен(ы). Это может быть сделано путем слияния второго лигандсвязывающего домена с полипептидом, несущим первый лигандсвязывающий домен, или путем введения дополнительных внеклеточных лигандсвязывающих доменов. Если данный второй лигандсвязывающий домен имеет другую специфичность, это образует биспецифический многоцепочечный CAR, а если имеют место дополнительные специфичности, то мультиспецифический многоцепочечный CAR. Это особенно выгодно с точки зрения нацеливания на заданные клетку или вирус, несущие два или более различных рецептора, присутствующих на их поверхности. Это увеличивает специфичность такого многоцепочечного CAR в направлении указанных клетки или вируса. С другой стороны, количество сигнальных доменов может позволять модуляцию сигнала в соответствии с различными связывающими доменами. Кроме того, каждый рекомбинантный полипептид, образующий CAR, может быть экспрессирован независимо с различными уровнями экспрессии для дополнительной модуляции активности CAR.
Настоящее изобретение относится к данной новой архитектуре CAR, к рекомбинантным полинуклеотидам, кодирующим их, а также к способам конструирования иммунных клеток для специфичного распознавания клеток, какими бы ни были цель и природа иммунных клеток.
Настоящее изобретение дополнительно предлагает способы получения таких иммунных клеток, более подходящих для целей иммунотерапии.
Например, иммунные клетки могут быть дополнительно сконструированы так, чтобы быть неаллореактивными и/или резистентными к иммуносупрессивным средствам, в частности, посредством инактивации генов TCR-альфа или бета в первичных клетках и/или посредством соединения инактивации генов, кодирующих мишени для различных иммуносупрессивных средств, в частности, CD52 и GR (глюкокортикоидных рецепторов), и последующей селекции клеток, устойчивых к упомянутым иммуносупрессивным средствам.
В дополнение к вышеуказанной концепции генетически модифицированных иммунных клеток настоящее изобретение также относится к вариантам осуществления, в которых иммунные клетки конструируют так, чтобы позволять пролиферацию, когда TCR-альфа инактивирована, например, путем временной экспрессии preT-альфа в клетках, посредством чего восстанавливается функциональный комплекс CD3 в отсутствие функциональной альфа/бета-TCR.
Для того, чтобы сконструировать генетически высоко активные модифицированные иммунные клетки, изобретение также предлагает способы, в которых иммунные контрольные точки блокированы недостаточной экспрессией генов, таких как PD1 и CTLA-4.
Настоящая заявка дополнительно раскрывает сконструированные иммунные клетки, в частности, T-клетки, для применения в качестве лекарственного средства, более конкретно, для лечения или профилактики злокачественных опухолей посредством введения таких иммунных клеток в живой организм.
Краткое описание фигур и таблиц
В дополнение к вышеуказанным признакам изобретение дополнительно содержит другие признаки, которые будут следовать из следующего описания, а также из прилагаемых чертежей. Более полное понимание настоящего изобретения и многих его сопутствующих преимуществ будет легко получено, поскольку оно станет более понятным с помощью ссылки на следующие фигуры в сочетании с подробным описанием ниже.
Фигура 1: Схематическое представление нормального отношения между T-клетками и антиген-презентирующей клеткой.
Фигура 2: Схематическое представление генетически модифицированных терапевтических T-клеток в соответствии с настоящим изобретением и опухолевых клеток пациента.
Фигура 3: Схематическое представление многоцепочечного CAR.
Фигура 4: Схема различных вариантов многоцепочечных CAR. A. Схема рецептора FcεRI. B-C. Различные варианты многоцепочечных CAR (от csm1 до csm10), содержащие scFv и участок в виде ножки CD8, слитый с трансмембранным доменом альфа-цепи FcεRI. По меньшей мере один из доменов 41BB, CD28 и/или CD3-дзета может быть слит с FcεRI-альфа, бета и/или гамма-цепью.
Фигура 5: Схематическое представление одного примера способа получения аллогенных клеток человека способами генной инженерии для иммунной терапии.
Фигура 6: Концентрация в клетках на миллилитр живых CD52-положительных или CD52-отрицательных клеток после лечения с помощью анти-CD52 антитела (CAMPATH1-H) с комплементом или контролем.
Фигура 7: Сравнение распределения прямого светорассеяния (FSC), индикатора размера клеток, между TCR-положительными и TCR-отрицательными клетками или между CD52-положительными и CD52-отрицательными клетками и не активированными клетками в качестве контроля.
Фигура 8: Анализ с помощью проточной цитометрии экспрессии CD107a (маркер дегрануляции) на целевых инактивированных по CD52 и TCR-альфа T-клетках. Экспрессию CD107 анализировали на CD52+TCRαβ+ клетках (первая колонка), CD52-TCRαβ- клетках (вторая колонка), CD52-TCRαβ+ клетках (третья колонка) и CD52+TCRαβ- клетках (четвертая колонка) перед (A) и после инкубации с клетками Дауди (B); C) представляет анализ с помощью проточной цитометрии T-клеток, дополнительно трансфицированных CAR и инкубированных с клетками Дауди; D) представляет анализ с помощью проточной цитометрии T-клеток, трансфицированных CAR, но не инкубированных с клетками Дауди, и E) представляет анализ с помощью проточной цитометрии T-клеток, трансфицированных CAR и обработанных PMA/иономицином (положительный контроль).
Фигура 9: Анализ с помощью глубокого секвенирования потенциальных мишеней вне сайта TALE-нуклеаз CD52 и TRAC. Фигура 9 раскрывает последовательности "левой полумишени" как SEQ ID NO:149-165 и последовательности "правой полумишени" как SEQ ID NO:166-182, все, соответственно, в порядке изображения.
Фигура 10: Анализ геномного локуса PDCD1 и CTLA-4 посредством T7-эндонуклеазного анализа. Стрелки показывают на расщепленные продукты ПЦР.
Фигура 11: Схематическое представление некоторых примеров конструктов preT-альфа.
Фигура 12: Анализ с помощью проточной цитометрии эффективности трансдукции (% BFP+ клеток) и активность конструктов FL, Δ18, Δ48 pT-альфа (% поверхностной экспрессии CD3) в TCR-альфа-инактивированных клетках Jurkat.
Фигура 13: Схематическое представление лентивирусного конструкта, кодирующего белок pT-альфа (пре-TCRα).
Фигура 14: A. Изображение экспериментального протокола. B. Анализ с помощью проточной цитометрии экспрессии TCR-альфа/бета, CD3 и экспрессии BFP на TCR-альфа-инактивированных T-клетках (KO), трансдуцированных или BFP-2A-pT-альфа-Δ48 (KO/Δ48), или контрольным лентивирусным вектором BFP (KO/BFP), до и после очистки. C. Анализ с помощью проточной цитометрии экспрессии TCR-альфа/бета и CD3 на очищенных TCR-альфа-инактивированных клетках, трансдуцированных (BFPpos) или не трансдуцированных (BFPneg) лентивирусным вектором BFP-2A-pT-альфа-Δ48. NEP представляет не электропорированные клетки с TRAC-TALE-нуклеазами.
Фигура 15: A-B. Анализ с помощью проточной цитометрии экспрессии маркера ранней активации CD69 (A), маркера поздней активации CD25 (B) через 24 и 48 часов после реактивации с помощью гранул с анти-CD3/CD28, соответственно, на не электропорированных клетках (NEP) и TCR-альфа-инактивированных клетках (KO), трансдуцированных лентивирусным вектором BFP-2A-pΤα-Δ48 (pΤα-Δ48), лентивирусным вектором BFP-2A-pΤα-Δ48.41BB (pΤα-Δ48.ΒΒ) или контрольным вектором BFP (BFP). Гистограммы pΤα-Δ48 соответствуют сигналу, детектируемому в TCR-инактивированных клетках, экспрессирующих pΤα-Δ48 (BFP+ клетки), тогда как гистограммы KO соответствуют TCR-альфа-инактивированным клеткам, которые не экспрессируют pΤα-Δ48 (BFP- клетки). Гистограммы pΤα-Δ48.ΒΒ соответствуют сигналу, детектируемому в TCR-инактивированных клетках, экспрессирующих pΤα-Δ48.41ΒΒ (BFP+ клетки), тогда как гистограммы KO соответствуют TCR-альфа-инактивированным клеткам, которые не экспрессируют pΤα-Δ48.41ΒΒ (BFP-клетки). Гистограммы NEP (не электропорированные) соответствуют сигналу, детектируемому в неинженерных клетках. C. Анализ с помощью проточной цитометрии размера клеток через 72 часа после реактивации с помощью гранул с анти-CD3/CD28 на не электропорированных клетках (NEP) и TCR-альфа-инактивированных клетках (KO), трансдуцированных лентивирусным вектором BFP-2A-pΤα-Δ48 (pΤα-Δ48), лентивирусным вектором BFP-2A-pΤα-Δ48.41BB (pΤα-Δ48.ΒΒ) или контрольным вектором BFP (BFP). Значения, указанные в верхней части каждого графика, соответствуют среднему геометрическому флуоресценции каждой популяции.
Фигура 16: Анализ клеточного роста TCR-альфа-инактивированных клеток (KO), трансдуцированных pT-альфа-Δ48 (pTaΔ48) или контрольным вектором BFP (BFP), выдерживаемых в IL2 или в IL2 с гранулами анти-CD3/CD28, в различных временных точках (ось x). Количество BFP+ клеток определяли в различных временных точках для каждого варианта и определяли, во сколько раз изменится индукция данных клеток (ось y) по отношению к значению, полученному на день 2 после реактивации. Результаты получали с двумя независимыми донорами. Для второго донора клеточный рост также определяли для клеток, трансдуцированных pT-альфа-Δ48.41BB (pΤα-Δ48.BB) и полноразмерным pT-альфа (pΤα-FL).
Фигура 17: Анализ с помощью проточной цитометрии GFP-положительных клеток на PBMC, электропорированных с помощью пяти различных программ CytoPulse. A. NEP, EP#1 (GFP) и EP#2 (GFP); B. EP#3 (pUC), EP#4 (GFP) и EP#5 (GFP). Верхняя линия соответствует трансфекции 6×106 клеток на кювету, в то время как нижняя линия соответствует трансфекции 3×106 клеток на кювету.
Фигура 18: Анализ с помощью проточной цитометрии смертности очищенных T-клеток с помощью красителя для определения жизнеспособности (eFluor-450) и GFP-положительных клеток среди жизнеспособной популяции после электропорации мРНК GFP, ДНК GFP и контрольной ДНК pUC. A. NT и NEP; B. EP (нет ДНК) и ДНК GFP; C. ДНК pUC и мРНК GFP. NEP соответствует клеткам, которые выдерживали в буфере для электропорации, но не электропорировали, и NT соответствует не электропорированным клеткам, выдерживаемым в культуральной среде.
Фигура 19: Анализ с помощью проточной цитометрии экспрессии TCR-альфа/бета и CD3 на первичных T-клетках человека после электропорации мРНК TRAC-TALE-нуклеазы (сверху). Анализ с помощью глубокого секвенирования геномной ДНК, экстрагированной из первичных T-клеток человека после электропорации мРНК TRAC-TALE-нуклеазы (снизу) (SEQ ID NO:183-192, соответственно, в порядке изображения).
Фигура 20: A. Анализ с помощью проточной цитометрии экспрессии CAR (анти-F(ab')2) после электропорации T-клеток с или без мРНК, кодирующей одноцепочечный CAR. B. Анализ с помощью проточной цитометрии экспрессии CD107a (маркер дегрануляции) на электропорированных T-клетках, совместно культивированных с клетками Дауди.
Фигура 21: A. Изображение мРНК, кодирующей многоцепочечный CAR. B. Анализ с помощью проточной цитометрии экспрессии CAR (анти-F(ab')2) на жизнеспособных T-клетках, электропорированных с или без полицистронной мРНК, кодирующей многоцепочечный CAR. C. Анализ с помощью проточной цитометрии экспрессии CD107a (маркер дегрануляции) на электропорированных T-клетках, совместно культивированных с клетками Дауди.
Фигура 22: Экспрессия многоцепочечных CAR в T-клетках человека после электропорации полицистронных мРНК.
Фигура 23: Экспрессия мультисубъединичных CAR обусловливается экспрессией трех цепей: α, β и γ.
Фигура 24: T-клетки человека, временно экспрессирующие многоцепочечные CAR, подвергаются дегрануляции после совместного культивирования с клетками-мишенями.
Фигура 25: T-клетки человека, временно экспрессирующие многоцепочечные CAR, секретируют цитокины после совместного культивирования с клетками-мишенями.
Фигура 26: T-клетки человека, временно экспрессирующие многоцепочечные CAR, лизируют клетки-мишени.
Таблица 1: Описание GR-TALE-нуклеаз и последовательности сайтов-мишеней TALE-нуклеаз в гене GR человека.
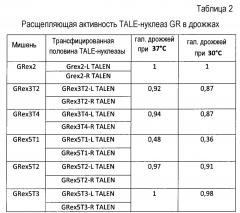
Таблица 2: Расщепляющая активность GR-TALE-нуклеаз в дрожжах. Значения лежат между 0 и 1. Максимальное значение составляет 1.
Таблица 3: Процентная доля направленного мутагенеза в сайтах-мишенях эндогенных TALE-нуклеаз в клетках 293.
Таблица 4: Процентная доля направленного мутагенеза в сайтах-мишенях эндогенных TALE-нуклеаз в первичных T-лимфоцитах.
Таблица 5: Описание TALE-нуклеаз CD52, TRAC и TRBC и последовательности сайтов-мишеней TALE-нуклеаз в соответствующих генах человека.
Таблица 6: Дополнительные последовательности-мишени для TALE-нуклеаз TRAC и CD52.
Таблица 7: Процентная доля вставок-делеций для TALE-нуклеазы, нацеленной на мишени CD52_T02, TRAC_T01, TRBC_T01 и TRBC_T02.
Таблица 8: Процентные доли CD52-отрицательных, TCR-отрицательных и CD52/TCR-двойных отрицательных T-лимфоцитов после трансфекции соответствующих экспрессирующих TALE-нуклеазу полинуклеотидов.
Таблица 9: Процентные доли TCR-отрицательных T-лимфоцитов после трансфекции экспрессирующих TRBC-TALE-нуклеазу полинуклеотидов.
Таблица 10: Описание TALE-нуклеаз CTLA4 и PDCD1 и последовательности сайтов-мишеней TALE-нуклеаз в соответствующих генах человека.
Таблица 11: Описание выборки конструктов pT-альфа.
Таблица 12: Активность различных конструктов pT-альфа в TCR-альфа-инактивированных клетках Jurkat. Активность измеряли посредством анализа с помощью проточной цитометрии экспрессии CD3 на TCR-альфа-инактивированных клетках Jurkat, трансфицированных различными конструктами preT-альфа.
Таблица 13: Различные программы CytoPulse, использованные для определения минимального напряжения, требуемого для электропорации в происходящих от PBMC T-клетках.
Таблица 14: Программа CytoPulse, использованная для электропорации очищенных T-клеток.
Таблица 15: Описание составов цепей FcR вариантов многоцепочечных CAR.
Подробное описание изобретения
Если специально не определено в настоящем документе, все используемые технические и научные термины имеют то значение, которое обычно понимается специалистом в областях генной терапии, биохимии, генетики и молекулярной биологии.
Все способы и материалы, аналогичные или эквивалентные тем, которые описаны в настоящем документе, могут быть использованы в осуществлении на практике или тестировании настоящего изобретения, причем подходящие способы и материалы описаны в настоящем документе. Все публикации, патентные заявки, патенты и другие ссылки, указанные в настоящем документе, включены в качестве ссылки во всей их полноте. В случае конфликта, настоящее описание изобретения, включая определения, будет иметь преимущество. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения, если не указано иное.
Осуществление настоящего изобретения на практике будет использовать, если не указано иное, обычные методы клеточной биологии, клеточной культуры, молекулярной биологии, трансгенной биологии, микробиологии, рекомбинантной ДНК и иммунологии, которые известны специалистам в данной области. Такие методы подробно описаны в литературе. См., например, Current Protocols in Molecular Biology (Frederick M. AUSUBEL, 2000, Wiley and son Inc, Library of Congress, США); Molecular Cloning: A Laboratory Manual, Third Edition, (Sambrook et al, 2001, Cold Spring Harbor, New York: Cold Spring Harbor Laboratory Press); Oligonucleotide Synthesis (M. J. Gait ed., 1984); Mullis et al., патент США № 4683195; Nucleic Acid Hybridization (B. D. Harries & S. J. Higgins eds. 1984); Transcription And Translation (B. D. Hames & S. J. Higgins eds. 1984); Culture Of Animal Cells (R. I. Freshney, Alan R. Liss, Inc., 1987); Immobilized Cells And Enzymes (IRL Press, 1986); B. Perbal, A Practical Guide To Molecular Cloning (1984); серия Methods In ENZYMOLOGY (J. Abelson and M. Simon, eds.-in-chief, Academic Press, Inc., New York), особенно тома 154 и 155 (Wu et al. eds.) и том 185 "Gene Expression Technology" (D. Goeddel, ed.); Gene Transfer Vectors For Mammalian Cells (J. H. Miller and M. P. Calos eds., 1987, Cold Spring Harbor Laboratory); Immunochemical Methods In Cell And Molecular Biology (Mayer and Walker, eds., Academic Press, London, 1987); Handbook Of Experimental Immunology, Volumes I-IV (D. M. Weir and C. C. Blackwell, eds., 1986); и Manipulating the Mouse Embryo, (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1986).
Многоцепочечный химерный антигенный рецептор (CAR)
Настоящее изобретение относится к многоцепочечному химерному антигенному рецептору (CAR), в частности, к приспособленному к иммунным клеткам, применяемым в иммунотерапии.
Многоцепочечный CAR в соответствии с настоящим изобретением обычно содержит по меньшей мере:
- один трансмембранный полипептид, содержащий по меньшей мере один внеклеточный лигандсвязывающий домен и;
- один трансмембранный полипептид, содержащий по меньшей мере один передающий сигнал домен;
так что указанные полипептиды собирают вместе с образованием многоцепочечного химерного антигенного рецептора.
Термин "внеклеточный лигандсвязывающий домен", как используется в настоящем документе, определяется как олиго- или полипептид, который способен к связыванию с лигандом. Предпочтительно, данный домен будет способен к взаимодействию с молекулой клеточной поверхности. Например, внеклеточный лигандсвязывающий домен может быть выбран для распознавания лиганда, который действует в качестве маркера клеточной поверхности на клетках-мишенях, связанных с конкретным состоянием заболевания. Таким образом, примеры маркеров клеточной поверхности, которые могут действовать как лиганды, включают связанные с вирусными, бактериальными и паразитарными инфекциями, аутоиммунным заболеванием и раковыми клетками. В частности, внеклеточный лигандсвязывающий домен может содержать антигенсвязывающий домен, происходящий от антитела против антигена мишени. В качестве неограничивающих примеров, антиген мишени может представлять собой опухолеассоциированный поверхностный антиген, такой как ErbB2 (HER2/neu), карциноэмбриональный антиген (CEA), молекула адгезии эпителиальных клеток (EpCAM), рецептор эпидермального фактора роста (EGFR), EGFR вариант III (EGFRvIII), CD19, CD20, CD30, CD40, дисиалоганглиозид GD2, дуктально-эпителиальный муцин, gp36, TAG-72, гликосфинголипиды, глиома-ассоциированный антиген, β-хорионический гонадотропин человека, альфафетопротеин (AFP), лектин-реактивный AFP, тиреоглобулин, RAGE-1, MN-CA IX, обратная транскриптаза теломеразы человека, RU1, RU2 (AS), кишечная карбоксилэстераза, mut hsp70-2, M-CSF, простаза, простатический специфический антиген (PSA), PAP, NY-ESO-1, LAGA-1a, p53, простеин, PSMA, выживание и теломераза, опухолевый антиген-1 карциномы простаты (PCTA-1), MAGE, ELF2M, нейтрофил-эластаза, эфрин B2, CD22, инсулиноподобный фактор роста (IGF1)-I, IGF-II, рецептор IGFI, мезотелин, молекула главного комплекса гистосовместимости (MHC), презентирующая эпитоп опухолеспецифического пептида, 5T4, ROR1, Nkp30, NKG2D, опухолевые стромальные антигены, экстра домен A (EDA) и экстра домен B (EDB) фибронектина, и домен A1 тенасцина-C (TnC A1), и связанный с фибробласта