Содержащий трегалозу и декстран раствор для трансплантации клеток млекопитающих
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к способу сохранения клеток млекопитающего в течение длительного периода времени с использованием раствора для трансплантации клеток, содержащего 2,0-6,0% (масс./об.) трегалозы, либо соли указанной трегалозы, и 4,0-7,0% (масс./об.) декстрана, либо соли декстрана. Изобретение позволяет повысить выживаемость клеток млекопитающего при хранении для последующей трансплантации в течение длительного периода времени, по меньшей мере 14 дней. 4 з.п. ф-лы, 9 ил., 3 табл., 6 пр.
Реферат
Область техники
Настоящее изобретение относится к способу сохранения клеток млекопитающих в физиологическом водном растворе для трансплантации клеток, содержащем 2,0-6,0% (масс./об.) трегалозы, ее производного, либо соли трегалозы или ее производного (далее в настоящем документе иногда называемых «трегалоза») и 4,0-7,0% (масс./об.) декстрана, его производного, либо соли декстрана или его производного (далее в настоящем документе иногда называемых «декстран») (далее в настоящем документе иногда называемом «настоящий раствор для трансплантации клеток»), настоящему раствору для трансплантации, а также физиологическому водному раствору, содержащему клетки для трансплантации, который содержит клетки млекопитающих, а также трегалозу и декстран (далее в настоящем документе называемому «настоящий раствор, содержащий клетки для трансплантации»).
Уровень техники
В последние годы быстрое развитие исследований стволовых клеток способствовало значительному прогрессу регенеративной медицины, и знание и понимание в этой области стало достоянием не только научного сообщества, но и широкой общественности. Регенеративная медицина с использованием стволовых клеток является областью медицины, занимающейся восстановлением функции клеток и тканей, поврежденных в результате различных заболеваний, за счет использования потенциала самообновления и плюрипотентности стволовых клеток или факторов, секретируемых стволовыми клетками. Трансплантация костного мозга у пациентов, страдающих трудноизлечимыми гематологическими заболеваниями, такими как лейкоз и апластическая анемия, приводит к приживлению гемопоэтических клеток-предшественников в организме этих пациентов, что позволяет сохранять кроветворную способность на протяжении почти всей жизни. В последнее время многие исследователи направили свои усилия на клиническое применение иных стволовых клеток, чем гемопоэтические стволовые клетки, обнаружили стволовые клетки в центральных нервах, периферических нервах, костном мозге, тонком кишечнике и тому подобном, и начали проводить лечение травматических заболеваний и дегенеративных заболеваний тканей путем трансплантации тканевых стволовых клеток (непатентные документы 1-3). С другой стороны, лечение рака иммунными клетками является наиболее передовой областью клеточной медицины, при этом иммунные клетки, атакующие рак, забирают из организма, повышают их эффективность и затем вновь возвращают клетки в организм, и осуществляют терапию с использованием T-клеток, такую как терапия вакциной на основе дендритных клеток, альфа/бета T-клеточная терапия (αβ T-клеточная терапия), гамма/дельта T-клеточная терапия (γδ T-клеточная терапия), CTL терапия и терапия с помощью клеток - естественных киллеров (NK-клеточная терапия).
Когда стволовые клетки или T-клетки, используемые для трансплантационной терапии, сохраняют в течение длительного периода времени, содержание в жидкости не позволяет сохранять достаточную степень выживаемости клеток. Например, сообщают, что хранение охлажденных (при 4°C) человеческих стволовых клеток костного мозга в солевом растворе снижает жизнеспособность клеток до 40% или менее через 48 часов и до 20% или менее через 72 часа (непатентный документ 4). Таким образом, если стволовые клетки для трансплантации или T-клетки для трансплантации сохраняют в течение длительного периода времени, обычно используют низкотемпературную консервацию. Однако жидкость для низкотемпературной консервации, как правило, содержит средство для низкотемпературной консервации, такое как ДМСО или глицерин; следовательно, в случае трансплантации необходимо удалять средство для низкотемпературной консервации перед проведением трансплантационной терапии после размораживания сохраняемых при низкой температуре стволовых клеток или T-клеток, что считается проблематичным из-за трудоемкости процедуры. Жидкость для низкотемпературной консервации, содержащая средство для низкотемпературной консервации, также считается проблематичной, поскольку она приводит к значительному повреждению цитоскелета вследствие кристаллизации воды в процессе замораживания и уменьшает выживаемость клеток после замораживания и оттаивания. Таким образом, как считают, существует острая потребность в разработке жидкости для консервации клеток, превосходной с точки зрения простоты использования и способной подавлять уменьшение выживаемости клеток.
Трегалоза представляет собой дисахарид, образованный за счет 1,1-гликозидной связи молекул глюкозы. Трегалозу используют в различных продуктах и косметических товарах, поскольку она обладает сладким вкусом и имеет высокую влагоудерживающую способность. Трегалозу также используют в качестве активного ингредиента защищающего органы раствора при трансплантации органов, поскольку она обладает способностью стабилизировать клеточные мембраны и препятствовать повреждению клеток. Например, разработаны превосходные сохраняющие органы растворы, содержащие трегалозу, такие как раствор ET-Kyoto и раствор New ET-Kyoto (патентные документы 1 и 2 и непатентный документ 5).
Декстран представляет собой полисахарид, состоящий из глюкозы, и широко используется в качестве загустителя, увлажнителя или тому подобного в медицинских и косметических продуктах.
Авторы настоящего изобретения сообщали, что промывание мезенхимальных стволовых клеток, открепленных от сосуда для культивирования клеток путем обработки протеолитическими ферментами, содержащим трегалозу физиологическим водным раствором приводит к подавлению гибели мезенхимальных стволовых клеток (патентный документ 3). Поскольку повреждение клеток в результате обработки протеолитическими ферментами индуцирует путь клеточной гибели (апоптоз или тому подобное), такой эффект трегалозы, возможно, является следствием подавления пути апоптоза или стимулирования функции восстановления поврежденных клеток. Авторы настоящего изобретения также сообщали, что добавление сахарида, такого как трегалоза или декстран, к суспензии мезенхимальных стволовых клеток может подавлять агрегацию и уменьшение выживаемости мезенхимальных стволовых клеток при сохранении их в течение короткого периода времени (от 30 минут до 6 часов) (патентный документ 4). Тем не менее, оставалось неясным, будет ли комбинированное использование трегалозы и декстрана приводить к синергическому подавлению уменьшения выживаемости клеток млекопитающих, таких как мезенхимальные стволовые клетки, и синергическому увеличению процентной доли живых клеток.
Документы предшествующего уровня техники
Патентные документы
Патентный документ 1: Японский патент № 3253131
Патентный документ 2: Международная публикация № WO 2007/043698
Патентный документ 3: Международная публикация № WO 2012/133575
Патентный документ 4: Публикация Японской нерассмотренной патентной заявки № 2012-115253.
Непатентные документы
Непатентный документ 1: Gage, F. H., Science 287: 1433-1438 (2000)
Непатентный документ 2: Morrison, S. J. et al., Cell 96: 737-749 (1999)
Непатентный документ 3: Batle, E. et al., Cell 111: 251-263 (2002)
Непатентный документ 4: Lane, T. A. et al., Transfusion 49: 1471-1481 (2009)
Непатентный документ 5: Chem, F. et al., Yonsei Med. J. 45: 1107-1114 (2004)
Сущность изобретения
Цель, достигаемая с помощью изобретения
Целью настоящего изобретения является предложение способа сохранения клеток млекопитающих в течение длительного периода времени за счет использования раствора для трансплантации клеток, способного эффективно подавлять клеточную гибель при хранении клеток млекопитающих, а также раствора для трансплантации клеток.
Способы достижения цели
Авторы настоящего изобретения сообщали, что, как описано выше, кратковременное (от 30 минут до 6 часов) сохранение мезенхимальных стволовых клеток в растворе, содержащем сахарид, такой как трегалоза или декстран, может приводить к подавлению уменьшения выживаемости клеток (патентный документ 4). Однако изобретение, описанное в патентном документе 4, не демонстрирует синергический эффект комбинированного использования трегалозы и декстрана. В интенсивных исследованиях для решения указанной выше проблемы было обнаружено, что сохранение человеческих мезенхимальных стволовых клеток из костного мозга (hMSC-BM) или человеческих T-клеток периферической крови (hPBT) в физиологическом водном растворе, содержащем трегалозу и декстран в конкретных концентрациях 2,0-6,0% [масс./об.] и 4,0-7,0% [масс./об.], соответственно, может приводить к синергическому подавлению уменьшения выживаемости клеток в течение длительного периода времени (по меньшей мере 14 дней) и синергическому увеличению процентной доли живых клеток, что явилось сущностью настоящего изобретения.
Таким образом, настоящее изобретение относится к (1) способу сохранения клетки млекопитающего в физиологическом водном растворе для трансплантации клеток, содержащем 2,0-6,0% (масс./об.) трегалозы, ее производного, либо соли трегалозы или ее производного, и 4,0-7,0% (масс./об.) декстрана, его производного, либо соли декстрана или его производного, (2) способу по вышеуказанному пункту (1), в котором физиологический водный раствор выбирают из группы, состоящей из раствора Рингера-лактата, солевого раствора, раствора Рингера и раствора Рингера-ацетата, (3) способу по вышеуказанным пунктам (1) или (2), в котором клетку млекопитающего сохраняют в физиологическом водном растворе для трансплантации клеток в течение 3-14 дней, (4) способу по любому из вышеуказанных пунктов (1)-(3), в котором клетка млекопитающего представляет собой мезенхимальную стволовую клетку млекопитающего или T-клетку млекопитающего, и (5) способу по вышеуказанному пункту (4), в котором мезенхимальная стволовая клетка млекопитающего представляет собой человеческую мезенхимальную стволовую клетку из костного мозга и T-клетка млекопитающего представляет собой человеческую T-клетку периферической крови.
Настоящее изобретение также относится к (6) физиологическому водному раствору для трансплантации клеток, содержащему 2,0-6,0% (масс./об.) трегалозы, ее производного, либо соли трегалозы или ее производного и 4,0-7,0% (масс./об.) декстрана, его производного, либо соли декстрана или его производного, (7) физиологическому водному раствору для трансплантации клеток по вышеуказанному пункту (6), выбранному из группы, состоящей из раствора Рингера-лактата, солевого раствора, раствора Рингера и раствора Рингера-ацетата, (8) физиологическому водному раствору для трансплантации клеток по вышеуказанному пункту (6) или (7) в случае, когда клетка млекопитающего представляет собой мезенхимальную стволовую клетку млекопитающего или T-клетку млекопитающего, и (9) физиологическому водному раствору для трансплантации клеток по вышеуказанному пункту (8) в случае, когда мезенхимальная стволовая клетка млекопитающего представляет собой человеческую мезенхимальную стволовую клетку из костного мозга и T-клетка млекопитающего представляет собой человеческую T-клетку периферической крови.
Настоящее изобретение также относится к (10) физиологическому водному раствору, содержащему клетку для трансплантации, который содержит: клетку млекопитающего; 2,0-6,0% (масс./об.) трегалозы, ее производного, либо соли трегалозы или ее производного; и 4,0-7,0% (масс./об.) декстрана, его производного, либо соли декстрана или его производного, (11) физиологическому водному раствору, содержащему клетку для трансплантации, по вышеуказанному пункту (10), выбранному из группы, состоящей из раствора Рингера-лактата, солевого раствора, раствора Рингера и раствора Рингера-ацетата, (12) физиологическому водному раствору, содержащему клетку для трансплантации, по вышеуказанному пункту (10) или (11), в котором клетка млекопитающего представляет собой мезенхимальную стволовую клетку млекопитающего или T-клетку млекопитающего, и (13) физиологическому водному раствору, содержащему клетку для трансплантации, по вышеуказанному пункту (12), в котором мезенхимальная стволовая клетка млекопитающего представляет собой человеческую мезенхимальную стволовую клетку из костного мозга и T-клетка млекопитающего представляет собой человеческую T-клетку периферической крови.
Другие варианты осуществления настоящего изобретения могут включать сочетание физиологического водного раствора и трегалозы, ее производного, либо соли трегалозы или ее производного и декстрана, его производного, либо соли декстрана или его производного для сохранения клеток млекопитающего, а также использование сочетания физиологического водного раствора и трегалозы, ее производного, либо соли трегалозы или ее производного и декстрана, его производного, либо соли декстрана или его производного для получения раствора для трансплантации клеток млекопитающего; более конкретно, вышеописанная трегалоза, ее производное, либо соль трегалозы или ее производного и декстран, его производное, либо соль декстрана или его производного являются активными ингредиентами для подавления уменьшения выживаемости клеток.
Эффект изобретения
В соответствии с настоящим изобретением уменьшение выживаемости клеток, включая стволовые клетки, такие как мезенхимальные стволовые клетки, и лейкоциты, такие как T-клетки, может быть подавлено, если суспензию клеток сохраняют в течение длительного периода времени (по меньшей мере 14 дней); таким образом, хорошего качества клеточная суспензия для трансплантации в регенеративной медицине или в лечении рака может быть доступна не только там, где получают клеточную суспензию, и поблизости, но и в отдаленных местах, и хотя тест на стерильность выполняют для проверки обеспечения качества при транспортировке фармацевтического препарата и выполнение теста на стерильность занимает 14 дней в соответствии с японской фармакопеей, хорошего качества клеточная суспензия может быть доступна даже после получения клеточной суспензии и выполнения теста на стерильность.
Краткое описание чертежей
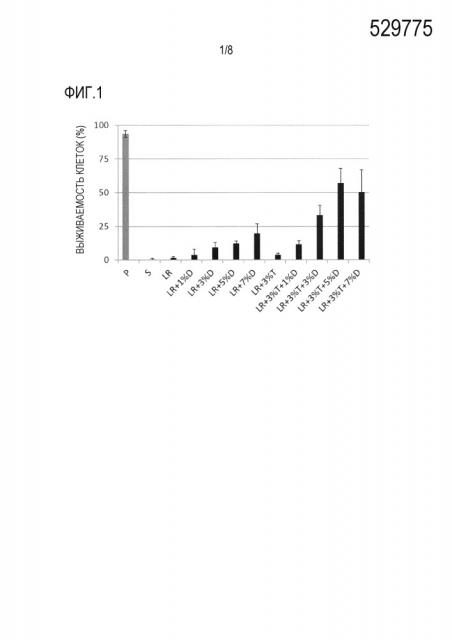
Фиг. 1 представляет собой график, демонстрирующий результаты анализа выживаемости клеток, когда hMSC-BM сохраняли в течение 14 дней с использованием каждого из 11 растворов для трансплантации клеток млекопитающих (растворов S, LR, «LR + 1% D», «LR + 3% D», «LR + 5% D», «LR + 7% D», «LR + 3% T», «LR + 3% T + 1% D», «LR + 3% T + 3% D», «LR + 3% T + 5% D» и «LR + 3% T + 7% D»: см. раздел «1-1-1 Раствор для трансплантации клеток» в примере 1). По оси ординат показана процентная доля живых клеток от общего количества клеток в качестве степени выживаемости клеток (%) (среднее ± стандартное отклонение [n=4]). В качестве контроля показана степень выживаемости клеток до сохранения в фосфатно-солевом буферном растворе Дульбекко (D-PBS [-]) (далее в настоящем документе для простоты называемом «PBS») («P» на оси абсцисс фигуры).
Фиг. 2 представляет собой график, демонстрирующий результаты анализа выживаемости клеток, когда hMSC-BM сохраняли в течение 3 дней, 7 дней и 14 дней с использованием каждого из 11 растворов для трансплантации клеток млекопитающих (растворов S, LR, «LR + 1% D», «LR + 3% D», «LR + 5% D», «LR + 7% D», «LR + 3% T», «LR + 3% T + 1% D», «LR + 3% T + 3% D», «LR + 3% T + 5% D» и «LR + 3% T + 7% D» [«2-12», соответственно, на оси абсцисс фигуры]: см. раздел «1-1-1 Раствор для трансплантации клеток» в примере 1). По оси ординат показана процентная доля живых клеток от общего количества клеток в качестве степени выживаемости клеток (%) (среднее ± стандартное отклонение [n=4]). В качестве контроля показана степень выживаемости клеток до сохранения (0 дней после сохранения) в растворе PBS («1» по оси абсцисс на фигуре).
Фиг. 3 представляет собой график, демонстрирующий результаты анализа выживаемости клеток, когда hMSC-BM сохраняли в течение 14 дней с использованием каждого из 13 растворов для трансплантации клеток млекопитающих (растворов S, LR, «LR + 1% T», «LR + 3% T», «LR + 5% T», «LR + 7% T», «LR + 10% T», «LR + 5% D», «LR + 5% D + 1% T», «LR + 5% D + 3% T», «LR + 5% D + 5% T», «LR + 5% D + 7% T» и «LR + 5% D + 10% T»: см. раздел «2-1-1 Раствор для трансплантации клеток» в примере 2). По оси ординат показана процентная доля живых клеток от общего количества клеток в качестве степени выживаемости клеток (%) (среднее ± стандартное отклонение [n=4]). В качестве контроля показана степень выживаемости клеток до сохранения в растворе PBS («P» по оси абсцисс на фигуре).
Фиг. 4 представляет собой график, демонстрирующий результаты анализа выживаемости клеток, когда hMSC-BM сохраняли в течение 3 дней, 7 дней и 14 дней с использованием каждого из 11 растворов для трансплантации клеток млекопитающих (растворов S, LR, «LR + 1% T», «LR + 3% T», «LR + 5% T», «LR + 7% T», «LR + 5% D», «LR + 5% D + 1% T», «LR + 5% D + 3% T», «LR + 5% D + 5% T» и «LR + 5% D + 7% T» [«2-12», соответственно, по оси абсцисс на фигуре]: см. раздел «2-1-1 Раствор для трансплантации клеток» в примере 2). По оси ординат показана процентная доля живых клеток от общего количества клеток в качестве степени выживаемости клеток (%) (среднее ± стандартное отклонение [n=4]). В качестве контроля показана степень выживаемости клеток до сохранения (0 дней после сохранения) в растворе PBS («1» по оси абсцисс на фигуре).
Фиг. 5 представляет собой график, демонстрирующий результаты анализа выживаемости клеток, когда hMSC-BM сохраняли в течение 14 дней с использованием каждого из 11 растворов для трансплантации клеток млекопитающих (растворов S, LR, LRD, LRTD, «LRD + GL», «LRD + SR», «LRD + MN», «LRD + LC», «LRD + RF», «LRD + ML» и «LRD + SC»: см. раздел «3-1-1 Раствор для трансплантации клеток» в примере 3). По оси ординат показана процентная доля живых клеток от общего количества клеток в качестве степени выживаемости клеток (%) (среднее ± стандартное отклонение [n=4]). «*» на фигуре указывает на наличие статистически значимого отличия (P < 0,05) относительно LRD согласно критерию Даннета.
Фиг. 6 представляет собой график, демонстрирующий результаты анализа выживаемости клеток, когда hMSC-BM сохраняли в течение 14 дней с использованием каждого из 11 растворов для трансплантации клеток млекопитающих (растворов S, LR, LRT, LRTD, «LRT + GL», «LRT + SR», «LRT + MN», «LRT + LC», «LRT + RF», «LRT + ML» и «LRT + SC»: см. раздел «4-1-1 Раствор для трансплантации клеток» в примере 4). По оси ординат показана процентная доля живых клеток от общего количества клеток в качестве степени выживаемости клеток (%) (среднее ± стандартное отклонение [n=4]). «*» на фигуре указывает на наличие статистически значимого отличия (P<0,05) относительно LRT согласно критерию Даннета.
Фиг. 7 представляет собой график, демонстрирующий результаты анализа выживаемости клеток, когда hMSC-BM сохраняли в течение 14 дней с использованием каждого из 11 растворов для трансплантации клеток млекопитающих (растворов S [нормальный солевой раствор Otsuka], LR [инъекция Lactec], LRD [содержащая 5% (масс./об.) декстрана инъекция Lactec], LRT [содержащая 3% (масс./об.) трегалозы инъекция Lactec], «LR + GL» [содержащая глюкозу инъекция Lactec], «LR + SR» [содержащая сорбит инъекция Lactec], «LR + MN» [содержащая маннит инъекция Lactec], «LR + LC» [содержащая лактозу инъекция Lactec], «LR + RF» [содержащая рафинозу инъекция Lactec], «LR + ML» [содержащая мальтозу инъекция Lactec] и «LR + SC» [содержащая сахарозу инъекция Lactec]). По оси ординат показана процентная доля живых клеток от общего количества клеток в качестве степени выживаемости клеток (%) (среднее ± стандартное отклонение [n=4]). «***» на фигуре указывает на наличие статистически значимого отличия (P<0,001) относительно LR согласно критерию Даннета.
Фиг. 8 представляет собой график, демонстрирующий результаты анализа выживаемости клеток, когда hMSC-BM сохраняли в течение 14 дней с использованием каждого из 10 растворов для трансплантации клеток млекопитающих (растворов LR, LRTD, S, STD, 5% глюкоза, 5% глюкоза TD, Рингера, Рингера TD, Veen и Veen TD: см. раздел «5-1-1 Раствор для трансплантации клеток» в примере 5). По оси ординат показана процентная доля живых клеток от общего количества клеток в качестве степени выживаемости клеток (%) (среднее ± стандартное отклонение [n=4]). В качестве контроля показана степень выживаемости клеток до сохранения в растворе PBS («P» по оси абсцисс на фигуре).
Фиг. 9 представляет собой график, демонстрирующий результаты анализа выживаемости клеток, когда hPBT сохраняли в течение 1 дня, 3 дней, 7 дней и 14 дней с использованием каждого из 5 растворов для трансплантации клеток млекопитающих (S, LR, LRT, LRD и LRTD). По оси ординат показана процентная доля живых клеток от общего количества клеток в качестве степени выживаемости клеток (%) (среднее ± стандартное отклонение [n=6]). В качестве контроля показана степень выживаемости клеток до сохранения (0 дней после сохранения) в растворе PBS («P» по оси абсцисс на фигуре).
Способ осуществления изобретения
Способ сохранения клеток млекопитающего по настоящему изобретению представляет собой способ с ограниченным применением «для использования в трансплантации клеток», что включает сохранение клеток млекопитающего в физиологическом водном растворе, содержащем 2,0-6,0% (масс./об.) трегалозы и 4,0-7,0% (масс./об.) декстрана (настоящий раствор для трансплантации клеток); более конкретно, настоящий раствор для трансплантации клеток содержит трегалозу и декстран в качестве активных ингредиентов для подавления уменьшения выживаемости клеток. Плотность клеток млекопитающего, сохраняемых в настоящем растворе для трансплантации клеток, находится, как правило, в диапазоне от 103 до 1010 клеток/мл.
В случае настоящего раствора, содержащего клетки для трансплантации, клетки млекопитающего, как правило, находятся в настоящем растворе для трансплантации клеток. Настоящий раствор, содержащий клетки для трансплантации, можно получать путем добавления клеток млекопитающего в настоящий раствор для трансплантации клеток или путем добавления трегалозы до концентрации 2,0-6,0% (масс./об.) и декстрана до концентрации 4,0-7,0% (масс./об.) в физиологический водный раствор, содержащий клетки млекопитающего.
Примеры млекопитающего по настоящему изобретению могут включать грызуна, такого как мышь, крыса, хомяк или морская свинка, зайцеобразного, такого, как кролик, копытного, такого как свинья, корова, коза, лошадь или овца, хищника, такого как собака или кошка, и примата, такого как человек, обезьяна, макака-резус, яванский макак, мартышка, орангутан или шимпанзе; в частности, предпочтительные примеры могут включать мышь, свинью и человека.
Физиологический водный раствор, используемый для настоящего раствора для трансплантации клеток и настоящего раствора, содержащего клетки для трансплантации, не имеет конкретных ограничений при условии, что он представляет собой изотонический водный раствор, в котором концентрацию соли, сахара и тому подобного доводят при помощи натрия, калия и тому подобного таким образом, чтобы обеспечивать почти такое же осмотическое давление, как осмотическое давление жидкостей организма или клеточной жидкости. Конкретные примеры растворов могут включать солевой раствор, солевые растворы, имеющие буферные свойства (фосфатно-солевой буфер [PBS], трис-буферный солевой раствор [TBS] и HEPES-буферный солевой раствор), раствор Рингера, раствор Рингера-лактат, раствор Рингера-ацетат, раствор Рингера-бикарбонат, 5% водный раствор глюкозы, минимальные среды для культивирования животных клеток (DMEM, EMEM, RPMI-1640, α-MEM, F-12, F-10, M-199 и тому подобное) и изотонические средства (глюкозу, D-сорбит, D-маннит, лактозу, хлорид натрия и тому подобное); в частности, предпочтительным является раствор, выбранный из группы, состоящей из раствора Рингера-лактата, солевого раствора, раствора Рингера и раствора Рингера-ацетата; особенно предпочтительным является раствор Рингера-лактат или солевой раствор. Физиологический водный раствор может быть коммерчески доступным или полученным самостоятельно раствором. Примеры коммерчески доступного раствора могут включать нормальный солевой раствор Otsuka (от компании Otsuka Pharmaceutical Factory Co., Ltd.) (солевой раствор), раствор Рингера «Otsuka» (от компании Otsuka Pharmaceutical Factory Co., Ltd.) (раствор Рингера), инъекцию Lactec (R) (от компании Otsuka Pharmaceutical Factory Co., Ltd.) (раствор Рингера-лактат), инфузию Veen F (от компании Kowa Pharmaceutical Co., Ltd.) (раствор Рингера-ацетат), инъекцию 5% глюкозы Otsuka (от компании Otsuka Pharmaceutical Factory Co., Ltd.) (5% водный раствор глюкозы) и инфузию Bicanate (от компании Otsuka Pharmaceutical Factory Co., Ltd.) (раствор Рингера-бикарбонат). Используемый в настоящем документе термин «изотонический» означает имеющий осмотическое давление в диапазоне от 250 до 380 мОсм/л.
Настоящий раствор для трансплантации клеток и настоящий раствор, содержащий клетки для трансплантации, можно должным образом дополнять добавками, такими как стабилизатор (например, человеческий сывороточный альбумин или полиэтиленгликоль), буфер (например, фосфатный буфер или натрий-ацетатный буфер), хелатирующий агент (например, ЭДТА, ЭГТА, лимонная кислота или салицилат), аминокислота (например, заменимая аминокислота, такая как глютамин, аланин, аспарагин, серин, аспарагиновая кислота, цистеин, глютаминовая кислота, глицин, пролин или тирозин), витамин (например, холина хлорид, пантотеновая кислота, фолиевая кислота, никотинамид, пиридоксаль гидрохлорид, рибофлавин, тиамина гидрохлорид, аскорбиновая кислота, биотин или инозитол), солюбилизатор, консервант и антиоксидант.
Период хранения, в течение которого клетки млекопитающего сохраняют в настоящем растворе для трансплантации клеток, может представлять собой время (период), достаточное для подавления уменьшения выживаемости клеток и повышения процентной доли живых клеток, и составляет, например, 12 часов или более, 1 день или более, 2 дня или более, 3 дня или более, либо 7 дней или более. Поскольку слишком долгий период сохранения клеток млекопитающего может отрицательно влиять на выживаемость клеток, данный период, как правило, составляет 21 день или менее, предпочтительно 16 дней или менее, более предпочтительно 14 дней или менее, с тем, чтобы избежать неблагоприятного эффекта на выживаемость клеток. Таким образом, период сохранения составляет, как правило, от 12 часов до 21 дня, от 1 до 21 дня, от 2 до 21 дня, от 3 до 21 дня или от 7 до 21 дня, предпочтительно от 12 часов до 16 дней, от 1 до 16 дней, от 2 до 16 дней, от 3 до 16 дней или от 7 до 16 дней, более предпочтительно от 12 часов до 14 дней, от 1 до 14 дней, от 2 до 14 дней, от 3 до 14 дней или от 7 до 14 дней, наиболее предпочтительно от 3 до 14 дней. Подавление гибели клеток млекопитающего, сохраняемых в настоящем растворе для трансплантации клеток, можно подтверждать известным методом, позволяющим определять гибель клеток, таким как метод окрашивания трипановым синим, метод TUNEL, метод Nexin или метод FLICA.
Температура хранения, при которой клетки млекопитающего сохраняют в настоящем растворе для трансплантации клеток, может представлять собой температуру, при которой раствор для трансплантации клеток не замерзает и клетки являются жизнеспособными, и она находится в диапазоне, как правило, от 0 до 37°C, предпочтительно от 0 до 25°C (комнатная температура).
Примеры трегалозы в качестве описанной выше трегалозы могут включать α,β-трегалозу в виде дисахарида, в котором молекулы α-глюкозы и β-глюкозы связаны 1,1-гликозидной связью, и β,β-трегалозу в виде дисахарида, в котором 2 молекулы β-глюкозы связаны 1,1-гликозидной связью, в дополнение к α,α-трегалозе в виде дисахарида, в котором 2 молекулы α-глюкозы связаны 1,1-гликозидной связью; в частности, α,α-трегалоза является предпочтительной. Эти трегалозы можно получать любым из известных методов, таким как химический синтез, продуцировать с помощью микроорганизмов и продуцировать с помощью ферментов; однако также можно использовать коммерчески доступные соединения. Примеры трегалозы могут включать α,α-трегалозу (от компании Hayashibara Co., Ltd.) и α,α-трегалозу (от компании Wako Pure Chemical Industries Ltd.).
Производное трегалозы в качестве описанной выше трегалозы не имеет конкретных ограничений при условии, что оно является одним из гликозилтрегалоз, в которых одна или более сахаридных единиц связаны с трегалозой в виде дисахарида; гликозилтрегалозы включают гликозилтрегалозу, мальтозилтрегалозу и мальтотриозилтрегалозу.
Примеры соли трегалозы или ее производного в качестве описанной выше трегалозы могут включать кислотно-аддитивную соль, такую как гидрохлорид, гидробромат, гидроиодид, фосфат, нитрат, сульфат, ацетат, пропионат, толуолсульфонат, сукцинат, оксалат, лактат, тартрат, гликолят, метансульфонат, бутират, валерат, цитрат, фумарат, малеат, и малат; соль металла, такую как соль натрия, соль калия и соль кальция; соль аммония и соль алкиламмония. Каждую из этих солей используют в форме раствора в момент использования, и их действие предпочтительно имеет такую же эффективность, что и действие трегалозы. Эти соли могут образовывать гидраты или сольваты, и могут быть использованы отдельно или в надлежащем сочетании двух или более из них.
Декстран в качестве описанного выше декстрана не имеет конкретных ограничений при условии, что он представляет собой полисахарид (C6H10O5)n, состоящий из D-глюкозы, имеющий α 1 → 6 связь в основной цепи, и примеры декстрана могут включать декстран 40 (средневесовая молекулярная масса (Mw) = 40000) и декстран 70 (Mw=70000). Эти декстраны можно получать любым из известных методов, таким как химический синтез, продуцировать с помощью микроорганизмов и продуцировать с помощью ферментов; однако также можно использовать коммерчески доступные соединения. Примеры декстрана могут включать коммерческие продукты, такие как инъекция низкомолекулярного декстрана L (от компании Otsuka Pharmaceutical Factory Co., Ltd.) и декстран 70 (от компании Tokyo Kasei Kogyo Co., Ltd.).
Примеры производного декстрана в качестве описанного выше декстрана включают сульфат декстрана, карбоксилированный декстран и диэтиламиноэтил (ДЭАЭ)-декстран.
Примеры соли декстрана и ее производного в качестве описанного выше декстрана могут включать кислотно-аддитивную соль, такую как гидрохлорид, гидробромат, гидроиодид, фосфат, нитрат, сульфат, ацетат, пропионат, толуолсульфонат, сукцинат, оксалат, лактат, тартрат, гликолят, метансульфонат, бутират, валерат, цитрат, фумарат, малеат и малат; соль металла, такую как соль натрия, соль калия и соль кальция; соль аммония и соль алкиламмония. Каждую из этих солей используют в форме раствора в момент использования, и их действие предпочтительно имеет такую же эффективность, что и действие декстрана. Эти соли могут образовывать гидраты или сольваты, и могут быть использованы отдельно или в надлежащем сочетании двух или более из них.
Примеры клеток млекопитающего по настоящему изобретению могут включать клетки панкреатических островков млекопитающего, вводимые внутривенно пациентам с диабетом I типа, и дендритные клетки млекопитающего, клетки - естественные киллеры (NK), T-клетки (например, альфа/бета (αβ) T-клетки, гамма/дельта (γδ) T-клетки, цитотоксические T-лимфоциты (CTL) и хелперные T-клетки), макрофаги и лейкоциты (например, нейтрофилы и эозинофилы), вводимые внутривенно онкологическим пациентам, в дополнение к стволовым клеткам млекопитающего, вводимым через кровеносный сосуд в регенеративной медицине, или тому подобное; предпочтительными являются T-клетки. Эти клетки можно выделять известными общими методами. Например, лейкоциты, T-клетки, T-хелперы, цитотоксические T-клетки и γδ T-клетки можно выделять из образца подвергнутой гемодиализу периферической крови или пуповинной крови с использованием клеточного сортера с возбуждением флуоресценции (FACS) при помощи антител к поверхностному маркеру лейкоцитов (CD45), поверхностному маркеру T-клеток (CD3), поверхностному маркеру T-хелперов (CD4), поверхностному маркеру цитотоксических T-клеток (CD8) и поверхностному маркеру γδ T-клеток (CD39), либо с использованием автоматического магнитного сепаратора клеток (autoMACS) при помощи антител к клеточным поверхностным маркерам, меченых маркирующим веществом, таким как флуоресцентное вещество, биотин или авидин, и конъюгированного с гранулой MACS (магнитной гранулой) антитела к маркирующему веществу. Примеры маркирующего вещества могут включать аллофикоцианин (APC), фикоэритрин (PE), FITC (флуоресцеин изотиоцианат), Alexa Fluor 488, Alexa Fluor 647, Alexa Fluor 700, PE-Texas Red, PE-Cy5 и PE-Cy7.
Термин «стволовые клетки» означает незрелые клетки, имеющие способность к самообновлению и способность к дифференциации/пролиферации. Стволовые клетки включают такие субпопуляции, как плюрипотентные стволовые клетки, полипотентные стволовые клетки или унипотентные стволовые клетки, в зависимости от способности к дифференциации. Плюрипотентные стволовые клетки представляют собой клетки, которые, как таковые, не могут становиться индивидуальным организмом, но обладают способностью к дифференциации во все ткани или клетки, составляющие живой организм. Полипотентные стволовые клетки представляют собой клетки, обладающие способностью к дифференциации во многие, но не во все, типы тканей или клеток. Унипотентные стволовые клетки представляют собой клетки, обладающие способностью к дифференциации в конкретную ткань или клетку.
Примеры плюрипотентных стволовых клеток могут включать эмбриональные стволовые клетки (ES клетки), EG клетки и iPS клетки. ES клетки можно получать путем культивирования внутренней клеточной массы на фидерных клетках или в среде, содержащей LIF. Способ получения ES клеток описан, например, в WO 96/22362, WO 02/101057, US 5843780, US 6200806 или US 6280718. EG клетки можно получать путем культивирования примордиальных зародышевых клеток в среде, содержащей mSCF, LIF, и bFGF (Cell, 70: 841-847, 1992). iPS клетки можно получать путем введения факторов перепрограммирования, таких как Oct3/4, Sox2, Klf4 (и, необязательно, дополнительно c-Myc или n-Myc), в соматические клетки (например, фибробласты или клетки кожи) (Cell, 126: p. 663-676, 2006; Nature, 448: p. 313-317, 2007; Nat. Biotechno1, 26: p. 101-106, 2008; Cell, 131: p. 861-872, 2007; Science, 318: p. 1917-1920, 2007; Cell Stem Cells, 1: p. 55-70, 2007; Nat. Biotechnol, 25: p. 1177-1181, 2007; Nature, 448: p. 318-324, 2007; Cell Stem Cells, 2: p. 10-12, 2008; Nature, 451: p. 141-146, 2008; Science, 318: p. 1917-1920, 2007). Стволовые клетки, полученные путем культивирования ранних эмбрионов, созданных за счет трансплантации ядра соматических клеток, также предпочтительны в качестве плюрипотентных стволовых клеток (Nature, 385, 810 (1997); Science, 280, 1256 (1998); Nature Biotechnology, 17, 456 (1999); Nature, 394, 369 (1998); Nature Genetics, 22, 127 (1999); Proc. Natl. Acad. Sci. USA., 96, 14984 (1999)), а также Rideout III et al. (Nature Genetics, 24, 109 (2000)).
Примеры полипотентных стволовых клеток включают мезенхимальные стволовые клетки, способные дифференцироваться в такие клетки, как адипоцит, остеоцит, хондроцит и адипоцит, гемопоэтические предшественники, способные дифференцироваться в гематоциты, такие как лейкоцит, эритроцит и тромбоцит, нервные стволовые клетки, способные дифференцироваться в такие клетки, как нейрон, астроцит и олигодендроцит, и соматические стволовые клетки, такие как миелоидная стволовая клетка и зародышевая стволовая клетка. Полипотентные стволовые клетки предпочтительно являются мезенхимальными стволовыми клетками. Мезенхимальные стволовые клетки представляют собой стволовые клетки, способные дифференцироваться во все или некоторые из остеобласта, хондробласта и липобласта. Полипотентные стволовые клетки можно выделять из живого организма способами, известными как таковые. Например, мезенхимальные стволовые клетки можно собирать из костного мозга, жировой ткани, периферической крови, пуповинной крови и тому подобного у млекопитающих известными общими методами. Например, человеческие мезенхимальные стволовые клетки можно выделять путем культивирования и пересева гемопоэтических стволовых клеток или тому подобного после пункции костного мозга (Journal of Autoimmunity, 30 (2008) 163-171). Полипотентные стволовые клетки также можно получать путем культивирования вышеописанных плюрипотентных стволовых клеток в подходящих условиях индукции. Мезенхимальные стволовые клетки предпочтительно являются мезенхимальными стволовыми клетками, полученными из костного мозга человека.
Примеры клеток млекопитающего по настоящему изобретению могут включать прикрепляющиеся клетки. Используемый в настоящем документе термин «прикрепляющиеся» клетки означает зависящие от подложки клетки, способные выживать, пролиферировать и продуцировать вещества, будучи прикрепленными к подложке. Примеры прикрепляющихся стволовых клеток могут включать плюрипотентные стволовые клетки, мезенхимальные стволовые клетки, нервные стволовые клетки, миелоидные стволовые клетки и зародышевые стволовые клетки. Прикрепляющиеся стволовые клетки предпочтительно являются мезенхимальными стволовыми клетками или плюрипотентными стволовыми клетками.