Антитело к pd-1 и его применение
Иллюстрации
Показать всеНастоящее изобретение относится к области иммунологии. Предложены антитело и его функциональный фрагмент, способные к связыванию с PD-1. Также рассмотрена молекула нуклеиновой кислоты, кодирующая антитело или его фрагмент, экспрессионный вектор, клетка-хозяин и способ получения антитела или его функционального фрагмента. Кроме того, описан иммуноконъюгат и фармацевтическая композиция, а также способ лечения заболеваний, ассоциированных с PD-1. Данное изобретение может найти дальнейшее применение в терапии различных состояний, в частности различных видов рака, инфекционных и воспалительных заболеваний. 8 н. и 6 з.п. ф-лы, 13 ил., 14 пр.
Реферат
ПРЕДПОСЫЛКИ ДЛЯ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[0001] Уровень техники
[0002] Данное изобретение принадлежит к области биомедицины и относится к антителу (антителам) или его функциональному фрагменту (их функциональным фрагментам), которые с высокой степенью аффинности специфически связываются с PD-1. Оно также обеспечивает молекулу (молекулы), кодирующие антитело (антитела) или его фрагмент (их фрагменты) в соответствии с настоящим изобретением, экспрессионный вектор (экспрессионные векторы) и клетки для экспрессирования антитела (антител) или его функционального фрагмента (их функциональных фрагментов) в соответствии с настоящим изобретением, а также способ (способы) получения антитела (антител) или его функционального фрагмента (функциональных фрагментов) в соответствии с настоящим изобретением. Настоящее изобретение также обеспечивает иммуноконъюгат (иммуноконъюгаты) и фармацевтическую композицию (фармацевтические композиции), содержащие антитела или их функциональные фрагменты в соответствии с настоящим изобретением, а также способ (способы) лечения множества заболеваний (включая рак (виды рака), инфекционное заболевание (инфекционные заболевания) и воспалительное заболевание (воспалительные заболевания)), с использованием антитела (антител) или его функционального фрагмента (их функциональных фрагментов) в соответствии с настоящим изобретением.
[0003] Описание предшествующего уровня техники
[0004] Белок программируемой смерти клеток 1, PD-1, является членом семейства CD28 и иммунодепрессивных рецепторов, которые экспрессируются на поверхностях активированных Т- и В-клеток (Yao, Zhu et al. Advances in targeting cell surface signalling molecules for immune modulation. Nat Rev Drug Discov, 2013,12(2): 130-146). Этот рецептор может связываться со своими лигандами, PD-L1 и PD-L2, чтобы эффективно уменьшать иммунную реакцию привлеченных иммунных Т-клеток. Опухолевые клетки избегают иммунного надзора внутри тела из-за высокого экспрессирования PD-L1 (Okazaki and Honjo, PD-1 and PD-1 ligands: from discovery to clinical application. International Immunology, 2007, 19(7): 813-824 2007). Взаимодействие между PD1 и PD-L1 может быть заблокировано, чтобы очевидно улучшить активность CD8+ цитотоксических Т-клеток в отношении уничтожения опухолевые клетки.
[0005] В основном PD-1 экспрессируются на поверхности CD4+ Т-клеток, CD8+ Т-клеток, клеток NKT, В-клеток и активированных моноцитов. В основном его экспрессирование индуцируется сигналами Т-клеточного рецептора (TCR) или B-клеточного рецептора (BCR). Фактор некроза опухолей (TNF) может повысить экспрессирование PD-1 на поверхности таких клеток (Francisco, Sage et al., The PD-1 pathway in tolerance and autoimmunity. Immunol Rev, 2010, 236: 219-242). Человеческий PD-1, кодируемый геном Pdcd1, расположен на участке хромосомы 2q37.3 общей длиной 9,6 т.п.о. Он включает в себя пять экзонов и четыре интрона, а часть, расположенная против хода транскрипции, содержит промотор размером 663 п. о. Молекулярная структура PD-1 включает внеклеточный, трансмембранный и внутриклеточный участки. Аминокислотная последовательность (аминокислотные последовательности) во внеклеточной области имеет 24% гомологию с CTLA-4 и 28% гомологию с CD28. Ее ген имеет в основном семь сайтов однонуклеотидного полиморфизма. Внеклеточная область включает в себя один структурный домен вариабельной цепи иммуноглобулина IgV. Внутриклеточная область включает в себя два мотива сигнальной трансдукции на основе тирозина - ITIM (иммунорецепторного тирозинового ингибирующего мотива) и ITSM (иммунорецепторного тирозинового переключающего мотива). После активации Т-клеток, PD-1 собирает тирозин фосфатазы SHP2, главным образом, через мотив ITSM, что приводит к дефосфорилированию эффекторных молекул, включая CD3ζ, PKCθ и ZAP70 и т.д.
[0006] Существует два лиганда для PD-1: PD-L1 и PD-L2. PD-L1 также называется B7H1 или CD274, а PD-L2 называется B7DC или CD273. Ген PD-L расположен в локусе 9p24.2 хромосомы человека размером 42 т.п.о. Эти лиганды имеют 21~27%-ную гомологию аминокислотной последовательности и структурное сходство с В7-1, В7-2 и ICOSL: все они содержат по одному структурному домену иммуноглобулин-подобного вариабельного участка, по одному структурному домену константного участка, по одному трансмембранному участку и по одному короткому цитоплазматическому хвосту. Цитоплазматический хвост PD-L1 более консервативен, чем PD-L2. PD-L1 и PD-L2 экспрессируются в разных клеточных популяциях (Shimauchi, Kabashima et al., Augmented expression of programmed death-1 in both neoplastic and non-neoplastic CD4+ T cells in adult T cell leukemia/lymphoma. Int J Cancer, 2007, 121(12): 2585-2590). И эти клетки включают негемопоэтическую ткань и различные типы опухолей. В основном PD-L1 экспрессируется на Т-клетках, В-клетках, дендритных клетках, макрофагах, мезенхимальных стволовых клетках и тучных клетках, происходящих из костного мозга. PD-L1 также экспрессируется на клетках, не происходящих из костного мозга, таких как эндотелиальные клетки сосудов, клетки эпителия, клетки скелетных мышц, гепатоциты, эпителиальные клетки почечных канальцев, инсулоциты, астроциты головного мозга и разные типы нелимфоидных опухолей, такие как меланома, рак печени, рак желудка, почечно-клеточная карцинома. Он также экспрессируется на клетках иммунологически привилегированных сайтов, таких как плацента, глаза. Это дает основания полагать, что PD-L1 может до определенной степени существенно регулировать аутореактивные Т-клетки, В-клетки и иммунологическую толерантность, а также может играть определенную роль в реакции периферических тканей Т-клеток и В-клеток. Тем не менее, PD-L2 имеет очень ограниченный участок экспрессии и существует только в макрофагах и дендритных клетках. Считается, что он играет важную роль в основном в иммунном презентировании.
[0007] PD-1 и PD-L1 взаимодействуют друг с другом, чтобы регулировать и контролировать активацию Т-клеток, что было подтверждено у множества опухолей и вирусных инфекций. PD-L1 экспрессируется на поверхностях различных опухолевых клеток, которые включают рак легкого, рак печени, рак яичника, рак шейки матки, рак кожи, рак мочевого пузыря, рак толстого кишечника, рак молочной железы, глиому, рак почки, рак желудка, рак пищевода, плоскоклеточный рак полости рта, рак головы/шеи. Кроме того, существует большое количество CD8+ Т-клеток, экспрессирующих PD-L1, выявленных при этих видах рака. Клиническая статистика показала, что высокий уровень экспрессии PD-L1 на раковых клетках связан с неблагоприятным прогнозом для пациентов со злокачественными новообразованиями (Okazaki and Honjo 2007. Там же).
[0008] Многие вирусы, вызывающие хронические и острые инфекции, также избегают иммунного надзора организма посредством сигналов PD-1 и PD-L1. Например, уровень экспрессирования PD-1 у ВИЧ-инфицированных пациентов тесно связан со степенью истощения Т-клеток и может быть использован в качестве одного из маркеров прогрессирования СПИДа (Trabattoni, Saresella et al., B7-H1 is up-regulated in HIV infection and is a novel surrogate marker of disease progression. Blood, 2003, 101(7): 2514-2520). То же самое происходит у пациентов с хроническим гепатитом В (Evans, Riva et al., Programmed death 1 expression during antiviral treatment of chronic hepatitis B: Impact of hepatitis B e-antigen seroconversion., Hepatology, 2008, 48(3): 759-769). Исследования на животных показали, что мыши, чей ген PD-1 нокаутирован, могут контролировать вирусную инфекцию лучше, чем обычные мыши; и гепатит может быть вызван путем переноса HBV-специфических Т-клеток трансгенным животным с вирусом гепатита В.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0009] Настоящее изобретение относится к антителу (антителам) к PD-1 и их функциональному фрагмента (функциональным фрагментам), которые могут связываться с белком программируемой смерти клеток (PD 1).
[0010] С одной стороны, в соответствии с настоящим изобретением антитело (антитела) или их функциональный фрагмент (функциональные фрагменты) содержат CDR тяжелой цепи, выбранный из аминокислотной последовательности с SEQ ID NO: 1, 2, 3, 7, 8, 9, 13, 14, 15 или любого варианта указанной последовательности, и/или CDR легкой цепи, выбранный из аминокислотной последовательности с SEQ ID NO: 4, 5, 6, 10, 11, 12,16, 17, 18 или любого варианта указанной последовательности.
[0011] В некоторых предпочтительных вариантах осуществления аминокислотные последовательности CDR1, CDR2 и CDR3 тяжелой цепи указанного антитела (указанных антител) или их функционального фрагмента (функциональных фрагментов) выбраны из каких-либо следующих групп разных аминокислотных последовательностей или их вариантов:
| HCDR1 | HCDR2 | HCDR3 | |
| A | SEQ ID NO:1 | SEQ ID NO:2 | SEQ ID NO:3 |
| B | SEQ ID NO:7 | SEQ ID NO:8 | SEQ ID NO:9 |
| C | SEQ ID NO:13 | SEQ ID NO:14 | SEQ ID NO:15 |
,
и/или аминокислотные последовательности CDR1, CDR2 и CDR3 легкой цепи, выбраны из какой-либо из следующих групп разных аминокислотных последовательностей или их вариантов:
| LCDR1 | LCDR2 | LCDR3 | |
| A | SEQ ID NO:4 | SEQ ID NO:5 | SEQ ID NO:6 |
| B | SEQ ID NO:10 | SEQ ID NO:11 | SEQ ID NO:12 |
| C | SEQ ID NO:16 | SEQ ID NO:17 | SEQ ID NO:18 |
.
В некоторых предпочтительных вариантах осуществления в соответствии с настоящим изобретением аминокислотные последовательности CDR1, CDR2 и CDR3 тяжелой цепи, а также CDR1, CDR2 и CDR3 легкой цепи антитела (антител) или их функционального фрагмента (функциональных фрагментов) выбраны из следующих групп разных аминокислотных последовательностей или их вариантов:
| HCDR1 | HCDR2 | HCDR3 | LCDR1 | LCDR2 | LCDR3 | |
| A | SEQ ID NO:1 | SEQ ID NO:2 | SEQ ID NO:3 | SEQ ID NO:4 | SEQ ID NO:5 | SEQ ID NO:6 |
| B | SEQ ID NO:7 | SEQ ID NO:8 | SEQ ID NO:9 | SEQ ID NO:10 | SEQ ID NO:11 | SEQ ID NO:12 |
| C | SEQ ID NO:13 | SEQ ID NO:14 | SEQ ID NO:15 | SEQ ID NO:16 | SEQ ID NO:17 | SEQ ID NO:18 |
.
[0012] В некоторых вариантах осуществления в соответствии с настоящим изобретением антитело (антитела) или его функциональный фрагмент (функциональные фрагменты) содержат вариабельный участок (вариабельные участки) тяжелой цепи, выбранные из аминокислотной последовательности с SEQ ID NO: 19, 21, 23 или любого варианта указанной последовательности, и/или вариабельный участок (вариабельные участки) легкой цепи, выбранные из аминокислотной последовательности с SEQ ID NO: 20, 22, 24 или любого варианта указанной последовательности.
[0013] В одном предпочтительном варианте осуществления указанный вариабельный участок (указанные вариабельные участки) тяжелой цепи представляет собой SEQ ID NO: 19 или ее вариант, а указанный вариабельный участок (указанные вариабельные участки) легкой цепи представляет собой SEQ ID NO: 20 или ее вариант.
[0014] В другом более предпочтительном варианте осуществления указанный вариабельный участок (указанные вариабельные участки) тяжелой цепи представляет собой SEQ ID NO: 21 или ее вариант, а указанный вариабельный участок (указанные вариабельные участки) легкой цепи представляет собой SEQ ID NO: 22 или ее вариант.
[0015] В другом более предпочтительном варианте осуществления указанный вариабельный участок (указанные вариабельные участки) тяжелой цепи представляет собой SEQ ID NO: 23 или ее вариант, а вариабельный участок (вариабельные участки) легкой цепи представляет собой SEQ ID NO: 24 или ее вариант.
[0016] В соответствии с настоящим изобретением антитело (антитела) или его функциональный фрагмент (их функциональные фрагменты) может являться химерным антителом, гуманизированным антителом или полностью человеческим антителом.
[0017] В соответствии с настоящим изобретением антитело (антитела) или его функциональный фрагмент (функциональные фрагменты) могут являться гуманизированными. Способ (способы) получения гуманизированного антитела обычно известны специалистам в данной области. Например, последовательность CDR в соответствии с настоящим изобретением может быть перенесена в вариабельный участок человеческого антитела для получения гуманизированного антитела к PD-1 по настоящему изобретению. Указанное гуманизированное антитело не будет вызывать реакцию антиантитела (AAR) и реакцию человеческого антитела к мышиному антигену (HAMA), и не будет быстро удаляться из-за нейтрализации антиантителом, а будет играть роль в иммунологическогом эффекте, таком как ADCC и CDC.
[0018] В некоторых предпочтительных вариантах осуществления в соответствии с настоящим изобретением гуманизированное антитело (антитела) к PD-1 или его функциональный фрагмент (их функциональные фрагменты) содержат вариабельный участок (вариабельные участки) тяжелой цепи, выбранные из аминокислотной последовательности с SEQ ID NO: 33, 35, 36 или какого-либо варианта указанной последовательности, и/или вариабельный участок (вариабельные участки) легкой цепи, выбранные из аминокислотной последовательности с SEQ ID NO: 34, 37 или любого варианта вышеуказанной последовательности.
[0019] В одном предпочтительном варианте осуществления гуманизированного антитела (гуманизированных антител) или его функционального фрагмента (их функциональных фрагментов) в соответствии с настоящим изобретением вышеуказанный вариабельный участок (вариабельные участки) тяжелой цепи представляет собой SEQ ID NO: 33 или ее вариант, а указанный вариабельный участок (вариабельные участки) легкой цепи представляет собой SEQ ID NO: 34 или ее вариант.
[0020] В другом предпочтительном варианте осуществления гуманизированного антитела (гуманизированных антител) или его функционального фрагмента (их функциональных фрагментов) в соответствии с настоящим изобретением указанный вариабельный участок (вариабельные участки) тяжелой цепи представляет собой SEQ ID NO: 35 или ее вариант, а указанный вариабельный участок (вариабельные участки) легкой цепи представляет собой SEQ ID NO: 34 или ее вариант.
[0021] В другом предпочтительном варианте осуществления гуманизированного антитела (гуманизированных антител) или его функционального фрагмента (их функциональных фрагментов) в соответствии с настоящим изобретением указанный вариабельный участок (вариабельные участки) тяжелой цепи представляет собой SEQ ID NO: 36 или ее вариант, а указанный вариабельный участок (вариабельные участки) легкой цепи представляет собой SEQ ID NO: 34 или ее вариант.
[0022] В другом более предпочтительном варианте осуществления гуманизированного антитела (гуманизированных антител) или его функционального фрагмента (их функциональных фрагментов) в соответствии с настоящим изобретением указанный вариабельный участок (вариабельные участки) тяжелой цепи представляет собой SEQ ID NO: 35 или ее вариант, а указанный вариабельный участок (вариабельные участки) легкой цепи представляет собой SEQ ID NO: 37 или ее вариант.
[0023] Настоящее изобретение также обеспечивает отдельную молекулу нуклеиновой кислоты (отдельные молекулы нуклеиновой кислоты), кодирующую антитело (антитела) или его функциональный фрагмент (их функциональные фрагменты) в соответствии с настоящим изобретением. В одном из предпочтительных вариантов осуществления указанная молекула нуклеиновой (молекулы нуклеиновой кислоты) содержит нуклеотидные последовательности, изложенные в SEQ ID NO: 25-30, 38-42, или их комбинацию.
[0024] Настоящее изобретение также обеспечивает экспрессионный вектор (экспрессионные векторы), содержащий указанную молекулу нуклеиновой кислоты (молекулы нуклеиновой кислоты), а также клетку-хозяина (клетки-хозяева), содержащую указанный экспрессионный вектор (экспрессионные векторы).
[0025] Настоящее изобретение обеспечивает способ (способы) получения антитела (антител) к PD-1 или его функционального фрагмента (их функциональных фрагментов), который включает культивирование указанной клетки-хозяина (клеток-хозяев) в соответствии с настоящим изобретением в условиях, которые обеспечивают продуцирование указанного антитела (указанных антител) или его функционального фрагмента (функциональных фрагментов), а также выделение указанного антитела (антител) или его функционального фрагмента (их функциональных фрагментов), полученного таким образом.
[0026] С другой стороны, настоящее изобретение относится к иммуноконъюгату (иммуноконъюгатам), содержащему антитело (антитела) или его функциональный фрагмент (их функциональные фрагменты) в соответствии с настоящим изобретением, которые связанны с терапевтическим средством (терапевтическими средствами). Указанное терапевтическое средство (терапевтические средства) предпочтительно является токсином, радиизотопом, лекарственным средством или цитотоксическим средством.
[0027] Настоящее изобретение также относится к фармацевтической композиции, содержащей (антитело) антитела или его функциональный фрагмент (их функциональные фрагменты) в соответствии с настоящим изобретением, а также фармацевтический носитель (фармацевтические носители).
[0028] С другой стороны, настоящее изобретение обеспечивает способ (способы), применяемый для профилактики или лечения заболеваний или состояний путем устранения, подавления или снижения активности PD-1, который включает введение нуждающемуся пациенту эффективной лечебной дозы антитела (антител) или его функционального фрагмента (их функциональных фрагментов) в соответствии с настоящим изобретением, нуклеиновой кислоты, экспрессионного вектора, клетки-хозяина, иммуноконъюгата или фармацевтической композиции, где указанные заболевания или состояния выбраны из видов рака, инфекционных заболеваний или воспалительных заболеваний, при этом указанные виды рака предпочтительно выбраны из меланомы, рака почки, рака предстательной железы, рака молочной железы, рака толстого кишечника, рака легкого, рака кости, рака поджелудочной железы, рака кожи, рака головы или шеи, кожной или внутриглазной злокачественной меланомы, рака матки, рака яичника, рака прямой кишки, рака анального канала, рака желудка, рака яичка, рака матки, рака фаллопиевых труб, рака эндометрия, рака шейки матки, рака влагалища, рака вульвы, болезни Ходжкина, неходжкинской лимфомы, рака пищевода, рака тонкого кишечника, рака эндокринной системы, рака щитовидной железы, рака паращитовидной железы, рака надпочечника, саркомы мягких тканей, рака уретры, рака полового члена, хронического или острого лейкоза, который включает в себя острый миелоидный лейкоз, хронический миелоидный лейкоз, острый лимфобластный лейкоз, хронический лимфоцитарный лейкоз, солидных опухолей у детей, лимфоцитарной лимфомы, рака мочевого пузыря, рака почки или уретры, рака почечной лоханки, патологического разрастания ткани центральной нервной системы, первичной лимфомы центральной нервной системы, ассоциированного с опухолью ангиогенеза, опухолей оси позвоночника, глиомы ствола мозга, аденомы гипофиза, саркомы Капоши, эпидермоидной карциномы, плоскоклеточного рака, Т-клеточной лимфомы, вызванных влиянием окружающей среды видов рака, в том числе вызванных асбестом, и сочетания указанных видов рака, при этом указанные инфекционные заболевания предпочтительно выбраны из ВИЧ, гриппа, герпеса, лямблиоза, малярии, лейшманиоза, из патогенных инфекций, вызванных следующими вирусами: вирусы гепатита (гепатита А, В и С), вирусы герпеса (например, VZV, HSV-1, HAV-6, HSV-II и CMV, вирус Эпштейна-Барр), аденовирус, вирус гриппа, флавивирусы, эховирус, риновирус, вирус Коксаки, коронавирус, респираторно-синцитиальный вирус, вирус эпидемического паротита, ротавирус, вирус кори, вирус краснухи, парвовирус, вирус коровьей оспы, вирус HTLV, вирус денге, вирус папилломы, вирус моллюска, вирус полиомиелита, вирус бешенства, вирус JC и вирус арбовирусного энцефалита, из патогенных инфекций, вызванных следующими бактериями: хламидии, риккетсии, микобактерии, стафилококки, стрептококки, пневмококки, менингококки и гонококки, клебсиелла, протей, серратия, псевдомонады, легионеллы, из возбудителей дифтерии, сальмонеллеза, туберкулеза, холеры, столбняка, ботулизма, сибирской язвы, чумы, лептоспироза и бактерий болезни Лайма, из патогенных инфекций, вызванных следующими грибами: кандида (Candida albicans, Candida krusei, Candida glabrata, Candida tropicalis и т.д.), Cryptococcus neoformans, аспергиллы (Fumigatus, Aspergillus niger и т.д.), род Mucor (Mucor, Absidia, Rhizopus), Sporothrix schenckii, вызывающие дерматит почкующиеся дрожжи, Paracoccidiodes brasiliensis, Coccidioides immitis и Histoplasma capsulatum, из патогенных инфекций, вызванных следующими паразитами: дизентерийная амеба, балантидия толстого кишечника, черви Фернандо, амеба, поражающая головной мозг, лямблия, криптоспоридия, Pneumocystis carinii, P. vivax, бабезии полевых мышей, Trypanosoma brucei, Trypanosoma cruzi, Leishmania donovani, Toxoplasma gondii и Nippostrongylus brasiliensis, при этом указанные воспалительные заболевания предпочтительно выбраны из следующих: острый рассеянный энцефаломиелит, болезнь Аддисона, анкилозирующий спондилит, синдром антифосфолипидных антител, аутоиммунная гемолитическая анемия, аутоиммунный гепатит, артрит, болезнь Бехчета, буллезный дерматит, целиакия, болезнь Шагаса, болезнь Крона, дерматомиозит, сахарный диабет 1 типа, легочное кровотечение - аутоиммунная гемолитическая анемия, реакция трансплантат против хозяина, болезнь Грейвса, синдром Гийена-Барре, тиреоидит Хашимото, синдром гипериммуноглобулинемии Е, идиопатическая тромбоцитопеническая пурпура, системная красная волчанка, рассеянный склероз, миастения гравис, пемфигус, злокачественная анемия, полимиозит, первичный билиарный цирроз, псориаз, ревматоидный артрит, синдром Шегрена, височный артериит, васкулит и гранулематоз Вегенера.
[0029] Настоящее изобретение также предлагает применение антитела (антител) или его функционального фрагмента (их функциональных фрагментов) в соответствии с настоящим изобретением, нуклеиновой кислоты, экспрессионного вектора, клетки-хозяина, иммуноконъюгата или фармацевтической композиции в получении лекарственных средств для лечения заболеваний или состояний.
КРАТКОЕ ОПИСАНИЕ РЯДА ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0030] На фигуре 1 изображено разделение по массе белка внеклеточного структурного участка PD-1, полученного от человека (hu) и Macaca fascicularis (макака-крабоеда) (cyno), проведенное с помощью SDS-PAGE (электрофореза в полиакриламидном геле в присутствии натрия додецилсульфата).
[0031] На фигуре 2 изображено связывание меченного биотином rh-PD-L1 и Т-клеток человека, измеренное с помощью проточной цитометрии.
[0032] На фигуре 3 показано, что контрольный PD-L1, клоны 1, 10, 11, 55 и 64 блокируют связывание между PD-1 с лигандом PD-L1 на поверхности клеток, что измерено с помощью проточной цитометрии.
[0033] На фигуре 4 показано связывание контрольного антитела, клонов 1, 10, 11, 55 и 64 с PD-1, а также других членов семейства CD28 (ICOS, CTLA-4 и CD28).
[0034] На фигуре 5 изображен эксперимент со стимуляцией столбнячным токсином для измерения стимуляции химерными антителами Т-клеток in vitro.
[0035] На фигуре 6 изображен уровень секреции IL2 клонами 38, 39, 41 и 48 (контроль (conIgG4)) гуманизированного антитела, измеренного с помощью набора реактивов для анализа секреции цитокинов клетками CD8+.
[0036] На фигуре 7 изображено значение флуоресценции GFP, полученное после совместного культивирования дендритных клеток и модифицированных клеток MD-МАВ-453 в течение 3 дней и последующего добавления извлеченных Т-клеток и клонов 38, 39, 41 и 48 (контроль (conIgG4)) гуманизированного антитела к PD-1 в соответствии с настоящим изобретением для совместного культивирования в течение 3 дней.
[0037] На фигуре 8 изображено связывание гуманизированного антитела согласно настоящему изобретению с белками PD-1, полученными от человека, Macaca fascicularis и мыши.
[0038] На фигуре 9 изображено сравнение между последовательностями PD-1 человека, Macaca fascicularis (сyno) и мыши, где основные отличающиеся участки мышиного белка PD-1 и белка человека/PD-1 Macaca fascicularis обведены прямоугольной рамкой.
[0039] На фигуре 10 изображен результат эксперимента пролиферации Т-клеток, стимулированных in vitro гуманизированным антителом - эксперимента с анамнестической реакцией на антиген столбняка.
[0040] На фигуре 11 изображен результат эксперимента пролиферации Т-клеток, стимулированных in vitro гуманизированным антителом - эксперимента с анамнестической реакцией на антиген в виде вирусных полипептидов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
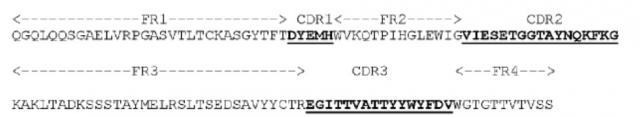
[0041] Если не указано иное, все технические термины, используемые в этом патенте, имеют те же значения, понятные обычному специалисту в данной области. Что касается определений и терминов из уровня техники, в частности, специалисты могут обратиться к литературному источнику Current Protocols in Molecular Biology (Ausubel). При сокращении названий аминокислотных остатков используется форма стандартного кода, состоящего из 3 букв и/или 1 буквы, применяемого в данной области для каждой из 20 обще используемых L-аминокислот.
[0042] Настоящее изобретение обеспечивает антитело (антитела) к PD-1 и его функциональный фрагмент (их функциональные фрагменты), которые могут связываться с белком программируемой смерти клеток (PD -1). Антитело (антитела) и его функциональный фрагмент (их функциональные фрагменты) в соответствии с настоящим изобретением характеризуются по меньшей мере одним из следующих признаков: способны блокировать взаимодействие между PD-1 и PD-L1 с высокой аффинностью или способны связываться с PD-1 с высокой специфичностью, но не с другими членами семейства CD28 (например, ICOS, CTLA-4 и CD28), или активировать опухолеспецифические Т-клетки для уничтожения опухолевых клеток, и активируют CD8+ для проникновения в ткань солидной опухоли в такой степени, чтобы в значительной мере увеличить уровни иммунных эффекторов, таких как IFNγ.
[0043] Настоящее изобретение также обеспечивает гуманизированное антитело (антитела) к PD-1 и его функциональный фрагмент (их функциональные фрагменты). Указанное гуманизированное антитело (гуманизированные антитела) получают путем использования методики компьютерного моделирования мышиного антитела, полученного от иммунизированной мыши, в сочетании с технологией бактериофагового дисплея. Его эпитопы связывания также определены на основе его характеристик связывания с белками PD-1 различных видов. Кроме благоприятных характеристик антитела (антител) к PD-1 и его функционального фрагмента (их функциональных фрагментов), описанных выше, указанное гуманизированное антитело (гуманизированные антитела) к PD-1 и его функциональный фрагмент (их функциональные фрагменты) в соответствии с настоящим изобретением также связывается с белками PD-1 человека или Macaca fascicularis с высокой аффинностью, но не взаимодействует с полученным от мыши белком PD-1.
[0044] Исходя из незначительного влияния на активность антитела, специалисты в данной области могут заменить, добавить и/или удалить одну или более (например, 1, 2, 3, 4, 5, 6, 7, 9, 10 или более) аминокислот в последовательности в соответствии с настоящим изобретением таким образом, чтобы получить вариант (варианты) последовательности указанного антитела (антител) или его функционального фрагмента (их функциональных фрагментов). Все они считаются включенными в объем охраны, предоставляемой настоящим изобретением. Например, аминокислота (аминокислоты) в вариабельном участке может быть заменена аминокислотами с аналогичными характеристиками. Последовательность указанного варианта в соответствии с настоящим изобретением может характеризоваться идентичностью с ее исходной последовательностью, составляющей по меньшей 95%, 96%, 97%, 98% или 99%. Идентичность указанной последовательности, описанная в настоящем изобретении, может быть измерена с помощью программного обеспечения для анализа последовательностей, например, компьютерной программы BLAST с использованием параметра по умолчанию, в особенности BLASTP или TBLASTN.
[0045] Антитело в соответствии с настоящим изобретением может быть антителом полной длины (например, антитела IgG1 или IgG4) или содержать часть, которая связывается с антигеном (например, фрагменты Fab, F(ab')2 или scFv), или может быть модифицировано для влияния на его функцию. Настоящее изобретение предусматривает антитело (антитела) к PD-1, содержащее модифицированный паттерн гликозилирования. В ряде применений может быть целесообразным проведение модификации для удаления нежелательного сайта (сайтов) гликозилирования или избежать присоединения части фукозы на олигосахаридную цепь, например, чтобы повысить функцию антитела в антителозависимой клеточноопосредованной цитотоксичности (ADCC). В некоторых других применениях модификация путем галактозилирования может быть проведена, чтобы изменить комплементзависимую цитотоксичность (CDC).
[0046] Используемый в данном патенте термин ”функциональный фрагмент” относится, в частности, к фрагменту (фрагментам) антитела, таким как Fv, scFv (”sc” означает однонитевой), фрагменты Fab, F(ab')2, Fab', scFv-Fc или диатело, или какой-либо фрагмент, время полужизни которого должно быть по возможности увеличено путем химической модификации или введения в липосомы, при этом указанная химическая модификация представляет собой, например, добавление полиалкиленгликоля, такого как полиэтиленгликоль (“пегилирование, ПЭГилированный”) (далее именуемый как пегилированный фрагмент, такой как Fv-PEG, scFv-PEG, Fab-PEG, F(ab')2-PEG или Fab'-PEG) (“ПЭГ” представляет собой полиалкиленгликоль), и указанный фрагмент обладает EGFR-связывающей активностью. Предпочтительно указанные функциональные фрагменты cодержат неполную последовательность тяжелой или легкой цепи их исходного антитела (исходных антител). Указанная неполная последовательность является достаточной для поддержания специфичности связывания и достаточной аффинности, аналогичных ее исходному антителу. Что касается PD-1, то предпочтительной является аффинность, составляющая по меньшей мере 1/100 его исходного антитела, и более предпочтительно по меньшей мере 1/10. Такой тип функционального фрагмента (функциональных фрагментов) включает по меньшей мере 5 аминокислот, а предпочтительно 10, 15, 25, 50 и 100 последовательных аминокислот из последовательности его исходного антитела.
[0047] Специалисты в данной области могут клонировать молекулу (молекулы) ДНК, кодирующую указанное антитело к PD-1 в соответствии с настоящим изобретением, в вектор, а затем трансформировать вектором клетку-хозяин. Таким образом, настоящее изобретение может также обеспечивать тип вектора на основе рекомбинантной ДНК, который содержит молекулу (молекулы) ДНК, кодирующую указанное антитело (указанные антитела) к PD-1 в соответствии с настоящим изобретением.
[0048] Предпочтительно указанный вектор на основе рекомбинантной ДНК является типом экспрессионного вектора. Специалисты в данной области могут клонировать молекулу (молекулы) ДНК указанного антитела в экспрессионный вектор и трансформировать вектором клетку-хозяина для получения антитела посредством индуцирования экспрессии. Экспрессионный вектор согласно настоящему изобретению содержит последовательность (последовательности) ДНК, кодирующую вариабельный участок тяжелой цепи, вариабельный участок легкой цепи и/или константный участок антитела (антител) к PD-1. Тем не менее, два типа экспрессионных векторов могут быть созданы отдельно. Один содержит вариабельный участок тяжелой цепи и константный участок, а другой вариабельный участок легкой цепи и константный участок. Они вместе трансфицируют клетки млекопитающих. В одном предпочтительном варианте осуществления указанный экспрессионный вектор дополнительно содержит промотор и последовательность (последовательности) ДНК, кодирующую секретируемые сигнальные пептиды, а также по меньшей мере один тип устойчивого к лекарственным средствам гена, используемого для скрининга.
[0049] Указанная клетка-хозяин (клетки-хозяева) в соответствии с настоящим изобретением может быть прокариотической клеткой-хозяином, эукариотической клеткой-хозяином или бактериофагом. Указанная прокариотическая клетка-хозяин может представлять собой кишечную палочку, сенную палочку, стрептомицеты или протей мирабилис и т.д. Указанная эукариотическая клетка-хозяин может представлять собой грибы, такие как Pichia pastoris, Saccharomyces cerevisiae, делящиеся дрожжи и Trichoderma, клетки насекомых, таких как Spodoptera frugiperda, клетки растений, таких как табак, клетки млекопитающих, такие как клетки ВНК, СНО, COS и миеломные клетки. В некоторых вариантах осуществления указанные клетки-хозяева в соответствии с настоящим изобретением представляют собой предпочтительно клетки млекопитающих, и более предпочтительно клетки ВНК, СНО, NSO или COS.
[0050] Термин “фармацевтическая композиция”, который используется в данном патенте, относится к комбинации по меньшей мере одного вида лекарственного средства и случайно выбранных фармацевтических носителей или вспомогательных веществ для специальных целей. В некоторых вариантах осуществления указанная фармацевтическая композиция (фармацевтические композиции) включает в себя комбинации, которые разделены во времени и/или пространстве, при условии, что они могут функционировать синергетически, чтобы выполнить цели настоящего изобретения. Например, ингредиенты, содержащиеся в указанной фармацевтической композиции (например, антитело, молекула нуклеиновой кислоты, комбинация и/или конъюгат молекулы нуклеиновой кислоты), могут быть введены пациенту вместе или по отдельности. В случае если ингредиенты, содержащиеся в указанной фармацевтической композиции, вводят пациенту отдельно, они могут быть использованы одновременно или поочередно. Предпочтительно указанный фармацевтически носитель (фармацевтические носители) представляют собой воду, буферный водный раствор, изотонические солевые растворы, такие как PBS (фосфатный буфер), глюкозу, маннит, декстрозу, лактозу, крахмал, стеарат магния, целлюлозу, карбонат магния, 0,3% глицерин, гиалуроновую кислоту, этанол или полиалкиленгликоли, такие как полипропиленгликоль, триглицериды и т.д. Тип используемого фармацевтического носителя зависит от того, составляется ли композиция в соответствии с настоящим изобретением для перорального, интраназального, внутрикожного, подкожного, внутримышечного или внутривенного введения. Композиция согласно настоящему изобретению может содержать увлажняющее средство (увлажняющие средства), эмульгатор (эмульгаторы) или буферный раствор (буферные растворы) в качестве добавки.
[0051] Фармацевтическая композиция в соответствии с настоящим изобретением может быть введена посредством любого соответствующего пути введения, например, перорально, интраназально, внутрикожно, подкожно, внутримышечно или внутривенно.
[0052] В одном соответствующем аспекте настоящее изобретение обеспечивает фармацевтическую композицию в сочетании с антителом к PD-1 и вторым терапевтическим средством. В одном варианте осуществления указанное второе терапевтическое средство представляет собой любое средство, являющееся предпо