Лечение инфекций h. pylori с применением ингибиторов mtan
Иллюстрации
Показать всеИзобретение относится к способу лечения инфекций Helicobacter pylori (H. Pylori). Для лечения инфекции Helicobacter pylori (H. pylori) у индивидуума осуществляют введение индивидууму соединения формулы (I) в количестве, эффективном для ингибирования роста H. pylori, где формула (I) представляет собой
(I),
где R представляет собой Q или CH2SQ, где Q представляет собой C1-C9-алкил, арил, гетероарил, аралкил или C4-C7-циклоалкил, и где Q является необязательно замещенным одним или несколькими выбранными из галогена, OH- и/или NH2-групп, или его фармацевтически приемлемой соли или сложного эфира. Изобретение позволяет повысить эффективность борьбы с инфекцией. 4 н. и 21 з.п. ф-лы, 1 ил., 3 табл.
Реферат
ПРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
[0001] Для настоящей заявки испрашивается приоритет по предварительной патентной заявке США № 61/938755, зарегистрированной 12 февраля 2014 года, содержание которой включено в настоящее описание посредством ссылки в полном объеме.
ЗАЯВЛЕНИЕ О ГОСУДАРСТВЕННОЙ ПОДДЕРЖКЕ
[0002] Настоящее изобретение получено при государственной поддержке по гранту № GM41916, выданному National Institutes of Health, и по гранту Center for Synchrotron Biosciences № P30-EB-009998, выданному National Institute of Biomedical Imaging and Bioengineering (NIBIB). Правительство имеет определенные права на изобретение.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0003] Изобретение относится к лечению инфекций Helicobacter pylori (H. pylori) с применением ингибиторов MTAN (5'-метилтиоаденозиннуклеозидазы) H. pylori, в частности, у индивидуумов, имеющих пептическую язву.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0004] На всем протяжении настоящей заявки различные публикации обозначают с помощью сносок. Полное цитирование для этих ссылок можно найти в конце описания перед формулой изобретения. Таким образом, описания этих публикаций включены в настоящую заявку посредством ссылок в полном объеме для более полного описания уровня техники, к которому относится настоящая заявка.
[0005] H. pylori является грамотрицательной бактерией и существует микроаэрофильно в слизистой оболочке желудка человека-хозяина. Она связана с 85 процентами случаев язвы желудка и 95 процентами случаев язвы двенадцатиперстной кишки1. В клинических изолятах H. pylori преобладает устойчивость к лекарственным средствам. После менее чем тридцати лет специфического лечения антибиотиками становится все труднее осуществлять эрадикацию H. pylori с использованием комбинации двух антибиотиков при двухнедельной терапии2. Для лечения инфекций H. pylori необходимы антибиотики с новыми мишенями и механизмами действия.
[0006] Грамотрицательные бактерии зависят от менахинонов в качестве транспортеров электронов при дыхании и имеют поддерживаемые пути биосинтеза для этих необходимых метаболитов3. В отличие от этого, у людей отсутствует путь синтеза менахинона, и воздействие на путь менахинона представляет собой подход для дизайна антибактериальных лекарственных средств. Недавно представлен путь синтеза менахинона в Campylobacter и Helicobacter, отличающийся от большинства бактерий4,5. В этом пути 6-амино-6-дезоксифуталозин синтезируется с помощью MqnA и расщепляется по N-рибозильной связи с помощью MTAN со специфичностью, также распространяющейся на 5′-метилтиоаденозин и аденозилгомоцистеин, а также 6-амино-6-дезоксифуталозин. HpMTAN превращает 6-амино-6-дезоксифуталозин в аденин и дегипоксантин футалозин, последний из которых служит процессором при синтезе менахинона. Ранние реакции этого пути не существуют в нормальной бактериальной флоре людей, что делает ферменты, катализирующие эти реакции, привлекательными мишенями для лекарственных средств. HpMTAN тесно связана с 5′-метилтиоаденозин/S-аденозилгомоцистеингидролазами (MTAN), обнаруживаемыми у других бактерий. Хорошо изученные MTAN ассоциированы с чувством кворума и круговоротом S-аденозилметионина у большинства видов и не являются необходимыми для бактериального роста6. Разработаны ингибиторы аналогов переходных комплексов с аффинностью от пикомолярной до фемтомолярной для противодействия бактериальным функциям, ассоциированным с чувством кворума6,7.
[0007] Настоящее изобретение направлено на удовлетворение потребности в новых соединениях, избирательно блокирующих рост H. pylori.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0008] Изобретение относится к способам лечения инфекции Helicobacter pylori (H. pylori) у индивидуума, включающим введение индивидууму соединения формулы (I) в количестве, эффективном для ингибирования роста H. pylori, где формула (I) представляет собой
(I)
где R представляет собой Q или CH2SQ, где Q представляет собой C1-C9-алкил, арил, гетероарил, аралкил или C4-C7-циклоалкил, и где Q является необязательно замещенным одним или несколькими из галогена, OH- и/или NH2-групп,
или его фармацевтически приемлемую соль или сложный эфир.
[0009] Изобретение дополнительно относится к соединению, имеющему структуру:
,,,,,,,,,,,,,,или,
или его фармацевтически приемлемой соли или сложному эфиру.
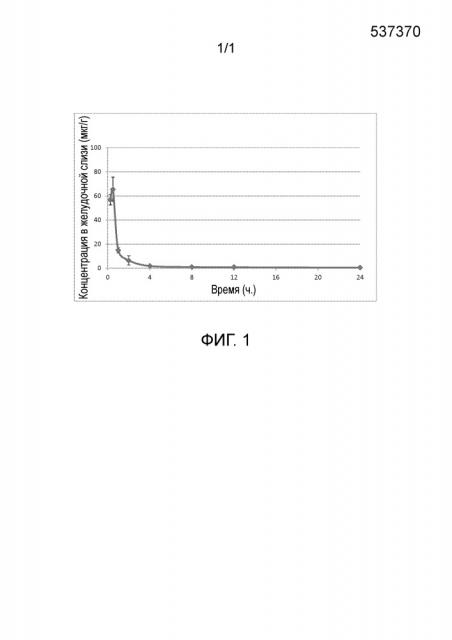
[0010] Фиг. 1 - концентрация гексил-SerMe-иммуциллина A в желудочной слизи мыши относительно времени после введения однократной дозы 10 мг/кг PO.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0011] Изобретение относится к способу лечения инфекции Helicobacter pylori (H. pylori) у индивидуума, включающему введение индивидууму соединения формулы (I) в количестве, эффективном для ингибирования роста H. pylori, где формула (I) представляет собой
(I)
где R представляет собой Q или CH2SQ, где Q представляет собой C1-C9-алкил, арил, гетероарил, аралкил или C4-C7-циклоалкил, и где Q является необязательно замещенным одним или несколькими из галогена, OH- и/или NH2-групп,
или его фармацевтически приемлемой соли или сложному эфиру.
[0012] Предпочтительные соединения включают соединения, имеющие формулу
.
[0013] Q может представлять собой, например, C1-C9-алкил, например, C1-C5-алкил; например, метильную (Me), этильную (Et), пропильную (Pr), бутильную или пентильную группу. Q может представлять собой, например, C4-C7-циклоалкил, т.е. C4-циклоалкил, C5-циклоалкил, C6-циклоалкил или C7-циклоалкил. Q может представлять собой, например, арил. Термин "арил" означает ароматический радикал, содержащий от 4 до 12 атомов углерода. Примеры включают фенил, 1-нафтил и 2-нафтил. "Гетероарил" означает 4-12-членное кольцо, включающее один или несколько атомов N, S, или O в кольце. Примеры включают имидазол-4-ил, имидазол-2-ил, тиазол-2-ил, тиазол-4-ил, тиазол-5-ил, пиридин-2-ил, пиридин-3-ил, пиридин-4-ил и пиразин-2-ил. Предпочтительные арилы и гетероарилы включают те, которые содержат 5 или 6 членов в кольце. Предпочтительно, аралкил включает C1-C3-алкильную группу и 4-6-членное кольцо, которое может включать гетероатомы.
[0014] Q можно замещать одним или несколькими из галогена, гидроксильной или NH2-групп. Предпочтительными галогенами являются Cl, F, Br или I. Хлор и фтор являются более предпочтительными галогенами. Замену можно осуществлять в орто-, мета или пара-положении.
[0015] Предпочтительные соединения включают те, в которых R представляет собой Q или CH2SQ, где Q представляет собой линейный C2-C9-алкил, арил, гетероарил, аралкил или C4-C7-циклоалкил, и где Q является необязательно замещенным одним или несколькими из галоген, OH- и/или NH2-групп. Предпочтительные соединения также включают те, в которых Q представляет собой линейный C3-C9-алкил или гетероарил.
[0016] Предпочтительные соединения включают те, которые выбраны из группы, состоящей из
,,,,,,,,,,,,,и,
или его фармацевтически приемлемой соли или сложному эфиру.
[0017] Настоящее изобретение относится к способу лечения инфекции Helicobacter pylori (H. pylori) у индивидуума, включающему введение индивидууму соединения в количестве, эффективном для ингибирования роста H. pylori, где соединение выбрано из группы, состоящей из:
,,,,,,,,,,,,,,и,
или его фармацевтически приемлемой соли или сложному эфиру.
[0018] Изобретение дополнительно относится к соединению, имеющему структуру:
,,,,,,,,,,,,,или,
или его фармацевтически приемлемой соли или сложному эфиру.
[0019] Термин "фармацевтически приемлемые соли" включает нетоксичные соли, полученные из неорганических или органических кислот, включая, например, следующие кислые соли: ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфаты, бутират, цитрат, камфорат, камфоросульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептаноат, глицерофосфат, гликолят, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, йодогидрат, 2-гидроксиэтансульфонат, лактат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, оксалат, пальмоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, p-толуолсульфонат, салицилат, сукцинат, сульфат, тартрат, тиоцианат и ундеканоат.
[0020] Предпочтительно, соединение вводят в количестве, эффективном для ингибирования 5'-метилтиоаденозиннуклеозидазы (MTAN) H. pylori.
[0021] Предпочтительно, соединение ингибирует рост H. pylori, но не ингибирует рост одной или нескольких бактерий, выбранных из группы, состоящей из E. coli, V. cholerae, S. aureus, K. pneumoniae, S. flexneri, S. enterica и P. aeruginosa. Более предпочтительно, соединение не ингибирует рост всех из E. coli, V. cholerae, S. aureus, K. pneumoniae, S. flexneri, S. enterica и P. aeruginosa. Предпочтительно, соединение является более эффективным в ингибировании роста H. pylori, чем амоксициллин, метронидазол или тетрациклин.
[0022] Предпочтительно, индивидуум имеет пептическую язву, такую как язва желудка или язва двенадцатиперстной кишки.
[0023] Предпочтительно, соединение вводят перорально. В случае перорального введения, соединение можно составлять в твердых или жидких препаратах, например, таблетках, капсулах, порошках, растворах, суспензиях и дисперсиях. Соединение можно составлять со средствами, такими как, например, лактоза, сахароза, кукурузный крахмал, желатин, картофельный крахмал, альгиновая кислота и/или стеарат магния.
[0024] Соединение также можно вводить индивидууму другими путями, известными в этой области, такими как, например, парентеральный, посредством ингаляции, местный, ректальный, назальный, буккальный или посредством имплантированного резервуара. Соединение можно вводить с помощью средств с замедленным высвобождением.
[0025] Изобретение дополнительно относится к применению соединения, ингибирующего MTAN Helicobacter pylori (H. pylori), для получения лекарственного средства для лечения инфекции H. pylori. Изобретение также относится к соединению, ингибирующему MTAN Helicobacter pylori (H. pylori), для применения в лечении инфекции H. pylori.
[0026] Изобретение дополнительно относится к применению соединения, ингибирующего MTAN Helicobacter pylori (H. pylori), для получения лекарственного средства для лечения пептической язвы. Изобретение также относится к соединению, ингибирующему MTAN Helicobacter pylori (H. pylori), для применения в лечении пептической язвы.
[0027] Способы по настоящему изобретению также можно применять для лечения инфекций другими видами Helicobacter и видами Campylobacter, такими как C. jejuni.
[0028] Изобретение дополнительно относится к фармацевтической композиции, содержащей любое из соединений, представленных в настоящем описании, и фармацевтически приемлемый носитель. Как применяют в настоящем описании, "фармацевтически приемлемый носитель" (i) совместим с другими ингредиентами композиции, не делая композицию неподходящей для предполагаемой цели, и (ii) пригоден для использования в отношении индивидуумов, как представлено в настоящем описании, без чрезмерных побочных эффектов (таких как токсичность, раздражение и аллергический ответ). Побочные эффекты являются "чрезмерными", когда их риск перевешивает пользу, приносимую композицией. Не ограничивающие примеры фармацевтически приемлемых носителей включают любые из стандартных фармацевтических носителей, такие как фосфатно-солевые буферные растворы, вода и эмульсии, такие как эмульсии масла/воды и микроэмульсии.
[0029] Настоящее изобретение будет более понятным с учетом следующих подробностей экспериментов. Однако специалисту в этой области будет понятно, что конкретные способы и обсуждаемые результаты представлены исключительно в целях иллюстрирования изобретения, более подробно описанного в формуле изобретения ниже.
ПОДРОБНОСТИ ЭКСПЕРИМЕНТОВ
ПРИМЕР 1
Материалы и способы
[0030] Материалы. H. pylori (J99 и 43504), K. pneumoniae, S. flexneri, S. enterica, S. aureus и P. aeruginosa приобретали в American Type Culture Collection. Дефибринированную кровь лошади (DHB) получали из Hemostat Laboratories (Dixon, CA). Триптический соевый агар (TSA) приобретали в Becton Dickinson and Company (Sparks, MD). Агар МакКонки получали из Oxoid LTD. (Basingstoke, Hampshire, England). Ксантиноксидазу и 5ʹ-метилтиоаденозин приобретали в Sigma-Aldrich (St Louis, MO). Остальные материалы приобретали с наиболее высокой доступной чистотой.
[0031] Очистка HpMTAN. Способ очистки HpMTAN описывали ранее10. В кратком изложении, клетки BL21 (DE3), несущие плазмиду, кодирующую HpMTAN с N-концевой меткой His6, выращивали до оптической плотности 0,7, измеряемой при 595 нм, и вносили IPTG до конечной концентрации 0,5 мМ. Через 15 часов при 22°C клетки собирали посредством центрифугирования. Осадок суспендировали, а затем разрушали с помощью ячейки давления и обработки ультразвуком. Растворимую часть наносили на колонку Ni-NTA и элюировали HpMTAN с использованием градиента концентрации имидазола от 200 до 500 мМ. Белок обессоливали с использованием колонки для гель-фильтрации Superdex G15, затем уравновешивали и концентрировали в 10 мМ Hepes, 30 мМ KCl, pH 7,6. Чистоту подтверждали посредством электрофореза в ПААГ в присутствие SDS.
[0032] Определение Ki. Кинетику HpMTAN определяли с использованием прямого анализа, включающего непрерывное снижение поглощения при 274 нм вследствие образования свободного аденина из 5ʹ-метилтиоаденозина. Значения Ki и Ki* определяли с использованием сопряженных анализов, в которых ксантиноксидазу использовали в качестве присоединяющего фермента, и наблюдали повышение поглощения при 292 нм с превращением продукта аденина в 2,8-дигидроксиаденин. Оба анализа описаны ранее8.
[0033] Выращивание бактерий. H. pylori выращивали в течение 72 часов в микроаэрофильных условиях (5% O2, 10% CO2 и 85% N2) при 37°C на триптическом соевом агаре с 5% кровью лошади. Для определения значений MIC тестируемое вещество добавляли в раствор геля непосредственно перед разливкой. Для сравнения зон ингибирования в центр диска после распространения H. pylori добавляли конкретные антибиотики, а, затем H. pylori позволяли расти в течение 72 часов в микроаэрофильных условиях при 37°C.
[0034] Общий эксперимент для соединений. Все реакции осуществляли в атмосфере аргона. Органические растворы сушили с помощью безводного MgSO4 и выпаривали растворители при пониженном давлении. Безводные и хроматографические растворители получали в коммерческих источниках и использовали без какой-либо дополнительной очистки. Трет-бутоксид калия возгоняли при 220°C/0,1 мм рт.ст. Тонкослойную хроматографию (TLC) осуществляли на стекле или листах алюминия, покрытых силикагелем 60 F254. Органические соединения визуализировали под УФ-излучением и/или погружали в 0,1% нингидрин в EtOH, раствор Эрлиха или молибдат аммония (5% масс.) и сульфат церия (IV)⋅4 H2O (0,2% масс.) в воде. H2SO4 (2 M). Хроматографию (флэш-хроматографию или хроматографию с помощью автоматизированной системы с оборудованием для непрерывного градиента) осуществляли на силикагеле (40-63 мкм). Вращение плоскости поляризации света регистрировали при длине пути 1 дм и выражали в единицах 10-1град см2 г-1; концентрации выражали в г/100 мл. 1H-спектры ЯМР измеряли в CDCl3 или CD3OD (внутренний Me4Si, δ 0) и 13C-спектры ЯМР в CDCl3 (центральная линия, как указано) или CD3OD (центральная линия, как указано). Определение резонансов 1H и 13C основано на экспериментах 2D (1H-1H DQF-COSY, 1H-13C HSQC) и DEPT. Используемые сокращения: с, синглет, д, дублет, т, триплет, к, квартет, ш.с., широкий синглет, ш.т., широкий триплет, дд, дублет дублетов, ддд, дублет дублетов дублетов, дт, дублет триплетов. Массовые спектры с электрораспылением с высоким разрешением (ESI-HRMS) регистрировали с помощью тандемного масс-спектрометра Q-TOF.
[0035] Пример A. Синтез 2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]этан-1-ола (A.1).
[0036] 2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]этан-1-ол (A.1). 2-Аминоэтанол (0,099 мл, 1,64 ммоль), 9-деазааденин (0,220 г, 1,64 ммоль) и водный раствор формальдегида (37%, 0,15 мл, 1,99 ммоль) смешивали в трет-бутаноле (3 мл) при 70°C в течение 16 часов. Для поглощения всех растворителей добавляли силикагель, затем выпаривали растворитель и очищали остаток посредством хроматографии на силикагеле (CHCl3-MeOH-28% водн. NH4OH, 70:25:5). Выпаривали фракции, содержащие продукт, и остаток снова хроматографировали на силикагеле (2-PrOH-28% водн. NH4OH, 92:8) для получения A.1 в виде бесцветного твердого вещества (0,101 г, 30%). 1H ЯМР (500 МГц, CD3OD): δ 8,16 (с, 1H), 7,47 (с, 1H), 3,95 (с, 2H), 3,68 (т, J=5,6 Гц, 2H), 2,78 (т, J=5,6 Гц, 2H). 13C ЯМР (125,7 МГц, CD3OD, центральная линия δ 49,0): δ 152,1 (C), 150,9 (CH), 146,6 (C), 129,0 (CH), 115,4 (C), 114,4 (C), 61,6 (CH2), 51,6 (CH2), 43,4 (CH2). ESI-HRMS вычислены для C9H14N5O+, (M+H)+, 208,1193, найдено 208,1192.
[0037] Пример B. Синтез (2S)-2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]пропан-1-ола (B.1).
[0038] (2S)-2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]пропан-1-ол (B.1). (2S)-2-аминопропан-1-ол (0,120 г, 1,60 ммоль), 9-деазааденин (0,179 г, 1,33 ммоль) и водный раствор формальдегида (37%, 0,12 мл, 1,60 ммоль) смешивали в трет-бутаноле (3 мл) при 70°C в течение 16 часов. Для поглощения всех растворителей добавляли силикагель, затем выпаривали растворитель и очищали остаток посредством хроматографии на силикагеле (CHCl3-MeOH-28% водн. NH4OH, 80:18,5:1,5) для получения B.1 в виде бесцветного твердого вещества (0,180 г, 61%). 1H ЯМР (500 МГц, CD3OD): δ 8,16 (с, 1H), 7,47 (с, 1H), 4,01 (д, J=13,6 Гц, 1H), 3,92 (д, J=13,6 Гц, 1H), 3,54 (дд, J=11,0, 4,8 Гц, 1H), 3,43 (дд, J=11,0, 7,0 Гц, 1H), 2,84 (м, 1H), 1,09 (д, J=6,5 Гц, 3H). 13C ЯМР (125,7 МГц, CD3OD, центральная линия δ 49,0): δ 152,1 (C), 150,9 (CH), 146,5 (C), 128,9 (CH), 115,4 (C), 114,5 (C), 66,6 (CH2), 54,8 (CH), 41,0 (CH2), 16,5 (CH3). ESI-HRMS вычислены для C10H16N5O+, (M+H)+, 222,1350, найдено 222,1349.
[0039] Пример C. Синтез (2S)-2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]бутан-1-ола (C.1).
[0040] (2S)-2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]бутан-1-ол (C.1). (2S)-2-аминобутан-1-ол (0,100 г, 1,12 ммоль), 9-деазааденин (0,150 г, 1,12 ммоль) и водный раствор формальдегида (37%, 0,101 мл, 1,35 ммоль) смешивали в трет-бутаноле (3 мл) при 70°C в течение 16 часов. Для поглощения всех растворителей добавляли силикагель, затем выпаривали растворитель и очищали остаток посредством хроматографии на силикагеле (CHCl3-7M NH3/MeOH, 9:1, затем 85:15) для получения C.1 в виде бесцветного твердого вещества (0,133 г, 50%). 1H ЯМР (500 МГц, CD3OD): δ 8,16 (с, 1H), 7,47 (с, 1H), 3,99 (д, J=13,6 Гц, 1H), 3,95 (д, J=13,6 Гц, 1H), 3,67 (дд, J=11,2, 4,4 Гц, 1H), 3,48 (дд, J=11,2, 6,5 Гц, 1H), 2,61 (м, 1H), 1,62-1,53 (м, 1H), 1,51-1,42 (м, 1H), 0,91 (т, J=7,5 Гц, 3H). 13C ЯМР (125,7 МГц, CD3OD, центральная линия δ 49,0): δ 152,1 (C), 150,8 (CH), 146,6 (C), 128,9 (CH), 115,4 (C), 114,8 (C), 63,9 (CH2), 60,9 (CH), 41,1 (CH2), 24,6 (CH2), 10,7 (CH3). ESI-HRMS вычислены для C11H17N5NaO+, (M+Na)+, 258,1326, найдено 258,1321.
[0041] Пример D. Синтез (2S)-2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]пентан-1-ола (D.1).
[0042] (2S)-2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]пентан-1-ол (D.1). (2S)-2-аминопентан-1-ол (0,050 г, 0,48 ммоль), 9-деазааденин (0,065 г, 0,48 ммоль) и водный раствор формальдегида (37%, 0,044 мл, 0,59 ммоль) смешивали в трет-бутаноле (2 мл) при 70°C в течение ночи. Для поглощения всех растворителей добавляли силикагель, затем выпаривали растворитель и очищали остаток посредством хроматографии на силикагеле (CHCl3-7M NH3/MeOH, 9:1, затем 85:15) для получения D.1 в виде бесцветного твердого вещества (0,073 г, 60%). 1H ЯМР (500 МГц, CD3OD):δ 8,16 (с, 1H), 7,47 (с, 1H), 3,99 (д, J=13,7 Гц, 1H), 3,96 (д, J=13,7 Гц, 1H), 3,66 (дд, J=11,3, 4,4 Гц, 1H), 3,48 (дд, J=11,3, 6,6 Гц, 1H), 2,69 (м, 1H), 1,54-1,30 (м, 4H), 0,89 (т, J=7,2 Гц, 3H). 13C ЯМР (125,7 МГц, CD3OD, центральная линия δ 49,0): δ 152,1 (C), 150,8 (CH), 146,6 (C), 128,9 (CH), 115,4 (C), 114,7 (C), 62,3 (CH2), 59,2 (CH), 41,1 (CH2), 34,3 (CH2), 20,3 (CH2), 14,6 (CH3). ESI-HRMS вычислены для C12H20N5O+, (M+H)+, 250,1663, найдено 250,1663.
[0043] Пример E. Синтез (2S)-2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]гексан-1-ола (E.1).
[0044] (2S)-2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]гексан-1-ол (E.1). (2S)-2-аминогексан-1-ол (0,100 г, 0,85 ммоль), 9-деазааденин (0,114 г, 0,85 ммоль) и водный раствор формальдегида (37%, 0,077 мл, 1,02 ммоль) смешивали при 70°C в трет-бутаноле (3 мл) в течение 16 часов. Для поглощения всех растворителей добавляли силикагель, затем выпаривали растворитель и очищали остаток посредством хроматографии на силикагеле (CHCl3-7M NH3/MeOH, 9:1, затем 85:15) для получения E.1 в виде бесцветного твердого вещества (0,112 г, 50%). 1H ЯМР (500 МГц, CD3OD): δ 8,16 (с, 1H), 7,47 (с, 1H), 3,97 (с, 2H), 3,65 (дд, J=11,2, 4,4 Гц, 1H), 3,48 (дд, J=11,2, 6,6 Гц, 1H), 2,66 (м, 1H), 1,55-1,38 (м, 2H), 1,32-1,22 (м, 4H), 0,88 (т, J=7,1 Гц, 3H). 13C ЯМР (125,7 МГц, CD3OD, центральная линия δ 49,0): δ 152,1 (C), 150,8 (CH), 146,6 (C), 128,9 (CH), 115,4 (C), 114,7 (C), 64,4 (CH2), 59,3 (CH), 41,2 (CH2), 31,7 (CH2), 29,3 (CH2), 23,9 (CH2), 14,3 (CH3). ESI-HRMS вычислены для C13H21N5NaO+, (M+Na)+, 286,1644, найдено 286,1644.
[0045] Пример F. Синтез (2R)-2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]гексан-1-ола (F.1).
[0046] (2R)-2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]гексан-1-ол (F.1). (2R)-2-аминогексан-1-ол (0,100 г, 0,85 ммоль), 9-деазааденин (0,114 г, 0,85 ммоль) и водный раствор формальдегида (37%, 0,077 мл, 1,02 ммоль) смешивали при 70°C в трет-бутаноле (3 мл) в течение 16 часов. Для поглощения всех растворителей добавляли силикагель, затем выпаривали растворитель и очищали остаток посредством хроматографии на силикагеле (CHCl3-7M NH3/MeOH, 9:1, затем 85:15) для получения F.1 в виде бесцветного твердого вещества (0,108 г, 48%). 1H- и 13C-спектры ЯМР являлись идентичными энантиомеру E.1. ESI-HRMS вычислены для C13H22N5O+ (M+H)+, 264,1819, найдено 264,1717.
[0047] Пример G. Синтез (2S)-2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]-3-метилбутан-1-ола (G.1).
[0048] (2S)-2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]-3-метилбутан-1-ол (G.1). (2S)-2-амино-3-метилбутан-1-ол (0,100 г, 0,97 ммоль) 9-деазааденин (0,130 г, 0,97 ммоль) и водный раствор формальдегида (37%, 0,087 мл, 1,16 ммоль) смешивали в трет-бутаноле (3 мл) при 70°C в течение 16 часов. Для поглощения всех растворителей добавляли силикагель, затем выпаривали растворитель и очищали остаток посредством хроматографии на силикагеле (CHCl3-7M NH3/MeOH, 93:7, затем 85:15) для получения G.1 в виде бесцветного твердого вещества (0,082 г, 34%). 1H ЯМР (500 МГц, CD3OD): δ 8,16 (с, 1H), 7,47 (с, 1H), 3,99 (д, J=13,6 Гц, 1H), 3,95 (д, J=13,6 Гц, 1H), 3,68 (дд, J=11,3, 4,8 Гц, 1H), 3,54 (дд, J=11,3, 6,5 Гц, 1H), 2,49 (м, 1H), 1,90 (м, 1H), 0,93 (д, J=6,9 Гц, 3H), 0,88 (д, J=6,9 Гц, 3H). 13C ЯМР (125,7 МГц, CD3OD, центральная линия δ 49,0): δ 152,1 (C), 150,8 (CH), 146,7 (C), 129,0 (CH), 115,4 (C), 115,0 (C), 64,6 (CH2), 62,3 (CH), 41,9 (CH), 29,8 (CH2), 19,2 (CH3), 18,9 (CH3). ESI-HRMS вычислены для C12H20N5O+ (M+H)+, 250,1663, найдено 250,1661.
[0049] Пример H. Синтез (2S)-2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]-4-метилпентан-1-ола (H.1).
[0050] (2S)-2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]-4-метилпентан-1-ол (H.1). (2S)-2-амино-4-метил-пентан-1-ол (0,100 г, 0,85 ммоль), 9-деазааденин (0,114 г, 0,85 ммоль) и водный раствор формальдегида (37%, 0,077 мл, 1,02 ммоль) смешивали в трет-бутаноле (3 мл) при 70°C в течение 16 часов. Для поглощения всех растворителей добавляли силикагель, затем выпаривали растворитель и очищали остаток посредством хроматографии на силикагеле (CHCl3-7M NH3/MeOH, 93:7, затем 85:15) для получения H.1 в виде бесцветного твердого вещества (0,102 г, 45%). 1H ЯМР (500 МГц, CD3OD): δ 8,16 (с, 1H), 7,47 (с, 1H), 3,97 (с, 2H), 3,65 (дд, J=11,3, 4,4 Гц, 1H), 3,47 (дд, J=11,3, 6,5 Гц, 1H), 2,75 (м, 1H), 1,62 (м, 1H), 1,35 (ддд, J=13,7, 7,4, 6,2 Гц, 1H), 1,28 (ддд, J=13,9, 7,2, 7,2 Гц, 1H), 0,88 (д, J=6,6 Гц, 3H), 0,80 (д, J=6,6 Гц, 3H). 13C ЯМР (125,7 МГц, CD3OD, центральная линия δ 49,0): δ 152,1 (C), 150,8 (CH), 146,6 (C), 129,0 (CH), 115,5 (C), 114,7 (C), 64,6 (CH2), 57,2 (CH), 41,6 (CH2), 41,0 (CH2), 26,0 (CH), 23,3 (CH3), 23,1 (CH3). ESI-HRMS вычислены для C13H22N5O+, (M+H)+, 264,1819, найдено 264,1820.
[0051] Пример I. Синтез (2S,3S)-2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]-3-метилпентан-1-ола (I.1).
[0052] (2S,3S)-2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]-3-метилпентан-1-ол (I.1). (2S,3S)-2-Амино-3-метилпентан-1-ол (0,120 г, 1,02 ммоль), 9-деазааденин (0,137 г, 1,02 ммоль) и водный раствор формальдегида (37%, 0,092 мл, 1,22 ммоль) нагревали и смешивали в трет-бутаноле (3 мл) при 70°C в течение 16 часов. Для поглощения всех растворителей добавляли силикагель, затем выпаривали растворитель и очищали остаток посредством хроматографии на силикагеле (CHCl3-7M NH3/MeOH, 92:8, затем 89:11, затем 85:15) для получения I.1 в виде бесцветного воскообразного твердого вещества (0,120 г, 45%). 1H ЯМР (500 МГц, CD3OD): δ 8,16 (с, 1H), 7,47 (с, 1H), 3,98 (с, 2H), 3,69 (дд, J=11,3, 4,3 Гц, 1H), 3,51 (дд, J=11,3, 7,1 Гц, 1H), 2,62 (ддд, J=7,0. 4,4, 4,4 Гц, 1H), 1,67 (м, 1H), 1,46 (м, 1H), 1,17 (м, 1H), 0,89-0,85 (м, 6H). 13C ЯМР (125,7 МГц, CD3OD, центральная линия δ 49,0): δ 152,1 (C), 150,8 (CH), 146,7 (C), 129,0 (CH), 115,4 (C), 114,9 (C), 63,1 (CH), 62,1 (CH2), 41,8 (CH2), 36,7 (CH), 27,2 (CH2), 15,0 (CH3), 12,3 (CH3). ESI-HRMS вычислены для C13H22N5O+, (M+H)+, 264,1819, найдено 264,1820.
[0053] Пример J. Синтез (2S)-2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]-2-фенилэтан-1-ола (J.1).
[0054] (2S)-2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]-2-фенилэтан-1-ол (J.1). (2S)-2-амино-2-фенил-этанол (0,150 г, 1,09 ммоль), 9-деазааденин (0,147 г, 1,10 ммоль) и водный раствор формальдегида (37%, 0,098 мл, 1,31 ммоль) смешивали и нагревали в трет-бутаноле (3 мл) при 70°C в течение 16 часов. Для поглощения всех растворителей добавляли силикагель, затем выпаривали растворитель и очищали остаток посредством хроматографии на силикагеле (CHCl3-7M NH3/MeOH, 92:8, затем 89:11, затем 85:15) для получения J.1 в виде бесцветной пены (0,117 г, 38%). 1H ЯМР (500 МГц, CD3OD): δ 8,14 (с, 1H), 7,38-7,31 (м, 5H), 7,28-7,24 (м, 1H), 3,88-3,82 (м, 2H), 3,75 (д, J=13,8 Гц, 1H), 3,65 (дд, J=11,0, 4,9 Гц, 1H), 3,60 (дд, J=11,0, 8,4 Гц, 1H). 13C ЯМР (125,7 МГц, CD3OD, центральная линия δ 49,0): δ 152,0 (C), 150,8 (CH), 146,6 (C), 141,5 (C), 129,6 (CH), 129,0 (CH), 128,8 (CH), 128,6 (CH), 115,5 (C), 114,7 (C), 67,7 (CH2), 65,4 (CH), 41,7 (CH2). ESI-HRMS вычислены для C15H18N5O+, (M+H)+, 284,1506, найдено 284,1501.
[0055] Пример K. Синтез (2R)-2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]-3-[(4-хлорфенил)сульфанил]пропан-1-ола (K.3).
[0056] Трет-бутил(4R)-4-{[(4-хлорфенил)сульфанил]метил}-2,2-диметил-1,3-оксазолидин-3-карбоксилат (K.1).
Этап 1. Метансульфонилхлорид (0,40 мл, 5,19 ммоль) по каплям добавляли к перемешанному раствору трет-бутил(4S)-4-(гидроксиметил)-2,2-диметил-1,3-оксазолидин-3-карбоксилата [полученного, как описано для его энантиомера, Dondoni, et al.13] (1,00 г, 4,32 ммоль) и триэтиламина (1,22 мл, 8,65 ммоль) в CH2Cl2 (15 мл) при 0°C. Смесь нагревали до комнатной температуры и перемешивали в течение 20 мин, затем промывали насыщенным NaHCO3 (3×5 мл), сушили и выпаривали растворитель для получения сырого мезилата в виде маслянистого вещества (1,22 г, 3,94 ммоль).
[0057] Этап 2. 4-Хлорбензол-1-тиол (0,351 г, 2,42 ммоль) добавляли к раствору гидрида натрия (60%, 0,089 г, 2,23 ммоль) в DMF (3 мл) при 0°C. Через 20 мин добавляли раствор мезилата из описываемого выше этапа 1 (0,30 г, 0,97 ммоль) в DMF (0,75 мл) и смесь нагревали до комнатной температуры и перемешивали в течение 16 часов. Добавляли воду (2 мл) и смесь экстрагировали с помощью Et2O (60 мл). Экстракт промывали H2O (3×5 мл), водным раствором солей (5 мл), сушили и выпаривали растворитель до получения бесцветного маслянистого вещества, которое хроматографировали на силикагеле (градиент 0-6% EtOAc в гексанах) для получения K.1 в виде бесцветной смолы (0,234 г, 67%). [α]-17,9 (c 1,05, CHCl3). 1H ЯМР (500 МГц, CDCl3): δ 7,40-7,30 (м, 2H), 7,28-7,22 (м, 2H), 4,11-3,98 (м, 1,5H), 3,94-3,89 (м, 1,5H), 3,50 (д, J=13,7 Гц, 0,5H), 3,27 (д, J=13,4 Гц, 0,5H), 2,79 (дд, J=13,5, 10,7 Гц, 1H), 1,63-1,56 (м, 3H), 1,51-1,42 (м, 12H). 13C ЯМР (125,7 МГц, CDCl3, центральная линия δ 77,0): δ 152,1, 151,4 (C), 134,2, 133,8 (C), 132,5, 131,6 (C), 130,9, 129,3 (CH), 129,1 (CH), 94,5, 93,9 (C), 80,5, 80,3 (C), 66,0 (CH2), 56,6, 56,3 (CH), 35,7, 33,8 (CH2), 28,5, 28,4 (CH3), 27,7, 27,0 (CH3), 24,3, 23,1 (CH3). ESI-HRMS вычислены для C17H2435ClNNaO3S+, (M+Na)+, 380,1058, найдено 380,1056.
[0058] (2R)-2-амино-3-[(4-хлорфенил)сульфанил]пропан-1-ол гидрохлорид (K.2). Соединение K.1 (0,228 г, 0,64 ммоль) растворяли в MeOH (3 мл), охлаждали до 0°C и добавляли водный раствор соляной кислоты (36%, 2 мл). Перемешивали смесь при комнатной температуре в течение 16 часов, затем выпаривали растворитель для получения K.2 в виде бесцветного твердого вещества (0,161 г, 99%). [α]-27,7 (c 1,09, MeOH). 1H ЯМР (500 МГц, CD3OD): δ 7,47 (д, J=8,6 Гц, 2H), 7,36 (д, J=8,7 Гц, 2H), 3,82 (дд, J=11,7, 3,4 Гц, 1H), 3,74 (дд, J=11,7, 5,0 Гц, 1H), 3,30-3,25 (м, 2H), 3,19 (dd. J=16,3, 9,2 Гц, 1H). 13C ЯМР (125,7 МГц, CD3OD, центральная линия δ 49,0): δ 134,31 (C), 134,26 (C), 132,9 (CH), 130,5 (CH), 61,2 (CH2), 53,5 (CH), 34,1 (CH2). ESI-HRMS вычислены для C9H1335ClNOS+, (M-HCl+H)+, 218,0401, найдено 218,0408.
[0059] (2R)-2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]-3-[(4-хлорфенил)сульфанил]пропан-1-ол (K.3). Соединение K.2 (0,151 г, 0,59 ммоль) растворяли в MeOH (10 мл) и нейтрализовали с помощью смолы Amberlyst A21. Затем смесь пропускали через короткую колонку с той же смолой и элюировали с помощью MeOH для получения свободной амино-формы K.2 в виде желтого маслянистого вещества (129 мг). Его растворяли в трет-бутаноле (3 мл), затем добавляли водный раствор формальдегида (37%, 0,060 мл, 0,80 ммоль) и 9-деазааденин (0,080 г, 0,60 ммоль) и перемешивали смесь при 70°C в течение 16 часов. Для поглощения всех растворителей добавляли силикагель, затем выпаривали растворитель и очищали остаток посредством хроматографии на силикагеле (CHCl3-7M NH3/MeOH, 92:8, затем 85:15) и выпаривали фракции, содержащие продукт. Затем очищали остаток на силикагеле (CHCl3-MeOH-28% водн. NH4OH, 92:8:0,5) для получения K.3 в виде бесцветной пены (0,022 г, 10%). 1H ЯМР (500 МГц, CD3OD): δ 8,16 (с, 1H), 7,35 (с, 1H), 7,13-7,08 (м, 4H), 4,02 (д, J=14,0 Гц, 1H), 3,92 (д, J=14,0 Гц, 1H), 3,70 (дд, J=11,3, 5,2 Гц, 1H), 3,66 (дд, J=11,3, 5,2 Гц, 1H), 3,13 (дд, J=13,8, 6,2 Гц, 1H), 2,92 (дд, J=13,8, 6,9 Гц, 1H), 2,75 (м, 1H). 13C ЯМР (125,7 МГц, CD3OD, центральная линия δ 49,0): δ 152,0 (C), 150,8 (CH), 146,5 (C), 135,8 (C), 133,0 (C), 131,8 (CH), 129,8 (CH), 129,1 (CH), 115,5 (C), 114,4 (C), 63,5 (CH2), 57,0 (CH), 41,0 (CH2), 36,1 (CH2). ESI-HRMS вычислены для C16H1835ClN5NaOS+ (M+Na)+, 386,0813, найдено 386,0816.
[0060] Пример L. Синтез (2R)-2-[({4-амино-5H-пирроло[3,2-d]пиримидин-7-ил}метил)амино]-3-(бензилсульфанил)пропан-1-ола (L.3).
[0061] Трет-бутил(4R)-4-[(бензилсульфанил)метил]-2,2-диметил-1,3-оксазолидин-3-карбоксилат (L.1). Фенилметантиол (0,285 мл, 2,42 ммоль) добавляли к перемешанному раствору гидрида натрия (60%, 0,089 г, 2,23 ммоль) в DMF (3 мл) при 0°C. Через 20 мин добавляли раствор сырого мезилата (0,3 г, 0,97 ммоль, из этапа 1 получения K.1) в DMF (0,75 мл), затем смесь нагревали до комнатной