Способ получения 6-дегидро-6-метилгидрокортизона или его эфиров из 21-ацетата гидрокортизона
Иллюстрации
Показать всеИзобретение относится к способу получения 6-дегидро-6-метилгидрокортизона (11β,17α,21-тригидрокси-6-метилпрегна-4,6-диен-3,20-диона) или его эфиров общей формулы I
в которой R=COCF3 или Н; R1=СОСН3 или Н, из 21-ацетата гидрокортизона формулы II, последовательностью превращений, включающей защиту 11β-гидроксильной группы этерификацией производным трифторуксусной кислоты в среде апротонного растворителя в условиях основного катализа с использованием эффективного количества катализатора с образованием 21-ацетокси-17α-гидрокси-11β-трифторацетилоксипрегн-4-ен-3,20-диона формулы III, енолэтерификацию Δ4-3-кетосистемы полученного соединения действием триалкилортоформиата в присутствии кислого катализатора с образованием 3-алкоксиэфира Δ3,5-3-гидроксипроизводного общей формулы IV, конденсацию его с реагентом Манниха, образующимся in situ из формальдегида и вторичного амина, в присутствии кислого катализатора с образованием смеси 6α- и 6β-изомеров 6-(N-метил-N-фенил)-аминометилпроизводного общей формулы V, расщепление полученной смеси стероидных оснований Манниха по связи C-N действием протонной минеральной кислоты в присутствии солей галогеноводородной кислоты с образованием 6-метиленпроизводного формулы VI, изомеризацию 6-экзометиленовой связи в 6,7-эндометиленовую; удаление защитных группировок 11β- и 21-гидроксильных групп полностью или частично; этерификацию 21-гидроксильной группы производным уксусной кислоты в условиях основного катализа. Технический результат: разработан простой способ получения соединения формулы I из 21-ацетата гидрокортизона с выходом целевых продуктов не менее 80%. 54 з.п. ф-лы, 12 пр.
Реферат
Область техники
Настоящее изобретение относится к области органического синтеза, конкретно касается получения стероидных соединений (кортикостероидов), таких как 6-дегидро-6-метилгидрокортизон или его эфиры, и может быть использовано в химической и фармацевтической отраслях промышленности, а также в промышленной биотехнологии, для производства стероидных медицинских препаратов.
Уровень техники
6-Дегидро-6-метилгидрокортизон (11β,17α,21-тригидрокси-6-метилпрегна-4,6-диен-3,20-дион, CAS №85310-39-0) является промежуточным соединением в синтезе 6α-метилгидрокортизона (CAS №1625-39-4), а также 6α-метилпреднизолона (CAS №83-43-2), из гидрокортизона (CAS №50-23-7) или 21-ацетата гидрокортизона (CAS №50-03-3).
Полученные в соответствии с предлагаемым способом 6-дегидро-6-метилгидрокортизон или его эфиры (11-трифторацетат 6-дегидро-6-метилгидрокортизона, 21-ацетат 6-дегидро-6-метилгидрокортизона (CAS №22032-37-7) и 11-трифторацетат 21-ацетата 6-дегидро-6-метилгидрокортизона) не только служат исходными субстратами для дальнейшего превращения в 6α-метилгидрокортизон и 6α-метилпреднизолон (химическим и комбинированным химико-биотехнологическим способами соответственно), но также могут быть использованы для получения 6-дегидро-6-метилпреднизолона (CAS №95810-22-3) химическим или биотехнологическим способами. Кроме того, 6-дегидро-6-метилгидрокортизон и его эфиры могут представлять интерес как самостоятельные лекарственные средства, так как известно, что, например, 21-ацетат 6-дегидро-6-метилгидрокортизона обладает глюкокортикоидной активностью в три раза большей, чем гидрокортизон, и противовоспалительной активностью, превосходящей таковую у гидрокортизона более чем в 8 раз [GB 895817, 1962].
Известные способы введения 6-дегидро-С6-метильного фрагмента с эндометиленовой 6,7-двойной связью в молекулу Δ4-3-кето-стероида можно разделить на 2 группы: 1) дегидрирование соответствующих 6-метил-Δ4-3-кето-стероидов и 2) каталитическая изомеризация 6-экзометиленовой связи замещенных 6-метилен-Δ4-3-кето-стероидов в 6,7-эндометиленовую.
Таким образом, в первом варианте синтез 6-дегидро-С6-метил-производного из Δ4-3-кето-стероида представляет собой процесс, который включает сначала введение метиленовой группы в положение С6, превращение ее в 6(ξ)-метильную группу, а затем дегидрирование с образованием 6,7-двойной связи. Последний этап, согласно литературным данным, проводят с применением в качестве дегидрирующего агента 2,3,5,6-тетрахлор-1,4-бензохинона (хлоранила) [von K.-Н. Bork, F. von Werder, H. Metz, K. Briickner und M. Baumgarth. Synthese eines hochwirksamen, Fluor-freien Glucocorticoid. Liebigs Ann. Chem. 747, 123-132 (1971)].
Применение хлоранила в синтезе 6-дегидро-6-метилгидрокортизона или его 21-ацетата известно.
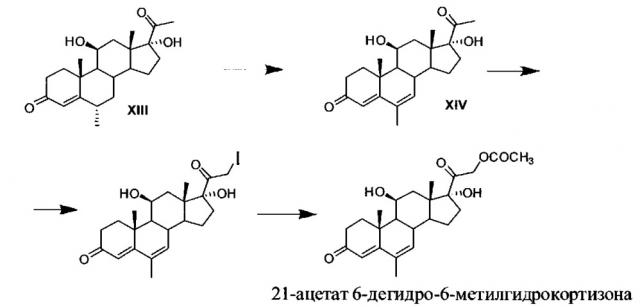
Так, описан способ получения 21-ацетата 6-дегидро-6-метилгидрокортизона [Huang Minion, Han Kuang-Tieng, Chow Wei-Zan. The synthesis of Δ6-6-methyl-steroids. Acta Chimica Sinica, 1963, 29(2), 99-108] из 11β,17α-дигидрокси-6α-метилпрегн-4-ен-3,20-диона (соединение XIII в описанном способе), заключающийся в последовательном введении 6,7-двойной связи и 21-ацетоксилировании образованного 11β,17α-дигидрокси-6-метилпрегна-4,6-диен-3,20-диона (соединение XIV в описанном способе) путем С21-иодирования с последующей трансэтерификацией образованного 21-I-производного взаимодействием с ацетатом калия.
Схема синтеза 21-ацетата 6-дегидро-6-метилгидрокортизона по известному способу [Huang Minlon, Han Kuang-Tieng, Chow Wei-Zan. The synthesis of Δ6-6-methyl-steroids. Acta Chimica Sinica, 1963, 29(2), 99-108].
Для этого 1 г соединения XIII растворяют в смеси 50 мл ледяной уксусной кислоты и 50 мл перегнанного этилацетата и добавляют хлоранил. По окончании реакции реакционную массу упаривают в вакууме досуха, остаток растворяют в хлороформе, отфильтровывают непрореагировавший хлоранил, фильтрат концентрируют, охлаждают, еще раз фильтруют от остатков хлоранила, фильтрат упаривают, полученный маслянистый коричневый остаток растирают в бензоле, твердый порошкообразный продукт отфильтровывают, промывают бензолом. Получают 0,8 г кристаллов соединения XIV. Затем 0,6 г соединения XIV растворяют в смеси 9,5 мл хлороформа и 6 мл метанола, добавляют 0,6 г гидроксида кальция, 50 мг оксида кальция и раствор 0.55 г йода в 2 мл тетрагидрофурана. По окончании реакции осадок отфильтровывают, промывают метанолом, фильтрат и промывку объединяют, упаривают при температуре не выше 30°С в вакууме, к полученному бледно-желтому маслу добавляют несколько мл насыщенного раствора соли, несколько кристаллов тиосульфата натрия и 1 мл 70% уксусной кислоты. Желтоватый осадок отфильтровывают, промывают небольшим количеством ледяной воды и сушат над пятиокисью фосфора в эксикаторе. Получают 0.78 г 21-йодида, который помещают в 5 мл диметилформамида и добавляют 1,5 г ацетата калия. Перемешивают сначала при комнатной температуре в течение 2 ч, затем 1.5 ч при 30°С и далее при 40-50°С в течение 4 ч. Затем реакционную массу охлаждают до 5°С, добавляют насыщенный раствор соли, выпавший осадок отфильтровывают, промывают ледяной водой, сушат в эксикаторе над пятиокисью фосфора. Остаток растворяют в ацетоне, нерастворимые в ацетоне вещества отфильтровывают, фильтрат концентрируют, осадок отфильтровывают, получают 0.4 г кристаллов 6-дегидро-6-метилгидрокортизона 21-ацетата с т.пл. 132-133°С, после повторной перекристаллизации т.пл. 141-143°С.
Также известны способ получения 6-метил-11β,17α,21-тригидроксипрегна-4,6-диен-3,20-диона или его 21-ацилата [GB 895817, 1962] и способ получения 6-метил-11,17α-дигидроксилированных 4,6-прегнадиенов [US 3031476, 1962], согласно описанию которых (примеры 1) 21-ацетат 6,7-дегидро-6-метилгидрокортизона получают взаимодействием 21-ацетата 6α-метилгидрокортизона с хлоранилом в среде 240 мл третичного амилового спирта при кипячении в течение 6 ч в токе азота. По окончании реакции смесь охлаждают и упаривают в вакууме досуха. Твердый остаток растворяют в ~100 мл эфира и фильтруют через бумажный фильтр от нерастворенного хлоранила. Хлоранил промывают эфиром на фильтре. Объединенный эфирный фильтрат промывают 2% раствором гидроксида натрия и далее водой до нейтральной реакции, затем насыщенным раствором хлорида натрия. Эфирный раствор сушат над сульфатом натрия и упаривают досуха, остаток кристаллизуют из ацетона. Получают 2,65 г (66,5%) 6-дегидро-6-метилгидрокортизона 21 ацетата в виде сольвата с ацетоном с т.пл. 133-137°С, образование и структура которого подтверждены элементным анализом и низкой температурой плавления, которая остается неизменной при высушивании в течение 4 ч при температуре 94-100°С. Полученный эфир гидролизуют с гидроксидом калия или карбонатом калия в метаноле или этаноле при комнатной температуре в атмосфере азота с образованием свободного триола - 6-метил-11β,17α,21-тригидрокси-4,6-прегнадиен-3,20-дионастлл. 190-194°С.
Известен способ получения 21-ацетата 6,7-дегидро-6-метилгидрокортизона [US 2010256105, 2010, интермедиат 3] дегидрированием 0,25 г 6α-метил-предшественника (интермедиат 2) путем взаимодействия с хлоранилом (0.5 г) в смеси 6,2 мл этилацетата и 1,25 мл уксусной кислоты. Смесь, перемешивая на магнитной мешалке, дегазируют азотом, нагревают до 85°С, затем оставляют на ночь при комнатной температуре. Смесь фильтруют, осадок промывают этилацетатом, фильтрат разбавляют этилацетатом и промывают раствором Na2CO3. Водную фазу экстрагируют этилацетатом, объединенные органические экстракты промывают 1М NaOH, водой и рассолом, сушат над Na2SO4. Растворитель упаривают в вакууме до зеленоватого остатка, который растворяют в дихлорметане и раствор упаривают досуха с образованием 0,27 г целевого продукта в виде коричневатой сухой пены. Далее без кристаллизации 0,25 г пены 21-ацетата 6,7-дегидро-6-метилгидрокортизона растворяют в 30 мл метанола и добавляют 6 мл 1М NaOH. Реакционную массу перемешивают в течение 3 ч, подкисляют 7 мл 1М HCl, органический растворитель удаляют в вакууме, полученный остаток экстрагируют этилацетатом. После промывки экстракта рассолом, осушки и упаривания в вакууме получают 220 мг 6,7-дегидро-6-метилгидрокортизона (интермедиат 4) в виде оранжевой пены, которая используется в последующем синтезе без кристаллизации.
Вторым известным путем введения 6-дегидро-С6-метильного фрагмента с эндометиленовой 6,7-двойной связью в молекулу стероида является изомеризация предварительно введенной в положение С6 Δ4-3-кето-стероида экзометиленовой группы. Этот путь наиболее привлекателен, так как не требует предварительного превращения 6-экзометиленовой группы в 6-метильную.
Таким образом, очевидно, что для введения 6-дегидро-С6-метильного фрагмента в молекулу 21-ацетата гидрокортизона необходимо предварительное введение экзометиленовой группы в положение С6.
Введение С6-метиленовой группы осуществляют различными методами, используя формальдегид или его производные как метиленирующие агенты. Однако все способы предусматривают обязательную предварительную енолизацию α,β-ненасыщенного кетона кольца А, необходимую для поляризации системы двойных связей с образованием нуклеофильного атома углерода С6, с последующим замещением атома водорода при С6 на формильную или метиленовую группу и различаются тем, что в одних случаях образованный промежуточный 3,5-диенол выделяют в виде эфира [D.Burn, D.N. Kirk and V. Petrow. Modified steroid hormones - XXXVIII. Some transfotmations of steroidal 3-alkoxy-6-formyl-3,5-dienes and related compounds. Tetrahedron, 1965, 21(6), 1619-1624] или 3,5-диенамина [F. Schneider, A. Boiler, M. , P. and A. den Verlauf der Umsetzung von Steroid-3,5-dienaminen mit Formaldehyd. Helv. Chim. Acta, 1973, 56(7), 2396-2404], в других же случаях енолизация проводится in situ без выделения промежуточного продукта.
Наиболее привлекательными являются методы так называемой прямой конденсации с формальдегидом или его производными. Это метод прямого γ-метиленирования, предложенный Анненом и соавт. [US 4322349, 1982; ЕР 0100874, 1984; ЕР 0149222, 1985; K. Annen, Н. Hofmeister, Н. Laurent, and R. Wiechert. A Simple Method for 6-Methylenation of 3-Oxo-Δ4-steroids. Synthesis, 1982(1), 34-40], и метод конденсации с реагентом Манниха [R. Bohlmann et al, DE 4121484, 1993].
Метод прямого γ-метиленирования заключается во взаимодействии стероида с производными формальдегида (такими как диметилацеталь, диэтилацеталь формальдегида или метоксиметилацетат) в хлорсодержащих растворителях при температуре кипения в присутствии избытка хлорокиси фосфора и ацетата натрия. Однако этот метод непригоден для метиленирования соединений, содержащих незащищенную 11β-гидроксильную группу. Так, при прямом γ-метиленировании 21-ацетата гидрокортизона выход 6-метиленпроизводного составляет всего лишь 18% [K. Annen, Н. Hofmeister, Н. Laurent, and R. Wiechert. A Simple Method for 6-Methylenation of 3-Oxo-Δ4-steroids. Synthesis, 1982(1), 34-40, Таблица 1, соединение 6n].
Известно также, что енолэтерификация Δ4-3-кетосистемы кольца А стероидов, катализируемая п-толуолсульфокислотой (п-ТСК), в присутствии незащищенной 11β-гидроксильной группы может сопровождаться нежелательной реакцией ее элиминирования с образованием Δ9(11)-связи [Q. Zhao and Z. Li. A Convenient Syntheses of 9(11)-Dehydrosteroids from 11β-Hydroxysteroids. Synth. Commun., 1993, 23(10), 1473-1478]. Поэтому для сохранения 11β-гидроксильной группы необходима ее защита.
Известно, что для защиты 11β-гидроксигруппы ее обычно этерифицируют, превращая в тригалогенацетат (в частности трифторацетат) или триметилсилиловый эфир. Эти защиты считаются наиболее приемлемыми, так как не только легко образуются, но и легко удаляются. Применение для защиты 11β-гидроксигруппы метода этерификации ангидридами низших кислот возможно, однако ограничено из-за проблем, возникающих при их последующем удалении химическими методами сольволиза.
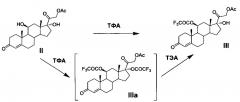
Способы применения трифторацетатной защиты 11β-гидроксильной группы молекулы 21-ацетата гидрокортизона (II) известны. Это способ, описанный в патенте [US 4330541, 1982, пример 1], который заключается в том, что реакцию этерификации 5 г 21-ацетата гидрокортизона проводят в среде пиридина действием трифторуксусного ангидрида при температуре минус 15°С. Далее смесь выливают в водный раствор хлорида натрия, отфильтрованный осадок растворяют в дихлорметане, органический раствор промывают водой, осушают сульфатом натрия и упаривают досуха. Получают 5.1 г (82,4%) остатка, содержащего 11-трифторацетокси-производное (III) 21-ацетата гидрокортизона (II). Однако это соединение не было охарактеризовано, так как содержащий его остаток без очистки и выделения кристаллического продукта был использован авторами патента на следующей стадии химического синтеза.
Другие патенты [DE 1112511, 1961 (пример 16) и DE 1125422, 1962 (пример 15)] описывают способ получения 11-трифторацетокси-производного (III) из 21-ацетата гидрокортизона (II) действием трифторуксусного ангидрида в среде абсолютного диоксана. После 18 ч выдержки при комнатной температуре реакционную смесь выливают на ледяную воду. Далее продукт экстрагируют, экстракт промывают водой, упаривают досуха в вакууме. После кристаллизации остатка в эфире и хроматографирования на окиси алюминия получают 11-трифторацетокси-производное (III) 21-ацетата гидрокортизона (II), выход которого не указан. Продукт охарактеризован: т.пл. 206-207°С, [α]D +165,7° (хлф); λmax 238-240 mμ. Спектральная характеристика отсутствует.
Получение метилового 3,5-диенолэфира 11-трифторацетокси-производного 21-ацетата гидрокортизона - соединения IVa - в литературных источниках не описано.
Получение этилового 3,5-диенолэфира 11-трифторацетокси-производного 21-ацетата гидрокортизона - соединения IVb - описано в патентах [DE 1112511, 1961 (пример 16) и DE 1125422, 1962 (пример 15)] и заключается в реакции соединения III с триэтилортоформиатом в среде диоксана в присутствии п-ТСК при комнатной температуре. После окончания реакции смесь выливают в воду и экстрагируют дихлорметаном. Экстракт промывают водой, осушают сульфатом натрия и упаривают досуха. Маслянистый остаток, содержащий соединение IVb, выход которого не указан, охарактеризован: [α]D ±0° (хлф); λmax 240-242 mμ, log ε 4,15. Соединение IVb не было выделено авторами в кристаллическом виде. Спектральная характеристика, отсутствует, температура плавления не определена.
6-Аминометильные производные общей формулы V являются новыми соединениями, в литературе не описаны.
6-Метилен-производное 11-трифторацетокси-производного 21-ацетата гидрокортизона - соединение VI - является новым соединением, в литературе не описано.
6-Дегидро-6-метил-производное 11-трифторацетокси-производного 21-ацетата гидрокортизона - соединение VII - является новым соединением, в литературе не описано.
Соединение VIII - 17α,21-дигидрокси-11β-трифторацетилокси-6-метилпрегна-4,6-диен-3,20-дион (11-трифторацетат 6-дегидро-6-метилгидрокортизона) - является новым соединением, в литературе не описано.
Соединение IX - 21-ацетокси-11β-17α-дигидрокси-6-метилпрегна-4,6-диен-3,20-дион (21-ацетат 6-дегидро-6-метилгидрокортизона) - известно. Известен способ получения 6-дегидро-С6-метил-производного гидрокортизона с защищенной 21-гидроксильной группой, но свободными 11β- и 17α- гидроксильными группами, каталитической изомеризацией 6-экзометиленовой связи [D. Burn, J.P. Yardley, and V. Petrow. Modified steroid hormones - LI: Application of the Vilsmeier reaction to 11β-hydroxy steroids. Tetrahedron, 1969, 25(5), 1155-1158], согласно которому 21-ацетат 6-метилен-гидрокортизона (1.75 г) в этаноле (35 мл) кипятят при перемешивании с 5% Pd/C (0.5 г), медленно добавляя 5% раствор бензилового спирта в этаноле (10 мл). После 1 ч выдержки определяют завершение реакции по изменению λmax от 260 mμ до 289 mμ в УФ спектре пробы. Затем катализатор удаляют фильтрацией, растворитель упаривают при пониженном давлении, остаток кристаллизуют из смеси хлороформа и ацетона. Получают 21-ацетокси-6-метил-4,6-прегнадиен-11β,17α-диол-3,20-дион (1.75 г) в виде сольватированных кристаллов с двойной т.пл. 147°С (вскипание) и 198°С. Следует отметить, что из уровня техники хорошо известно, что 11 (α или β)-гидрокси-прегнаны, в частности, производные гидрокортизона, способны образовывать стабильные кристаллические аддукты (сольватные комплексы) с хлорированными углеводородами (производными метана или этана), в частности, с хлороформом. Подобные аддукты (сольваты) гидрокортизона, эпи-гидрокортизона и их производных, в которых 1 моль стероида ассоциирован с 1 молем растворителя, характеризуются плохой растворимостью и относительно высокой стабильностью при повышенных температурах, при этом разрушение сольвата, содержащего ~22% хлороформа, осуществляют растворением аддукта с хлороформом в сольват-необразующем растворителе, например, метаноле, и удалением хлороформа методом азеотропной отгонки [US 2849460, 1955].
Известен способ получения 6-дегидро-С6-метил-производного гидрокортизона с защищенными 17α- и 21-гидроксильными группами, но свободной 11β-гидроксильной группой [O.I. Fedorova, S.D. Shuvalova, L.M. Alekseeva, G.S. Grinenko. Method of synthesis and technology of drug manufacture. Pharmaceutical Chemistry Journal, 1982, 16(11), 860-862] каталитической изомеризацией 6-метилен-предшественника. Для этого авторы нагревают раствор 17α-20:20,21-бисметилендиокси-6-метиленпрегн-4-ен-11β-ол-3-она (0,34 г) в 13 мл ледяной уксусной кислоты до 80°С в течение 1 ч в присутствии циклогексена (0,5 мл) в качестве донора водорода и 5% палладия на угле (70 мг). После этого катализатор отфильтровывают, растворители упаривают в вакууме до половины объема, к остатку добавляют эфир, охлаждают и осадок отфильтровывают. Получают 17α-20:20,21-бисметилендиокси-6-метилпрегна-4,6-диен-11β-ол-3-он (185 мг, выход 54,4%), который далее перекристаллизовывают из водного диоксана.
Известен способ получения 6-метил-3-оксо-дельта-4,6-стероидов изомеризацией соответствующих 6-метилен-прегн-4-ен-3-кето-соединений [US 3705181, 1972] обработкой сильной кислотой, предпочтительно арил- или алкил-сульфоновой кислотой, серной или хлорной кислотой, также предпочтительно в присутствии ацилирующего агента, такого как ангидрид или хлорангидрид карбоновой кислоты, согласно которому 17α-гидрокси-6-метилен-прогестерон или его ацетат обрабатывают уксусным ангидридом в присутствии п-толуолсульфокислоты в среде бензола в течение 4-5 ч при температуре кипения. Полученный технический продукт (с выходом от 46 до 88,7%) очищают колоночной хроматографией или перекристаллизацией. Однако в описании этого патента отсутствует упоминание возможности применения известного способа для синтеза 6-дегидро-6-метилгидрокортизона или его эфиров. Отличительным свойством этого способа является сопутствующее ацетилирование 17α-гидроксильной группы (пример 1 способа), что ограничивает область его применения.
Известен способ получения медрогестона (6,17α-диметилпрегна-4,6-диен-3,20-диона) из 17α-метил-6-метиленпрегн-4-ен-3,20-диона палладий-катализируемой изомеризацией [US 2006178520, 2006]. Согласно способу 17α-метил-6-метиленпрегн-4-ен-3,20-дион изомеризуют в медрогестон в С1-4-спирте или в смеси таких спиртов в присутствии палладиевого катализатора (5% Pd/C, или 5% Al2O3), при температуре от 60 до 95°С (температуре кипения растворителя) в течение от 30 мин. до 1.5-3 ч. Катализатор отфильтровывают, промывают спиртом, фильтрат концентрируют в вакууме, кристаллы осаждают добавлением воды. После фильтрации, промывки и сушки осадка получают медрогестон с выходом от 80,5% до 93%. Однако в описании этого патента отсутствует пример применения известного способа для синтеза 6-дегидро-6-метилгидрокортизона или его эфиров из 6-метилен-аналогов.
Соединение формулы 1 (6-дегидро-6-метилгидрокортизон) известно. Однако в литературе описано его получение из другого соединения другим способом [O.I. Fedorova, S.D. Shuvalova, L.M. Alekseeva, G.S. Method of synthesis and technology of drug manufacture. Grinenko. Pharmaceutical Chemistry Journal, 1982, 16(11), 860-862], а именно из 17α-20:20,21 -бисметилендиокси-6-метилпрегна-4,6-диен-11β-ол-3-она удалением бисметиленовой защиты диоксиацетоновой боковой цепи в среде уксусной кислоты при температуре 0-11°С действием концентрированной соляной кислоты (на 0.5 г стероида используют 2 мл уксусной кислоты и 15 мл соляной кислоты). Через 30 мин реакционную массу выпивают на лед, смесь экстрагируют хлористым метиленом, экстракт промывают насыщенным раствором бикарбоната натрия, упаривают до 1,5 мл, охлаждают, осадок отфильтровывают. Получают 6-дегидро-6-метилгидрокортизон с т. пл. 186-187°С. Выход не указан.
Таким образом, описанные выше способы каталитической изомеризации не описывают получение 6-дегидро-6-метилгидрокортизона с защищенными 11β- и 21-гидроксильными группами и незащищенной 17α-гидроксильной группой.
Наиболее близким по сущности введения 6-дегидро-С6-метильного фрагмента в молекулу Δ4-3-кето-прегнана к заявляемому способу является «Способ получения 17αльфа-ацетокси-6-метиленпрегн-4-ен-3,20-диона, медроксипрогестерона ацетата и мегестрола ацетата» [DE 102007026636, 2008]. Согласно этому способу суспензию 17αльфа-ацетокси-прегн-4-ен-3,20-диона в 2-х частях диметилового эфира этиленгликоля и 0,6 части триэтилортоформиата перемешивают при нагревании, затем добавляют 0,05 части метансульфоновой кислоты и перемешивают до полной конверсии. После добавления 0,3 части N-метиланилина и 4 частей диметилового эфира этиленгликоля добавляют в течение 30 мин. 0,23 части формальдегида (около 37%). Затем реакционную смесь перемешивают при температуре не менее 40°С. После завершения реакции реакционную смесь охлаждают, добавляют 4,8 части воды и перемешивают до осаждения осадка. Влажное вещество отделяют и перемешивают в 2,8 части диизопропилового эфира, фильтруют и промывают диизопропиловым эфиром. Полученное 6-метил-аминосоединение суспендируют в 4 частях диметилового эфира этиленгликоля и при охлаждении добавляют одну часть концентрированной соляной кислоты. После полного превращения при комнатной температуре твердое вещество отделяют, промывают диметиловым эфиром этиленгликоля, а затем промывают метанолом. Влажное вещество суспендируют в 1,4 части диметилформамида при нагревании. Кристаллы центрифугируют при комнатной температуре и промывают диметилформамидом, а затем водой. После сушки получают 0.83 части 17α-ацетокси-6-метиленпрегн-4-ен-3,20-диона. Далее суспензию 1 части 17α-ацетокси-6-метиленпрегн-4-ен-3,20-диона, 0,1 части ацетата натрия и 0,06 части катализатора Pd/C в 10 частях этанола и 0,01 части 4 метил-1-циклогексена нагревают при перемешивании с обратным холодильником, полноту изомеризации определяют методом тонкослойной хроматографии. Затем добавляют 1,5 части этанола и фильтруют в горячем состоянии от катализатора, который промывают горячим этанолом. Объединенные промывные жидкости и фильтрат концентрируют до 3-х частей. Для полного осаждения добавляют 7,5 части воды, кристаллы отделяют и промывают водой. После сушки получают 0,98 части мегестрола ацетата, который растворяют в 12 частях метанола при нагревании. Смесь концентрируют до остаточного объема 2,4 части, охлаждают и центрифугируют. Влажное вещество растворяют в 12 частях метанола при нагревании, охлаждают и концентрируют до остаточного объема 2-х частей. Твердое вещество отделяют, промывают метанолом и растворяют в 8 частях ацетона. После добавления 0,05 части активированного угля нагревают до кипения, отфильтровывают активированный уголь и фильтрат концентрируют до 1 части остаточного количества. Суспензию охлаждают, кристаллы отделяют и промывают ацетоном. После высушивания получают 0,85 частей ацетата мегестрола. Таким образом, выход на стадии изомеризации составляет 98%; а для очищенного продукта - 85%.
Однако этот способ не описывает получение 6-дегидро-С6-метилгидрокортизона или его эфиров. Способ, описанный в патенте [DE 102007026636, 2008] для получения конкретного соединения, а именно, мегестрола ацетата из ацетата 17α-гидроксипрогестерона, не может рассматриваться как общий способ введения 6-дегидро-С6-метильного фрагмента в молекулу Δ4-3-кето-стероида. Применение указанного в патенте способа для эффективного получения 6-дегидро-С6-метилгидрокортизона или его эфиров не является очевидным, так как специалисту, работающему в области органической химии, в частности в области химии стероидных соединений, хорошо известно, что применимость и эффективность метода существенно зависят от наличия в структуре исходного Δ4-3-кето-прегнана других заместителей в кольцах А, В, С и D и их природы, например, наличия гидроксильных групп. Молекула гидрокортизона отличается от молекулы 17α-гидроксипрогестерона наличием дополнительно двух гидроксильных групп в положениях С11 и С21. Следует отметить, что согласно описанию патента [DE 102007026636, 2008] в синтезе использован 17α-гидроксипрогестерон, единственная гидроксильная группа которого защищена образованием эфира уксусной кислоты.
Раскрытие изобретения
Технической задачей в заявленном изобретении является разработка более простого способа получения 6-дегидро-6-метилгидрокортизона или его эфиров из 21-ацетата гидрокортизона при обеспечении выхода целевых продуктов не менее чем 80%.
Упрощение способа обеспечивается 1) за счет проведения последовательных реакций функционализации положения С6 молекулы 11-трифторацетокси-производного 21-ацетата гидрокортизона (III) с образованием 21-ацетокси-11-трифторацетилокси-6-метилен-гидрокортизона (VI) при температуре окружающей среды (т.е. при комнатной температуре) без применения нагрева реакционных масс; 2) за счет проведения непрерывного технологического процесса функционализации положения С6 молекулы 11-трифторацетокси-производного 21-ацетата гидрокортизона (III) без выделения интермедиатов IV и V целевого продукта (VI) на ключевых стадиях синтеза и исключения тем самым не только потерь указанных интермедиатов IV и V в маточных растворах, но и механических потерь, которые обычно имеют место на технологических операциях экстракции, фильтрации, сушки и т.п.; 3) за счет достижения практически полной конверсии исходных продуктов и высокой селективности реакций образования интермедиатов IV и V и целевого продукта VI в процессе функционализации положения С6 молекулы 11-трифторацетокси-производного 21-ацетата гидрокортизона (III) и тем самым снижения вероятности протекания побочных реакций; 4) за счет практически полного исключения образования побочных продуктов и осмоления реакционной массы на стадиях каталитической изомеризации и удаления защитных группировок. В результате достигается высокий выход конечных продуктов I, VII, VIII и IX (от 80% до 92% и более), считая из 21-ацетата гидрокортизона (II).
Техническая задача решается способом получения 6-дегидро-6-метилгидрокортизона или его эфиров общей формулы (I)
где R=COCF3 или Н, R1=СОСН3 или Н
из 21-ацетата гидрокортизона формулы (II),
включающим предварительную защиту 11β-гидроксильной группы молекулы 21-ацетата гидрокортизона методом этерификации ангидридом трифторуксусной кислоты в условиях основного катализа с использованием каталитических количеств катализатора, последующее С6-метиленирование образовавшегося 21-ацетокси-17α-гидрокси-11β-трифторацетилокси-прегн-4-ен-3,20-диона, каталитическую изомеризацию 6-экзометиленовой связи полученного 6-метиленпроизводного в 6,7-эндометиленовую с образованием 21-ацетокси-17α-гидрокси-11β-трифторацетилокси-6-метилпрегна-4,6-диен-3,20-диона, одновременное, поэтапное или последовательное удаление защиты 11β- и 21- гидроксильных групп методами химического сольволиза, или поэтапную (последовательную) защиту гидроксильных групп 11β,17α,21-тригидрокси-6-метил-прегна-4,6-диен-3,20диона с образованием 21-ацетокси-17α-гидрокси-11β-трифторацетилокси-6-метилпрегна-4,6-диен-3,20-диона через 21-ацетокси-11β,17α-дигидрокси-6-метилпрегна-4,6-диен-3,20-дион.
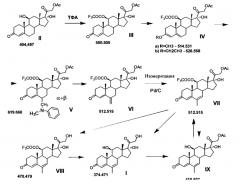
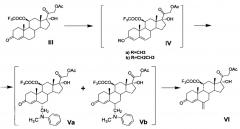
Ниже представлена предлагаемая схема синтеза 6-дегидро-6-метилгидрокортизона (I) или его сложных эфиров (VII, VIII и IX) из 21-ацетата гидрокортизона (II).
Схема включает 5 (для VII), или 6 (для I и VIII), или 7 (для IX) химических реакций, которые могут быть проведены в 3, или 4, или 5 технологических стадий соответственно. Химическая схема синтеза включает: 1) защиту 11β-гидроксильной группы молекулы 21-ацетата гидрокортизона (II) образованием 11β-трифторацетилокси-производного (III); 2) енолизацию α,β-ненасыщенного кетона кольца А соединения III с образованием 3,5-диенолэфира (IV); 3) реакцию трехкомпонентной конденсации по типу реакции Манниха с образованием смеси С6-аминометильных производных (V); 4) расщепление аминометильных производных (V) по связи C-N с образованием С6-метилен-производного (VI); 5) реакцию каталитической изомеризации 6-экзометиленовой связи в 6,7-эндометиленовую с образованием соединения VII; 6) удаление защитных группировок молекулы соединения VII полностью с образованием 6-дегидро-6-метилгидрокортизона (I) или частично по гидроксильной группе С21 с образованием соединения VIII, при этом 6-дегидро-6-метилгидрокортизон (I) может быть превращен в его 21-ацетокси-производное (IX) ацетилированием в условиях основного катализа, из которого затем может быть получено соединение VII.
Сущность заявленного изобретения, касающегося получения 6-дегидро-6-метилгидрокортизона или его эфиров, заключается в том, что с целью повышения выхода и упрощения процесса 21-ацетат гидрокортизона сначала подвергают предварительной защите 11β-гидроксильной группы, затем метиленированию положения С6, изомеризации экзометиленовой группы при С6 в 6,7-эндометиленовую, удалению защитных группировок.
Преимущества заявляемого способа состоят в следующем:
- проведение трифторацетатной защиты 11β-гидроксильной группы 21-ацетата гидрокортизона и селективной деэтерификации побочного продукта реакции этерификации 11,17-бис(трифторацетата) 21-ацетата гидрокортизона с регенерацией 17α-гидроксильной группы осуществляется в одну химическую стадию без выделения целевого продукта;
- проведение конденсации с реагентом Манниха в присутствии свободного гидроксила при С17 в мягких условиях (при комнатной температуре) исключает появление нежелательных продуктов (дегидратации 17α-гидроксигруппы с образованием Δ16-связи и D-гомоаннелирования с образованием 6-членного кольца D), что подтверждается данными ЯМР-спектроскопии;
- региоселективность расщепления стероидного основания Манниха минеральной кислотой исключительно по связи C-N обеспечивается присутствием в реакционной среде соли галогенводородной кислоты и щелочного, или щелочноземельного металла, или аммония;
- отсутствие необходимости использования многократной кристаллизации 11-трифторацетокси-производного 21-ацетата 6-дегидро-6-метилгидрокортизона или хроматографирования с целью его очистки, так как содержание основного вещества в продукте составляет 90-95% (ВЭЖХ), что соответствует требованиям, например, последующего процесса введения 1,2-двойной связи (химическим или биотехнологическим методом) или процесса гидрирования 6,7-двойной связи с образованием 11-трифторацетокси-производного 21-ацетата 6α-метилгидрокортизона;
- отсутствие необходимости использования многократной кристаллизации 6-дегидро-6-метилгидрокортизона или хроматографирования с целью его очистки, так как удаление защитных групп приводит к незначительному появлению побочных соединений; при этом содержание основного вещества в продукте составляет 90-95% (ВЭЖХ), что соответствует требованиям, например, последующего процесса введения 1,2-двойной связи (химическим или биотехнологическим методом) или процесса гидрирования 6,7-двойной связи с образованием 6α-метилгидрокортизона;
- реакции трифторацетилирования, енолэтерификации, конденсации с реагентом Манниха, дезаминирования стероидного основания Манниха проводятся при комнатной температуре;
- значительное сокращение потерь основного продукта на стадиях, что обеспечивается высокой селективностью химических реакций и возможностью совмещения химических стадий в один технологический процесс без выделения интермедиатов, позволяет существенно увеличить достигаемый общий выход 6-дегидро-6-метилгидрокортизона или его эфиров (21-ацетата, или 11-трифторацетата, или 11-трифторацетата-21-ацетата) из 21-ацетата гидрокортизона до 80,5%, или 80,0-92,17% соответственно.
Осуществление изобретения
21-Ацетат гидрокортизона (II), CAS №50-03-3, С23Н32О6 (качество USP, или ЕР, или BP), является коммерчески доступным, может быть приобретен, например, у компании Steraloids (USA), или у других производителей. 4-Диметиламинопиридин (≥99.0%), ангидрид трифторуксусной кислоты (≥99.0%), ангидрид уксусной кислоты (≥99.0%), триметилортоформиат (≥99.0%), триэтилортоформиат (≥98.0%), 5-сульфосалициловая кислота (≥99.0%), п-толуолсульфокислота (≥98.0%), N-метиланилин (≥98.0%), циклогексен (≥99.0%), триэтиламин (≥99.0%) являются коммерчески доступными, были приобретены у компании Sigma-Aldrich Со. Другие реагенты, растворители и инертные газы являются коммерчески доступными, были приобретены у российских производителей.
Для выделения продуктов по окончании реакций выливанием реакционных масс в воду, а также для промывки осадков, экстрактов в органических растворителях, использовали питьевую водопроводную воду, если не оговорено особо. Для приготовления водных растворов кислот, хлорида натрия, аммиака и гидроксида натрия использовали дистиллированную воду.
Все процедуры, если не оговорено особо, осуществляли при комнатной температуре или температуре окружающей среды, то есть в диапазоне от 20 до 25°С. Для процессов, требующих более низкие температуры, чем комнатная, охлаждение обеспечивали холодной водопроводной водой (в диапазоне от 10 до 20°С), или смесью колотого льда и холодной воды (в диапазоне от 5 до 10°С) или смесью колотого льда и хлорида кальция (при температуре ниже 5°С). Для обогрева при проведении реакций при температуре выше комнатной и для упаривания растворителей при атмосферном давлении использовали электрический колбонагреватель.
Упаривание растворителей в вакууме осуществляли с использованием ротационного вакуумного испарителя Rotavapor ( Labortechnik AG), при остаточном давлении 0,35±0,05 кгс/см2 (35±5 кПа) и температуре воды в бане в диапазоне от 35-50°С в зависимости от природы упариваемого растворителя.
Высушивание кристаллов продуктов до постоянного веса осуществляли при температуре 35-45°С при атмосферном давлении или с использованием вакуум-сушильного шкафа при остаточном давлении 0,35±0,05 кгс/см2 (35±5 кПа).
Для определения рН промывных вод использовали универсальную индикаторную бумагу с диапазоном значений от 0 до 12 (Лахема, Чехия).
Сухие (безводные) растворители (ацетон, триэтиламин, метанол, этанол) получали общеизвестными методами органической химии.
Колоночную хроматографию осуществляли на колонке (16×650 мм), используя силикагель марки Silica gel 60 (0.040-0.063 мм) (Merck, Germany).
Контроль за ходом реакций осуществляли методом тонкослойной хроматографии (ТСХ), используя пластины Silica gel 60 F254 (Merck, Germany). УФ-спектроскопическое определение окончания реакции изомеризации 6-метиленовой связи соединения VI проводили на УФ-спектрофотометре Cary 60 Agilent, измеряя соотношение оптических плотностей раствора пробы реакционной массы при длинах волн D286 и D258.
Структуру и чистоту всех выделенных соединений подтверждали, по меньшей мере, одним из следующих методов: ТСХ (пластины для ТСХ Silica gel 60 F254 (Merck, Germany)), масс-спектрометрия, элементный анализ или ядерный магнитный резонанс (ЯМР), высокоэффективная жидкостная хроматография (ВЭЖХ).
Температуру плавления выделенных соединений определяли на приборе для определения точки плавления М-565 ( Labortechnik AG).
1Н- и 13С- ЯМР спектры были определены на спектрометре Bruker Avance-400 (Bruker BioSpin GmbH) с рабочей частотой 400 МГц и 100.6 МГц соответственно, используя дейтерированный хлороформ (99,8% D, Sigma-Aldrich), или дейтерированный диметилсульфоксид (99,9% D, Sigma-Aldrich) в качестве растворителя относительно тетраметилсилана (TMS NMR grade ≥99,9%, Sigma-Aldrich) в качестве внутреннего стандарта, в миллионных долях (м.д.).
Элементный анализ был выполнен с использованием анализатора Vario MICRO Cube (Elementar Analysensysteme, GmbH).
ВЭЖХ-анализ проводили на хроматографе Knauer Smartline (Germany), укомплектованном градиентным HPLC-насосом, ячейкой для термостатированной колонки, инжектором, диодно-матричным детектором Smartline 2600, интегратором-компьютером, при температуре 24°С, скорости потока 1 мл/мин и УФ-детектировании при длине волны 254 нм. В качестве неподвижной фазы и