Способ концентрирования клеточного материала в экссудатах для цитологического исследования злокачественных новообразований
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к цитологии, и раскрывает способ концентрирования клеточного материала в экссудатах для цитологического исследования злокачественных новообразований. Способ характеризуется тем, что получают экссудат путем лапароцентеза или пневмоцентеза, добавляют к нему раствор антикоагулянта цитрата натрия 5% в соотношении 10:1, переносят экссудат в капельную воронку и отстаивают в течение 60 минут до образования обогащенного придонного слоя, после чего переносят 20–50 мл придонного обогащенного слоя экссудата из капельной воронки в центрифужные пробирки и центрифугируют, сливают надосадочную жидкость, переносят концентрированный клеточный осадок на предметное стекло и проводят цитологическое исследование. Способ позволяет повышать точность цитологической диагностики злокачественных новообразований и может быть использован в онкологии, гинекологии и клинической лабораторной диагностике. 8 ил., 1 табл., 1 пр.
Реферат
Изобретение относится к области медицины, в частности к диагностике физиологических состояний человеческого организма путем исследования биологического материала (асцитического и плеврального экссудатов) in vitro для цитологического и иммуноцитохимического исследований. Изобретение может быть использовано в онкологии, гинекологии, терапии, фтизиатрии и клинической лабораторной диагностике.
Основным условием первичной диагностики злокачественных новообразований, при наличии асцита и/или плеврита, является достаточное количество клеточного материала в экссудате для проведения цитологического исследования. Несмотря на большие достижения в цитологической диагностике, особенно за последние годы, исследование экссудатов является сложной диагностической задачей [4 стр. 5]. Злокачественные клетки в экссудатах плевральных и абдоминальных полостей не всегда удается обнаружить даже при поздних стадиях заболевания в силу недостаточного количества клеток в исследуемом материале. А своевременное установление распространенности опухолевого процесса, до появления клинических проявлений заболевания, имеет немаловажное значение для правильного выбора и своевременного начала лечения. Точность традиционного цитологического исследования экссудатов брюшной и плевральных полостей составляет не более 60%, что крайне недостаточно для установления правильного морфологического диагноза при злокачественных новообразованиях [3 стр. 53]. Основной причиной, обуславливающей невысокую достоверность исследования, является недостаточное количество клеточного материала в исследуемом экссудате.
Известен традиционный способ концентрации клеток в экссудатах, который заключается в повторном центрифугировании. Если при центрифугировании прозрачной серозной жидкости осадок образуется незначительный или он совсем не определяется, то на осадок, образовавшийся при центрифугировании первой порции экссудата, наливают до 5–6 порций выпота и повторно центрифугируют. Это трудоемкая процедура и не всегда позволяет получить в цитологических препаратах достаточное количество клеток, необходимое для морфологической диагностики злокачественных новообразований [2 стр. 8–9].
Известен способ седиментации, который заключается в осаждении дисперсной фазы из дисперсионной среды под действием силы тяжести для концентрирования дисперсионной фазы [1 стр. 338–339]. Этот способ применяется в том числе для разделения дисперсионной системы. Несмотря на то, что экссудат является дисперсионной системой, способ седиментации не используется для концентрирования клеточного материала в выпотных жидкостях при проведении цитологических исследований.
Цель изобретения – повышение точности цитологической диагностики злокачественных новообразований.
Для достижения указанной цели предложен cпособ концентрирования клеточного материала в экссудатах для цитологического исследования злокачественных новообразований, характеризующийся тем, что получают экссудат путем лапароцентеза или пневмоцентеза, добавляют к нему раствор антикоагулянта цитрата натрия 5% в соотношении 10:1, центрифугируют его, переносят клеточный осадок на предметное стекло и проводят цитологическое исследование с учетом того, что при больших объемах экссудата (до 500–1500 мл) собирают три порции – в начале, в середине и в конце пункции, смешивают объемы всех трех порций и используют для исследования 500–600 мл, а при малых объемах экссудата (до 500 мл) собирают весь объем экссудата, далее переносят экссудат в капельную воронку и отстаивают в течение 60 минут до образования обогащенного придонного слоя, после чего переносят 20–50 мл придонного обогащенного слоя экссудата из капельной воронки в центрифужные пробирки и центрифугируют, сливают надосадочную жидкость и переносят концентрированный клеточный осадок на предметное стекло, при этом время центрифугирования для получения концентрированного клеточного осадка составляет не более 10 минут при скорости центрифугирования 2000 об/мин.
Заявляемое изобретение направлено на решение задачи получения оптимальных цитологических препаратов из абдоминального и/или плеврального экссудатов для обеспечения достаточного количества клеточных образцов для рутинной цитологической диагностики злокачественных новообразований, а в сложных диагностических случаях – получение монослойных препаратов методом жидкостной цитологии и использование их для иммуноцитохимической диагностики, имеющей важное значение в определении гистогенеза опухоли, ее дифференцировки и органной принадлежности.
Технический результат заключается в том, что из экссудата брюшной и/или плевральной полостей получают сконцентрированный клеточный осадок выпотной жидкости, из которого готовят традиционные цитологические препараты и жидкостные монослойные препараты для диагностики злокачественных новообразований. В сложных диагностических случаях монослойные препараты используются для проведения иммуноцитохимического исследования и определения гистогенеза опухоли, ее органной принадлежности и степени дифференцировки.
Сущность заявляемого изобретения заключается в том, что цитологические препараты, приготовленные из обогащенного придонного слоя экссудата, в отличие от препаратов, имеющих клеточный осадок, полученный путем центрифугирования выпотной жидкости, содержат большее количество клеточного материала за счет предварительного осаждения большего количества клеток и это способствует повышению точности цитологического исследования.
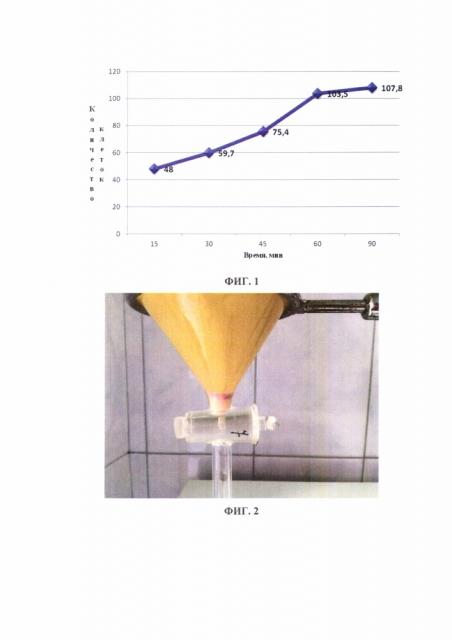
В таблице 1 представлены данные о количестве клеточного материала в 24 порциях экссудатов в зависимости от экспозиции времени его отстаивания (15, 30, 45, 60 и 90 минут).
Таблица 1
Количество клеточного материала в экссудате в зависимости от экспозиции времени отстаивания
| N образца | Вид экссудата | 15 мин | 30 мин | 45 мин | 60 мин | 90 мин |
| 1 | плевральная жидкость | 35 | 50 | 56 | 65 | 71 |
| 2 | асцитическая жидкость | 20 | 52 | 34 | 57 | 61 |
| 3 | асцитическая жидкость | 5 | 16 | 25 | 48 | 46 |
| 4 | асцитическая жидкость | 58 | 224 | 246 | 448 | 454 |
| 5 | асцитическая жидкость | 360 | 232 | 352 | 400 | 411 |
| 6 | плевральная жидкость | 28 | 49 | 52 | 60 | 64 |
| 7 | плевральная жидкость | 14 | 14 | 18 | 23 | 26 |
| 8 | асцитическая жидкость | 40 | 50 | 56 | 64 | 64 |
| 9 | асцитическая жидкость | 2 | 3 | 5 | 11 | 13 |
| 10 | асцитическая жидкость | 5 | 15 | 17 | 16 | 18 |
| 11 | плевральная жидкость | 18 | 28 | 40 | 65 | 67 |
| 12 | плевральная жидкость | 15 | 22 | 29 | 38 | 44 |
| 13 | асцитическая жидкость | 22 | 33 | 44 | 90 | 96 |
| 14 | асцитическая жидкость | 29 | 44 | 54 | 114 | 120 |
| 15 | асцитическая жидкость | 45 | 72 | 95 | 188 | 194 |
| 16 | асцитическая жидкость | 38 | 61 | 72 | 106 | 109 |
| 17 | плевральная жидкость | 16 | 30 | 44 | 56 | 59 |
| 18 | асцитическая жидкость | 208 | 196 | 242 | 254 | 261 |
| 19 | асцитическая жидкость | 67 | 84 | 96 | 112 | 120 |
| 20 | асцитическая жидкость | 32 | 47 | 59 | 71 | 82 |
| 21 | асцитическая жидкость | 18 | 21 | 39 | 39 | 36 |
| 22 | асцитическая жидкость | 54 | 61 | 89 | 94 | 98 |
| 23 | асцитическая жидкость | 6 | 4 | 7 | 16 | 22 |
| 24 | асцитическая жидкость | 17 | 24 | 38 | 49 | 52 |
| Среднее количество клеток | асцитическая/ плевральная жидкости | 48,0 | 59,7 | 75,4 | 103,5 | 107,8 |
Через 15 минут отстаивания среднее количество клеток в 24 исследуемых образцах экссудатов составило 48,0 в поле зрения, через 30 минут – 59,7, через 45 минут – 75,4, через 60 минут – 103,5, через 90 минут – 107,8 в поле зрения. На ФИГ. 1 представлена кривая осаждения клеточных образцов экссудатов в зависимости от экспозиции времени отстаивания.
При экспозиции времени отстаивания экссудата 60 минут количество клеточных образцов больше в 1,7 раза (на 73,3%), чем при экспозиции времени отстаивания 30 минут. Дальнейшее увеличение времени экспозиции не имеет значимого увеличения клеточных образцов в исследуемых экссудатах.
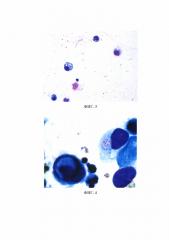
Таким образом, использование капельной воронки для концентрирования клеточного материала экссудатов в придонном слое выпотной жидкости и экспозиция времени отстаивания экссудата 60 минут являются оптимальными для получения качественных микропрепаратов, содержащих достаточное количество клеточного материала для цитологического исследования.
Использование в клинической онкологической, гинекологической, терапевтической, фтизиатрической и лабораторной практиках заявляемого способа обеспечивает повышение точности цитологической диагностики злокачественных новообразований.
Применяемая в данном способе технология концентрирования клеточного материала в экссудатах обеспечивает:
– возможность получения цитологических препаратов, содержащих достаточное количество клеточных образцов для цитологического и иммуноцитохимического исследований, что значительно снижает количество неудовлетворительных препаратов;
– сокращение времени и повышение производительности исследования;
– повышение точности цитологической диагностики злокачественных новообразований и рецидивов заболевания после проведенного лечения у больных с наличием серозных выпотов.
Преимущество изобретения заключается в том, что микропрепараты, полученные из концентрированного клеточного материала экссудатов, содержат достаточное количество клеток и тем самым способствуют повышению точности цитологического исследования.
Способ реализуется следующим образом: материалом для цитологического исследования служили экссудаты плевральной и брюшной полостей; при наличии выпота в плевральной или брюшной полостях, установленных с помощью лучевых методов диагностики (РКТ, МРТ, УЗИ и рентгенологического исследования), выполняли пункцию брюшной или плевральной полостей по общепринятым методикам с целью получения материала для цитологического исследования.
Весь полученный экссудат из плевральной полости собирали в полихлорвиниловый мешок для сбора жидкости одноразового набора Плеврофикс № 1. Предварительно в мешок добавляли 100 мл 5% раствора цитрата натрия для предотвращения коагуляции белка. Асцитическую жидкость собирали в три флакона емкостью 500 мл каждый, в которые предварительно добавляли 45–50 мл 5% раствора цитрата натрия. Первую порцию экссудата собирали в начале операции, вторую – в середине и третью – в конце. Полученный экссудат направляли в цитологическую лабораторию для исследования. При исследовании плевральной жидкости весь экссудат переливали в капельную воронку, при исследовании абдоминального выпота три порции экссудата вначале переливали в колбу, перемешивали, а затем около 500 мл экссудата переливали в капельную воронку, где клетки выпотной жидкости под действием силы тяжести оседали на дно капельной воронки (процесс седиментации). Отстаивание экссудата для концентрирования клеточных образцов проводили в капельной воронке в течение 60 минут (ФИГ. 2). По истечении времени экспозиции отстаивания экссудата обогащенный клеточными элементами придонный слой из капельной воронки сливали в 5–6 центрифужных пробирок. Затем центрифугировали экссудат на центрифуге «Элекон ЦЛМН-Р10-01» в течение 10 минут при скорости 2000 об/мин. Проводили оценку клеточности полученного препарата. Для этого каплю клеточного осадка переносили на предметное стекло, накрывали покровным стеклом и производили подсчет клеток в нативном препарате при увеличении 280х (объектив 40х, окуляр 7х) в 3–5 полях зрения.
Из полученного клеточного осадка делали 8–10 цитологических препаратов. Затем цитологические препараты сушили на воздухе. При окраске микропрепаратов по методу Паппенгейма их фиксировали раствором Май-Грюнвальда 15 минут и докрашивали в растворе азур-эозина по Романовскому-Гимзе 30 минут, а при окраске гематоксилин-эозином вначале препараты фиксировали этиловым спиртом 950 10 минут, затем окрашивали гематоксилином Майера 20 минут и эозином 30 секунд. Использование окраски гематоксилином и эозином делает препараты более прозрачными и лучше просматриваемыми.
Микроскопирование цитологических препаратов проводили под малым увеличением (объектив 10х) с использованием видеомикроскопа МС 1000 (LCD), Австрия, со встроенной электронной системой, жидкокристаллическим сенсорным дисплеем, что позволяет выполнить просмотр изображения в реальном времени. Обнаруженные атипические клетки исследовали при помощи иммерсионной системы (объектив 100х). Результаты микроскопирования фотографировали и сохраняли на CD Cart.
Заявленный способ лабораторной диагностики злокачественных новообразований при исследовании экссудатов является оптимальным и отвечает всем указанным требованиям.
Пример использования способа.
Клинический пример
Больная Х., 24 года, наблюдается в ГБУЗ «Онкологический диспансер № 3» (г. Новороссийск) с июля 2016 г. по поводу рака яичников. 16.10.14 г. была выполнена лапароскопическая операция по поводу апоплексии левого яичника. При УЗИ органов малого таза 20.05.2015 г. обнаружено кистозное образование левого яичника размером 5х4,5 см с пристеночным компонентом, в брюшной полости незначительное количество асцитической жидкости. 30.06.2016 г. выполнена лапаротомия. Сальпингоофорэктомия слева. ПГИ № 3241-7 папиллярная аденокарцинома яичника. От предложенного радикального оперативного лечения и проведения химиотерапии больная отказалась.
В июле 2016 г. у больной появилась одышка, которая усиливалась после незначительной физической нагрузки. СА 125 – 254,2 Ед/мл. 02.08.2016 г. была выполнена рентгенография органов грудной клетки. В плевральной полости справа обнаружен выпот до VI ребра. Предварительный диагноз – рецидив рака яичников. 03.08.2016 г. выполнена плевральная пункция. Эвакуировано 650 мл серозного экссудата. Из клеточного осадка, полученного из плеврального экссудата традиционным методом и с применением заявляемого способа лабораторной диагностики злокачественных новообразований, были приготовлены морфологические препараты.
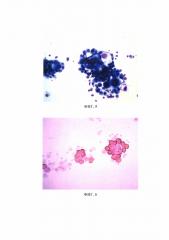
В цитологических препаратах, полученных рутинным способом, было обнаружено незначительное количество измененных клеток мезотелия (ФИГ. 3), что недостаточно для установления точного морфологического диагноза.
После концентрирования абдоминального экссудата предлагаемым способом в цитологических препаратах, полученным традиционном методом и методом жидкостной цитологии, были обнаружены комплексы клеток аденокарциномы и единичные клетки похожие на перстневидноклеточный рак (ФИГ. 4, 5).
Для уточнения гистогенеза опухоли, ее органной принадлежности и с целью проведения дифференциальной диагностики между аденокарциномой яичника и перстневидноклеточным раком желудочно-кишечного тракта было проведено иммуноцитохимическое исследование с использованием панели антител: СА 125, СК7, панцитокератин и CD45, CEAm.
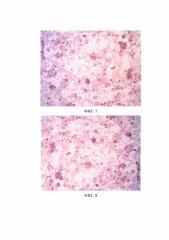
В результате проведенного исследования были получены мембранная и цитоплазматическая экспрессия опухолевых маркеров СА 125, СК7, панцитокератина (ФИГ. 6–8) и отрицательная CD45, CEAm.
Иммунофенотип опухоли соответствует аденокарциноме яичника. По результатам проведенного обследования у больной диагностирован рецидив рака яичника.
Приведенный пример может служить подтверждением того, что использование способа лабораторной диагностики злокачественных новообразований повышает точность установления клинического диагноза, что имеет важное значение для выбора правильного метода специального лечения в онкологии.
Сущность изобретения поясняется графическими материалами, которые представлены на:
ФИГ. 1. Количество клеток в экссудате в зависимости от экспозиции времени отстаивания
ФИГ. 2. Концентрирование клеточного осадка в капельной воронке
ФИГ. 3. Цитологический препарат, приготовленный традиционным методом (микрофотография). Клетки измененного мезотелия. Окраска по Романовскому-Гимзе. Ув. объ. х40
ФИГ. 4. Цитологический препарат, приготовленный традиционным методом (микрофотография). Комплексы клеток аденокарциномы и единичные клетки, подозрительные на перстневиноклеточный рак. Окраска по Романовскому-Гимзе. Ув. объ. х100
ФИГ. 5. Цитологический препарат, приготовленный традиционным методом (микрофотография). Комплексы клеток аденокарциномы и единичные клетки, подозрительные на перстневидноклеточный рак. Окраска по Романовскому-Гимзе. Ув. объ. х20
ФИГ. 6. ИЦХ (микрофотография). Мембранная и цитоплазматическая экспрессия СА 125. Ув. объ. х20
ФИГ. 7. ИЦХ (микрофотография). Мембранная и цитоплазматическая экспрессия СК 7. Ув. объ. х100
ФИГ. 8. ИЦХ (микрофотография). Мембранная и цитоплазматическая экспрессия панцитокератина. Ув. объ. х10
Источники информации
1. Балезин С.А., Ерофеев Б.В., Подобаев Н.И. Основы физической и коллоидной химии: учебное пособие для студентов биол.-химических и педагогических институтов. – М.: Просвещение, 1975. – 398 с.
2. Долгов В.В., Шабалова И.П., Миронова И.И. и соавт. Выпотные жидкости. Лабораторное исследование. – Москва–Тверь: ООО «Издательство «Триада», 2006. – 161 с.
3. Леонов М.Г., Беляева С.А., Ершова Я.Х.-Б., Селифонова Ж.П. Совершенствование цитологической диагностики рака яичников // Онкогинекология. – 2016. – № 2. – С. 52–58.
4. Цитологическая диагностика рака яичников: пособие для врачей / М.Г. Леонов, В.И. Новик, С.А. Беляева, Я.Х.-Б. Ершова. Краснодар: «Три-Мил», 2016. – 28 с.
Способ концентрирования клеточного материала в экссудатах для цитологического исследования злокачественных новообразований, характеризующийся тем, что получают экссудат путем лапароцентеза или пневмоцентеза, добавляют к нему раствор антикоагулянта цитрата натрия 5% в соотношении 10:1, центрифугируют его, переносят клеточный осадок на предметное стекло и проводят цитологическое исследование с учетом того, что при больших объемах экссудата (до 500–1500 мл) собирают три порции – в начале, в середине и в конце пункции, смешивают объемы всех трех порций и используют для исследования 500–600 мл, а при малых объемах экссудата (до 500 мл) собирают весь объем экссудата, далее переносят экссудат в капельную воронку и отстаивают в течение 60 минут до образования обогащенного придонного слоя, после чего переносят 20–50 мл придонного обогащенного слоя экссудата из капельной воронки в центрифужные пробирки и центрифугируют, сливают надосадочную жидкость и переносят концентрированный клеточный осадок на предметное стекло, при этом время центрифугирования для получения концентрированного клеточного осадка составляет не более 10 минут при скорости центрифугирования 2000 об/мин.