Связывающий антитело полипептид, связывающий антитело гибридный полипептид и адсорбционный материал
Иллюстрации
Показать всеИзобретение относится к связывающему антитело полипептиду, представленному в любой из SEQ ID NO: с 1 по 18, и адсорбционному материалу для антитела или производного антитела, где связывающий антитело полипептид иммобилизован на водонерастворимом носителе. Эти связывающий антитело полипептид и адсорбционный материал имеют прекрасные связывающие антитело свойства и селективность в отношении антител, а также прекрасную устойчивость к щелочи и временную стабильность. 5 н. и 1 з.п. ф-лы, 2 табл., 25 пр.
Реферат
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
1. Область техники, к которой относится изобретение
[0001] Настоящее изобретение относится к связывающему антитело полипептиду, связывающему антитело гибридному полипептиду и адсорбционному материалу.
2. Описание предшествующего уровня техники
[0002] В последние годы разработка лекарств на основе антител стремительно развивается. Это происходит потому, что лекарства на основе антител, находящие применение для иммунной функции человека, могут, как ожидается, обладать высокой эффективностью и также проявлять относительно слабые побочные эффекты, в результате чего такие лекарства на основе антител, как считается, в будущем будут в центре терапевтического применения. Методом, существенным для разработки и практического применения лекарств на основе антител, является поточный, широкомасштабный и высокоскоростной метод очистки антител. В настоящее время наиболее общепринятым используемым методом очистки антител является аффинная хроматография с использованием протеина А.
[0003] Протеин А представляет собой мембранный белок, присутствующий в клеточной стенке Staphylococcus aureus, и как известно, обладающий высоким связывающим сродством к константной области (области Fc, Fc=фрагмент, кристаллизуемый) молекулы антитела. Так как общие структуры являются консервативными в константной области между классами и подклассами различных молекул антител, аффинная хроматография с использованием протеина А в качестве лиганда, связывающего антитело, может быть использована для очистки различных типов молекул антител против различных антигенов.
[0004] Однако, так как протеин А получают с использованием метода генетической инженерии, проблема состоит в том, что методы получения являются сложными, что, следовательно, ведет в результате к высокой стоимости получения. Кроме того, протеин А не может быть использован с повторяющимися несколько раз промывками из-за недостаточной устойчивости к щелочи и временной стабильности, а также короткого времени жизни, возникающего из-за сильной деградации, обусловленной щелочной промывкой колонки. По этим причинам стоимость очистки антител с большой вероятностью является высокой.
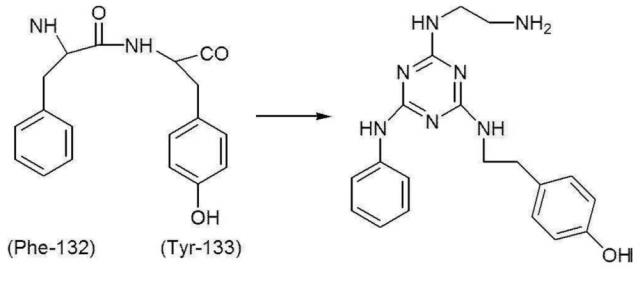
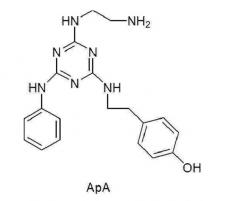
[0005] Чтобы справиться с такими проблемами, например, Li, R., Dowd, V., Steward, D. J., Burton, S. J., и Lowe, C. R., 1998, Nature Biotechnology, Vol. 16, pp. с 190 по 195 раскрывают низкомолекулярное соединение ApA (аббревиатура, принятая для «искусственного протеина А»), которое может быть получено в соответствии со следующей схемой реакций из дипептида, состоящего из фенилаланина 132 и тирозина 133 протеина А в качестве лиганда - миметика протеина А.
[0006]
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0008] Как будет описано в представленных ниже примерах, однако, в соответствии с исследованиями, проведенными изобретателями настоящего изобретения, низкомолекулярное соединение ApA, описанное у Li, R., Dowd, V., Steward, D. J., Burton, S. J., и Lowe, C. R., 1998, Nature Biotechnology, Vol. 16, pp. с 190 до 195, проявляло недостаточные связывающие свойства и селективность в отношении антител, таким образом не удовлетворяя требуемому уровню, хотя имело достаточную устойчивость к щелочи и временную стабильность.
[0009] Соответственно, целью настоящего изобретения является предоставление связывающего антитело полипептида и адсорбционного материала, которые имеют прекрасные связывающие антитело свойства и селективность в отношении антител, а также прекрасную устойчивость к щелочи и временную стабильность.
[0010] В результате интенсивных исследований, направленных на решение вышестоящих проблем, изобретатели настоящего изобретения обнаружили, что связывающий антитело полипептид, как представлено в любой из SEQ ID NOs: с 1 по 18, имеет связывающие свойства и селективность в отношении антител, сопоставимые с протеином А, а также проявляет высокую устойчивость к щелочи и временную стабильность. Настоящее изобретение выполнено на основе этих данных.
[0011] Таким образом, в изобретении предлагается следующее с (1) по (13).
(1) Связывающий антитело полипептид, представленный в любой из SEQ ID NOs: с 1 по 18.
(2) Связывающий антитело полипептид, обладающий последовательностью на 85% или более гомологичной полипептиду, представленному в любой из SEQ ID NOs: с 1 по 18.
(3) Связывающий антитело полипептид, в котором от 1 до 10 аминокислотных остатков ковалентно связаны, по меньшей мере, с одним участком, выбранным из N-концевого, C-концевого участков и аминокислотной боковой цепи полипептида, обладающего последовательностью на 85% или более гомологичной полипептиду, представленному в любой из SEQ ID NOs: с 1 по 18.
(4) Связывающий антитело полипептид, в котором от 1 до 24 этиленгликольных единиц ковалентно связаны, по меньшей мере, с одним участком, выбранным из N-концевого, C-концевого участков и аминокислотной боковой цепи полипептида, обладающего последовательностью на 85% или более гомологичной полипептиду, представленному в любой из SEQ ID NOs: с 1 по 18.
(5) Связывающий антитело полипептид, в котором, по меньшей мере, один участок, выбранный из N-концевого, C-концевого участков и аминокислотной боковой цепи полипептида, обладающего последовательностью на 85% или более гомологичной полипептиду, представленному в любой из SEQ ID NOs: с 1 по 18, модифицирован.
(6) Связывающий антитело гибридный полипептид, в котором от 2 до 10 доменных единиц соединены ковалентной связью, при использовании в качестве одной доменной единицы связывающего антитело полипептида по любому из пунктов от (1) до (3).
(7) Связывающий антитело гибридный полипептид, в котором, по меньшей мере, один участок, выбранный из N-концевого, C-концевого участков и аминокислотной боковой цепи связывающего антитело гибридного полипептида, в котором от 2 до 10 доменных единиц соединены ковалентной связью, при использовании в качестве одной доменной единицы связывающего антитело полипептида по любому из пунктов от (1) до (3), модифицирован.
(8) Связывающий антитело гибридный полипептид по п. (6) или (7), где связывающий антитело гибридный полипептид включает от 2 до 5 указанных выше доменных единиц и линкер, соединяющий указанные выше доменные единицы.
(9) Связывающий антитело гибридный полипептид по п. (8), в котором линкер представляет собой, по меньшей мере, один линкер, выбранный из группы, состоящей из пептидного линкера, состоящего из от 1 до 10 аминокислотных остатков на один линкер, полиэтиленгликольного (ПЭГ) линкера, состоящего из от 1 до 24 этиленгликольных единиц на один линкер, и комплексного линкера, состоящего из от 1 до 10 аминокислотных остатков и от 1 до 24 этиленгликольных единиц на один линкер.
(10) Связывающий антитело гибридный полипептид по п. (9), в котором линкер представляет собой, по меньшей мере, один линкер, выбранный из группы, состоящей из пептидного линкера, состоящего из от 1 до 10 аминокислотных остатков на один линкер, и комплексного линкера, состоящего из от 1 до 10 аминокислотных остатков и от 1 до 24 этиленгликольных единиц на один линкер, и от 1 до 10 аминокислотных остатков включают, по меньшей мере, один остаток, по меньшей мере, аминокислоты одного типа, выбранной из группы, состоящей из глицина (Gly), аланина (Ala) и серина (Ser).
(11) Связывающий антитело гибридный полипептид по п. (9), в котором линкер представляет собой, по меньшей мере, один линкер, выбранный из группы, состоящей из пептидного линкера, состоящего из от 1 до 10 аминокислотных остатков на один линкер, и комплексного линкера, состоящего из от 1 до 10 аминокислотных остатков и от 1 до 24 этиленгликольных единиц на один линкер, и от 1 до 10 аминокислотных остатков включают, по меньшей мере, один остаток, по меньшей мере, аминокислоты одного типа, выбранной из группы, состоящей из лизина (Lys), орнитина (Orn) и цистеина (Cys).
(12) Связывающий антитело гибридный полипептид по любому из пунктов с (9) по (11), где суммарная молекулярная масса аминокислотных остатков, содержащихся в доменной единице, и линкере, составляет 5000 или менее.
(13) Адсорбционный материал для антитела или производного антитела, где связывающий антитело полипептид по любому из пунктов с (1) по (5) или связывающий антитело гибридный полипептид по любому из пукнтов с (6) по (12) иммобилизован на водонерастворимом носителе.
[0012] В соответствии с настоящим изобретением можно предложить связывающий антитело полипептид, который имеет прекрасные связывающие свойства и селективность в отношении антител, а также прекрасную устойчивость к щелочи и временную стабильность, адсорбционный материал для антитела или производного антитела, который имеет прекрасные связывающие свойства и селективность в отношении антител, а также прекрасную устойчивость к щелочи и временную стабильность.
[0013] Кроме того, в соответствии с настоящим изобретением можно создать лучше отлаженный способ, так как промывка щелочью или тому подобным может быть усилена по сравнению с протеином А.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0014] В настоящем изобретении аминокислоты указаны по общим правилам с использованием названий, аббревиатур или тому подобного, утвержденных объединенной комиссией по биохимической номенклатуре (JCBN) международного союза теоретической и прикладной химии и международного союза биохимии и молекулярной биологии IUPAC-IUB. Аминокислотные остатки указаны с использованием аббревиатур аминокислот, от которых произошли соответствующие аминокислотные остатки. Следует отметить, что аминокислотный остаток включает N-концевую аминокислоту (N-концевой остаток) и C-концевую аминокислоту (C-концевой остаток).
Кроме того, если не указано иначе, аминокислотная последовательность (также обозначаемая как «первичная структура») полипептида или белка представлена таким образом, что аминокислотные остатки организованы в одном измерении в направлении от N-конца к C-концу в порядке слева направо.
[0015] Названия и аббревиатуры (однобуквенные аббревиатуры и трехбуквенные аббревиатуры) аминокислот, для которых однобуквенные аббревиатуры и трехбуквенные аббревиатуры официально приняты, представлены в таблице 1.
| Аминокислоты | Однобуквенные аббревиатуры | Трехбуквенные аббревиатуры | Аминокислоты | Однобуквенные аббревиатуры | Трехбуквенные аббревиатуры | |
| Аланин | A | Ala | Пролин | P | Pro | |
| Цистеин | C | Cys | Глутамин | Q | Gln | |
| Аспарагиновая кислота | D | Asp | Аргинин | R | Arg | |
| Глутаминовая кислота | E | Glu | Серин | S | Ser | |
| Фенилаланин | F | Phe | Треонин | T | Thr | |
| Глицин | G | Gly | Селеноцистеин | U | Sec | |
| Гистидин | H | His | Валин | V | Val | |
| Изолейцин | I | Ile | Триптофан | W | Trp | |
| Лизин | K | Lys | Тирозин | Y | Tyr | |
| Лейцин | L | Leu | Asp или Asn | B | Asx | |
| Метионин | M | Met | Glu или Gln | Z | Glx | |
| Аспарагин | N | Asn | Произвольная аминокислота | X | Xaa | |
| Пирролизин | O | Pyl |
[0017] Так называемые неприродные аминокислоты, которые будут описаны в настоящем документе ниже, перечисленные в таблице 1 в дополнение к обычным аминокислотам, могут быть использованы в качестве аминокислоты.
В настоящем изобретении термин «неприродная аминокислота» относится к аминокислоте, которая в природе не кодируется мРНК. Неприродные аминокислоты особенно не ограничиваются, и их примеры включают 2,3-диаминопропионовую кислоту (Dpr), 2,4-диаминомасляную кислоту (Dbu), орнитин (Orn), 3-гидроксипролин (3Hyp), 4-гидроксипролин (4Hyp), 2-аминоадипиновую кислоту (Aad), 2-аминомасляную кислоту (Abu), 2-аминоизомасляную кислоту (Aib), 2-аминовалериановую кислоту (норвалин; Nva), 2-аминокапроновую кислоту (норлейцин; Nle), 2-аминогептановую кислоту (Ahe), 2-аминопимелиновую кислоту (Apm), 2,2'-диаминопимелиновую кислоту (Dpm), аллогидроксилизин (aHyl), аллоизолейцин (aIle), 6-N-метиллизин (MeLys), теанин (2-амино-4-(этилкарбамоил)масляную кислоту), цитруллин (2-амино-5-(карбамоиламино)валериановую кислоту), десмозин (Des) и изодесмозин (Ide).
В том случае, когда используется неприродная аминокислота, ее предпочтительно использовать в линкерной части для связывания полипептида с носителем или в линкерной части, связывающей домены гибридного пептида.
[0018] В настоящем изобретении термин «единица домена» представляет собой единицу в структуре белка или полипептида более высокого порядка и обозначает единицу аминокислотного полимера, которая состоит из последовательности приблизительно от пяти до нескольких сотен аминокислотных остатков и, следовательно, достаточна для проявления некоторых типов физико-химических или биохимических функций.
[0019] В настоящем изобретении термин «гибридный полипептид» относится к полимерному соединению, которое образовано путем соединения двух или более полипептидов (доменных единиц), имеющих некоторые типы физико-химических или биохимических функций, прямо или через линкер.
В настоящем изобретении линкер, соединяющий доменные единицы, особенно не ограничивается, и его примеры включают пептидный линкер, состоящий из пептидных единиц (аминокислотных остатков), ПЭГ (полиэтиленгликольный) линкер, состоящий из этиленгликольных единиц, дисульфидной связи (SS-связи) и их сочетаний.
[0020] В настоящем изобретении термин «антитело» относится к иммуноглобулину или его аналогу, фрагменту или гибридному белку. При применении в настоящем описании термин «аналог» относится к природному или искусственно созданному белку или конъюгату белка, в котором структура или функция иммуноглобулина, по меньшей мере, частично сохранена. Кроме того, термин «фрагмент» относится к белку, обладающему частичной структурой иммуноглобулина, который создан в результате обработки ферментами или с помощью генетической инженерии. Далее, термин «гибрид» относится к белку, созданному с помощью генно-инженерного соединения функциональной части белка, обладающего биологической активностью, такого как различные цитокины или рецепторы цитокинов, с полноразмерным иммуноглобулином или его частью. Дополнительно антитело предпочтительно представляет собой моноклональное антитело или гибрид, имеющий Fc область иммуноглобулина, и более предпочтительно представляет собой моноклональное антитело. В настоящем изобретении иммуноглобулин может представлять собой любой иммуноглобулин из пяти классов (изотипов) иммуноглобулинов G (IgG), иммуноглобулинов M (IgM), иммуноглобулинов A (IgA), иммуноглобулинов D (IgD) и иммуноглобулинов E (IgE), но предпочтительно представляет собой IgG или IgM и более предпочтительно IgG.
[0021] В настоящем изобретении термин «производное антитела» относится к гибридному антителу, в котором область Fc иммуноглобулина человека соединена с областью Fab иммуноглобулина млекопитающего, не относящегося к человеку, к гибридному антителу, в котором несколько областей Fc иммуноглобулина человека соединены с несколькими областями Fv иммуноглобулина млекопитающего, не относящегося к человеку, к гуманизированному антителу, в котором оставшаяся часть за исключением части области, определяющей комплементарность (CDR) иммуноглобулина человека, соединена с областью CDR, иммуноглобулина млекопитающего, не относящегося к человеку, к гибридному антителу, в котором область Fc иммуноглобулина млекопитающего, не относящегося к человеку, соединена с областью Fab иммуноглобулина человека, к гибридному антителу, в котором несколько областей Fc иммуноглобулина млекопитающего, не относящегося к человеку, соединены с несколькими областями Fv иммуноглобулина человека, к антителу млекопитающих, не относящихся к человеку, в котором оставшаяся часть за исключением части CDR иммуноглобулина человека соединена с областью CDR антитела млекопитающих, не относящихся к человеку, к гибридному антителу, в котором область Fc иммуноглобулина млекопитающего, не относящегося к человеку, соединена с областью Fab иммуноглобулина млекопитающего, не относящегося к человеку, к гибридному антителу, в котором несколько областей Fc глобулина млекопитающего, не относящегося к человеку, соединены с несколькими областями Fv иммуноглобулина млекопитающего, не относящегося к человеку, к антителу млекопитающих, не относящихся к человеку, в котором оставшаяся часть за исключением части области CDR (области определяющей комплементарность) иммуноглобулина млекопитающего, не относящегося к человеку, соединена с областью CDR, иммуноглобулина млекопитающего, не относящегося к человеку, и белок оставшейся Fc области представляет собой белок, к которому добавляют химические модификации указанных выше антител.
[0022] В настоящем изобретении термин «свойства связывания антитела» относится к связыванию антитела или производного антитела с определенной аффинностью. Связывание антитела или производного антитела предпочтительно представляет собой связывание путем взаимодействия антигена с антителом, и сайт связывания предпочтительно представляет собой константную область (область Fc, область CL или область CH) антитела или производного антитела.
[0023] В настоящем изобретении термин «лиганд» относится к молекуле, которая связывается с определенным веществом с определенной аффинностью. Примеры таких молекул включают белок, полипептид и низкомолекулярное соединение. В настоящем изобретении термин «лиганд, связывающий антитело» относится к лиганду, обладающему связывающими свойствами в отношении антитела, т.е. к лиганду, который связывается с антителом или производным антитела с определенной аффинностью. В настоящем изобретении лиганд, связывающий антитело, предпочтительно связывается с антителом или производным антитела в результате взаимодействия антигена с антителом, в результате которого возникает аффинность между специфическими молекулами, и сайт связывания предпочтительно представляет собой константную область (область Fc, область CL (константную область легкой цепи) или область CH (константную область тяжелой цепи) антитела или производного антитела с точки зрения разнообразия.
[0024] [Связывающий антитело полипептид]
В настоящем изобретении предлагается связывающий антитело полипептид, как представлено в любой их SEQ ID NOs: с 1 по 18. Этот связывающий антитело полипептид представляет собой полипептид, который связывается с антителом или производным антитела с определенной степенью сродства и связывается с константной областью (областью Fc) антитела или производного антитела.
Кроме того, в настоящем изобретении предлагается связывающий антитело полипептид, имеющий последовательность, гомологичную на 85% или более, еще более предпочтительно на 90% или более и даже более предпочтительно на 95% или более, полипептиду, как представлено в любой их SEQ ID NOs: с 1 по 18.
[0026] В настоящем изобретении гомологию двух аминокислотных последовательностей определяют следующим образом.
(1) Осуществляют выравнивание двух аминокислотных последовательностей.
Выравнивание осуществляют до достижения максимальных очков выравнивания таким образом, что подобранной паре дается очко +1, неподобранной паре дается очко -1, и пропуску дается очко -1.
(2) Рассчитывают гомологию последовательностей.
На основе полученного выравнивания гомологию последовательностей рассчитывают в соответствии со следующим равенством.
Гомология последовательностей [%]=(количество совпадающих положений/суммарное количество положений)×100[%]
Суммарное количество положений представляет собой длину выравнивания, а количество совпадающих положений представляет собой количество положений, в которых типы аминокислот совпадают.
В настоящем изобретении будут ли совпадать типы аминокислотных остатков или нет, будет основываться на том, будут ли структуры боковых цепей аминокислот (аминокислотные боковые цепи), на которых основаны соответствующие аминокислотные остатки, идентичны друг другу или нет. Структуры боковых цепей энантиомерных аминокислот не идентичны друг другу.
(3) Пример расчета гомологии последовательностей
В качестве примера дано рассмотрение следующих аминокислотных последовательностей.
Последовательность A EQQNAFY
Последовательность B KEQQSAFY
Когда эти аминокислотные последовательности выравниваются в условиях, описанных выше, они становятся следующими. В настоящем описании для ясности описания черта гомологии «|» присоединяется к тому месту, где типы аминокислот (остатков) совпадают между последовательностями A и B. Кроме того, «-» представляет собой пробел.
Очки для этого выравнивания составляют совпадения (+1)×6+несовпадения (-1) ×1+пробел (-1)×1=4.
В этом примере, так как суммарное количество положений равно 8, а количество совпадающих положений равно 6, гомология последовательностей, рассчитанная в соответствии с представленным выше равенством, составляет 6/8×100=75,0%.
[0027] Примеры связывающих антитело полипептидов с последовательностью на 85% или более гомологичной полипептиду (EQQNAFY), как представлено в SEQ ID NO: 1, включают полипептид (KEQQNAFY, 87,5%), как представлено в SEQ ID NO: 2, полипептид (EGQNAFY, 85,7%) как представлено в SEQ ID NO: 5, полипептид (EQNAFY, 85,7%) как представлено в SEQ ID NO: 9, полипептид (EQQSAFY, 85,7%) как представлено в SEQ ID NO: 10, полипептид (EAQQNAFY, 87,5%) как представлено в SEQ ID NO: 16, полипептид (EQQNAFY-NH2, 100%) (в котором «-NH2» представляет собой амидирование N-концевой карбоксильной группы. То же самое будет применяться в настоящем описании далее, как представлено в SEQ ID NO: 19, полипептид (Ac-EQQNAFYK, 87,5%) (в котором «Ac-» представляет собой ацетилирование C-концевой аминогруппы. То же самое будет применяться в настоящем описании далее, как представлено в SEQ ID NO: 20, и полипептид (H2N-(peg)8-EQQNAFYE, 87,5%) (где «peg» представляет собой единицу этиленгликоля, и «H2N-(peg)8-» демонстрирует, что полиэтиленгликольная цепь, состоящая из восьми этиленгликольных единиц, имеющая аминогруппу на конце, противоположном концу, связанному с полипептидной основной цепью, связана с N-концевой аминогруппой. То же самое будет применяться в настоящем описании далее, как представлено в SEQ ID NO: 24. Иногда процент, представленный после аминокислотной последовательности в скобках, представляет собой гомологию последовательности с полипептидом, представленным в SEQ ID NO: 1.
Кроме того, примеры связывающих антитело полипептидов с последовательностью на 87% или более гомологичной полипептиду, как представлено в SEQ ID NO: 1, включают полипептид, как представлено в SEQ ID NO: 2, полипептид, как представлено в SEQ ID NO: 16, полипептид, как представлено в SEQ ID NO: 19, полипептид, как представлено в SEQ ID NO: 20, и полипептид, как представлено в SEQ ID NO: 24.
Кроме того, примеры связывающих антитело полипептидов с последовательностью на 90% или более гомологичной полипептиду, как представлено в SEQ ID NO: 1, включают полипептид, как представлено в SEQ ID NO: 19.
[0028] Примеры связывающих антитело полипептидов с последовательностью на 85% или более гомологичной полипептиду (KEQQNAFY), как представлено в SEQ ID NO: 2, включают полипептид (EQQNAFY, 87,5%), как представлено в SEQ ID NO: 1, и полипептид (EQQNAFY-NH2, 87,5%), как представлено в SEQ ID NO: 19. Иногда процент, представленный после аминокислотной последовательности в скобках, представляет собой гомологию последовательности с полипептидом, как представлено в SEQ ID NO: 2.
Кроме того, примеры связывающих антитело полипептидов с последовательностью на 87% или более гомологичной полипептиду, как представлено в SEQ ID NO: 2, включают полипептид, как представлено в SEQ ID NO: 1, и полипептид, как представлено в SEQ ID NO: 19.
[0029] Примеры связывающих антитело полипептидов с последовательностью на 85% или более гомологичной полипептиду (EQQNAFYEILH), как представлено в SEQ ID NO: 3, включают полипептид (EQQNAFYEILHL, 91,7%) как представлено в SEQ ID NO: 4, полипептид (EQQSAFYEILH, 90,9%), как представлено в SEQ ID NO: 11, и полипептид (Ac-EQQNAFYEILHK, 91,7%) как представлено в SEQ ID NO: 21. Иногда процент, представленный после аминокислотной последовательности в скобках, представляет собой гомологию последовательности с полипептидом, как представлено в SEQ ID NO: 3.
Кроме того, примеры связывающих антитело полипептидов с последовательностью на 87% или более гомологичной полипептиду, как представлено в SEQ ID NO: 3, включают полипептид, как представлено в SEQ ID NO: 4, полипептид, как представлено в SEQ ID NO: 11, и полипептид, как представлено в SEQ ID NO: 21.
Кроме того, примеры связывающих антитело полипептидов с последовательностью на 90% или более гомологичной полипептиду, как представлено в SEQ ID NO: 3, включают полипептид, как представлено в SEQ ID NO: 4, полипептид, как представлено в SEQ ID NO: 11, и полипептид, как представлено в SEQ ID NO: 21.
[0030] Примеры связывающих антитело полипептидов с последовательностью на 85% или более гомологичной полипептиду (EQQNAFYEILHL), как представлено в SEQ ID NO: 4, включают полипептид (EQQNAFYEILH, 91,7%), как представлено в SEQ ID NO: 3 и полипептид, (Ac-EQQNAFYEILHK, 91,7%) как представлено в SEQ ID NO: 21. Иногда процент, представленный после аминокислотной последовательности в скобках, представляет собой гомологию последовательности с полипептидом, как представлено в SEQ ID NO: 4.
Кроме того, примеры связывающих антитело полипептидов с последовательностью на 87% или более гомологичной полипептиду, как представлено в SEQ ID NO: 4, включают полипептид, как представлено в SEQ ID NO: 3, и полипептид, как представлено в SEQ ID NO: 21.
Кроме того, примеры связывающих антитело полипептидов с последовательностью на 90% или более гомологичной полипептиду, как представлено в SEQ ID NO: 4, включают полипептид, как представлено в SEQ ID NO: 3, и полипептид, как представлено в SEQ ID NO: 21.
[0031] Примеры связывающих антитело полипептидов с последовательностью на 85% или более гомологичной полипептиду (EGQNAFY), как представлено в SEQ ID NO: 5, включают полипептид, (EQQNAFY, 85,7%) как представлено в SEQ ID NO: 1, полипептид, (EQNAFY, 85,7%), как представлено в SEQ ID NO: 9, и полипептид, (EQQNAFY-NH2, 85,7%), как представлено в SEQ ID NO: 19. Иногда процент, представленный после аминокислотной последовательности в скобках, представляет собой гомологию последовательности с полипептидом, как представлено в SEQ ID NO: 5.
[0032] Примеры связывающих антитело полипептидов с последовательностью на 85% или более гомологичной полипептиду (KKKEQQNAFYKKK), как представлено в SEQ ID NO: 6, включают полипептид (Ac-KKKEQQNAFYKKK, 100%), как представлено в SEQ ID NO: 22. Иногда процент, представленный после аминокислотной последовательности в скобках, представляет собой гомологию последовательности с полипептидом, как представлено в SEQ ID NO: 6.
Кроме того, примеры связывающих антитело полипептидов с последовательностью на 87% или более гомологичной полипептиду, как представлено в SEQ ID NO: 6, включают полипептид, как представлено в SEQ ID NO: 22.
Кроме того, примеры связывающих антитело полипептидов с последовательностью на 90% или более гомологичной полипептиду, как представлено в SEQ ID NO: 6, включают полипептид, как представлено в SEQ ID NO: 22.
[0033] Примеры связывающих антитело полипептидов с последовательностью на 85% или более гомологичной полипептиду (KKKEQQNAFYEILHKKK), как представлено в SEQ ID NO: 7, включают полипептид (Ac-KKKEQQNAFYEILHKKK, 100%), как представлено в SEQ ID NO: 23. Иногда процент, представленный после аминокислотной последовательности в скобках, представляет собой гомологию последовательности с полипептидом, как представлено в SEQ ID NO: 7.
Кроме того, примеры связывающих антитело полипептидов с последовательностью на 87% или более гомологичной полипептиду, как представлено в SEQ ID NO: 7, включают полипептид, как представлено в SEQ ID NO: 23.
Кроме того, примеры связывающих антитело полипептидов с последовательностью на 90% или более гомологичной полипептиду, как представлено в SEQ ID NO: 7, включают полипептид, как представлено в SEQ ID NO: 23.
[0034] Примеры связывающих антитело полипептидов с последовательностью на 85% или более гомологичной полипептиду (EQNAFY), как представлено в SEQ ID NO: 9, включают полипептид, (EQQNAFY, 85,7%), как представлено в SEQ ID NO: 1, полипептид, (EGQNAFY, 85,7%), как представлено в SEQ ID NO: 5, и полипептид, (EQQNAFY-NH2, 85,7%), как представлено в 19. Иногда процент, представленный после аминокислотной последовательности в скобках, представляет собой гомологию последовательности с полипептидом, как представлено в SEQ ID NO: 9.
[0035] Примеры связывающих антитело полипептидов с последовательностью на 85% или более гомологичной полипептиду (EQQSAFY), как представлено в SEQ ID NO: 10, включают полипептид (EQQNAFY, 85,7%), как представлено в SEQ ID NO: 1, полипептид (DQQSAFY, 85,7%), как представлено в SEQ ID NO: 12, полипептид (EAQQSAFY, 87,5%), как представлено в SEQ ID NO: 14, полипептид (EQSAFY, 85,7%), как представлено в SEQ ID NO: 15, и полипептид (EQQNAFY-NH2, 85,7%), как представлено в SEQ ID NO: 19. Иногда процент, представленный после аминокислотной последовательности в скобках, представляет собой гомологию последовательности с полипептидом, как представлено в SEQ ID NO: 10.
Кроме того, примеры связывающих антитело полипептидов с последовательностью на 87% или более гомологичной полипептиду, как представлено в SEQ ID NO: 10, включают полипептид, как представлено в SEQ ID NO: 14.
[0036] Примеры связывающих антитело полипептидов с последовательностью на 85% или более гомологичной полипептиду (EQQSAFYEILH), как представлено в SEQ ID NO: 11, включают полипептид (EQQNAFYEILH, 90,9%), как представлено в SEQ ID NO: 3, и полипептид (DQQSAFYEILH, 90,9%), как представлено в SEQ ID NO: 13. Иногда процент, представленный после аминокислотной последовательности в скобках, представляет собой гомологию последовательности с полипептидом, как представлено в SEQ ID NO: 11.
Кроме того, примеры связывающих антитело полипептидов с последовательностью на 87% или более гомологичной полипептиду, как представлено в SEQ ID NO: 11, включают полипептид, как представлено в SEQ ID NO: 3, и полипептид, как представлено в SEQ ID NO: 13.
Кроме того, примеры связывающих антитело полипептидов с последовательностью на 90% или более гомологичной полипептиду, как представлено в SEQ ID NO: 11, включают полипептид, как представлено в SEQ ID NO: 3, и полипептид, как представлено в SEQ ID NO: 13.
[0037] Примеры связывающих антитело полипептидов с последовательностью на 85% или более гомологичной полипептиду (DQQSAFY), как представлено в SEQ ID NO: 12, включают полипептид (EQQSAFY, 85,7%) как представлено в SEQ ID NO: 10, полипептид (DAQQSAFY, 87,5%), как представлено в SEQ ID NO: 17, и полипептид (DQSAFY, 85,7%), как представлено в SEQ ID NO: 18. Иногда процент, представленный после аминокислотной последовательности в скобках, представляет собой гомологию последовательности с полипептидом, как представлено в SEQ ID NO: 12.
Кроме того, примеры связывающих антитело полипептидов с последовательностью на 87% или более гомологичной полипептиду, как представлено в SEQ ID NO: 12, включают полипептид, как представлено в SEQ ID NO: 17.
[0038] Примеры связывающих антитело полипептидов с последовательностью на 85% или более гомологичной полипептиду (DQQSAFYEILH), как представлено в SEQ ID NO: 13, включают полипептид (EQQSAFYEILH, 90,9%) как представлено в SEQ ID NO: 11. Иногда процент, представленный после аминокислотной последовательности в скобках, представляет собой гомологию последовательности с полипептидом, как представлено в SEQ ID NO: 13.
Кроме того, примеры связывающих антитело полипептидов с последовательностью на 87% или более гомологичной полипептиду, как представлено в SEQ ID NO: 13, включают полипептид, как представлено в SEQ ID NO: 11.
Кроме того, примеры связывающих антитело полипептидов с последовательностью на 90% или более гомологичной полипептиду, как представлено в SEQ ID NO: 13, включают полипептид, как представлено в SEQ ID NO: 11.
[0039] Примеры связывающих антитело полипептидов с последовательностью на 85% или более гомологичной полипептиду (EAQQSAFY), как представлено в SEQ ID NO: 14, включают полипептид (EQQSAFY, 87,5%), как представлено в SEQ ID NO: 10, полипептид (EAQQNAFY, 87,5%), как представлено в SEQ ID NO: 16, и полипептид (DAQQSAFY, 87,5%), как представлено в SEQ ID NO: 17. Иногда процент, представленный после аминокислотной последовательности в скобках, представляет собой гомологию последовательности с полипептидом, как представлено в SEQ ID NO: 14.
Кроме того, примеры связывающих антитело полипептидов с последовательностью на 87% или более гомологичной полипептиду, как представлено в SEQ ID NO: 14, включают полипептид, как представлено в SEQ ID NO: 10, полипептид, как представлено в SEQ ID NO: 16, и полипептид, как представлено в SEQ ID NO: 17.
[0040] Примеры связывающих антитело полипептидов с последовательностью на 85% или более гомологичной полипептиду (EQSAFY), как представлено в SEQ ID NO: 15, включают полипептид (EQQSAFY, 87,5%) как представлено в SEQ ID NO: 10. Иногда процент, представленный после аминокислотной последовательности в скобках, представляет собой гомологию последовательности с полипептидом, как представлено в SEQ ID NO: 15.
[0041] Примеры связывающих антитело полипептидов с последовательностью на 85% или более гомологичной полипептиду (EAQQNAFY), как представлено в SEQ ID NO: 16, включают полипептид (EQQNAFY, 87,5%), как представлено в SEQ ID NO: 1, полипептид (EAQQSAFY, 87,5%), как представлено в SEQ ID NO: 14, и полипептид (EQQNAFY-NH2, 87,5%), как представлено в SEQ ID NO: 19. Иногда процент, представленный после аминокислотной последовательности в скобках, представляет собой гомологию последовательности с полипептидом, как представлено в SEQ ID NO: 16.
Кроме того, примеры связывающих антитело полипептидов с последовательностью на 87% или более гомологичной полипептиду, как представлено в SEQ ID NO: 16, включают полипептид, как представлено в SEQ ID NO: 1, полипептид, как представлено в SEQ ID NO: 14, и полипептид, как представлено в SEQ ID NO: 19.
[0042] Примеры связывающих антитело полипептидов с последовательностью на 85% или более гомологичной полипептиду (DAQQSAFY), как представлено в SEQ ID NO: 17, включают полипептид (DQQSAFY, 87,5%), как представлено в SEQ ID NO: 12, и полипептид (EAQQSAFY, 87,5%), как представлено в SEQ ID NO: 14. Иногда процент, представленный после аминокислотной последовательности в скобках, представляет собой гомологию последовательности с полипептидом, как представлено в SEQ ID NO: 17.
Кроме т