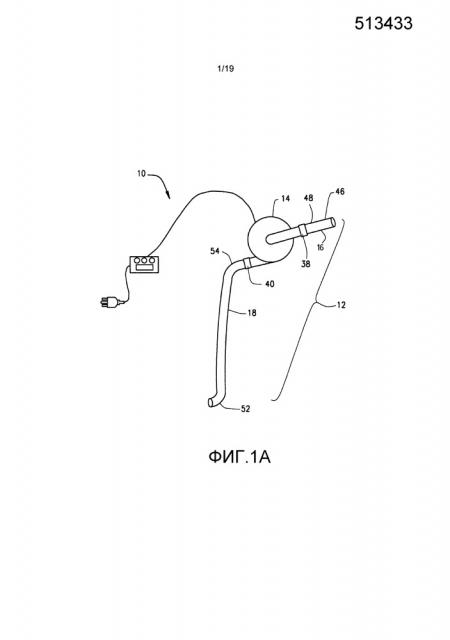
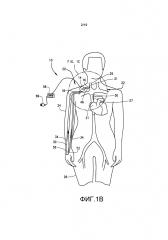
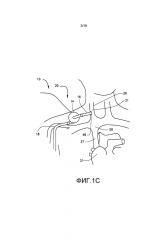
Система и способ повышения наружного диаметра вен и артерий
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к гемодиализу. Соединяют по текучей среде один конец узла насос-трубка с отдающей артерией. Соединяют по текучей среде другой конец узла насос-трубка с принимающим местоположением. Выполняют перекачивание оксигенированной крови из отдающей артерии в принимающее местоположение в течение от 7 до 84 суток, причем таким образом, чтобы напряжение сдвига стенки в отдающей артерии составляло от 1,5 до 23 Па. Создают артериовенозную фистулу и артериовенозный трансплантат у пациента при помощи части отдающей артерии с постоянно увеличенным наружным диаметром. Способ реализуется посредством заявленного устройства. Группа изобретений позволяет увеличить диаметр отдающей артерии, который остается после завершения перекачивания. 2 н. и 37 з.п. ф-лы, 14 ил.
Реферат
[0001] По данной заявке испрашивают приоритет патентной заявки США № 61/561,859, озаглавленной «System and Method to Increase the Overall Diameter of Veins and Arteries», которая подана 19 ноября 2011 года, и испрашивают приоритет патентной заявки США № 61/524,759, озаглавленной «System and Method to Increase the Overall Diameter of Veins and Arteries», которая подана 17 августа, 2011, которая является частичным продолжением патентной заявки США № 13/030,054, озаглавленной «System and Method to Increase the Overall Diameter of Veins and Arteries», которая подана 17 февраля 2011 года, по которой испрашивают приоритет предварительной заявки США № 61/305,508, озаглавленной «System and Method to Increase the Overall Diameter of Veins and Arteries», которая подана 17 февраля 2010 года и связана с совместно рассматриваемой совместно поданной международной патентной заявкой PCT, которая имеет номер патентного реестра 430365PCT, озаглавлена «Blood Pump Systems and Methods», подана 15 августа 2012 года и связана с совместно рассматриваемой патентной заявкой США № 61/524,761, озаглавленной «Blood Pump Systems and Methods» и совместно рассматриваемой патентной заявкой США № 61/564,671, озаглавленной «Blood Pump Systems and Methods», все они включены посредством ссылки во всей своей полноте.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0002] Настоящее изобретение относится к системам и способам для постоянного увеличения наружного диаметра и диаметра просвета вен и артерий у человека. В частности, настоящее изобретение относится к системам и способам, в которых используют кровяной насос для того, чтобы повышать скорость крови и напряжение сдвига у стенки (НСС) на эндотелии периферических вен и артерий в течение достаточного периода времени, чтобы это привело к постоянному увеличению наружного диаметра и диаметра просвета этих вен и артерий.
УРОВЕНЬ ТЕХНИКИ
[0003] Многие пациенты с хронической почечной недостаточностью (CKD) в конечном итоге прогрессируют до терминальной стадии почечной недостаточности (ESRD) и нуждаются в заместительной почечной терапии для того, чтобы удалять текучее вещество и продукты жизнедеятельности из их организмов и поддерживать их жизни. Большинство пациентов с ESRD, нуждающиеся в заместительной почечной терапии, получают гемодиализ, в котором кровь удаляют из системы кровообращения, очищают в аппарате для гемодиализа и затем возвращают в систему кровообращения. Для того чтобы содействовать гемодиализу, хирурги создают отдельные «места сосудистого доступа», которые можно использовать для того, чтобы быстро удалять и возвращать кровь пациентам с ESRD. Несмотря на то, что выполнено множество улучшений самих аппаратов для гемодиализа и других частей процесса гемодиализа, создание надежных и прочных мест сосудистого доступа показало только значительное улучшение и остается ахилловой пятой заместительной почечной терапии. Невозможность предоставить подходящие сайты сосудистого доступа часто ведет к болезни и смерти пациентов с ESRD и накладывает значительное бремя на поставщиков медицинских услуг, плательщиков и программы социальной помощи по всему миру.
[0004] Места сосудистого доступа для гемодиализа в целом имеют три формы: артериовенозные фистулы (АВФ), артериовенозные трансплантаты (АВТ) и катетеры. Каждый тип места доступа в высокой степени подвержен отказам и осложнениям, как описано ниже.
[0005] АВФ создают хирургическим путем посредством создания прямого соединения между артерией и веной. Функциональная АВФ, создаваемая на запястье между лучевой артерией и плечевой веной, представляет собой наиболее долгосрочную и наиболее желаемую форму гемодиализного доступа, со средней проходимостью приблизительно 3 года. Вену, идущую от соединения, называют «отводящей» веной. Постоянное увеличение наружного диаметра и диаметра просвета отводящей вены представляет собой ключевой компонент для того, чтобы АВФ «созрела» и стала пригодной для использования. Многие полагают, что быстрый поток крови в отводящей вене создают посредством АВФ и НСС, прикладываемое к эндотелию вены, представляет собой основной фактор при обеспечении постоянного увеличения наружного диаметра и диаметра просвета отводящей вены. К сожалению, приблизительно 80% пациентов с ESRD не подходит для размещения АВФ на запястье, обычно из-за неподходящих диаметров вен или артерий. Для подходящих пациентов, у которых пытаются создать АВФ, это место может не подходить для использования без дополнительного вмешательства в приблизительно 50-60% случаев, эта проблема известна как «невозможность созревания». Малый диаметр кровеносного сосуда, в частности, малый диаметр вены, идентифицирован в качестве фактора невозможности созревания АВФ. Быстрое возникновение агрессивного рубцевания стенки вены, известное как «гиперплазия интимы», также идентифицировано в качестве важного фактора невозможности созревания АВФ. Некоторые исследователи выдвигают постулат о том, что области относительно быстрого или турбулентного потока крови в вене (который ведет к высокому локальному НСС) представляют собой основной фактор, вызывающий рубцевание стенки вены, тогда как другие исследователи предполагают, что рубцевание обусловлено областями относительно медленного или осциллирующего потока крови и относительно низкого или осциллирующего НСС. В ответ на это предприняты попытки для того, чтобы модулировать паттерны потокав отводящих венах АВФ для того, чтобы минимизировать степень отказов АВФ. Другие исследователи выдвигают постулат о том, что циклическое растяжение вены, обусловленное входящей пульсирующей артериальной кровью также может играть роль в стимуляции гиперплазии интимы и обструкции отводящей вены в АВФ. В данное время не существует способа, который сохраняет положительные эффекты увеличенной скорости крови и НСС, которые вызывают постоянное увеличение наружного диаметра и диаметр просвета артерий и вен, при этом устраняя отрицательные эффекты рубцевания стенки вены и обструкции. Не удивительно, что пациент со вновь диагностированной ESRD и необходимостью гемодиализа имеет шанс только 50% иметь функциональную АВФ в течение шести месяцев после начала гемодиализа. Эти пациенты без функциональной АВФ должны проходить гемодиализ с использованием более дорогих форм сосудистого доступа и при более высоком риске осложнений, болезни и смерти.
[0006] Второй тип места сосудистого доступа для гемодиализа представляет собой артериовенозный трансплантат (АВТ). АВТ конструируют, помещая сегмент синтетической трубки между артерией и веной. Типично, АВТ конструируют в руке или ноге. Часть синтетической трубки помещают непосредственно под кожей и используют для игольного доступа. Больше пациентов подходят для АВТ, а не АВФ, поскольку вены, которые не видны на поверхности кожи, можно использовать для выходящего потока, и степень ранних отказов значительно ниже, чем у АВФ. К сожалению, АВТ имеет среднюю первоначальную проходимость в течение только приблизительно 4-6 месяцев, поскольку быстро развивается агрессивная гиперплазия интимы и рубцевание в стенке отводящей вены рядом с соединением с синтетической трубкой, таким образом приводя к стенозу и тромбозу. Подобно отказу АВФ, некоторые исследователи выдвигают постулат о том, что быстрый и турбулентный поток крови в отводящей вене, создаваемый посредством АВТ, вызывает гиперплазию интимы и рубцевание стенки отводящей вены, тогда как другие исследователи выдвигают предположение о том, что это рубцевание обусловлено областями относительно медленного или осциллирующего потока крови и относительно низкого или осциллирующего НСС. другие исследователи выдвигают постулат о том, что циклическое растяжение вены, обусловленное вхождением пульсирующей артериальной крови в отводящую вену также может играть роль в формировании гиперплазии интимы и обструкции отводящей вены в АВТ. Несмотря на то, что АВТ является менее желаемым, чем АВФ, приблизительно 25% пациентов получают диализ с использованием АВТ, главным образом поскольку они не подходят для того, чтобы получать АВФ.
[0007] Третий тип места сосудистого доступа представляет собой катетер. Пациенты, которые не способны получать гемодиализ через АВФ или АВТ, могут иметь большой катетер, вставленный в шею, грудную клетку или ногу для того, чтобы получать гемодиализ. Часто происходит инфицирование этих катетеров, таким образом, накладывая на пациента высокий риск сепсиса и смерти. Пациентам с сепсисом катетера обычно требуется госпитализация, удаление катетера, установка временного катетера, внутривенное лечение антибиотиками и затем размещение нового катетера или места доступа другого типа, когда инфекция устранена. Катетеры также подвержены обструкции тромбами и отложениями фибрина вокруг кончина. Гемодиализные катетеры имеют среднюю проходимость в течение приблизительно 6 месяцев и в целом представляют собой наименее желаемую форму гемодиализного доступа. Несмотря на то, что катетеры являются менее желаемыми, чем АВФ и АВТ, приблизительно 20% пациентов получают диализ с использованием катетера, главным образом поскольку они не способны получать функциональные АВФ или АВТ или не подходят для того, чтобы получать АВФ или АВТ.
[0008] Проблемы отказа места гемодиализного доступа получили в последнее время большее внимание, поскольку по всему миру возросло число пациентов с ESRD, которые проходят регулярный гемодиализ. В 2004 году Centers for Medicare & Medicaid Services (CMS) анонсировали инициативу «Fistula First», чтобы повышать использование АВФ для предоставления гемодиализного доступа для пациентов с терминальной стадией почечной недостаточности. Эта основная инициатива является реакцией на опубликованные данные Medicare, которые показывают, что пациенты, которые проходят диализ с использованием АВФ, имеют сниженную болезненность и смертность по сравнению с пациентами с АВТ или катетером. Расходы, связанные с пациентами с АВФ, по существу ниже, чем расходы, связанные с пациентами с АВТ, в первый год диализа и в последующие годы. Экономия на диализе с использованием АВФ еще выше по сравнению с диализом с использованием катетера.
[0009] Чтобы подходить для АВФ, пациенты в целом должны иметь периферическую вену с наружным диаметром по меньшей мере 2,5 мм и периферическую артерию с наружным диаметром по меньшей мере 2,0 мм, и при этом следует понимать, что различные сосудистые хирурги будут устанавливать различные пороговые уровни. Чтобы подходить для АВТ, пациенты в целом должны иметь периферическую вену с наружным диаметром по меньшей мере 4 мм и периферическую артерию с наружным диаметром по меньшей мере 3,0 мм, и при этом следует понимать, что различные сосудистые хирурги будут задавать различные пороговые уровни. В настоящее время не существует способа постоянного увеличения наружного диаметра и диаметра просвета периферических вен и артерий у пациентов с ESRD, которые имеют неподходящий начальный размер вены или артерии перед созданием АВФ или АВТ. Следовательно, у пациентов с венами или артериями, которые слишком малы, чтобы попытаться создать АВФ или АВТ, следует использовать менее желаемые формы сосудистого доступа, такие как катетеры. Аналогичным образом, в настоящее время не существует одобренного способа лечения невозможности созревания АВФ, которая непропорционально выпадает пациентам с малыми диаметрами вен и артерий, таким как женщины и меньшинства. Таким образом, существует потребность в системах и способах для увеличения наружного диаметра и диаметра просвета вены или артерии перед созданием АВФ или АВТ. Недавнее исследование показало, что пациенты с ESRD, у которых приходится использовать менее желаемые формы сосудистого доступа, такие как катетеры, имеют по существу более высокий риск заболеть или умереть по сравнению с пациентами, у которых можно использовать АВФ или АВТ для гемодиализа.
[0010] Также существует необходимость постоянно увеличивать диаметр вены или артерии у пациентов с атеросклеротическими блокадами периферических или коронарных артерий, которые нуждаются в трансплантации шунта. Пациенты с заболеванием периферических артерий (ЗПА), которые имеют обструкцию потока крови в артериях на ногах, часто страдают от хромоты, изъязвления кожи и ишемии тканей. Многим из этих пациентов может в конечном итоге потребоваться ампутация частей пораженной конечности. У некоторых пациентов с ЗПА обструкцию можно облегчать в достаточной степени посредством баллонной ангиопластики или имплантации сосудистого стента. Однако у других пациентов обструкция является слишком тяжелой для этих типов минимально инвазивной терапии. Следовательно, хирурги часто должны создавать шунтирующие трансплантаты, которые отводят кровь вокруг непроходимых артерий и сохраняют достаточный поток крови к пораженной конечности. Однако, у многих пациентов, нуждающихся в периферическом шунтирующем трансплантате, нельзя использовать их собственные вены в качестве шунтирующих трубок из-за неподходящего диаметра вены или артерии и приходится использовать синтетические трубки, выполненные из таких материалов, как пористый политетрафторэтилен (пПТФЭ, например, Gore-Tex) или полиэтилентерефталат (ПЭТ, например, дакрон). Исследования показали, что использование собственных вен пациента в качестве шунтирующих трубок ведет к лучшей длительной проходимости, чем использование синтетических шунтирующих трубок, выполненных из материалов, таких как ПТФЭ, пПТФЭ или дакрон. Использование синтетической шунтирующей трубки повышает риск стеноза в артерии на дистальном конце трансплантата и тромбоза всей трубки, тем самым приводя к отказу шунтирующего трансплантата и возвращению или усугублению симптомов. Таким образом, существует потребность в системах и способах для увеличения наружного диаметра и диаметра просвета вен перед созданием шунтирующих трансплантатов у пациентов, которые не подходят для использования их собственных вен для создания шунтирующего трансплантата из-за неподходящего диаметра вены.
[0011] Пациенты с ишемической болезнью сердца (ИБС), которые имеют обструкцию потока крови в своем сердце, часто страдают от боли в груди, ишемии миокарда и инфаркта миокарда и многие из этих пациентов в конечном итоге умирают от этого заболевания. У некоторых из этих пациентов обструкцию можно облегчать в достаточной степени посредством баллонной ангиопластики или имплантации сосудистого стента. Однако у многих пациентов обструкция является слишком тяжелой для этих типов минимально инвазивной терапии. Следовательно, хирурги часто должны создавать шунтирующий трансплантат, который отводит кровь вокруг непроходимых артерий и сохраняет достаточный поток крови к пораженным областям сердца, с использованием внутренних маммарных артерий и лучевых артерий в качестве предпочтительных трубок. Однако, у некоторых пациентов, нуждающихся в коронарных шунтирующих трансплантатах, нельзя использовать внутренние маммарные или лучевые артерии из-за неподходящего диаметра артерии и следует использовать периферические вены. Исследования показали, что использование внутренних маммарных и лучевых артерий пациентов в качестве шунтирующих трубок ведет к лучшей длительной проходимости, чем использование сегментов периферических вен. Использование периферических вен в качестве шунтирующих трансплантатов повышает риск стеноза в трансплантате и тромбоза всей трубки, что ведет к отказу шунтирующего трансплантата и возвращению или усугублению симптомов. Таким образом, существует необходимость в системах и способах для увеличения наружного диаметра и диаметра просвета артерий перед созданием коронарных шунтирующих трансплантатов для пациентов, которые не подходят для использования их собственных артерий для создания шунтирующего трансплантата из-за неподходящего диаметра артерии. Кроме того, системы и способы для увеличения наружного диаметра и диаметра просвета вен перед созданием коронарных шунтирующих трансплантатов также являются желаемыми для пациентов с малыми диаметрами периферических вен.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0012] Настоящее изобретение включает способы использования кровяного насоса для того, чтобы повышать наружный диаметр и диаметр просвета периферических вен и артерий. описаны системы и способы, где или среднее напряжение сдвига у стенки или пиковое напряжение сдвига у стенки, которое прикладывают к эндотелию периферической вены или артерии, повышают посредством прокачивания крови в периферическую вену или артерию с достаточной скоростью и в течение периода времени, достаточных для того, чтобы достичь постоянного увеличения наружного диаметра и диаметра просвета периферической вены или артерии. Насос выбрасывает кровь в периферическую вену или артерию предпочтительно таким образом, что кровь имеет сниженное пульсовое давление по сравнению с пульсовым давлением крови в периферической артерии. Также описаны системы и способы, где напряжение сдвига у стенки (НСС), прикладываемое к эндотелию периферической вены или артерии, увеличивают посредством прокачивания крови из периферической вены или артерии и в другое местоположение в сосудистой системе, такое как правое предсердие с достаточной скоростью и в течение периода времени, достаточного для того, чтобы достичь постоянного увеличения наружного диаметра и диаметра просвета периферической вены или артерии.
[0013] Исследования показали, что базовый уровень гемодинамических сил и изменение гемодинамических сил внутри вен и артерий играет жизненно-важную роль при определении наружного диаметра и диаметра просвета этих вен и артерий. Например, постоянное увеличение скорости крови и НСС может вести к постоянному увеличению наружного диаметра и диаметра просвета вен и артерий, где количество увеличения наружного диаметра и диаметра просвета зависит как от уровня увеличенной скорости крови и НСС, так и от времени, в течение которого повышают скорость крови и НСС. Повышенные скорость крови и НСС воспринимают клетки эндотелия, которые запускают сигнальные механизмы, которые ведут к стимуляции гладкомышечных клеток сосудов, привлечению моноцитов и макрофагов и синтезу и высвобождению протеаз, способных разрушать компоненты внеклеточного матрикса, такие как коллаген и эластин. По существу, настоящее изобретение относится к увеличению скорости крови и НСС в течение периода времени, достаточных для того, чтобы достичь ремоделирования сосудов и постоянного увеличения наружного диаметра и диаметра просвета вен и артерий, предпочтительно в течение периода времени больше чем семь суток. Настоящее изобретение также относится к способам периодической ручной или автоматической корректировки параметров насоса для того, чтобы оптимизировать скорость крови и НСС в целевой артерии или вене, и для того, чтобы оптимизировать скорость и степень постоянного увеличения наружного диаметра и диаметра просвета вен и артерий.
[0014] Показано, что напряжение сдвига у стенки является ключевым фактором для того, чтобы вызывать постоянное увеличение наружного диаметра и диаметра просвета вен и артерий в ответ на увеличенный поток крови. Предполагая, что в сосуде имеет место поток крови по Хагену-Пуазейлю (т.е. Ламинарный поток с полностью проявленным параболическим профилем скоростей), НСС задает уравнение:
НСС (Па)=4Qμ/πR3,
где
Q - скорость потока (м3/с)
μ - вязкость крови (Па/с)
R - радиус сосуда (м)
[0015] Системы и способы, описанные в настоящем документе, увеличивают уровень НСС в периферических венах и артериях. Нормальное среднее НСС для вен находится в диапазоне между 0,076 Па и 0,76 Па. Для постоянного увеличения наружного диаметра и диаметра просвета вен, системы и способы, описанные в настоящем документе, увеличивают средний уровень НСС до диапазона между 0,76 Па и 23 Па, предпочтительно до диапазона между 2,5 Па и 10 Па. Нормальное среднее НСС для артерий находится в диапазоне между 0,3 Па и 1,5 Па. Для постоянного увеличения наружного диаметра и диаметра просвета артерий, системы и способы, описанные в настоящем документе, увеличивают средний уровень НСС до диапазона между 1,5 Па и 23 Па, предпочтительно до диапазона между 2,5 Па и 10 Па. Предпочтительно, средний НСС увеличивают от 1 суток до 84 суток (или дольше) для того, чтобы вызывать постоянное увеличение наружного диаметра и диаметра просвета периферических вен и артерий, которые изначально были непригодны или субоптимальны для применения в качестве места гемодиализного доступа или шунтирующего трансплантата, из-за того, что малый диаметр вены и артерии становится пригодным или более оптимальным. Это также можно выполнять посредством периодического увеличения среднего НСС во время периода воздействия, с промежуточными периодами нормального среднего НСС.
[0016] Системы и способы, описанные в настоящем документе, также увеличивают скорость крови в периферических венах и артериях. В покое средняя скорость крови в головной вене человека обычно находится в диапазоне между 5 и 9 см/с (0,05 и 0,09 м/с). Для систем и способов, описанных в настоящем документе, планируют среднюю скорость крови в периферической вене увеличивают до диапазона между 10 см/с и 120 см/с (0,1 и 1,2 м/с), предпочтительно до диапазона между 25 см/с и 100 см/с (0,25 и 1,0 м/с), в зависимости от начального диаметра вены, желаемого диаметра вены после воздействия и длительность времени воздействия (при повышенном НСС).
[0017] В покое средняя скорость крови в плечевой артерии обычно находится в диапазоне между 10 и 15 см/с (0,1 и 0,15 м/с). Для систем и способов, описанных в настоящем документе, планируют среднюю скорость крови в периферической артерии увеличивают до диапазона между 10 см/с и 120 см/с (0,1 и 1,2 м/с) и предпочтительно до диапазона между 25 см/с и 100 см/с (0,25 и 1,0 м/с), в зависимости от начального диаметра артерии, желаемого диаметра артерии после воздействия и длительности времени воздействия (при повышенном НСС).
[0018] Предпочтительно, среднюю скорость крови увеличивают в течение от 1 суток до 84 суток (или дольше) или предпочтительно между 7 и 42 сутками для того, чтобы вызывать постоянное увеличение наружного диаметра и диаметра просвета периферических вен и артерий так, что вены и артерии, которые изначально не подходили или были субоптимальными для применения в качестве места гемодиализного доступа или шунтирующего трансплантата из-за малого диаметра сосуда, становятся пригодными или более оптимальными. Это также можно выполнять посредством периодического увеличения средней скорости крови во время периода воздействия, с промежуточными периодами нормальной средней скорости крови.
[0019] Способ увеличения диаметра просвета и наружного диаметра периферической вены или периферической артерии у пациента изложен в настоящем документе. Способ включает осуществление первой процедуры для того, чтобы осуществлять доступ к артерии, вене, или правому предсердию (отдающий сосуд) и к периферической вене или артерии (принимающий сосуд) и «соединение по текучей среде» (т.е. соединение двух сосудов просвет в просвет для того, чтобы сделать возможным соединение по текучей среде между ними) отдающего сосуда с принимающим сосудом с использованием насосной системы. Затем насосную систему активируют для того, чтобы активно перемещать кровь из отдающего сосуда к принимающему сосуду. Способ также включает мониторинг процесса перекачивания крови в течение определенного периода времени. Способ дополнительно включает корректировку скорости насоса, скорости крови и/или скорости перекачиваемой крови, где конкретное направление или вектор потока крови является желаемым (например, в антероградном или ретроградном направлении), среднего НСС или пикового НСС на эндотелии принимающего сосуда, и снова мониторинг процесса перекачивания. По истечении периода времени для того, чтобы достичь постоянного увеличения наружного диаметра и диаметра просвета принимающего сосуда, диаметр принимающего сосуда измеряют для того, чтобы определять, достигнуто ли достаточное постоянное увеличение наружного диаметра и диаметра просвета принимающего сосуда. Скорость крови и/или скорость и НСС измеряют и снова корректируют процесс перекачивания, по мере необходимости. Когда достаточное количество постоянного увеличения наружного диаметра и диаметра просвета принимающего сосуда достигнуто, второе хирургическое вмешательство осуществляют для того, чтобы удалять насос. Место гемодиализного доступа (такое как АВФ или АВТ) или шунтирующий трансплантат можно создавать в момент удаления насоса или в последующий момент, используя по меньшей мере часть постоянно увеличенного принимающего сосуда.
[0020] Способ увеличения диаметра просвета и наружного диаметра периферической вены или периферической артерии у пациента также изложен в настоящем документе. Способ включает использование системы кровяного насоса для того, чтобы соединять по текучей среде периферическую артерию или вену (отдающий сосуд) и другим местоположением в венозной системе (принимающее местоположение) и затем активацию системы кровяного насоса для того, чтобы активно перемещать кровь из отдающего сосуда в принимающее местоположение, необязательно с использованием одной или нескольких трубок для крови. Способ также включает мониторинг процесса перекачивания крови в течение определенного периода времени. Способ дополнительно включает корректировку скорости насоса, скорости перекачиваемой крови или среднего НСС или пикового НСС на эндотелии отдающего сосуда и снова мониторинг процесса перекачивания. По истечении периода времени для того, чтобы достичь постоянного увеличения наружного диаметра и диаметра просвета отдающего сосуда, диаметр отдающего сосуда измеряют для того, чтобы определять, достигнуто ли достаточное постоянное увеличение наружного диаметра и диаметра просвета отдающего сосуда, измеряют скорость крови, НСС и процесс перекачивания корректируют снова, по мере необходимости. Когда достигают достаточного количества постоянного увеличения наружного диаметра и диаметра просвета отдающего сосуда, осуществляют второе хирургическое вмешательство для того, чтобы удалять насос. Место гемодиализного доступа (такое как АВФ или АВТ) или шунтирующий трансплантат можно создавать в момент удаления насоса или в последующий момент, используя по меньшей мере часть постоянно увеличенного отдающего сосуда.
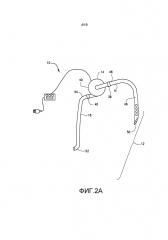
[0021] В одном из вариантов осуществления хирургическую процедуру осуществляют для того, чтобы обнажать сегменты двух вен. Один конец первой синтетической трубки соединяют по текучей среде с веной, кровь в которой подлежит удалению (отдающая вена). Другой конец первой синтетической трубки соединяют по текучей среде с портом входящего потока насоса. Один конец второй синтетической трубки соединяют по текучей среде с веной, в которую кровь подлежит перемещению (принимающая вена). Другой конец второй синтетической трубки соединяют по текучей СРЕДЕ с портом выходящего потока того же насоса. Деоксигенированную кровь перекачивают из отдающей вены в принимающую вену до тех пор, пока наружный диаметр и диаметр просвета принимающей вены не станет постоянно увеличенным на желаемое количество. Термин «постоянное увеличение» или «постоянная дилятация», когда используют для того, чтобы описывать дилятацию или увеличение наружного диаметра и диаметра просвета артерии или вены, используют в настоящем документе для того, чтобы обозначать, что даже если насос выключают, увеличение наружного диаметра или диаметра просвета сосуда все еще может быть продемонстрировано, по сравнению с наружным диаметром или диаметром просвета сосуда перед периодом перекачивания крови. То есть, наружный диаметр или диаметр просвета сосуда стал больше, независимо от давления, создаваемого посредством насоса. Когда возникает желаемое количество постоянного увеличения наружного диаметра и диаметра просвета принимающей вены, вторую хирургическую процедуру осуществляют для того, чтобы удалять насос и синтетические трубки. Место гемодиализного доступа (такое как АВФ или АВТ) или шунтирующий трансплантат, можно создавать в момент удаления насоса или в последующий момент, с использованием по меньшей мере части постоянно увеличенной принимающей вены. В этом варианте осуществления порт насоса можно соединять по текучей среде непосредственно с отдающей веной или принимающей веной без использования промежуточной синтетической трубки. В вариации этого варианта осуществления, принимающая вена может быть расположена в одном местоположении в организме, например, головная вена в руке, а отдающая вена может быть в другом местоположении, например, бедренная вена в ноге. В этом случае два конца узла насос-трубка располагают внутри организма и соединяющая часть узла насос-трубка может быть экстракорпоральной (снаружи организма, например, носимой под одеждой) или имплантированной (например, образующей туннель в подкожных тканях). Кроме того, в определенных случаях отдающий сосуд может быть более периферическим в относительном местоположении в организме, чем принимающая вена.
[0022] В другом варианте осуществления способ включает хирургическую процедуру, которую осуществляют для того, чтобы обнажать сегмент периферической артерии и сегмент периферической вены. Один конец первой синтетической трубки соединяют по текучей среде с периферической артерией. Другой конец первой синтетической трубки соединяют по текучей среде с портом входящего потока насоса. Один конец второй синтетической трубки соединяют по текучей среде с периферической веной. Другой конец второй синтетической трубки соединяют по текучей среде с портом выходящего потока того же насоса. Перекачивание оксигенированной крови из периферической артерии в периферическую вену осуществляют до тех пор, пока наружный диаметр и диаметр просвета вены или артерии не будет увеличен постоянно до желаемого уровня. Когда возникает желаемое количество постоянного увеличения наружного диаметра и диаметра просвета вены или артерии, вторую хирургическую процедуру осуществляют для того, чтобы удалять насос и синтетические трубки. Место гемодиализного доступа (такое как АВФ или АВТ) или шунтирующий трансплантат можно создавать в момент удаления насоса или в последующий момент, с использованием по меньшей мере части постоянно увеличенной принимающей вены или отдающей артерии, или обеих. Предусмотрена вариация этого варианта осуществления, где порт насоса можно соединять по текучей среде непосредственно с артерией или веной без использования промежуточной синтетической трубки.
[0023] В другом варианте осуществления способ включает хирургическую процедуру, которую осуществляют для того, чтобы обнажать сегмент периферической вены. Один конец первой синтетической трубки соединяют по текучей среде с периферической веной (отдающий сосуд), при этом другой конец первой синтетической трубки соединен по текучей среде с портом входящего потока насоса. Один конец второй синтетической трубки соединяют по текучей среде с верхней полой веной (принимающее местоположение), при этом другой конец второй синтетической трубки соединен по текучей среде с портом выходящего потока того же насоса. Перекачивание деоксигенированной крови из отдающей периферической вены в верхнюю полую вену осуществляют до тех пор, пока наружный диаметр и диаметр просвета отдающей периферической вены не будет постоянно увеличен до желаемого уровня. Когда возникает желаемое количество постоянного увеличения наружного диаметра и диаметра просвета отдающей периферической вены, осуществляют вторую хирургическую процедуру для того, чтобы удалять насос и синтетические трубки. Место гемодиализного доступа (такое как АВФ или АВТ) или шунтирующий трансплантат можно создавать в момент удаления насоса или в последующий момент, с использованием по меньшей мере части постоянно увеличенной периферической отдающей вены. Предусмотрена вариация этого варианта осуществления, где по меньшей мере один венозный клапан делают неработающим между 1) соединением первой синтетической трубки и периферической отдающей веной и 2) правым предсердием для того, чтобы сделать возможным ретроградный поток в периферическую отдающую вену.
[0024] В другом варианте осуществления способ включает хирургическую процедуру, которую осуществляют для того, чтобы обнажать сегмент периферической артерии. Один конец первой синтетической трубки соединяют по текучей среде с периферической артерией (отдающий сосуд), с другим концом первой синтетической трубки, соединенным по текучей среде с портом входящего потока насоса. Один конец второй синтетической трубки соединяют по текучей среде с верхней полой веной (принимающее местоположение), при этом другой конец второй синтетической трубки соединен по текучей среде с портом выходящего потока того же насоса. Перекачивание оксигенированной крови из периферической артерии в верхнюю полую вену осуществляют до тех пор, пока наружный диаметр и диаметр просвета периферической отдающей артерии не будет постоянно увеличен до желаемого уровня. Когда возникает желаемое количество постоянного увеличения наружного диаметра и диаметра просвета периферической отдающей артерии, осуществляют вторую хирургическую процедуру для того, чтобы удалять насос и синтетические трубки. Место гемодиализного доступа (такое как АВФ или АВТ) или шунтирующий трансплантат можно создавать в момент удаления насоса или в последующий момент, с использованием по меньшей мере части постоянно увеличенной периферической отдающей артерии. Предусмотрена вариация этого варианта осуществления, где синтетическую трубку используют для того, чтобы непосредственно соединять по текучей среде отдающий сосуд (такой как периферическая артерия) и принимающее местоположение (такое как верхняя полая вена или правое предсердие), где кровь течет пассивно из отдающей артерии высокого давления в принимающее местоположение низкого давления без насоса. В этом варианте осуществления увеличенная скорость крови и НСС в отдающей артерии является результатом шунта крови из отдающей артерии высокого давления в принимающее местоположение низкого давления и, когда поддерживают в течение достаточного количества времени, ведет к постоянному увеличению наружного диаметра и диаметра просвета отдающей артерии. Этот вариант осуществления отличается от существующих трансплантатов от периферической артерии к правому предсердию для гемодиализа тем, что система и способ выполнены с возможностью вызывать постоянное увеличение наружного диаметра и диаметра просвета отдающей артерии и не выполнены для регулярных игольных проколов или регулярного сосудистого доступа для гемодиализа. Например, синтетическая трубка в этом варианте осуществления имеет более короткий сегмент из синтетического материала, такого как ПТФЭ, пПТФЭ или дакрон, который предусматривает анастомоз с периферической артерией, но не является эффективным или оптимальным для регулярных игольных проколов, чтобы предоставлять сосудистый доступ для гемодиализа.
[0025] В другом варианте осуществления пару специализированных катетеров вставляют в венозную систему. Первый конец одного катетера (далее «трубка входящего потока») прикрепляют к порту входящего потока насоса, тогда как первый конец другого катетера (далее «трубка выходящего потока») прикрепляют к порту выходящего потока насоса. Необязательно, часть двух катетеров можно соединять вместе для того, чтобы формировать двупросветный катетер. В одном из вариантов осуществления каждая из трубок имеет индивидуальную длину между 2 см и 110 см и объединенную длину между 4 см и 220 см, и хирург или другой врач может усекать ее до желаемой длины, в том числе во время имплантации насосной системы. Каждая трубка имеет внутренний диаметр между 2 мм и 10 мм и предпочтительно 4 мм. Трубки можно формировать по меньшей мере отчасти из полиуретана (такого как Pellethane® или Carbothane®), поливинилхлорида, полиэтилена, силиконового эластомера, политетрафторэтилена (ПТФЭ), пористого политетрафторэтилена (пПТФЭ), полиэтилентерефталата (ПЭТ, например, дакрон) и их сочетания. Катетеры выполнят с возможностью вставлять в просвет венозной системы. После вставления, кончик второго конца трубки входящего потока