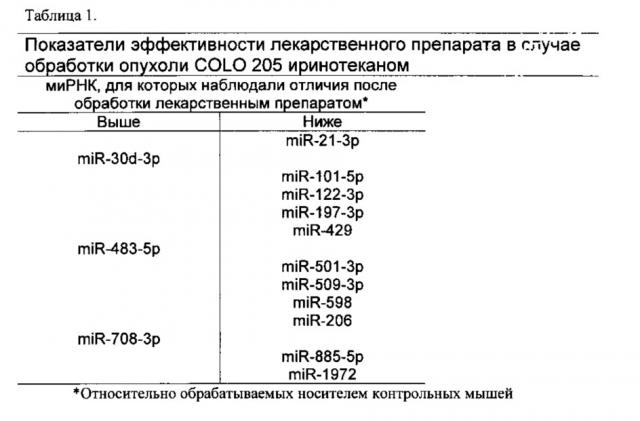
Маркеры ответа опухолевых клеток на противораковую терапию
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описаны композиции и способы для определения находящихся в системе кровообращения биомолекул до, во время и/или после лечения пациента противораковым или противоопухолевым лекарственным препаратом (или предполагаемым лекарственным препаратом). Предложены способы лечения на основании описанных в данном документе композиций и способов. Предложены неинвазивные способы и наборы для оценки эффективности противораковой терапии, направленной на уничтожение или повреждение раковых клеток. Варианты реализации изобретения применяют для определения противораковой эффективности противоракового лекарственного препарата у пациента, для оптимизации выбора противоракового лекарственного препарата для лечения пациента, для корректировки дозировки противоракового лекарственного препарата для лечения конкретного вида рака у пациента и для выявления эффективных противораковых терапевтических средств против любого конкретного типа рака. 2 н. и 10 з.п. ф-лы, 8 ил., 1 табл., 4 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
[0001] В данном документе предложены способы для применения в области техники рака и противораковых терапевтических средств, в частности, для определения эффективности противораковых терапевтических средств. Предложены способы и композиции для измерения уровня находящихся в системе кровообращения биомолекул, таких как, например, нуклеиновые кислоты и белки, в сочетании с противораковой терапией.
УРОВЕНЬ ТЕХНИКИ
[0002] Термин рак обычно относится к широкой группе заболеваний, характеризуемых неконтролируемым ростом клеток, которые образуют злокачественные опухоли. Противораковые терапии в общем случае уничтожают клетки, в идеале - первичные опухолевые клетки, но также и нормальные клетки. Существующие на данное время способы определения эффективности противораковой терапии включают инвазивные процедуры, такие как биопсии, а также методы визуализации, такие как срез КТ, магнитно-резонансная томография (МРТ) и позитронная эмиссионная томография (ПЭТ). Однако чтобы использовать преимущества таких неинвазивных способов, опухоли, как правило, должны уменьшиться в размере достаточно сильно для того, чтобы разницу можно было выявить методами визуализации. Чтобы способствовать определению того может ли новый противораковый лекарственный препарат или противоопухолевый лекарственный препарат эффективно убивать раковые или опухолевые клетки, или того, является ли противораковый лекарственный препарат или противоопухолевый лекарственный препарат эффективным против конкретного типа рака или опухоли, было бы целесообразно разработать способ для неинвазивного определения у пациента количества уничтоженных раковых или опухолевых клеток по отношению к уничтоженным нормальным клеткам. Также необходимы способы и композиции для неинвазивного определения находящихся в системе кровообращения биомолекул после уничтожения раковых или опухолевых клеток терапевтическим средством или предполагаемым терапевтическим средством.
[0003] МикроРНК представляют собой небольшие (состоящие приблизительно из 22 нуклеотидов) одноцепочечные РНК, которые можно обнаружить главным образом в цитоплазме высших эукариотов (растений и многоклеточных животных). Их основной функцией является регулирование генной экспрессии посредством связывания со специфическими мРНК-мишенями, обычно в 3'-нетранслируемой области (3'-НТО), и ингибирования их трансляции и параллельного способствования их разрушению. Существует более 1000 идентифицированных миРНК у мышей и более 2000 у людей. Считается, что большинство миРНК имеют большое количество мРНК-мишеней, которое может доходить до сотен. Многие мРНК, которые регулируются посредством миРНК, содержат в своих 3'-НТО участки связывания для большого количества миРНК. Некоторые миРНК экспрессируются фактически повсеместно; другие демонстрируют сильно ограниченную тканеспецифическую экспрессию.
[0004] В недавних исследованиях было обнаружено, что подгруппа из нескольких сотен миРНК присутствует и легко выявляется в сыворотке и плазме крови млекопитающих. Профиль сывороточной/плазменной миРНК исключительно стабилен у нормальных здоровых животных, но может изменяться при болезненных состояниях или в ответ на индуцированную лекарственными или химическими препаратами токсичность. Профиль сывороточной/плазменной миРНК отличается от профиля клеточного компонента крови.
[0005] В научной литературе начинает появляться все больше примеров профилей сывороточной/плазменной миРНК, которые могут считаться биомаркерами для диагностирования и прогнозирования в случае таких заболеваний, как фиброз печени, дисфункция миокарда и разные виды рака. Также было показано, что при помощи профилей сывороточной/плазменной миРНК можно прогнозировать эффективность лекарственных препаратов, их токсичность и поражение конкретных органов и тканей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0006] В различных аспектах описаны композиции и способы для определения находящихся в системе кровообращения биомолекул до, во время и/или после лечения пациента противораковым или противоопухолевым лекарственным препаратом (или предполагаемым лекарственным препаратом). Также предложены способы лечения на основании описанных в данном документе композиций и способов. Аспекты и варианты реализации изобретения, которые относятся к противораковой терапии, вне зависимости от того, оговорено это специально или нет, представляют собой аспекты и варианты реализации изобретения, которые также могут относиться к противоопухолевой терапии. Аналогично, аспекты и варианты реализации изобретения, в которых применяются противораковые лекарственные препараты, также можно применять в отношении противоопухолевых лекарственных препаратов.
[0007] В разных аспектах предложены неинвазивные способы и наборы для оценки эффективности противораковой терапии, направленной на уничтожение или повреждение раковых клеток. Варианты реализации изобретения применяют для определения противораковой эффективности противоракового лекарственного препарата у пациента, для оптимизации выбора противоракового лекарственного препарата для лечения пациента, для корректировки дозировки противоракового лекарственного препарата для лечения конкретного вида рака у пациента и для выявления эффективных противораковых терапевтических средств против любого конкретного типа рака.
[0008] В данном документе предложены неинвазивные способы для определения противораковой эффективности у пациента, которому проводят лечение при помощи противораковой терапии и, в частности, противоракового лекарственного препарата. В некоторых вариантах реализации изобретения указанные способы включают измерение уровня внутриклеточного специфического в отношении раковых клеток маркера в крови пациента после введения предполагаемого противоракового лекарственного препарата. В некоторых вариантах реализации изобретения уровень специфического в отношении опухолевых клеток маркера можно измерять до и после введения противоракового лекарственного препарата. Изменения уровня такого специфического в отношении опухолевых клеток маркера могут свидетельствовать об эффективности предполагаемого противоракового лекарственного препарата. Повышение уровня внутриклеточного специфического в отношении раковых клеток маркера в крови пациента по сравнению с контрольным маркером свидетельствует об эффективности предполагаемого противоракового лекарственного препарата. В других вариантах реализации изобретения снижение уровня внутриклеточного специфического в отношении раковых клеток маркера в образце по сравнению с контрольным маркером свидетельствует об эффективности предполагаемого противоракового лекарственного препарата. В определенных вариантах реализации изобретения изменения уровня специфического в отношении опухолевых клеток маркера согласуется с терапевтической эффективностью противоракового лекарственного препарата.
[0009] Лечение пациента предполагаемым противораковым лекарственным препаратом можно проводить в случае, когда уровень внутриклеточного специфического в отношении раковых клеток маркера в системе кровообращения пациента повышается после введения предполагаемого противоракового лекарственного препарата по отношению к контрольному маркеру. В альтернативном варианте лечение пациентов предполагаемым противораковым лекарственным препаратом можно проводить в случае, когда уровень специфического в отношении раковых клеток маркера в образце снижается после введения предполагаемого противоракового лекарственного препарата по отношению к контрольному маркеру. В некоторых вариантах реализации изобретения противораковый лекарственный препарат представляет собой противоопухолевый лекарственный конъюгат антигенсвязывающего белка и лекарственного препарата, специфический в отношении раковых клеток маркер представляет собой опухолеспецифический маркер, а рак представляет собой солидную опухоль или В-клеточный рак. В определенных вариантах реализации изобретения специфический в отношении раковых клеток маркер представляет собой микроРНК (миРНК).
[0010] Также предложены неинвазивные способы выбора эффективного противоракового лекарственного препарата для лечения нуждающегося в этом пациента. В некоторых вариантах реализации изобретения указанные способы включают измерение первого уровня специфического в отношении раковых клеток маркера в первом образце, полученном от ракового пациента, введение пациенту предполагаемого противоракового лекарственного препарата и измерение второго уровня специфического в отношении раковых клеток маркера во втором образце, полученном от пациента. Повышение в случае второго уровня свидетельствует о противораковой эффективности предполагаемого противоракового лекарственного препарата, а пациенту проводят лечение при помощи предполагаемого противоракового лекарственного препарата, выбирая, таким образом, эффективный противораковый лекарственный препарат для лечения пациента. В некоторых вариантах реализации изобретения повышение уровня специфического в отношении раковых клеток маркера в крови пациента сравнивают с соответствующим изменением для контрольного маркера. В зависимости от выбранного маркера, снижение в случае второго уровня может свидетельствовать об эффективности предполагаемого противоракового лекарственного препарата, а пациентам проводят лечение при помощи предполагаемого противоракового лекарственного препарата, выбирая, таким образом, эффективный противораковый лекарственный препарат для лечения пациента. В определенных вариантах реализации изобретения измеряемый для определения эффективности противоракового лекарственного препарата маркер представляет собой опухолевый биомаркер. В некоторых вариантах реализации изобретения противораковый лекарственный препарат представляет собой противоопухолевый лекарственный конъюгат антигенсвязывающего белка и лекарственного препарата, специфический в отношении раковых клеток маркер представляет собой опухолеспецифический маркер, а рак представляет собой солидную опухоль или В-клеточный рак. В одном варианте реализации изобретения контрольный маркер представляет собой маркер, полученный из нераковой (неопухолевой) клетки.
[0011] Дополнительно предложены неинвазивные способы корректировки дозировки противоракового лекарственного препарата для лечения рака у пациента. В некоторых вариантах реализации изобретения указанные способы включают измерение уровня одного или более специфических в отношении раковых клеток маркеров в системе кровообращения пациента, которому ввели начальное количество противоракового лекарственного препарата, и корректировку дозировки для последующего введения противоракового лекарственного препарата пациенту на основании уровня одного или более специфических в отношении раковых клеток маркеров в системе кровообращения пациента после введения начального количества противоракового лекарственного препарата. В некоторых вариантах реализации изобретения указанные способы дополнительно включают измерение уровня по меньшей мере одного контрольного маркера в системе кровообращения для нормализации уровня одного или более специфических в отношении раковых клеток маркеров. В определенных вариантах реализации изобретения измеряемый для определения эффективности противоракового лекарственного препарата маркер представляет собой опухолевый биомаркер. В некоторых вариантах реализации изобретения противораковый лекарственный препарат представляет собой противоопухолевый лекарственный конъюгат антигенсвязывающего белка и лекарственного препарата, специфический в отношении раковых клеток маркер представляет собой опухолеспецифический маркер, а рак представляет собой солидную опухоль или В-клеточный рак.
[0012] Например, пациенты, имеющие более высокий уровень опухолевого биомаркера после первого введения противоракового лекарственного препарата, могут в среднем получать большую вторую дозу противоракового лекарственного препарата, чем пациенты, имеющие более низкий уровень опухолевого биомаркера после первой дозы противоракового лекарственного препарата. В альтернативном варианте, в зависимости от индивидуального маркера, пациенты, имеющие более низкий уровень опухолевого биомаркера после первого введения противоракового лекарственного препарата, могут в среднем получать большую вторую дозу противоракового лекарственного препарата, чем пациенты, имеющие более высокий уровень опухолевого биомаркера после первой дозы противоракового лекарственного препарата.
[0013] Дополнительно предложены неинвазивные способы оценки терапевтической эффективности противоракового лекарственного препарата у пациента. В некоторых вариантах реализации изобретения указанные способы включают (а) получение первого исходного образца из системы кровообращения пациента, при этом у пациента есть рак (или опухоль); (b) введение пациенту дозы противоракового лекарственного препарата, при этом по меньшей мере один специфический в отношении раковых клеток маркер заблокирован в раковой клетке пациента перед введением противоракового лекарственного препарата, но высвобождается в систему кровообращения пациента после введения противоракового лекарственного препарата; (с) получение второго образца из системы кровообращения пациента; (d) измерение количества по меньшей мере одного специфического в отношении раковых клеток маркера (i) в первом исходном образце и (ii) во втором образце, и (е) сравнение количества специфического в отношении раковых клеток маркера в первом исходном образце с количеством специфического в отношении раковых клеток маркера во втором образце. Повышение количества по меньшей мере одного специфического в отношении раковых клеток маркера во втором образце по сравнению с количеством по меньшей мере одного специфического в отношении раковых клеток маркера в первом исходном образце свидетельствует о повышении гибели раковых клеток у пациента. Лечение пациента можно проводить при помощи противоракового лекарственного препарата, который повышает уровень по меньшей мере одного специфического в отношении раковых клеток маркера. В альтернативном варианте, в зависимости от индивидуального маркера, пациенты, имеющие более низкий уровень биомаркера после первого введения противоракового лекарственного препарата, могут в среднем получать большую вторую дозу противоракового лекарственного препарата, чем пациенты, имеющие более высокий уровень биомаркера после первой дозы противоракового лекарственного препарата. В некоторых вариантах реализации изобретения противораковый лекарственный препарат представляет собой противораковый лекарственный конъюгат антигенсвязывающего белка и лекарственного препарата, специфический в отношении раковых клеток маркер представляет собой опухолеспецифический маркер, а рак представляет собой солидную опухоль или В-клеточный рак. Также в данном документе предложены опухолевые биомаркеры, количество которых может изменяться в ответ на опухолевую нагрузку, но при этом они не обязательно получены из опухоли.
[0014] Также предполагается, что описанные в данном документе варианты реализации изобретения можно применять для выявления противораковых лекарственных препаратов, обладающих высокой эффективностью против конкретных типов рака. В частности, субъекта, как правило, мышь или другого грызуна, имеющего предопределенную форму рака, исследуют в отношении исходного уровня одной или более биомолекул, связанных с предопределенной формой рака, например, маркера лимфомы CD20. Предложенный противораковый лекарственный препарат против предопределенной формы рака вводят субъекту и определяют уровень биомолекул. Повышение или снижение уровней биомолекул по сравнению с контрольными маркерами используют для выявления противораковых лекарственных препаратов, обладающих большей эффективностью в отношении уничтожения или повреждения предопределенной формы рака у субъекта. В альтернативном варианте повышение или снижение уровней биомолекул до и после введения противоракового лекарственного препарата можно использовать для выявления кандидатных противораковых лекарственных препаратов, обладающих большей эффективностью в отношении уничтожения или повреждения предопределенной формы раковых клеток у субъекта. Предполагается, что, применяя этот способ, можно исследовать множество противораковых лекарственных препаратов для выявления и определения противораковых лекарственных препаратов, обладающих повышенной эффективностью в отношении разных форм рака. Кроме того, также можно проводить выявление противораковых лекарственных препаратов, обладающих повышенной эффективностью в отношении одного типа рака по сравнению с другим типом рака, таким образом, максимизируя уничтожение и повреждение раковых клеток в случае любого из противораковых лекарственных препаратов.
[0015] В одном аспекте предложен способ выбора противоракового лекарственного препарата для лечения человеческой опухоли, включающий внесение в подходящее отличное от человека животное-хозяина (например, любого грызуна или мышь) ксенотрансплантата человеческой опухоли, введение предполагаемого или кандидатного противоракового агента отличному от человека животному-хозяину с ксенотрансплантатной опухолью (например, мыши) и определение уровня одного или более внутриклеточных опухолевых маркеров, которые попали в систему кровообращения мыши из клетки ксенотрансплантата, при этом предполагаемый противораковый агент, который приводит к высвобождению предопределенного уровня одного или более внутриклеточных маркеров опухолевых клеток из клеток ксенотрансплантата, выбирают в качестве подходящего терапевтического средства для лечения человеческой опухоли. В некоторых вариантах реализации изобретения опухолевую клетку, опухолевую ткань или опухолевый орган можно вносить в любое животное-хозяина (например, любого грызуна), чтобы определить эффективность противоракового лекарственного препарата путем измерения уровня специфического в отношении опухолевых клеток маркера до и после введения противоракового лекарственного препарата.
[0016] В другом варианте реализации изобретения предполагаемый или кандидатный противораковый лекарственный препарат выбирают на основании уровня клеточно-специфического маркера до и после введения лекарственного препарата отличному от человека животному-хозяину (например, любому грызуну), несущему ксенотрансплантат опухолевой клетки, опухолевой ткани или опухолевого органа. Например, в некоторых вариантах реализации изобретения противораковый лекарственный препарат выбирают, когда происходит снижение уровня специфического в отношении опухолевых клеток маркера после введения предполагаемого противоракового агента отличному от человека животному-хозяину (например, любому грызуну) с ксенотрансплантатной опухолью по сравнению с уровнем специфического в отношении опухолевых клеток маркера перед введением кандидатного противоракового агента. В других вариантах реализации изобретения противораковый лекарственный препарат выбирают, когда происходит повышение уровня специфического в отношении опухолевых клеток маркера после введения предполагаемого или кандидатного противоракового лекарственного препарата отличному от человека животному-хозяину (например, любому грызуну) с ксенотрансплантатной опухолью по сравнению с уровнем специфического в отношении опухолевых клеток маркера перед введением противоракового агента. В определенных вариантах реализации изобретения маркер представляет собой маркер миРНК, а опухоль представляет собой рак легких, рак простаты или рак толстой кишки.
[0017] В одном аспекте предложен способ выбора противоракового лекарственного препарата для лечения пациента, у которого есть опухоль, включающий внесение в подходящую мышь или отличное от человека животное-хозяина (например, любого грызуна) ксенотрансплантата опухоли пациента, введение предполагаемого или кандидатного противоракового агента мыши или отличному от человека животному-хозяину (например, любому грызуну) с ксенотрансплантатной опухолью и определение уровня одного или более внутриклеточных опухолевых маркеров, которые попали в систему кровообращения мыши из клетки ксенотрансплантата, при этом предполагаемый или кандидатный противораковый агент, который приводит к высвобождению предопределенного уровня одного или более внутриклеточных маркеров опухолевых клеток из клеток ксенотрансплантата, выбирают в качестве подходящего терапевтического средства для лечения пациента. Таким образом, употребляемый в данном документе термин «полученный от» относится к опухолевой клетке, опухолевой ткани или опухолевому органу, полученному от пациента-человека или репродуцированному из опухолевой клетки или опухолевой ткани, полученной от пациента-человека.
[0018] В приведенных в данном документе вариантах реализации изобретения предложены наборы для определения статуса рака у субъекта, при этом наборы можно применять для определения описанного в данном документе дифференциального присутствия биомаркеров. Например, наборы можно применять для определения дифференциального присутствия любой комбинации биомаркеров в опухолевых образцах раковых субъектов до и после обработки противораковым лекарственным препаратом или другим терапевтическим лекарственным препаратом. Наборы согласно изобретению имеют много применений. Например, наборы можно применять, чтобы проводить мониторинг эффективности терапевтического лекарственного препарата у ракового субъекта. Также наборы можно применять, чтобы выявлять агенты, подходящие для лечения рака.
[0019] Другие признаки и преимущества настоящего изобретения станут очевидны их нижеприведенного описания и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0020] Фигура 1 иллюстрирует повышение уровней определенных маркеров миРНК после имплантации раковой опухоли легких А549 и последующее снижение уровня маркера миРНК через три дня после введения противоопухолевого лекарственного препарата цисплатина.
[0021] Фигура 2 иллюстрирует, что уровни конкретных маркеров миРНК снижаются после введения цисплатина в опухоли легких (А549) и введения доцетаксела в опухоли простаты (РС3М).
[0022] Фигура 3 иллюстрирует снижение уровней определенных маркеров миРНК после имплантации раковой опухоли легких А549 и последующее повышение уровня маркера миРНК через три дня после введения противоопухолевого лекарственного препарата цисплатина.
[0023] Фигура 4 иллюстрирует снижение уровней miR-16-5р, miR-1208, miR-24-3р и miR-588 после имплантации раковой опухоли легких А549 и последующее повышение уровня маркера миРНК через три дня после введения противоопухолевого лекарственного препарата цисплатина.
[0024] Фигура 5 иллюстрирует повышение уровней определенных маркеров миРНК после имплантации раковой опухоли простаты РС3М и последующее снижение уровня маркера миРНК после введения противоопухолевого лекарственного препарата доцетаксела.
[0025] Фигура 6 иллюстрирует повышение уровней miR-190, miR-153 и miR-92a-1 после имплантации раковой опухоли простаты РС3М и последующее снижение уровня маркера миРНК после введения противоопухолевого лекарственного препарата доцетаксела.
[0026] Фигура 7 иллюстрирует снижение уровней определенных маркеров миРНК после имплантации раковой опухоли простаты РС3М и последующее повышение уровня маркера миРНК после введения противоопухолевого лекарственного препарата доцетаксела.
[0027] Фигура 8 иллюстрирует снижение уровней miR-634 и miR-647 после имплантации раковой опухоли простаты РС3М и последующее повышение уровня маркера миРНК после введения противоопухолевого лекарственного препарата доцетаксела.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНА
[0028] В данном документе предложены способы, в которых определяют противораковую (или противоопухолевую) эффективность противоракового (или противоопухолевого) лекарственного препарата, включая случай пациента, которому проводят лечение при помощи противоракового лекарственного препарата, способы выбора эффективного противоракового лекарственного препарата для лечения нуждающегося в этом пациента, способы корректировки дозировки противоракового лекарственного препарата для лечения рака у пациента и способы оценки терапевтической эффективности противоракового лекарственного препарата в организме пациента. Каждый из этих способов является неинвазивным, требующим получения от пациента образцов, которые можно получить при помощи простого анализа крови или из крови, плазмы, сыворотки, цереброспинальной жидкости, синовиальной жидкости, лимфы, слюны или мочи, полученных от субъекта. Эти способы обеспечивают быстрое и точное получение информации пациентом и специалистом-медиком, таким образом, обеспечивая и максимизируя пользу от лечения, связанного с применением противораковых лекарственных препаратов или других противораковых терапевтических средств. Также предложены способы для отбора и выбора противораковых терапевтических средств против целевых типов рака и выявление целевых терапевтических средств, наиболее целесообразных для лечения какого-либо конкретного типа рака.
[0029] В этом свете раскрыты способы, в которых измеряют уровни определенных раково-специфических биомаркеров, таких как микроРНК, бесклеточная ДНК (бкДНК) и другие цитозольные или ядерные макромолекулы, которые обычно содержаться в клетках, но высвобождаются из раковых клеток после воздействия противоракового лекарственного препарата; и сравнивают высвобождение контрольных маркеров из нормальных клеток после воздействия того же самого противоракового лекарственного препарата, чтобы определить степень и соотношение уничтожения раковых клеток по сравнению с уничтожением нормальных клеток после противораковой обработки. В конкретных вариантах реализации изобретения биомаркеры представляют собой опухолевые биомаркеры, которые отвечают на изменения опухолевой нагрузки, но не обязательно получены из опухолевой клетки, опухолевой ткани или опухолевого органа. При некоторых обстоятельствах уровни определенных биомаркеров (например, маркеров миРНК) в образце снижаются после введения противоракового лекарственного препарата.
[0030] Перед дальнейшим описанием вариантов реализации настоящего изобретения следует обратить внимание на то, что описанные в данном документе способы не ограничены приведенными экспериментальными условиями; следовательно, эти способы и условия могут варьироваться. Также следует понимать, что употребляемая в данном документе терминология имеет цель описания только конкретных вариантов реализации изобретения и не должна считаться ограничивающей, так как объем настоящего изобретения ограничен только прилагаемой формулой изобретения.
[0031] Хотя для практической реализации или испытания настоящего изобретения можно применять любые способы и материалы, сходные или эквивалентные тем, что описаны в данном документе, ниже приведено описание разных вариантов реализации способов и материалов. Все патенты, заявки и непатентные публикации, которые упоминаются в этом описании, в полном объеме включены в данный документ посредством ссылки.
[0032] Если не указано иное, все технические и научные термины, употребляемые в данном документе, имеют значения, которые обычно подразумеваются специалистом в данной области техники, к которой относится это изобретение. По следующим ссылкам специалист в данной области техники может ознакомиться с общими определениями многих терминов, употребляемых в этом изобретении: Lackie and Dow, The Dictionary of Cell & Molecular Biology (3 ed. 1999); Singleton et al., Dictionary of Microbiology and Molecular Biology (2nd ed. 1994); The Cambridge Dictionary of Science and Technology (Walker ed., 1988); The Glossary of Genetics, 5th Ed., R. Rieger et al. (eds.), Springer Verlag (1991); и Hale & Marham, The Harper Collins Dictionary of Biology (1991). В контексте данного документа нижеприведенные термины имеют приписанные им значения, если не указано иное.
[0033] Употребляемый в данном документе термин «около», используемый в отношении конкретной приведенной числовой величины, означает, что указанная величина может отличаться от приведенной величины не более чем на 1%. Например, употребляемое в данном документе выражение «около 100» включает 99 и 101, а также все промежуточные величины (например, 99,1, 99,2, 99,3, 99,4 и т.д.).
[0034] Термины «рак» и «раковый» относятся к или описывают физиологическое состояние млекопитающих, которое, как правило, характеризуется нерегулируемым ростом клеток. Примеры рака включают, но не ограничиваются этим, лимфому и лейкемию, а также солидные опухоли. Под «В-клеточным раком» или «раком В-клеточной линии дифференцировки», или «ростом неопластических В-клеток» подразумевается любой тип рака, в котором разрегулированный или нерегулируемый рост клеток связан с В-клетками.
[0035] В контексте данного документа «опухоль» относится к росту и пролиферации неопластических клеток, как злокачественных, так и доброкачественных, а также прераковых и раковых клеток и тканей. В контексте данного документа «неопластический» относится к любой форме разрегулированного или нерегулируемого роста клеток, как злокачественных, так и доброкачественных, который приводит к аномальному разрастанию тканей. Таким образом, «неопластические клетки» включают злокачественные и доброкачественные клетки, характеризующиеся разрегулированным или нерегулируемым клеточным ростом. Как описано в данном документе, композиции и способы можно использовать как для противораковых, так и для противоопухолевых применений.
[0036] Рак может происходить из органа, например, выбранного из группы, состоящей из кожи, толстой кишки, щитовидной железы, яичников, легких и поджелудочной железы. В одном варианте реализации изобретения рак кожи представляет собой меланому. В другом варианте реализации изобретения рак выбран из группы, состоящей из: карциномы простаты, карциномы легких, карциномы молочной железы, карциномы яичников, карциномы кожи, карциномы толстой кишки, карциномы мочевого пузыря, карциномы печени, карциномы желудка, карциномы клеток почек, носоглоточной карциномы, плоскоклеточной карциномы, папиллярной карциномы щитовидной железы, карциномы шейки матки, саркомы, глиомы, острой миелоцитарной лейкемии, карциномы поджелудочной железы и карциномы головы и шеи. В другом варианте реализации изобретения рак представляет собой неходжкинскую лимфому, хроническую лимфоцитарную лейкемию, множественную миелому, В-клеточную лимфому, низкодифференцированную В-клеточную лимфому, среднедифференцированную В-клеточную лимфому, высокодифференцированную В-клеточную лимфому, В-клеточную острую лимфобластическую лейкемию, болезнь Ходжкина, плазмоцитому, фолликулярную лимфому, фолликулярную мелкоклеточную лимфому с расщепленными ядрами, фолликулярную крупноклеточную лимфому, фолликулярную смешанную мелкоклеточную лимфому с расщепленными ядрами, диффузную мелкоклеточную лимфому с расщепленными ядрами, диффузную мелкоклеточную лимфоцитарную лимфому, пролимфоцитарную лейкемию, лимфоплазмоцитарную лимфому, лимфому маргинальной зоны, лимфому лимфоидной ткани, ассоциированной со слизистой, лимфому моноцитоидных В-клеток, селезеночную лимфому, лейкемию ворсистых клеток, диффузную крупноклеточную лимфому, медиастинальную крупноклеточную лимфому В-клеток, лимфогранулематоз, внутрисосудистый лимфомутоз, диффузную смешанно-клеточную лимфому, диффузную крупноклеточную лимфому, иммунобластную лимфому, лимфому Беркитта, СПИД-ассоциированную лимфому, макроглобулинемию Вальденстрема, мантийноклеточную лимфому и болезнь тяжелых цепей. В некоторых аспектах опухоль характеризуется ростом неопластических В-клеток.
[0037] Употребляемое в данном документе слово «метка» относится к выявляемому соединению или композиции, которая конъюгирована прямым или непрямым образом с антигенсвязывающим белком или его антигенсвязывающим фрагментом для того, чтобы получить «меченый» антигенсвязывающий белок или его антигенсвязывающий фрагмент. Метка может быть выявляемой сама по себе (например, метки-радиоизотопы или флуоресцентные метки) или, в случае ферментной метки, может катализировать такие химические изменения субстратного соединения или композиции, которые можно выявить.
[0038] «Субъект» является представителем позвоночных, например, млекопитающим, и, в качестве иллюстрации, приматом, таким как человек. Млекопитающие включают, но не ограничиваются этим, приматов (включая человека), сельскохозяйственных животных, спортивных животных, диких и домашних животных. «Пациентом» может быть любой субъект, но, как правило, это человек. Слово «пациент» может также относиться к множеству пациентов, например, к множеству пациентов-людей.
[0039] «Образец» или «биологический образец» включает, например, кровь, плазму, сыворотку, цереброспинальную жидкость, синовиальную жидкость, лимфу, слюну или мочу, полученные от субъекта. Образец может представлять собой любую жидкость или компонент, полученные от субъекта, в которых можно измерить уровень клеточно-специфического маркера.
[0040] В контексте данного документа «специфический в отношении опухолевых клеток маркер» включает полипептид (имеющий конкретную молекулярную массу) или нуклеиновую кислоту, которые заблокированы в опухолевой клетке до гибели опухолевой клетки, например, до лечения противоопухолевым лекарственным препаратом, но высвобождаются в систему кровообращения пациента после лечения. «Специфический в отношении опухолевых клеток маркер» также включает маркеры, которые высвобождаются опухолевыми клетками до повреждения или гибели опухолевой клетки (например, до лечения противоопухолевым лекарственным препаратом), но сохраняются в клетке после лечения противоопухолевым лекарственным препаратом. В определенных вариантах реализации изобретения специфические в отношении опухолевых клеток маркеры представляют собой маркеры миРНК. Полипептидные биомаркеры можно определить по молекулярной массе в Дальтонах, и они включают массы, соответствующие определенным молекулярным массам для каждого маркера. Нуклеотидные биомаркеры можно определить по последовательности. «Специфический в отношении опухолевых клеток биомаркер» включает, например, биомаркеры клеточного апоптоза, клеточной пролиферации и выживаемости. Типовые специфические в отношении опухолевых клеток биомаркеры включают, но не ограничиваются этим, CD20, В-лимфоидную тирозинкиназу (BLK) и их комбинации. В разных аспектах гибель раковых или опухолевых клеток может происходить спонтанно или по естественным или неизвестным причинам, а в разных вариантах реализации изобретения изменение уровня конкретного маркера в ответ на противораковую или противоопухолевую терапию является индикатором эффективности или предполагаемой эффективности противораковой или противоопухолевой терапии человека..
[0041] Употребляемый в данном документе термин «биомаркер» включает, но не ограничивается этим, нуклеиновую кислоту, пептид, белок, липид, антиген, углевод или протеогликан, например, ДНК (включая, например, бесклеточную ДНК (бкДНК)) или РНК. РНК может представлять собой мРНК, миРНК, мноРНК, мяРНК, рРНК, тРНК, малые интерферирующие РНК, гяРНК или кшРНК, или короткие или длинные некодирующие РНК. ДНК (например, бкДНК) или РНК (например, мРНК) могут содержать точечные мутации, гиперметилирование ДНК, микросателлитную нестабильность и утрату гетерозиготности или комбинации вышеперечисленного.
[0042] Употребляемый в данном документе термин «опухолевый биомаркер» включает нормальный компонент сыворотки, плазмы или другой жидкости организма, который изменяется в ответ на опухолевую нагрузку, но не обязательно получен из опухоли. Уровни опухолевых биомаркеров могут быть прямо или обратно пропорциональны опухолевой нагрузке. Это означает, ч