Иммуногенная композиция, включающая ее вакцина, набор для приготовления вышеуказанной композиции и способ лечения заболеваний, связанных с патологией секреции гастрина
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к иммуногенным композициям гастрина-17, и может быть использовано в медицине для лечения заболеваний, связанных с патологией секреции гастрина. Иммуногенная композиция включает а) первый компонент, который содержит адъювант, содержащий группу анти-CD32, связанную с лигандом TLR9, и первую пептидную альфа-спираль, и б) второй компонент, который содержит по меньшей мере один пептидный иммуноген гастрин-17, который связан со второй пептидной альфа-спиралью. Причем указанная первая пептидная альфа-спираль первой части скручена со второй пептидной альфа-спиралью второй части, образуя тем самым скрученную спиральную структуру. Изобретение позволяет повысить эффективность иммунизации против гастрина-17, преодолев естественную иммунологическую толерантность против аутологичного антигена G17M. 4 н. и 11 з.п. ф-лы, 3 ил., 2 табл., 7 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к иммуногенным композициям, содержащим пептидный иммуноген гастрин и анти-CD32 группу, связанную с лигандом TLR9, и к вакцине, содержащей такую иммуногенную композицию, и к ее применению при лечении болезненных состояний, связанных с патологией секреции гастрина.
Уровень техники
Рак или с медицинской точки зрения злокачественное новообразование - это широкая группа различных заболеваний, для которых характерен нерегулируемый клеточный рост. При раке клетки делятся и растут бесконтрольно, образуя злокачественные опухоли, и внедряются в другие части тела. Рак также распространяется на более отдаленные части тела через лимфатическую систему или кровоток. Не все опухоли являются злокачественными. Доброкачественные опухоли не растут бесконтрольно, не внедряются в соседние ткани и не распространяются по всему телу. Существует более 200 различных известных видов рака, поражающих человека.
Определение причины развития рака представляется сложным. Многие факторы, как известно, увеличивают риск развития рака, в том числе, употребление табака, некоторые инфекции, радиация, отсутствие физической активности, ожирение и загрязнители окружающей среды. Эти факторы могут непосредственно влиять на повреждение генов или усугублять существующие генетические дефекты в клетках, что вызывает возникновение заболевания. Примерно 5-10% всех случаев рака являются наследственными.
Рак может быть обнаружен несколькими путями, в том числе по наличию некоторых признаков и симптомов, при помощи скрининговых тестов или методами медицинской визуализации. После того, как обнаружен возможный рак, для его диагностики проводят микроскопическое изучение образца ткани. Рак обычно лечат при помощи химиотерапии, радиотерапии или хирургически. Шансы на выживание при данном заболевании в значительной степени варьируются в зависимости от типа и локализации рака и стадии заболевания на момент начала лечения. Несмотря на то, что рак поражает людей всех возрастов, и что некоторые типы рака являются более распространенными у детей, риск развития рака, как правило, с возрастом повышается. В 2007 г. рак стал причиной смерти примерно в 13% случаев от общего количества по всему миру (7,9 миллионов). Показатели увеличиваются из-за того, что все больше людей доживает до старости, а также из-за массового улучшения образа жизни в развивающихся странах.
После того, как иммунная система сталкивается с факторами окружающей среды, она встречает их на основе различия свой-чужой, и многие виды опухолевых клеток, возникающих в результате появления рака, более или менее допускаются собственной иммунной системой больного, поскольку опухолевые клетки по существу являются его собственными клетками, которые растут, делятся и распространяются без соответствующего регулирующего контроля.
Иммунная толерантность или иммунологическая толерантность - это процесс, при котором иммунная система не атакует антиген. При врожденной или аутотолерантности организм не дает иммунный ответ на аутоантигены. Встречаются три формы: центральная толерантность, периферическая толерантность и приобретенная толерантность.
Далее в описании следуют ссылки на следующие работы уровня техники:
1. Mathis, D. and C. Benoist. 2004. Back to central tolerance. Immunity 20: 509-516.
2. Miller, J.F.A.P. and G. Morahan. 1992. Peripheral T cell tolerance. Annu. Rev. Immunol. 10: 51-69.
3. Tafuri, A., J. Alferink, P.M Iler, G.J.H mmerling, and B. Arnold. 1995. T cell awareness of paternal alloantigens during pregnancy. Science 270: 630-633.
4. Cheever, M.A. and C.S. Higano. 2011. PROVENGE (Sipuleucel-T) in prostate cancer: the first FDA-approved therapeutic cancer vaccine. Clin. Cancer Res. 17: 3520-3526.
5. Linley, A.J., M. Ahmad, and R.C. Rees. 2011. Tumour-associated antigens: considerations for their use in tumour immunotherapy. Int. J. Hematol. 93: 263-273.
6. Brett, B.T., S.C. Smith, C.V. Bouvier, D. Michaeli, D. Hochhauser, B.R. Davidson, T.R. Kurzawinski, A.F. Watkinson, S.N. Van, R.E. Pounder, and M.E. Caplin. 2002. Phase II study of anti-gastrin-17 antibodies, raised to G17DT, in advanced pancreatic cancer. J Clin Oncol 20: 4225-4231.
7. Rengifo-Cam, W. and P. Singh. 2004. Role of progastrins and gastrins and their receptors in GI and pancreatic cancers: targets for treatment. Curr. Pharm. Des 10: 2345-2358.
8. Watson, S.A., D. Michaeli, T.M. Morris, P. Clarke, A. Varro, N. Griffin, A. Smith, T. Justin, and J.D. Hardcastle. 1999. Antibodies raised by gastrimmune inhibit the spontaneous metastasis of a human colorectal tumour, AP5LV. Eur J Cancer 35: 1286-1291.
9. Watson, S.A., T.M. Morris, D.F. McWilliams, J. Harris, S. Evans, A. Smith, and P.A. Clarke. 2002. Potential role of endocrine gastrin in the colonic adenoma carcinoma sequence. Br. J Cancer 87: 567-573.
10. Morton, M., G.C. Prendergast, and T.D. Barrett. 2011. Targeting gastrin for the treatment of gastric acid related disorders and pancreatic cancer. Trends in pharmacological sciences 32: 201-205.
11. Ciccotosto, G.D., J.K. Dawborn, K.J. Hardy, and A. Shulkes. 1996. Gastrin processing and secretion in patients with end-stage renal failure. J Clin Endocrinol. Metab 81: 3231-3238.
12. Eaton-Bassiri, A., S.B. Dillon, M. Cunningham, M.A. Rycyzyn, J. Mills, R.T. Sarisky, and M.L. Mbow. 2004. Toll-like receptor 9 can be expressed at the cell surface of distinct populations of tonsils and human peripheral blood mononuclear cells. Infect. Immun. 72: 7202-7211.
13. Saikh, K.U., T.L. Kissner, A. Sultana, G. Ruthel, and R.G. Ulrich. 2004. Human monocytes infected with Yersinia pestis express cell surface TLR9 and differentiate into dendritic cells. J. Immunol. 173: 7426-7434.
14. Tanaka, J., K. Sugimoto, K. Shiraki, M. Tameda, S. Kusagawa, K. Nojiri, T. Beppu, K. Yoneda, N. Yamamoto, K. Uchida, T. Kojima, and Y. Takei. 2010. Functional cell surface expression of toll-like receptor 9 promotes cell proliferation and survival in human hepatocellular carcinomas. Int. J Oncol. 37: 805-814.
15. Hartmann, G., J. Battiany, H. Poeck, M. Wagner, M. Kerkmann, N. Lubenow, S. Rothenfusser, and S. Endres. 2003. Rational design of new CpG oligonucleotides that combine В cell activation with high IFN-a induction in plasmacytoid dendritic cells. Eur. J. Immunol. 33: 1633-1641.
16. Tversky, J.R., A.P. Bieneman, K.L. Chichester, R.G. Hamilton, and J.T. Schroeder. 2010. Subcutaneous allergen immunotherapy restores human dendritic cell innate immune function. Clin. Exp. Allergy. 40: 94-102.
17. Abel, K., Y. Wang, L. Fritts, E. Sanchez, E. Chung, P. Fitzgerald-Bocarsly, A.M. Krieg, and C.J. Miller. 2005. Deoxycytidyl-deoxyguanosine oligonucleotide classes A, B, and С induce distinct cytokine gene expression patterns in rhesus monkey peripheral blood mononuclear cells and distinct alpha interferon responses in TLR9-expressing rhesus monkey plasmacytoid dendritic cells. Clin Diagn. Lab Immunol 12: 606-621.
18. Puig, M., K.W. Tosh, L.M. Schramm, L.T. Grajkowska, K.D. Kirschman, C. Tami, J. Beren, R.L. Rabin, and D. Verthelyi. 2012. TLR9 and TLR7 agonists mediate distinct type I IFN responses in humans and nonhuman primates in vitro and in vivo. J Leukoc. Biol. 91: 147-158.
19. Arndt, K.M., K.M. Muller, and A. Pluckthun. 2001. Helix-stabilized Fv (hsFv) antibody fragments: substituting the constant domains of a Fab fragment for a heterodimeric coiled-coil domain. J Mol. Biol. 312: 221-228.
20. Van Reijsen, F.C, C.A.F.M. Bruijnzeel-Koomen, F.S. Kalthoff, E. Maggi, S. Romagnani, J.K.T. Westland, and G.C. Mudde. 1992. Skin-derived aeroallergen-specific T-cell clones of Th2 phenotype in patients with atopic dermatitis. J. Allergy Clin. Immunol. 90: 184-193.
21. Krieg, A.M., A.K. Yi, S. Matson, T.J. Waldschmidt, G.A. Bishop, R. Teasdale, G.A. Koretzky, and D.M. Klinman. 1995. CpG motifs in bacterial DNA trigger direct B-cell activation. Nature. 374: 546-549.
22. Chao, H., D.L. Bautista, J. Litowski, R.T. Irvin, and R.S. Hodges. 1998. Use of a heterodimeric coiled-coil system for biosensor application and affinity purification. J. Chromatogr. В Biomed. Sci. Appl. 715: 307-329.
23. Litowski, J.R. and R.S. Hodges. 2001. Designing heterodimeric two-stranded alpha-helical coiled-coils: the effect of chain length on protein folding, stability and specificity. J. Pept. Res. 58: 477-492.
24. Litowski, J.R. and R.S. Hodges. 2002. Designing heterodimeric two-stranded alpha-helical coiled-coils. Effects of hydrophobicity and alpha-helical propensity on protein folding, stability, and specificity. J. Biol. Chem. 277: 37272-37279.
25. Greenman, J., A.L. Tutt, A.J. George, K.A. Pulford, G.T. Stevenson, and M.J. Glennie. 1991. Characterization of a new monoclonal anti-Fc gamma RII antibody, AT10, and its incorporation into a bispecific F(ab')2 derivative for recruitment of cytotoxic effectors. Mol. Immunol 28: 1243-1254.
26. Stuart, S.G., M.L. Trounstine, D.J. Vaux, T. Koch, C.L. Martens, I. Mellman, and K.W. Moore. 1987. Isolation and expression of cDNA clones encoding a human receptor for IgG (Fc gamma RII). J. Exp. Med. 166: 1668-1684.
27. Macintyre, E.A., P.J. Roberts, R.bdul-Gaffar, K. O'Flynn, G.R. Pilkington, F. Farace, J. Morgan, and D.C. Linch. 1988. Mechanism of human monocyte activation via the 40-kDa Fc receptor for IgG. J Immunol. 141: 4333-4343.
28. Krug. A., S. Rothenfusser, V. Hornung, B. Jahrsdorfer, S. Blackwell, Z.K. Ballas, S. Endres, A.M. Krieg, and G. Hartmann. 2001. Identification of CpG oligonucleotide sequences with high induction of IFN-alpha/beta in plasmacytoid dendritic cells. Eur J Immunol. 31: 2154-2163.
29. Tel, J., N. Beenhakker, G. Koopman, B. Hart, G.C. Mudde, and V. de, I. 2012. Targeted delivery of CpG ODN to CD32 on human and monkey plasmacytoid dendritic cells augments IFNalpha secretion. Immunobiology. 217: 1017-1024.
30. Berntzen, G., J.T. Andersen, K. Ustgard, T.E. Michaelsen, S.A. Mousavi, J.D. Qian, P.E. Kristiansen, V. Lauvrak, and I. Sandlie. 2009. Identification of a high affinity Fcgamma RIIA binding peptide that distinguishes Fcgamma RIIA from Fcgamma RIIB and exploits Fcgamma RIIA mediated phagocytosis and degradation. J. Biol. Chem. 284: 1126-1135.
31. Stuart, S.G., N.E. Simister, S.B. Clarkson, B.M. Kacinski, M. Shapiro, and I. Mellman. 1989. Human IgG Fc receptor (hFcRII; CD32) exists as multiple isoforms in macrophages, lymphocytes and IgG-transporting placental epithelium. EMBO J. 8: 3657-3666.
Центральная толерантность1:
Центральная толерантность возникает в процессе развития лимфоцита в тимусе и костном мозге. Именно здесь уничтожаются Т-и В-лимфоциты, которые распознают собственные аутоантигены прежде, чем они превратятся в полностью иммунокомпетентные клетки, что предотвращает развитие аутоиммунных реакций. Этот процесс наиболее активен в эмбриональном периоде, но продолжается и в течение всей жизни пока образуются незрелые лимфоциты.
Периферическая толерантность2:
Периферическая толерантность - это иммунологическая толерантность, развивающаяся после того, как Т- и В-лимфоциты достигают зрелости и выходят на периферию. Т-клетки, которые покидают тимус, не являются полностью безопасными. Некоторые будут обладать рецепторами (TCRs), которые могут реагировать на аутоантигены, присутствующие в такой высокой концентрации, что они могут связываться со слабыми рецепторами Т-клеток и с которыми они не встречаются в тимусе (такие как тканеспецифические молекулы, подобные молекулам в островках Лангерганса, головного или спинного мозга). Эти аутореактивные Т-клетки, которые избегают внутритимусового негативного отбора в тимусе, могут вызывать повреждение клеток, если они не будут удалены или эффективно нейтрализованы в периферической ткани. Известно несколько механизмов обратной связи, которые отключают такие потенциально аутореактивные Т-клетки. Различают следующие механизмы: анергия, гибель клеток, индуцированная активацией, периферическая супрессия
Приобретенная или индуцированная толерантность3:
Приобретенная или индуцированная толерантность относится к адаптации иммунной системы к внешним антигенам, характеризующаяся специфической нечувствительностью лимфоидных тканей к данному антигену, что, при других обстоятельствах, могло бы индуцировать клеточно-опосредованный или гуморальный иммунитет. Одним из наиболее важных видов приобретенной толерантности является иммунная толерантность при беременности, когда плод и плацента должны быть толерогенны по отношению к материнской иммунной системе.
Иммунотерапия, нацеленная на опухоль-ассоциированные антигены:
Иммунотерапия рака заключается в использовании иммунной системы для отторжения рака. Основной предпосылкой является стимулирование иммунной системы пациента, чтобы она атаковала злокачественные опухолевые клетки, являющиеся причиной заболевания. Это может происходить или путем активной иммунизации пациента (например, путем введения клеточной противораковой вакцины, такой как Provenge от компании "Дендреон", Сиэтл, штат Вашингтон, США)4, в этом случае иммунная система пациента обучается распознавать опухолевые клетки в качестве мишеней для уничтожения, или путем введения терапевтических антител в качестве лекарств, в этом случае иммунная система пациента мобилизуется на уничтожение опухолевых клеток при помощи терапевтических антител. Другой подход к активации иммунной системы против опухолей заключается в использовании так называемых опухоль-ассоциированных антигенов (ОАА), являющихся собственными протеинами, которые в некоторой степени экспрессируются на здоровых нормальных клетках, но избыточно экспрессируются на опухолевых клетках5. Эти ОАА создаются и презентируются организмом в иммуногенном образе, чтобы иммунная система создавала ответ, несмотря на то, что эти протеины являются своими. Очевидно, что такой подход будет полезен для ОАА, против которых у пациента развилась периферийная или приобретенная толерантность. В том случае, когда Т- и В-лимфоциты, распознающие ОАА, удалены из иммунологического репертуара, активная иммунотерапия рака становится невозможной.
Гастрин:
Примером аутоантигена, который может быть использован в качестве мишени для лечения раковых заболеваний желудочно-кишечного тракта (ЖКТ), таких как рак поджелудочной железы, является "малый гастрин" (G17)6-9. Дополнительно, нейтрализация G17 также может быть полезна в случае любого гастрин-ассоциированного патологического состояния, включая язву желудка, гастроэзофагеальную рефлюксную болезнь (ГЭРБ)10, поскольку pH желудка регулируется гастрином, и терминальную стадию почечной недостаточности (ТСПН)11, поскольку у пациентов с ТСПН гастрин циркулирует в более высоких концентрациях, чем обычно.
Патент US 5023077 описывает иммуногенные композиции и способы лечения и профилактики язвенной болезни желудка и двенадцатиперстной кишки, в соответствии с которым иммуногенные композиции основаны на пептидах ряда гастрина, которые соединены с иммуногенным носителем, таким как дифтерийный анатоксин, столбнячный анатоксин, гемоцианин лимфы улитки или бычий сывороточный альбумин.
Гастрин обладает несколькими важными функциями в желудочно-кишечном тракте, из которых две наиболее важные - это стимуляция кислотной секреции и стимуляция роста клеток в ЖКТ. Гормон существует как минимум в двух молекулярных формах, в форме гептадека-гастрина, также называемого "малым" гастрином ("G17"), и тетратриаконто-гастрина ("G34"), названных в соответствии с числом аминокислотных остатков ("AK") в каждой молекуле, где G17 представляет собой 17-членный аминокислотный терминальный ("N-терминальный") остаток от G34.
Патент US 5609870 описывает получение анти-G17 иммуногена, инициирующего выработку антител у млекопитающих против их собственного G17 и не реагирующих на G34, содержащего конъюгированный пептид, состоящий из последовательности, соответствующей фрагменту N-терминальной аминокислотной последовательности G17 вплоть до аминокислотного остатка №12 на его С-конце, и спейсерный пептид, который конъюгирован с иммуногенным носителем, таким как дифтерийный анатоксин, столбнячный анатоксин, гемоцианин лимфы улитки и бычий сывороточный альбумин.
Иммунный баланс:
Иммунный баланс регулируется при помощи Th1/Th2/Th17/Treg клеток, играющих важную роль в разработке методов иммунотерапии.
Th1 клетки (Т-хелперы 1 типа) характеризуются продукцией провоспалительных цитокинов, таких как IFN-γ, IL-2 и TNF-β. Th1 клетки вовлечены в клеточно-опосредованный иммунитет. Цитокины, продуцируемые Th1 клетками, стимулируют фагоцитоз и разрушают микробиальные патогены. Несколько хронических воспалительных заболеваний было описано как Th1 доминантные заболевания, например, рассеянный склероз, диабет и ревматоидный артрит.
Th2 клетки (Т-хелперы 2 типа) характеризуются продукцией IL-4, IL-5, IL-9, IL-10 и IL-13. Th2 клетки, как полагают, играют роль в аллергических ответах. Цитокины, такие как IL-4, в основном стимулируют продукцию антител. IL-5 стимулирует ответы эозинофилов, что также является частью иммунного ответа. Атопия и аллергия, как полагают, являются Th2 доминантными заболеваниями.
Дисбаланс Th1/Th2 или Th17/Treg иммунитета становится причиной различных иммунных заболеваний.
Аллергия рассматривается как гиперчувствительная реакция на белки в окружающей среде. Аллергены - это антигены, в ответ на которые пациенты отвечают продукцией антител IgE, что затем приводит к аллергическим реакциям. Антигены в комплексах или в виде слитых белков могут быть экзогенными аллергенами (например, клещи домашней пыли, пыльца березы, пыльца трав, кошачие антигены, антигены тараканов) или пищевыми аллергенами (например, коровье молоко, арахис, креветки, соя) или комбинацией обоих. Молекулы IgE важны из-за их роли в активации эффекторных клеток (тучные клетки, базофилы и эозинофилы). Общепринято, что IgE также играют важную роль в индукционной фазе аллергических заболеваний, через положительную регуляцию антиген-захватывающего потенциала В-клеток и дендритных клеток (DC), в обоих случаях как через низко-аффинные (CD23), так и высоко-аффинные рецепторы (Fc∈RI). Отрицательные функции антител IgE могут быть нейтрализованы при помощи аллерген-специфичных антител класса IgG, поскольку они перенаправляют иммунный ответ от В-клеток к моноцитам и DC. Дополнительно, они конкурируют с молекулами IgE за места связывания аллергена. Поэтому, аллергии могут подвергаться лечению, вылечены или предупреждены путем индукции аллерген-специфичных молекул IgG.
Период полувыведения молекул IgG из сыворотки равен примерно трем неделям по сравнению с тремя днями для молекул IgE. Молекулы IgE индуцируются при взаимодействии между (наивными) В-клетками и Th2 клетками, которые обеспечивают экспрессию IL-4 и IL-13 вместе с экспрессией CD40L, что необходимо для индукции переключения класса в сторону IgE в В-клетках памяти и плазматических клетках. В противоположность этому, Th1 клетки, которые продуцируют IFN-γ и IL-2, индуцируют переключение класса в сторону IgG. Таким образом, индукция Th1 вместо ответа Т-хелперов Th2-типа против аллергенов, имеет практическую значимость для предупреждения, лечения и излечения аллергических заболеваний.
В публикации WO 97/07218 описаны аллерген-анти-CD32 слитые белки. В данной публикации обойдены проблемы с изоляцией специфичных молекул IgG и с низким сродством этих IgG-антител к CD32, и ликвидированы факторы риска классической иммунотерапии, которая использует полное "IgE связывание" аллергенов.
Публикация WO 2007098934 A1 описывает молекулы, способные связываться с TLR9 и CD32, содержащие по крайней мере один эпитоп или по крайней мере один антиген, их получение и их использование в качестве лекарственного средства, в первую очередь, для лечения аллергий.
Роль TLR9:
Толл-подобные рецепторы (TLRs) - это класс белков, которые играют ключевую роль воврожденной иммунной системе. Они являются одиночными, трансмембранными, некаталитическимирецепторами, обычно экспрессированными на клеточной поверхности и в эндоцитозном компартменте сигнальных клеток, таких как макрофаги и дендритные клетки. TLRs распознают патоген-ассоциированные молекулярные паттерны (PAMPs), структурно консервативные молекулы, происходящие от микроорганизмов, и инициируют передачу сигналов для индукции продукции цитокинов, необходимых для врожденной иммунной системы и последующей адаптивной иммунной системы.
Разные TLRs обнаруживают различные паттерны экспрессии. Этот ген экспрессируется преимущественно в богатых иммунными клетками тканях, например, селезенкой, в лимфатическом узле, костном мозге и лейкоцитах периферической крови.
Всего было идентифицировано 13 общих TLRs (названных просто от TLR1 до TLR13) у людей и мышей, аналогичные формы многих TLRs были найдены и у других видов млекопитающих. В то же время не каждый TLR-рецептор у мышей может быть найден у людей и наоборот. Кроме того, не для каждого TLR-рецептора известны лиганд и функция, например, TLR10 - это редкий рецептор с неизвестной функцией.
Активация TLR-рецепторов используется для лечения различных заболеваний, например, активация TLR9 при помощи лекарственных средств показала преимущества в лечении аллергии и онкологических заболеваний. Исследования на мышах и людях показывают, что природными лигандами для TLR9 являются неметилированные CpG-последовательности в молекулах ДНК. Сайты CpG относительно редки (~1%) в геномах позвоночных по сравнению с бактериальными геномами или вирусной ДНК. TLR9 экспрессируются многими клетками иммунной системы, такими какдендритные клетки, В-лимфоциты, моноциты и естественные киллеры (NK). Однако, у здоровых людей экспрессия TLR9 ограничена плазматическим дендритными клетками (pDCs) и В-клетками. Экспрессия происходит внутриклеточно, в пределах эндосомальных компартментов и функциональных отделов, для предупреждения иммунной системы о вирусных или бактериальных инфекциях путем связывания с ДНК, богатой CpG-мотивами. Однако в условиях патологии сообщалось об экспрессии TLR9 также и на поверхности клеток12-14.
Сообщалось о многих различных синтетических молекулах - агонистах TLR9. Агонистические лиганды (активация TLR9) были классифицированы по трем группам:
Группа, состоящая из CpG класса А, в частности, олигодеоксинуклеотидов (ОДН) класса CpG-A(D)15, также известных как ОДН типа "D". Указанные агонисты TLR9 вызывают мощную индукцию IFNa, минимальную матурацию дендритных клеток и именуются в данном случае лигандами TLR9 "группа 1". Примером может служить ODN221616: (SEQ ID NO: 46)
Группа, состоящая из CpG класса В, в частности олигодеоксинуклеотидов (ОДН) класса CpG-B (K)15, также известных как ОДН типа «K». Указанные агонисты TLR9 вызывают мощную индукцию IFNa, минимальную матурацию дендритных клеток, и именуются в данном случае лигандами TLR9, "группа 2". Примером может служить ODN200617;18: (SEQ ID NO: 47)
Группа, состоящая из CpG класс С, также известная как олигодеоксинуклеотиды (ОДН) класса CpG-C15. Указанные агонисты TLR9 вызывают индукцию IFNa, матурацию дендритных клеток и именуются в данном случае лигандами TLR9, "группа 3". Примером может служить ODNM36215:
(SEQ ID NO: 48)
Все лиганды для TLR9, описанные до настоящего времени, базируются на нуклеотидах. Несмотря на то, что описаны антитела, специфичные для TLR9 и используемые для того, чтобы продемонстрировать присутствие и расположение рецептора, данные молекулы не описаны в качестве лигандов TLR9, и не существует описаний о какой-либо активирующей или ингибирующей активности в отношении TLR9.
Роль CD32:
CD32 сильно экспрессируются на моноцитах/дендритных клетках и В-клетках и такие молекулы предназначены для того, чтобы перенаправить иммунный ответ на эти важные иммунологические клетки, с целью предотвращения презентации антигена В-клетками, наряду с усилением презентации антигена исключительно дендритными клетками (DCs), что, при достаточной стимуляции, далее приводит к индукции Th1 - ответов против антигена. Существует как минимум два типа DCs: миелоидные (mDC) и плазматические дендритные клетки (pDC), что привело к возникновению новой концепции клеток DC1 и DC2. В соответствии с данной концепцией, DC1-клетки способствуют индукции развития Th1-клеток после стимуляции специфическим антигеном, а DC2-клетки поддерживают развитие Th2-клеток. DC, произошедшие от моноцитов (или mDC), обычно рассматриваются как тип DC1, в то время как pDC рассматриваются как тип DC2. Оба типа DC экспрессируют CD32a и будут индуцировать антиген-специфичный Т-клеточный ответ; однако это не гарантирует, что результатом будет ответ типа Th1. Более того, у доноров с аллергией выше вероятность Th2-ответов. Важно отметить, что pDC экспрессируют TLR9-рецептор, который связывает CpG-ODNs (олигодеоксинуклеотиды (ОДН), содержащие неметилированные CpG-мотивы). Активация этого рецептора на pDC ведет к очень сильной продукции IFN-альфа и IL-12, что способствует индукции Th1 и, таким образом, превращает потенциальные DC2-клетки в DC1-клетки.
Таким образом, указанные молекулы могут сочетать активацию TLR9-рецептора на pDC со специфической стимуляцией и индукцией антиген-специфичных Th1-клеток.
При иммунотерапии опухолей одной из особых целей является использование специфичных Т-хелперов типа 1 (Th1) в дополнение к цитотоксическим Т-лимфоцитам (CTL).
Суперспирали:
Суперспирали состоят из структурных белковых мотивов, в которых 2-7 альфа-спиралей закручены вместе наподобие прядей каната; наиболее распространенными видами являются димеры и тримеры. Суперспирали использовались для стабилизации Fv-фрагментов антител, что приводит к образованию гетеродимерных суперспирализованных доменов19.
Раскрытие изобретения
Существует необходимость в обеспечении улучшенных методов иммунотерапии, нацеленной на гастрин и гастрин-зависимые болезненные состояния. Таким образом, задачей изобретения является создание вакцины с улучшенной иммуногенностью, стабильностью и структурой для регуляции иммунного ответа в отношении специфичных эпитопов гастрина.
Эта задача решается сущностью признаков, представленных в формуле изобретения.
В соответствии с настоящим изобретением предложена иммуногенная композиция, содержащая
а) направляющий адъювант, содержащий по крайней мере группу анти-CD32, связанную с лигандом TLR9, и первую пептидную альфа-спираль, и
б) пептидный иммуноген гастрин-17, связанный со второй пептидной альфа-спиралью, скрученной вокруг первой альфа-спирали, где пептидный иммуноген представляет собой любого из нижеперечисленных элементов:
(i) человеческий гастрин-17, содержащий аминокислотную последовательность SEQ ID NO: 1, или ее фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 2, или по крайней мере 4 N-терминальные аминокислоты из SEQ ID NO: 2;
(ii) аналог (i), предпочтительно происходящий от макаки-резуса или мышиного происхождения, и/или
(iii) функционально активный вариант любого из (i) или (ii), с одной, двумя, тремя или четырьмя точечными мутациями в аминокислотной последовательности SEQ ID NO: 2.
В конкретном плане, упомянутый иммуноген является линейным пептидом, содержащим или включающим в себя:
(i) аминокислотную последовательность SEQ ID NO: 3, предпочтительно SEQ ID NO: 4;
(ii) аминокислотную последовательность SEQ ID NO: 5, предпочтительно SEQ ID NO: 6;
(iii) аминокислотную последовательность SEQ ID NO: 7, предпочтительно SEQ ID NO: 8, или
(iii) аминокислотную последовательность SEQ ID NO: 2 или NO: 9.
Предпочтительно, чтобы иммуногенная композиция по изобретению содержала по крайней мере два пептидных иммуногена, связанных со второй пептидной альфа-спиралью, предпочтительно 2, 3 или 4 пептидных иммуногена.
Когда со второй альфа-спиралью связано более одного пептидного иммуногена, то пептидные иммуногены могут быть конъюгированы с альфа- последовательно, то есть иммуногенные пептиды пришиты один за другим, например, путем сшивания С-конца первого пептидного иммуногена с N-концом второго иммуногенного пептида, где первый и второй иммуногенные пептиды являются идентичными или отличающимися друг от друга.
В другом варианте, или дополнительно, последующие пептидные иммуногены могут быть включены в иммуногенную композицию по изобретению при помощи перекрестного сшивания, например, двух или более иммуногенных пептидов, которые являются или идентичными или отличающимися один от другого и связаны с той же самой альфа-спиралью при помощи химической реакции, такой как химическая поперечная сшивка, позволяющая создать межмолекулярные поперечные связи, например, с гомо-бифункциональными агентами, такими как диметиладипимидат (ДМА), диметилсуберимидат (ДМС) или глутаральдегид. Например, такие поперечные сшивки могут быть выполнены при помощи глутаральдегида, перекрестно сшиваемого со свободными лизиновыми группами в альфа-спирали и спейсере/линкере, соответственно. Таким образом, два или более пептидных иммуногена, используемые по настоящему изобретению, соединены с альфа-спиралью параллельно или бок о бок.
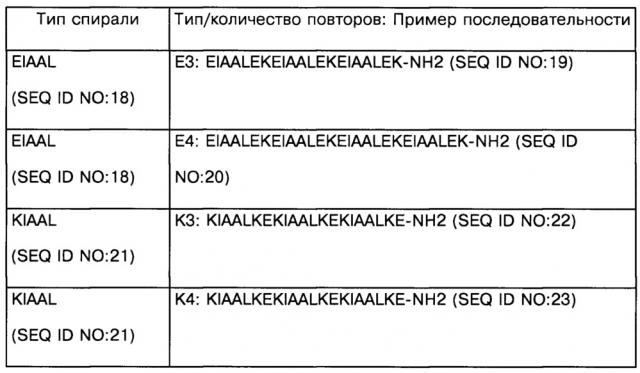
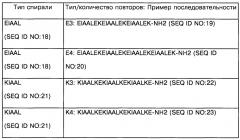
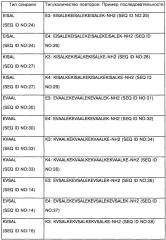
Согласно конкретному аспекту изобретения, каждая из упомянутых первая и вторая альфа-спирали содержат по 3-5 аминокислотных повторов аминокислотного мотива, специфически связывающихся друг с другом с константой диссоциации Kd менее чем 10-6 М, предпочтительно с Kd менее чем 10-7 М, более предпочтительно менее чем 10-8 М или 10-9 М.
Согласно дополнительному конкретному варианту изобретения, упомянутая анти-CD32 группа выбрана из группы, включающей анти-CD32 антитело, фрагмент антитела и пептид, предпочтительно целевой по отношению к CD32a. Фрагмент антитела в конкретном плане может, например, быть Fab, Fv, scFv, dAb, F(ab)2 или Fcab фрагментом или любой другой связывающей единицей, при условии, что она специфически связывается с рецептором и интернализуется после связывания.
В конкретном плане упомянутая анти-CD32 группа является специфической по отношению к CD32a, предпочтительно с высоким сродством с Kd≤10-6 М, более предпочтительно менее чем 10-7 М или менее чем 10-8 М.
Более конкретно, упомянутая анти-CD32 группа является специфическим или селективным CD32a-связывающим агентом, то есть не является специфической по отношению к CD32b или CD32b с низким сродством с Kd>10-6 М, предпочтительно высшим чем 10-5 М, более предпочтительно высшим чем 10-4 М. Дифференциальное сродство связывания с CD32a и CD32b составляет предпочтительно по крайней мере 1 логарифм, более предпочтительно по крайней мере 2 логарифма или по крайней мере 3 логарифма от большей разницы в значении Kd.
Конкретно, предпочтительно высокое сродство или высокое дифференциальное сродство анти-CD32 группы к связыванию с CD32a, а не с CD32b, что обычно используется в иммуностимулирующей вакцине с дополнительным использованием агонистического лиганда TLR9.
Сродство связывания анти-CD32 группы, специфичной по отношению к любому из CD32a или CD32b или к ним обоим, может быть определено подходящим анализом, таким как типичный ИФА с использованием коммерчески доступных рекомбинантных форм CD32a и CD32b c HIS-метками, нанесенных на планшеты для ИФА типа Ni-NTA, например, планшеты типа Ni-NTA HisSorb (Qiagen, Австрия). Анти-CD32 группы могут быть биотинилированы и в таком виде могут быть обнаружены при помощи стрептавидина-HRP или стрептавидина АР и надлежащего субстрата. В другом варианте, группы могут быть протестированы FACS-анализом при помощи U937-клеток (например, АТСС: CRL 1593), экспрессирующих CD32a, но не CD32b и EBV трансформированных В-клеток, например, CFB4:2, как описано у van Reijsen и др.20, экспрессирующих CD32b и не экспрессирующих CD32a
Согласно дополнительному конкретному варианту изобретения, упомянутый лиганд TLR9 является агонистом TLR9, выбранным из группы, состоящей из олигодеоксинуклеотидов CpG классов А, В и С, или иммуностимулирующим пептидом, имитирующим любой из олигодеоксинуклеотидов CpG.
Согласно конкретному варианту изобретения, лиганд TLR9 является агонистом TLR9, выбранным из группы, состоящей из CpG класса А, в частности, олигодеоксинуклеотидов (ОДН) CpG-A (D)17, также известных как ОДН типа "D". Указанные агонисты TLR9 вызывают мощную индукцию IFNa, минимальную матурацию дендритных клеток и именуются в данном случае лигандами TLR9 "группа 1".
В соответствии с другим специфическим вариантом изобретения, лиганд TLR9 является агонистом TLR9, выбранным из группы, состоящей из CpG класса В, в частности, олигодеоксинуклеотидов (ОДН) CpG-B (K)21, также известных как ОДН типа "K". Указанные агонисты TLR9 вызывают мощную индукцию IFNa, минимальную матурацию дендритных клеток, и именуются в данном случае лигандами TLR9 "группа 2".
В соответствии с другим специфическим вариантом изобретения, лиганд TLR9 является агонистом TLR9, выбранным из группы, состоящей из CpG класса С, также известных как олигодеоксинуклеотиды (ОДН) CpG-C15; 21. Такие агонисты TLR9 вызывают индукцию IFNa и матурацию дендритных клеток, и именуются в данном случае лигандами TLR9 "группа 3".
Индукция IFNa может быть определена по уровню экспрессии IFNa и соответствующему приросту по сравнению с контрольным уровнем. Прирост по отношению к непростимулированным клеткам может быть сравнен с уровнями индукции, вызванными эталонами, установленными для каждого типа CpG, определенными в зависимости от группы лиганда TLR9 - 1, 2 или 3, и, как правило, он находится в диапазоне от 30% до 300% от соответствующего эталона, предпочтительно по крайней мере 100%, более предпочтительно по крайней мере 120%, по крайней мере 150%, по крайней мере 200% или по крайней мере 250%.
Матурация незрелых дендритных клеток может быть определена по уровню экспрессии любого из маркеров CD80, CD83 и CD86. Прирост по отношению к непростимулированным клеткам может быть сравнен с уровнями индукции, вызванными эталонами, установленными для каждого типа CpG, определенными в зависимости от группы лиганда TLR9 - 1, 2 или 3, и, как правило, он находится в диапазоне от 30% до 300% от соответствующего эталона, предпочтительно по крайней мере 100%, более предпочтительно по крайней мере 120%, по крайней мере 150%, по крайней мере 200% или по крайней мере 250%.
Конкретно, агонист TLR9 из группы 1 и 3 приведет к усилению экспрессии IFNa и агонист TRL9 из группы 2 и 3 приведет к усиленной экспрессии любого из факторов созревания DC - CD80, CD83 и CD86. Антагонист TLR9 приведет к уменьшению экспрессии IFNa и уменьшению экспрессии любого из факторов созревания DC - CD80, CD83 и CD86, даже в присутствии с агонистом TLR9 из любой группы 1-3.
В качестве альтернативы полинуклеотидным лигандам TLR9, описанным выше, может быть использован любой другой Т1Л9-связывающий агент с агонистическими свойствами, например, пептидный связывающий агент, включая антитела или фрагменты антител.
Согласно дополнительному конкретному аспекту изобретения, иммуногенная композиция содержит одну или более линкерных последовательностей, предпочтительно состоящих из остатков глицина и/или серина и/или лизина, предпочтительно аминокислотную последовательность SEQ ID NO: 12 или NO: 13. Линкерные последовательности могут быть линейными или разветвленными, например, для того, чтобы обеспечить перекрестную сшивку между двумя или более пептидными или полипептидными единицами.
Согласно дополнительному конкретному варианту изобретения, иммунологическая композиция содержит или состоит из аминокислотной последовательности SEQ ID NO: 10 или SEQ ID NO: 11.
Согласно настоящему изобретению предложена вакцина, содержащая иммуногенную композицию по изобретению и фармацевтически приемлемый носитель. Такая вакцина является обычно иммуностимулирующей вакциной, например, стимулирующей гуморальный или Т-клеточный (Th1) иммунный ответы.
В соответствии с предпочтительным вариантом осуществления, гуморальный и Т-клеточный (Th1) иммунный ответы являются транзиторными, например, с достижением определенного максимума титра IgG, вызванного вакцинацией, что, как правило, достигается в течение от 2 до 8 недель после вакцинации, с последующим снижением титра на как минимум 30%, предпочтительно как минимум 40%, или как минимум 50%, или как минимум 60%, или как минимум 70%, или как минимум 80%, или как минимум 90%, или как минимум 100%, в течение 6 месяцев после вакцинации, предпочтительно в течение 5 месяцев, или в течение 4 месяцев, или в течение 3 месяцев, или в течение 2 месяцев. Такой сниженный титр может быть снова повышен после бустерной инъекции. В серии вакцинации транзиторный иммунный ответ может быть определен после последней инъекции иммуногенной композиции или вакцины. Транзиторный иммунный ответ имеет преимущество контролируемой терапии, например, возможность прервать или прекратить лечение при необходимости.
Согласно настоящему изобретению предложен набор для получения иммуногенной композиции по изобретению, содержащей следующие компоненты:
а) направляющий адъювант, содержащий по крайней мере группу анти-CD32, связанную с лигандом TLR9, и первую пептидную альфа-спираль, и
б) пептидный иммуноген гастрин-17, связанный со второй пептидной альфа-спиралью, скрученной вокруг первой альфа-спирали, где пептидный иммуноген представляет собой любой из нижеперечисленных элементов:
(i) человеческий гастрин-17, содержащий аминокислотную последовательность SEQ ID NO: 1, или ее фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 2, или по крайней мере 4 N-терминальные аминокислоты из SEQ ID NO: 2;
(ii) аналог (i), предпочтительно происходящий от макаки-резуса или мышиного происхождения, и/или
(iii) функционально активный вариант любого из (i) или (ii), с одной, двумя, тремя или четырьмя точечными мутациями в аминокислотной последовательности SEQ ID NO: 2.
Набор конкретно может быть использован для облегчения производства вакцины при помощи предварительно полученного направляющего адъювантного компонента для комбинации с иммуногеном, что может быть обеспечено в соответствии с потребностями группы объектов или индивидуального объекта.
Согласно изобретению далее предложена иммуногенная композиция для использования при лечении объекта, страдающего гастрин-зависимыми заболеваниями или болезненными состояниями. Такие заболевания или болезненные состояния прежде всего вызваны или связаны с продукцией эндогенного гастрина или его гиперпродукцией у объекта. Гастрин-зависимые заболевания или болезненные состояния конкретно включают гастрин-зависимые опухоли или гастрин-зависимый рак, такой как рак поджелудочной железы, или рак ЖКТ, язва желудка, гастроэзофагеальная рефлюксная болезнь (ГЭРБ), терминальная стадия почечной недостаточности(ТСПН), или ожирение.
Таким образом, изобретение конкретно предлагает способ лечения объекта, страдающего гастрин-зависимыми заболеваниями, такими как гастрин-зависимый рак, такой как рак поджелудочной железы, или рак ЖКТ, язва желудка, гастроэзофагеальная рефлюксная болезнь (ГЭРБ), терминальная стадия почечной недостаточности (ТСПН), или ожирение, при помощи введения объекту эффективного количества иммуногенной композиции или вакцины по изобретению, либо профилактически, например, чтобы предотвратить вспышку заболевания или болезненного состояния или прогрессирование заболевания, либо терапевтически, например, для улучшения заболевания или болезненного состояния.
Конкретно, композиция вводится объекту в эффективном количестве