Штамм микроскопического гриба fusarium equiseti, содержащий биологически активные вещества, проявляющие противоопухолевую и противовирусную активность
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Штамм микроскопического гриба Fusarium equiseti Т-14 обладает ингибирующей активностью против вируса простого герпеса 2 типа, вируса гриппа A/H1N1/California/2009 и цитостатической противоопухолевой активностью в отношении карциномы гортани (Нер-2), миеломы костного мозга человека (IM-9), лимфомы человека (Namalva). Штамм Fusarium equiseti депонирован во Всероссийской Коллекции Промышленных Микроорганизмов под регистрационным номером ВКПМ F–1302 и может быть использован для получения противоопухолевых и противовирусных препаратов. Изобретение позволяет получать соединения, проявляющие ингибирующую активность в отношении клеток опухолей и некоторых вирусов, патогенных для человека. 1 ил., 4 табл., 4 пр.
Реферат
Изобретение относится к штамму микроскопического гриба Fusarium equiseti, этилацетатный экстракт которого содержит комплекс соединений, проявляющих противоопухолевую и противовирусную активность и может быть использован в биотехнологии и микробиологической промышленности для получения противоопухолевых и противовирусных препаратов.
Заявляемый штамм относится к роду анаморфных плесневых микроскопических грибов Fusarium.
Известно, что штаммы гриба Fusarium equiseti обладают способностью продуцировать такие метаболиты, как циклогексадепсипептиды боверицин [Logrieco A, Moretti A, Castella G, Kostecki М, Golinski Р, Ritieni А, Chelkowski. Beauvericin production by Fusarium species. J. Appl Environ Microbiol. 1998. 64(8):3084-8] и энниотины A, A1, В, B1 [Covarelli L, Beccari G, Prodi A, Generotti S, Etruschi F, Meca G, Juan C, Manes J. Biosynthesis of beauvericin and enniatins in vitro by wheat Fusarium species and natural grain contamination in an area of central Italy. Food Microbiol. 2015. 46:618-26], эквизетин [M.H. Wheeler, R.D. Stipanovic, L.S. Puckhaber. Phytotoxicity of equisetin and epi-equisetin isolated from Fusarium equiseti and F. pallidoroseum. Mycological Research, Volume 103, Issue 8, 1999, Pages 967-973; патент США US 3959468 A] и фузарохроманон [Elahe Mahdavianl, Phillip Palyok, Steven Adelmund, Tara Williams-Hart, Brian D Furmanski, Yoon-Jee Kim, Ying Gu, Mansoureh Barzegar, Yang Wu, Kaustubh N Bhinge, Gopi K Kolluru, Quincy Quick, Yong-Yu Liu, Christopher G Kevil, Brian A Salvatore, Shile Huang and John L Clifford. Biological activities of fusarochromanone: a potent anti-cancer agent. Mahdavian et al. BMC Research Notes 2014, 7:601].
Смесь энниатинов A, A1, В, B1 в микромолярных концентрациях может оказывать цитостатическое или цитотоксическое действие на ряд клеточных линий, полученных из таких разных опухолевых тканей, как карциномы, саркомы, лейкемии и нейронного происхождения [Dornetshuber R, Heffeter Р, Kamyar MR, Peterbauer T, Berger W, Lemmens-Gruber R. Enniatin exerts p53-dependent cytostatic and p53-independent cytotoxic activities against human cancer cells.Chem Res Toxicol. 2007. 20(3):465-73]. Энниатины A1, B, B1, выделенные из эндофитного штамма Fusarium tricinctum, проявили умеренную цитотоксичность (АС50 10-25 мкМ) в отношении линии Hep G2 (культура опухолевых клеток человека, полученная из ткани донора с высокодифференцированной гепатоцеллюлярной карциномой) и клеток глиомы крысы С6, но обладали более сильным воздействием (АС50 1-2,5 мкМ) на клетки гепатомы крысы H4IIE [ W, Debbab A, Hohlfeld A, Chovolou Y, A, Edrada RA, Ebel R, Hakiki A, Mosaddak M, Totzke F, Kubbutat MH, Proksch P. Enniatins A1, В and B1 from an endophytic strain of Fusarium tricinctum induce apoptotic cell death in H4IIE hepatoma cells accompanied by inhibition of ERK phosphorylation. Mol Nutr Food Res. 2009. 53(4):431-40].
В опытах in vitro смесь энниатинов A, A1, B, B1 предотвращала индуцируемую HIV-1 гибель лимфобластоидных клеток человека с «терапевтическим индексом» около 200 [McKee ТС, Bokesch HR, McCormick JL, Rashid MA, Spielvogel D, Gustafson KR, Alavanja MM, Cardelline JH 2nd, Boyd MR. Isolation and characterization of new anti-HIV and cytotoxic leads from plants, marine, and microbial organisms. J Nat Prod. 1997. 60(5):431-8].
Показана цитотоксичность микромолярных концентраций боверицина в опытах с линиями мастоцитомы Р815, лимфомы Yac-1 и тимомы EL-4 мышей [Ojcius DM, Zychlinsky A, Zheng LM, Young JD-E. Ionophoreinduced apoptosis: role of DNA fragmentation and calcium fluxes. Exp Cell Res 1991; 197:43-9], опухоли RBL-1 крысы, фибробластоидных клеток африканской зеленой мартышки CV-1, лимфомы Беркетта IARC/BL 41, карциномы Hela и гепатомы Hep G2 [Logrieco A, Moretti A, Ritieni A, Caiaffa MF, Macchia L. Beauvericin: chemistry biology and significance. In: Upadhyay R, editor. Advances in microbial toxin research and its biotechnological exploitation. New York: Kluwer Academic; 2002. p.23-30; Macchia L, Di Paola R, Fornelli F, Nenna S, Moretti A, Napoletano R, Logrieco A, Caiaffa MF, Tursi A, Bottalico A. Cytotoxicity of beauvericin to mammalian cells. In: Proceedings of the International Seminar on Fusarium Mycotoxin, Taxonomy and Pathogenicity, 1995 May 9-13; Martina Franca, Bari, Italy. Abstract book. p. 72-3]. Боверицин способен вызывать апоптоз клеточных линий миелоидного происхождения [Calo L, Fornelli F, Ramires R, Nenna S, Tursi A, Caiaffa MF, Macchia L. Cytotoxic effects of the mycotoxin beauvericin to human cell lines of myeloid origin.Pharmacol Res. 2004. 49(l):73-7] и немелкоклеточнго рака легкого А549 [Lu CL, Lin HI, Chen BF, Jow GM. Beauvericin-induced cell apoptosis through the mitogen-activated protein kinase pathway in human nonsmall cell lung cancer A549 cells. J Toxicol Sci. 2016; 41(3):429-37].
Известен способ получения биологически активного вещества циклодепсипептида, обладающего иммуностимулирующим действием на организм путем многоступенчатой экстрации трихлорэтиленом мицелия штамма микроскопического гриба Fusarium equiseti (номер штамма Saccardo №213107) с последующей обработкой полученного осадка гексаном и повторной экстракцией раствором метанола (патент США №4233291, МПК А61К 39/00, опубл. 18.07.1982 г.).
Известен способ ингибирования ангиогенеза у людей или животных, включающий введение указанным пациентам терапевтически активной дозы водорастворимого фузарохроманона, выделенного из грибных культур, где указанный водорастворимый фузарохроманон вводят через фармацевтически или ветеринарно приемлемый носитель на некоторое время, эффективный для ингибирования образования новых кровеносных сосудов у указанного пациента. Указанный водорастворимый фузарохроманон выбран из группы, состоящей из FC101 и аналога FC101. Водорастворимый фузарохроманон выделяют из культур Fusarium equiseti (заявка США №2001011100, МПК A61K 36/06; А61Р 35/00, опубл. 02.08.2001 г.).
Наиболее близким аналогом (прототипом) является эндофитный штамм Fusarium equiseti, из культуральной жидкости которого получают путем этилацетатной экстракции биологически активные вещества, обладающие противоопухолевой и антимикробной активностью [Cui JL, Guo SX, Xiao PG. Antitumor and antimicrobial activities of endophytic fungi from medicinal parts of Aquilaria sinensis. J Zhejiang Univ Sci B. 2011.12(5):385-92]. Штаммы Fusarium equiseti выделены из ткани стебля Aquilaria sinensis. Экстракт штамма Fusarium equiseti HNAS 11 обладал высокой ингибирующей активностью зон роста Bacillus subtilis, а экстракт штамма Fusarium equiseti YNAS07 проявил высокую антагонистическую способность в отношении Staphylococcus aureus и среднюю ингибирующую скорость роста опухолевых клеток линий SKOV3 (клетки аденокарциномы яичника человека) и 293-Т (клеточная линия, полученная из эмбриональных клеток человека).
Однако во всех выше приведенных аналогах и прототипе отсутствуют сведения о том, что экстракты веществ из биомассы штаммов микроскопического гриба Fusarium equiseti обладают одновременно противоопухолевым и противовирусным действием.
Техническим результатом заявляемого изобретения является получение штамма микроскопического гриба Fusarium equiseti, продуцирующего соединения, экстрагируемые этилацетатом, проявляющие активность в отношении клеток опухолей и некоторых вирусов, патогенных для человека.
Указанный технический результат достигается получением из природной среды нового штамма гриба Fusarium equiseti Т-14 (авторское название), этилацетатные экстракты которого содержат соединения с противовирусной и противоопухолевой (цитостатической) активностью. Ингибирующая активность проявляется против вируса простого герпеса 2 типа, вируса гриппа A/H1N1/California/2009 и цитостатическую противоопухолевую активность в отношении карциномы гортани (Нер-2), миеломы костного мозга человека (IM-9), лимфомы человека (Namalva). Штамм Fusarium equiseti Т-14 выделен из бесплодного тела трутовика скошенного Inonotus obliquus (чага) с. Малиновка Новосибирской обл. в сентябре 2014 г.и депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) под номером F-1302 (справка о депонировании прилагается).
Культурально-морфологические особенности штамма на агаризованной питательной среде. На картофеле-глюкозной среде (КГА) образует колонии с беловато-песочным плотным мицелием, колонии с ровным краем, мицелий немного поднимающийся. Размер колоний (при определенном времени инкубации) - 30 мм - 3 суток, 60 мм - 5 суток, 90 мм - 10 суток. Воздушный мицелий песочного цвета, спороношение конидиями, цвет обратной стороны колонии (реверзум) - светло-коричневый. У длительно хранящихся культур цвет колоний становится коричневатым.
Микроморфологические признаки. Гифы с перегородками тонкие, до 2-3-х мкм в диаметре. По мере старения мицелий становится коричневым, в гифах появляются жировые включения. Конидиеносцы у основания прямые, затем образуют ответвления гиф, на которых формируются пучки конидий. Конидии - макроконидии чаще изогнутой, слегка серповидной формы, с 1-5 перегородками, чаще с 3-4, размером 15-40×3-5 мкм, микроконидии образуются редко. По мере старения содержимое средних клеток конидий становится резко очерченным, светящимся при просмотре под микроскопом, концевые клетки при этом выглядят темными, лишенными своего содержимого. В культуре на мицелии образуются округлые коричневые хламидоспоры, размером 7-10 мкм, в цепочках или в виде компактных комочков.
Идентификация штамма Т-14 проведена во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) на основании генетического анализа последовательности 18S rRNA (Отчет ВКПМ от 22.12.2015).
Этапы анализа.
а) Секвенирование участков последовательности, кодирующей ген 18S рРНК.
При секвенировании участка ДНК, кодирующего ген 18S рДНК исследуемого штамма, получена следующая последовательность:
б) Анализ последовательностей гена, кодирующего 18S рРНК.
Анализ сходства нуклеотидной последовательности гена, кодирующего 18S рДНК, изучаемого штамма был проведен с помощью сервера BLAST [http://www.ncbi.nlm.nih.gov/blast].
Результаты.
Первичный скрининг по базе данных GenBank показал, что исследуемый штамм принадлежит к следующей систематической группе: Eukaryota; Fungi; Dikarya; Ascomycota; Pezizomycotina; Sordariomycetes; Hypocreomycetidae; Hypocreales; Nectriaceae; Fusarium.
Для установления филогенетического родства близких видов был использован метод сравнения нуклеотидных последовательностей, кодирующих домен D1/D2 гена 26S р РНК.
При секвенировании участка ДНК, кодирующего домен D1/D2 гена 26S рРНК, получена следующая последовательность:
Анализ филогенетического родства, построенный с использованием штаммов близкородственных микроорганизмов, показал, что наиболее близкими к исследуемому штамму являются виды Fusarium equiseti и Fusarium oxysporum.
Для точного определения видовой принадлежности использовали метод идентификации с помощью видоспецифических праймеров.
Результаты исследования с использованием праймеров, специфичных для и Fusarium oxysporum (FOF1 и FOR1) и Fusarium equiseti (FEF1 и FER1), представлены на фиг. 1., где:
1. Маркер 1kb DNA GeneRuler (10000, 8000, 6000, 5000, 4000, 3500, 3000, 2500, 2000, 1500, 1000, 750, 500, 250 п.н., снизу вверх)
2. Результаты реакции с использованием праймеров FOF1 и FOR1
3. Результаты реакции с использованием праймеров FEF1 и FER1
Отсутствие фрагментов п.н. при использовании видоспецифических праймеров FOF 1 и FOR1 позволяет утверждать, что исследуемый штамм не относится к виду Fusarium oxysporum. Наработка фрагмента ДНК размером 389 п.н. при использовании видоспецифических праймеров FEF1 и FER1, позволяет отнести исследуемый штамм к виду Fusarium equiseti.
По результатам проведенного анализа нуклеотидной последовательности, кодирующей часть генов рРНК, а также метода идентификации с использованием видоспецифических праймеров установлено, что исследуемый штамм наиболее близок к виду Fusarium equiseti (97%).
Биологическая активность веществ, содержащихся в биомассе заявляемого штамма определяется в отношении вирусов и опухолевых клеток. Для ее определения могут быть использованы этилацетатные экстракты биомассы гриба, выращенной в глубинной культуре или на агаризованной среде.
Активность определяется по способности в условиях in vitro тормозить рост опухолевых клеток, например, Нер-2 (карцинома гортани) или оказывать вирулицидный эффект (ингибировать процесс репликации вируса) в клеточных культурах (Государственная фармакопея СССР. Общие методы анализа. Лекарственное сырье. - М.: Медицина, 1990. - II изд. - Вып. 2. - Т. 2. - С. 187-209; Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / Под общей редакцией члена-корреспондента РАМН, профессора Р.У. Хабриева. - 2-изд., перераб. и доп. - М.: ОАО «Издательство «Медицина», 2005. - 832 с; Экспериментальная оценка противоопухолевых препаратов в СССР и США, под ред. З.П. Софьиной, А. Голдина. М.: Медицина, 1980. - С. 105-106).
Штамм хранится в виде культур, выращенных на скошенной агаризованной среде (картофельно-глюкозный агар, среда Чапека) в пробирках при температуре (2-6)°С - 12 месяцев, а также в виде агаровых блоков в стерильной воде при (2-6)°С -12 месяцев.
Оптимальные среды для пересевов:
- жидкая на основе мелассы и кукурузного экстракта, г: кукурузный экстракт- 10,0; меласса свекловичная - 80,0; KH2PO4 - 1,2; MgSO4 × 7H2O - 2,0; NaNO3 - 3.0, вода водопроводная - до 1 л.
- агаризованная на основе мелассы и кукурузного экстракта (к жидкой среде, указанной выше, добавляется агар-агар из расчета 20 г на 1 л подготовленной среды).
Штамм не является генетически модифицированным и не содержит генов других организмов, перенесенных генов резистентности, генетических изменений, связанных с использованием генно-технических методик.
Преимуществом заявляемого штамма является способность этилацетатных экстрактов ингибировать развитие некоторых патогенных вирусов и опухолевых клеток человека.
Оценка токсигенного потенциала патентуемого штамма проводилась методом ВЭЖХ/МС, в Раменском центре контроля зерна с использованием утвержденного способа определения зараженности кормовых и пищевых продуктов. При используемых условиях культивирования не показано наличия в биомассе микотоксинов трихотеценового ряда, фуманизинов и группы других микотоксинов, синтезируемых представителями видов грибов рода Fusarium.
На фиг. 1 представлена электрофореграмма, касающаяся исследования видовой принадлежности исследуемого штамма с использованием видоспецифических праймеров.
Пример 1. Выращивание биомассы гриба на основе заявляемого штамма Fusarium equiseti Т-14 глубинным способом. Глубинное культивирование осуществляется на жидкой среде: кукурузный экстракт - 10,0; меласса свекловичная - 80,0; KH2PO4 - 1,2; MgSO4 × 7H2O - 2,0; NaNO3 - 3.0; вода водопроводная - до 1 л.
Среда разливается в колбы по 100 мл, засев производится спорово-мицелиальной суспензией гриба из расчета 5 мл на 100 мл среды. Суспензию получают из агаризованной культуры гриба, выращенной в биологической пробирке на скошенном агаре. В пробирку вливают 20 мл стерильной воды, при помощи стерильной стеклянной пипетки или шпателя снимают мицелий с конидиями и производят встряхивание для получения более равномерного распределения конидий и обрывков гиф в воде. Колбы помещают в термостатированные качалки в течение 3-4-х суток производится выращивание биомассы при температуре 28°С и скорости 180 оборотов/мин. Готовая биомасса имеет светло коричневатый цвет и творожистую консистенцию, а также содержит не менее 15 г/л сухих веществ.
Используют следующие схемы выделения метаболитов, обладающих интересуемым спектром биологической активности.
Пример 2. Получение экстрактов из биомассы и культуральной жидкости Fusarium equiseti Т-14. Полученную глубинную жидкую культуру разделяли пропусканием через стеклянный фильтр №3, покрытый бумажным фильтром (типа «красная лента»). Влажную биомассу (мицелий) промывали дистиллированной водой и высушивали при 30°С в течение 12 часов. Извлечение метаболитов проводили экстракцией этил ацетатом в отношении 1:5 (масса:объем) при комнатной температуре в течение 24 часов. Операцию повторяли трижды. Объединенные экстракты промывали дистиллированной водой в делительной воронке. Концентрирование верхней фазы органического растворителя проводили выпариванием под вакуумом на роторном испарителе при температуре 45°С. Получали маслянистую жидкость коричневого цвета.
Экстракцию из культуральной жидкости проводили трижды этилацетатом в сотношении 1:2 (объем:объем). Экстракты объединяли, промывали дистиллированной водой и концентрировали выпариванием в вакууме на роторном испарителе при 45°С. Выход интересующей фракции составил около 200 мг/1 литр жидкой культуры гриба.
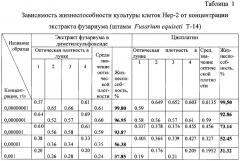
Пример 3. Определение цитотоксической активности заявляемого штамма Fusarium equiseti Т-14 в отношении клеток карциномы гортани Нер-2. Для изучения цитотоксической активности использовали МТТ-тест. Изучаемые соединения тестировали в трех параллельных измерениях при 6-и концентрациях - 10-8, 10-7, 10-6, 10-5, 10-4 и 10-3. Затем по кривой зависимости роста клеток от концентрации соединения определяли ИК50, то есть концентрацию препарата, вызывающую торможение роста клеток на 50%. После определения ИК50 проводили дополнительное тестирование при 4-5 концентрациях, близких к ИК50.
Критерий оценки цитотоксического эффекта. Соединение считается цитотоксически активным при ИК50≤10-4, аналог известного противоопухолевого препарата оценивается как цитотоксичный, если его ИК50≤ИК50 препарата сравнения.
МТТ-тест основан на ферментном восстановлении неокрашенной соли тетразолия (3-[4,5-диметилтиозол-2-ил]-2,5-дифенилтетрозолия бромид, МТТ) в живых метаболически активных клетках с образованием голубых кристаллов формазана.
Постановка эксперимента. Культуру клеток карциномы гортани Нер-2 в концентрации 5×103 в 100 мкл среды Игла MEM (ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора), содержащей 10% сыворотки крови плодов коровы (Gibco, США), помещали в 96-луночный планшет и инкубировали 24 ч при 37°С. Затем добавляли исследуемые соединения в различных концентрациях и инкубировали 48 ч при тех же условиях. После этого, в каждую лунку планшета добавляли по 5 мкл готового раствора МТТ (Sigma, США) (исходная концентрация 5 мг/мл) и дополнительно инкубировали 4 ч. По окончанию инкубации добавляли в каждую лунку планшета по 100 мкл диметилсульфоксида (ДМСО) для растворения образовавшихся в результате реакции синих кристаллов формазана и оценивали значения оптической плотности субстрата в лунках на микропланшетном ридере Tecan Sunrise (Tecan, Австрия) при длине волны 492 нм.
В качестве отрицательного контроля использовали клетки Нер-2 без добавления исследуемого препарата. В качестве референс-препарата (положительный контроль) использовали противоопухолевый препарат Цисплатин (Лэнс-Фарм, Россия).
Образец этилацетатного экстракта фузариума (штамм Fusarium equiseti Т-14) показал цитотоксический эффект (таблица 1) в концентрациях 10-3 и 10-5, сравнимый с положительным контролем (Цисплатином) в этих же концентрациях. Так, экстракт фузариума в концентрации 10-5 показал % жизнеспособности клеток 56,83%, Цисплатин в этой же концентрации - 52,45%; экстракт фузариума в концентрации 10" показал 37,85%, Цисплатин в этой же концентрации 31,32%.
Таким образом, можно сделать вывод, что образец экстракта фузариума (штамм Fusarium equiseti Т-14) оказывал цитотоксическое действие на культуру клеток Нер-2 в МТТ-тесте, сравнимое с противоопухолевым препаратом Цисплатином.
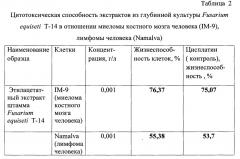
Пример 4. Определение цитотоксической активности заявляемого штамма Fusarium equiseti Т-14 в отношении клеток миеломы костного мозга человека (IM-9), лимфомы человека (Namalva). В соответствии с методикой, приведенной в примере 3, были проведены исследования на цитотоксичность этилацетатного экстракта биомассы штамма Fusarium equiseti Т-14 в отношении других опухолевых клеток: миеломы костного мозга человека (IM-9), лимфомы человека (Namalva). Результаты, свидетельствующие о цитостатической активности экстрактов из глубинной культуры Fusarium equiseti Т-14, представлены в таблице 2.
Пример 5. Исследование токсичности и противовирусной активности этилацетатного экстракта Fusarium equiseti Т-14 в отношении вируса простого герпеса второго типа (ВПГ-2). Оценку активности этилацетатного экстракта из глубинной культуры Fusarium equiseti Т-14 в отношении вируса простого герпеса 2 типа проводили в культуре клеток Vero. В работе был использован штамм MS вируса простого герпеса 2 типа (получен из Американской коллекции типовых культур). Приготовленные разведения препаратов наносили на двухсуточную культуру (по 3 повторам на каждое разведение), за исключением контрольных лунок (контроль вируса и контроль клеток). Для оценки токсичности образцов клетки окрашивали раствором генциан-виолета. Результаты окрашивания регистрировали с помощью фотометра 680 Земфира с управляющим компьютером BioRed RU Zemf в соответствии с инструкцией производителя. Получали показатели оптической плотности (ОП) для каждой из лунок планшета при длине волны 570 нм. Вычисляли среднее значение ОП для каждой группы из трех лунок с различными концентрациями образца. По полученным значениям строили график зависимости ОП от концентрации образца. По графикам определяли 50% токсическую концентрацию (ТС50). Для определения противовирусной активности в лунки добавляли вирус в дозе 2×10-5 БОЕ/клетку (объем рабочей смеси составлял 100 мкл). Учет реакции проводили на 4 сутки. Оценка активности проводилась при помощи метода ингибирования бляшкообразования. Клетки окрашивали генциан-виолетом. Процент ингибирования бляшкообразования (%ИБ) определяли по формуле: %ИБ=[1 - (число бляшек в тесте / количество бляшек в контроле вируса)] × 100. Определяли концентрацию, способную ингибировать развитие 50% бляшкообразующих единиц (БОЕ) от количества БОЕ в контроле (50% ингибирующую концентрацию - IC50). Вычисляли среднее значение %ИБ для каждой группы из двух лунок с различными концентрациями образца. По полученным значениям строили график зависимости %ИБ от концентрации образца. По графикам определяли IC50 - Индекс селективности (IS) определяли как отношение 50% токсической дозы к 50% ингибирующей дозы. Результаты приведены в таблице 3.
Примечание: TC50 - 50% токсическая доза: доза препарата, подавляющая рост клеток на 50%.
IC50 - ингибирующая доза: доза препарата, ингибирующая размножение вируса на 50%.
IS - индекс селективности, или терапевтический индекс: равен отношению 50% токсической дозы препарата к 50% ингибирующей дозе (TC50//IC50).
Препараты с IS>10 считали высокоактивными, а препараты с IS<2 не активными, препараты с IS между 2 и 10 считали средне активными (Paragas J. et al, 2004).
Пример 4. Исследование токсичности и противовирусной активности этилацетатного экстракта Fusarium equiseti Т-14 отношении вируса гриппа A/California/07/09 (H1N1pdm09) в культуре клеток MDCK (клетки почки собаки). Клетки MDCK рассевали в 96-луночных планшетах с посевной концентрацией 300000 кл./мл по 100 мкл в лунке Разведения исследуемых образцов этилацетатного экстракта из глубинной культуры Fusarium equiseti Т-14 готовили в поддерживающей среде. В работе использовали последовательные двоичные разведения образцов. Приготовленные разведения препаратов наносили на суточную культуру (по 3 повтора на каждое разведение), за исключением контрольных лунок (контроль вируса и контроль клеток). Для определения противовирусной активности в лунки добавляли вирус в дозе 100 ТЦИД50/лунку. Учет реакции проводили на 3 сутки. Оценка активности образцов была проведена с использованием красителя нейтрального красного. Результаты теста регистрировали с помощью фотометра 680 Земфира с управляющим компьютером BioRed RU Zemf в соответствии с инструкцией производителя. Получены показатели оптической плотности при длине волны 490 нм для каждой из лунок планшета. Для каждого разведения вычисляли среднее значение ОП. По полученным значениям строили графики зависимости ОП от концентрации препарата. По графикам определяли ТС50 и IC50. Индекс селективности (IS) рассчитывали, как отношение ТС50 к IC50 Результаты представлены в таблице 4.
Таким образом, данные, приведенные в примерах 2-5 подтверждают заявляемый технический результат, заключающийся в том, что штамм гриба Fusarium equiseti Т-14 продуцирует соединения, экстрагируемые из биомассы этилацетатом, проявляющие ингибирующую активность в отношении клеток опухолей и некоторых вирусов, патогенных для человека.
Штамм микроскопического гриба Fusarium equiseti Т-14, содержащий в биомассе биологически активные вещества, проявляющие ингибирующую активность против вируса простого герпеса 2 типа, вируса гриппа A/H1N1/California/2009 и цитостатическую противоопухолевую активность в отношении карциномы гортани (Нер-2), миеломы костного мозга человека (IM-9), лимфомы человека (Namalva) и депонированный во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) ФГУП ГосНИИгенетика под номером F-1302.