Композиции омега-3 полиненасыщенных жирных кислот в форме свободной кислоты, обогащенные dpa
Иллюстрации
Показать всеГруппа изобретений относится к медицине. Предложены: фармацевтическая композиция для лечения гипертриглицеридемии и смешанных дислипидемий, содержащая ЕРА (эйкозапентаеновую кислоту) в массовом процентном количестве от 50 до 60%; DHA (докозагексаеновую кислоту) в массовом процентном количестве от 17 до 23%; DPA (докозапентаеновую кислоту, 22:5 n-3) в массовом процентном количестве от 1 до 8%, где по меньшей мере 90% по массе полиненасыщенной кислоты в композиции присутствует в форме свободной кислоты; стандартная лекарственная форма – капсула для перорального введения указанной композиции и способы лечения гипертриглицеридемии с её использованием (варианты). Технический результат: существенное повышение биодоступности заявленной композиции у здоровых взрослых людей (увеличения отношений ЕР:АА в плазме крови) по сравнению с разовой дозой известных на рынке композиций с этиловым эфиром омега-3 кислот. 4 н. и 15 з.п. ф-лы, 56 ил., 40 табл.
Реферат
1. ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ НА ИЗОБРЕТЕНИЯ
В данной заявке на изобретение заявлен приоритет в соответствии с 35 U.S.С. (Свод законов США) §119(e) над предварительными заявками на патенты США №№61/583796, поданной 6 января 2012 года; 61/664047, поданной 25 июня 2012 года; 61/669940, поданной 10 июля 2012 года; 61/680622, поданной 7 августа 2012 года; 61/710517, поданной 5 октября 2012 года; и 61/713388, поданной 12 октября 2012 года, содержание всех из которых включено здесь посредством ссылки во всей их полноте.
2. ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Фармацевтические композиции, богатые омега-3 («ω-3» или «n-3») полиненасыщенными жирными кислотами («PUFA»), разрабатывают для лечения различных клинических показаний.
Эти продукты, которые происходят из естественных источников, как правило рыбьего жира, представляют собой гетерогенные композиции, и содержат различные виды омега-3 PUFA, омега-6 PUFA и другие минорные компоненты, включающие мононенасыщенные и насыщенные жирные кислоты. Обнаруженные клинические эффекты как правило приписываются композиции в целом, хотя полагают, что самые распространенные из видов PUFA, представленные в смеси, обычно ЕРА (эйкозапентаеновая кислота) и DHA (докозагексаеновая кислота), вносят существенный вклад в обнаруженный клинический эффект. Поскольку они представляют собой гетерогенные композиции, продукты определены как включающие некоторые обязательные виды полиненасыщенных жирных кислот, каждая из которых находится в пределах определенного диапазона допустимого процентного содержания. Композиции дополнительно определены таким образом, чтобы ограничить некоторые нежелательные компоненты, как происходящие из естественного источника, такие как некоторые примеси из окружающей среды, так и потенциально возникающие в процессе переработки.
Оптимальная композиция, вероятно, отличается в зависимости от предполагаемых клинических показаний. Тем не менее, даже для первого одобренного клинического показания, а именно, лечения тяжелой гипертриглицеридемии (TG (триглицериды) более 500 мг/дл), оптимальная композиция не была определена.
Таким образом, одобренная в первую очередь фармацевтическая композиция для лечения тяжелой гипертриглицеридемии содержит виды омега-3 PUFA, эйкозапентаеновую кислоту («ЕРА») и докозагексаеновую кислоту («DHA») в форме этиловых эфиров в массовых процентных долях приблизительно 46:38 (EPA:DHA), где ЕРА и DHA вместе составляют приблизительно 84% от всех видов PUFA в композиции. Наоборот, позже одобренный продукт Vascepa® (ранее известный как AMR101), который одобрен для того же самого клинического показания, более чем на 96% представляет собой чистую ЕРА в форме этилового эфира, по существу без DHA. Нутрицевтический продукт ОМАХ3, представленный на рынке в качестве пищевой добавки, и продвигаемый частично для снижения уровней триглицеридов, содержит ЕРА и DHA в массовом отношении приблизительно 4,1:1, где ЕРА и DHA аналогично представлены в форме этилового эфира, при этом композиция содержит более чем 84% ЕРА и DHA по массе и более чем 90% омега-3 жирных кислот по массе.
Эти широкие вариации в композиции отражают продолжающуюся неопределенность в отношении оптимальной композиции для данного клинического показания.
Неопределенность частично является следствием конкуренции клинических целей. Например, известно, что вид омега-3 PUFA, DHA, обладает большей силой в отношении снижения уровней триглицеридов в сыворотке крови по сравнению с ЕРА, но, как известно, обладает большей тенденцией в отношении повышения уровней LDL (липопротеиды низкой плотности), Mori et al., Am. J. Clin. Nutr. 71: 1085-94 (2000), Grimsgaard et al., Am. J. Clin. Nutr. 66: 649-59 (1997); полагают, что увеличение уровня LDL клинически неблагоприятно у субъектов с повышенным риском сердечно-сосудистых заболеваний. Хотя уменьшение агрегации тромбоцитов и тромбогенеза за счет омега-3 PUFA часто является клинически желательным, потенциальное увеличение времени свертывания крови побудило некоторых исследователей предложить добавление некоторого количества видов омега-6 PUFA, арахидоновой кислоты («АА»), в фармацевтические композиции, обогащенные в отношении омега-3 PUFA. Смотри публикацию заявки на патент США, опубликованной через 18 месяцев с даты приоритета, №2010/0160435.
Трудность в определении оптимальной композиции также частично возникает вследствие ферментативного взаимного превращения видов омега-3 PUFA, и в конкуренции между омега-3 и омега-6 полиненасыщенными жирными кислотами за ферменты, общие для соответствующих путей их биосинтеза из среднецепочечных потребляемых с пищей PUFA (смотри фиг. 1).
Еще одна проблема при разработке оптимальной композиции заключается в вариации биологической доступности перорально вводимых композиций PUFA. Известно, что например поглощение PUFA в форме этиловых эфиров зависит от присутствия панкреатической липазы, которая высвобождается в ответ на жиры, потребляемые в пищу. Поэтому поглощение этиловых эфиров PUFA является неэффективным, и подвергается значительной вариации как среди субъектов, так и у любого отдельного субъекта в зависимости от потребления жира с пищей. Смотри Lawson et al., "Human absorption of fish oil fatty acids as triacylglycerols, free acids, or ethyl esters," Biochem Biophys Res Commun. 152: 328-35 (1988); Lawson et al., Biochem Biophys Res Commun. 156: 960-3 (1988). Поглощение особенно снижено у субъектов, находящихся на диетах с низким содержанием жира, диете, предписанной для субъектов, имеющих повышенные уровни триглицеридов сыворотки или сердечно-сосудистое заболевание.
Для любой специфической желаемой фармацевтической композиции PUFA процесс переработки разработан таким образом, чтобы получать конечный продукт, имеющий обязательные компоненты жирных кислот, находящиеся в предопределенных пределах допустимого процентного содержания, и чтобы ограничить некоторые нежелательные компоненты уровнями, находящимися ниже определенных предопределенных пределов допустимости, причем достаточный выход делает процесс коммерчески реализуемым и экологически устойчивым. Различия в желаемой конечной композиции диктуют различия в способе переработки.
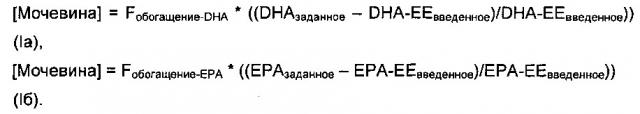
Тем не менее, соотношение различных стадий известного способа может варьировать, что затрудняет адаптацию и оптимизацию способа очистки конкретных композиций. Например, комплексообразование с включением мочевины (образование клатратов) в присутствие этанола часто используется для удаления насыщенных и мононенасыщенных длинноцепочечных жирных кислот, увеличения относительной доли желаемых длинноцепочечных омега-3 полиненасыщенных жирных кислот в получающейся в результате композиции. Слишком малое количество мочевины уменьшает обогащение длинноцепочечными омега-3 PUFA. Тем не менее, избыточное количество мочевины может приводить к концентрации нежелательных компонентов, и обладает потенциалом к тому, чтобы при любой заданной температуре и времени реакции приводить к увеличенному образованию этилкарбамата, представляющего собой канцерогенное вещество, содержание которого выше определенных низких пределов является недопустимым. Тем не менее, существующие альтернативы комплексообразованию с мочевиной представляют другие трудности.
Таким образом, существует потребность в улучшенных фармацевтических композициях, богатых омега-3 полиненасыщенными жирными кислотами, в частности для лечения гипертриглицеридемии и смешанных дислипидемий, и для улучшенных способов переработки таких композиций из рыбьего жира.
3. КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В первом аспекте описания настоящего изобретения предложены обогащенные DPA (докозапентаеновая кислота) фармацевтические композиции омега-3 полиненасыщенных жирных кислот в форме свободной кислоты. Обогащение по содержанию DPA представляло собой непреднамеренное и неожиданное следствие способа получения промышленного масштаба. Эти обогащенные DPA фармацевтические композиции демонстрировали исключительную фармакологическую и клиническую эффективность в экспериментах in vitro и в клинических исследованиях на людях.
Соответственно, в другом аспекте предложены способы лечения. В одной из серий воплощений лечения предложены способы лечения тяжелой гипертриглицеридемии (TG более 500 мг/дл). В еще одной серии воплощений лечения предложены способы лечения гипертриглицеридемии (200 мг/дл - 500 мг/дл) путем дополнительного введения статина и описанных здесь фармацевтических композиций. Дополнительные способы лечения включают среди прочего способы лечения для увеличения отношений ЕРА:АА в плазме крови, способы лечения для снижения уровней ApoCIII и способы лечения для уменьшения или предупреждения резистентности к ингибиторам агрегации тромбоцитов.
Также здесь раскрыты способы приготовления фармацевтических композиций в промышленном масштабе, в том числе способы, которые включают стадию комплексообразования с мочевиной, в которых ограниченные по своему составу партии трансэтерифицированного промежуточного сырья подвергают стадии комплексообразования с мочевиной с использованием количеств мочевины, находящихся в пределах диапазонов, определяемых при помощи алгоритма нового процесса.
4. КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
ФИГ. 1 демонстрирует известные пути биосинтеза у человека омега-3 и омега-6 длинноцепочных полиненасыщенных жирных кислот из имеющих промежуточную (среднюю) длину цепи незаменимых жирных кислот.
ФИГ. 2 представляет собой блок-схему примера способа изготовления промежуточного сырья этиловых эфиров PUFA.
ФИГ. 3А представляет среднюю относительную очистку классов жирных кислот через стадию комплексообразования с мочевиной, в которой алгоритмически определяемые количества мочевины добавляют к определенному по своему составу промежуточному сырью этиловых эфиров PUFA.
ФИГ. 3Б иллюстрирует среднюю дифференциальную очистку отдельных видов этиловых эфиров омега-3 и омега-6 PUFA, когда алгоритмически определенные количества мочевины добавляют к определенному по составу промежуточному сырью этиловых эфиров PUFA.
ФИГ. 4 представляет собой блок-схему лечения, иллюстрирующую схему клинического исследования ECLIPSE, дополнительно описанного в примере 7.
ФИГ. 5 сравнивает биологическую доступность общих ЕРА и DHA (изменение, скорректированное относительно базового уровня) после разовой дозы (4 г) Lovaza® в течение периодов соблюдения диеты с высоким и низким содержанием жиров.
ФИГ. 6 сравнивает биологическую доступность общих ЕРА и DHA (изменение, скорректированное относительно базового уровня) после разовой дозы (4 г) Lovaza® («EE-FA») или Epanova®, обогащенной DPA композиции омега-3 PUFA в форме свободной кислоты («FFA»), в течение периода соблюдения диеты с высоким содержанием жиров.
ФИГ. 7 сравнивает общие концентрации ЕРА и DHA в плазме крови (изменение, скорректированное относительно базового уровня) после разовой дозы (4 г) Lovaza® или Epanova® в течение периода соблюдения диеты с низким содержанием жиров.
ФИГ. 8 сравнивает общие концентрации ЕРА в плазме крови (изменение, скорректированное относительно базового уровня) после разовой дозы (4 г) Lovaza® или Epanova® в течение периода соблюдения диеты с низким содержанием жиров.
ФИГ. 9 сравнивает общие концентрации DHA в плазме крови (изменение, скорректированное относительно базового уровня) после разовой дозы (4 г) Lovaza® или Epanova® в течение периода соблюдения диеты с низким содержанием жиров.
ФИГ. 10А и 10Б представляют ответы AUC0-t (площадь под фармакокинетической кривой) у отдельных субъектов в течение периода соблюдения диет с низким и высоким содержанием жиров, выраженные как отношение (%) AUC0-t при низком содержании жиров к AUC0-t при высоком содержании жиров. Отрицательные отношения не представлены.
ФИГ. 11 представляет собой блок-схему лечения, иллюстрирующую схему 14-суточного сравнительного исследования биологической доступности, дополнительно описанного в примере 8 (временная шкала не масштабирована).
ФИГ. 12А представляет зависимость средних нескорректированных общих концентраций ЕРА и DHA в зависимости от времени (линейная шкала) для лечения Lovaza® по сравнению с лечением Epanova® в 14-суточном сравнительном исследовании биологической доступности, дополнительно описанном в примере 8.
ФИГ. 12Б представляет собой гистограмму, демонстрирующую различие в нескорректированных ЕРА и DHA (нмоль/мл) для точек, заключенных в скобки на фиг. 12А.
ФИГ. 13 представляет средние скорректированные относительно базового уровня общие концентрации ЕРА и DHA в плазме крови в зависимости от времени (линейная шкала) для лечения Lovaza® по сравнению с лечением Epanova® в 14-суточном сравнительном исследовании биологической доступности.
ФИГ. 14А представляет собой гистограмму, на которой изображено увеличение от базового значения до стабильного состояния нескорректированных уровней ЕРА и DHA в крови в группах Lovaza® и Epanova® 14-суточного сравнительного исследования биологической доступности.
ФИГ. 14Б представляет собой гистограмму, на которой изображено увеличение от базового значения до стабильного состояния нескорректированных Cavg для ЕРА и DHA в группах Lovaza® и Epanova® 14-суточного сравнительного исследования биологической доступности.
ФИГ. 15А представляет собой гистограмму, на которой изображено увеличение от базового значения до стабильного состояния общих уровней DHA в крови в группах Lovaza® и Epanova® 14-суточного сравнительного исследования биологической доступности.
ФИГ. 15Б представляет собой гистограмму, на которой изображено увеличение от базового значения до стабильного состояния уровней Cavg DHA в группе Epanova® по сравнению с группой Lovaza® в 14-суточном сравнительном исследовании биологической доступности.
ФИГ. 16А представляет собой гистограмму, на которой изображено увеличение от базового значения до стабильного состояния общих уровней ЕРА в крови в группах Lovaza® и Epanova® 14-суточного сравнительного исследования биологической доступности.
ФИГ. 16Б представляет увеличение от базового значения до стабильного состояния уровней Cavg ЕРА в группах Epanova® и Lovaza® в 14-суточном сравнительном исследовании биологической доступности.
ФИГ. 17 представляет блок-схему лечения, иллюстрирующую схему исследования EVOLVE, дополнительно описанного в примере 10.
ФИГ. 18 обобщает схему исследования EVOLVE более подробно, дополнительно идентифицируя моменты времени визитов для исследования.
ФИГ. 19 демонстрирует распределение субъектов в исследовании EVOLVE.
ФИГ. 20А-20Г отображают средние базовые уровни в плазме крови ЕРА (ФИГ. 20А), DHA (ФИГ. 20Б), DPA (ФИГ. 20В) и АА (ФИГ. 20Г) и уровни в плазме крови в конце лечения («ЕОТ») (в мкг/мл), для каждой из подвергаемых лечению групп в исследовании EVOLVE.
ФИГ. 20Д сравнивает средние базовые уровни ЕРА и уровни ЕРА EOT для исследования ECLIPSE, описанного в примере 7, представляющего собой 14-суточное исследование биологической доступности, описанное в примере 8, исследования статинового межлекарственного взаимодействия («STATIN DDI»), описанного в примере 11, каждой подвергаемой лечению группы, а также контрольной группы исследования EVOLVE, описанного в примере 10, и значений, ранее представленных в литературе для несвязанного исследования JELIS («JELIS»), в котором использовалась отличающаяся композиция омега-3.
ФИГ. 21А-21Г представляют медиану для базовых уровней ЕРА (ФИГ. 21A), DHA (ФИГ. 21Б), DPA (ФИГ. 21В) и АА (ФИГ. 21Г) в плазме крови и уровней в плазме крови в конце лечения («ЕОТ») (в мкг/мл) в исследовании EVOLVE.
ФИГ. 22А и 22Б представляют изменение от базового значения до EOT для абсолютных уровней (в мкг/мл) АА, DHA, ЕРА и DPA в плазме крови для каждой из подвергаемых лечению групп в исследовании EVOLVE. ФИГ. 22А представляет средние изменения; ФИГ. 22Б отображает медианы изменений.
ФИГ. 23А представляет среднее изменение от базового значения до EOT в виде процентного изменения относительно базовой величины для АА, DHA, ЕРА и DPA в каждой из подвергаемых лечению групп в исследовании EVOLVE. ФИГ. 23Б представляет медиану процентного изменения от базового значения до EOT.
ФИГ. 24А-24И представляют средние базовые и уровни EOT в плазме крови (в мг/дл, за исключением того, что LpPLA2 (липопротеин-ассоциированная фосфолипаза А2) представлены в нг/мл) в исследовании EVOLVE для триглицеридов (ФИГ. 24А), не-HDL-C (холестерин, не связанный с липопротеинами высокой плотности) (ФИГ. 24Б), HDL-C (холестерин, связанный с липопротеинами высокой плотности) (ФИГ. 24В), V-LDL-C (холестерин, связанный с липопротеинами очень низкой плотности) (ФИГ. 24Г), LDL-C (холестерин, связанный с липопротеинами низкой плотности) (ФИГ. 24Д), АроВ (аполипопротеин В) (ФИГ. 24Е), ApoCIII (аполипопротеин С III) (ФИГ. 24Ж), RLP (рецептороподобный белок) (ФИГ. 243), LpPLA2 (ФИГ. 24И).
ФИГ. 25А-25И представляет медиану для базовых уровней и EOT в плазме крови (в мг/дл, за исключением того, что LpPLA2 представлены в нг/мл) в исследовании EVOLVE для триглицеридов (ФИГ. 25А), He-HDL-C (ФИГ. 25Б), HDL-С (ФИГ. 25В), V-LDL-C (ФИГ. 25Г). LDL-C (ФИГ. 25Д), АроВ (ФИГ. 25Е), ApoCIII (ФИГ. 25Ж), RLP (ФИГ. 253), LpPLA2 (ФИГ. 25И).
ФИГ. 26А и 26Б представляют изменение от базового значения до EOT абсолютных уровней в плазме крови (в мг/дл) в исследовании EVOLVE для триглицеридов («TG»), He-HDL-C («NHDL-C»), HDL-C, VLDL-C, и LDL-C для каждой из подвергаемых лечению групп в исследовании EVOLVE, где ФИГ. 26А представляет среднее изменение и ФИГ. 26Б демонстрирует медиану изменения.
ФИГ. 27 представляет процентную долю субъектов в исследовании EVOLVE, приведенную по оси Y, для которых уровни триглицеридов уменьшались на указанную процентную долю, приведенную по оси X, для дозы Epanova® 2 г и дозы 4 г.
ФИГ. 28А представляет среднее изменение от базового значения до EOT в виде процентного изменения относительно базовой величины для TG, не-HDL-c («NHDL-C»), HDL-C, VLDL-C, LDL-C, АроВ, ApoCIII, LpLPA2 и RLP в каждой из подвергаемых лечению групп в исследовании EVOLVE, где ФИГ. 28Б представляет медиану процентного изменения от базового значения до EOT.
ФИГ. 29 представляет скорость изменения (абсолютная величина) медианы процентного изменения относительно базового значения в уровнях плазмы крови для ЕРА, DHA, DPA, АА, TG, NHDL-C и HDL-C между дозами Epanova® 2 г и 4 г в исследовании EVOLVE.
ФИГ. 30 иллюстрирует сравнительные данные для Epanova®, измеренные в исследовании EVOLVE, и данные, представленные другими исследователями для AMR-101 (Vascepa) в обозначенных дозах, относительно уровней TG.
ФИГ. 31 иллюстрирует сравнительные данные для Epanova®, измеренные в исследовании EVOLVE и AMR-101 (Vascepa), в отношении различных липидных параметров крови. Данные для AMR-101 предоставлены другими исследователями. (*) обозначает, что величина p составляет менее 0,05, (**) обозначает, что величина p составляет менее 0,01, и (***) обозначает, что величина p составляет менее 0,001.
ФИГ. 32 иллюстрирует сравнительные данные для доз Epanova® 2 г и 4 г, определенные в исследовании EVOLVE, и дозы Lovaza® 4 г в отношении различных липидных параметров крови. Данные для Lovaza® предоставлены другими исследователями. (*) обозначает, что величина p составляет менее 0,05, (**) обозначает, что величина p составляет менее 0,01, и (***) обозначает, что величина p составляет менее 0,001.
ФИГ. 33 иллюстрирует сравнительные данные для доз Epanova® 2 г и 4 г, оцененные в исследовании EVOLVE, и дозы Lovaza® 4 г, предоставленные другими исследователями, в отношении уровней TG. Верхние индексы указывают на данные, полученные из (1) исследования EVOLVE, (2) мета-анализа из Lovaza® New Drug Application («NDA») (3) одобренной FDA (Управление по санитарному надзору за пищевыми продуктами и медикаментами) инструкции к продукту Lovaza® и (4) исследования Takeda. (*) обозначает, что величина p составляет менее 0,05, (**) обозначает, что величина p составляет менее 0,01, и (***) обозначает, что величина p составляет менее 0,001.
ФИГ. 34 представляет корреляцию между процентным изменением для LDL и процентным изменением для ApoCIII, измеренными в исследовании EVOLVE.
ФИГ. 35 представляет среднее процентное изменение, вычисленное по методу наименьших квадратов (LS), относительно базового значения для подгруппы субъектов исследования EVOLVE, имеющих базовые уровни TG более 750 мг/дл или равные этому значению, для указанных подвергаемых лечению групп исследования EVOLVE, как дополнительно описано в Примере 10. (*) обозначает, что величина p составляет менее 0,05, (**) обозначает, что величина p составляет менее 0,01, и (***) обозначает, что величина p составляет менее 0,001.
ФИГ. 36 представляет среднее процентное изменение, вычисленное по методу наименьших квадратов (LS), относительно базового значения для подгруппы субъектов, страдающих от сахарного диабета II типа, для указанных подвергаемых лечению групп исследования EVOLVE, как описано в Примере 10. (*) обозначает, что величина p составляет менее 0,05, (**) обозначает, что величина p составляет менее 0,01, и (***) обозначает, что величина p составляет менее 0,001.
ФИГ. 37 представляет среднее процентное изменение, вычисленное по методу наименьших квадратов (LS), относительно базового значения для подгруппы субъектов, подвергающихся одновременной статиновой терапии, для указанных подвергаемых лечению групп исследования EVOLVE, как описано в Примере 10. (*) обозначает, что величина p составляет менее 0,05, (**) обозначает, что величина p составляет менее 0,01, и (***) обозначает, что величина p составляет менее 0,001.
ФИГ. 38 представляет среднюю процентную разницу, вычисленную по методу наименьших квадратов (LS), по сравнению с контролем для триглицеридов («TG»), He-HDL-холестерина («NHDL-C»), HDL-C, LDL-C, ТС, VLDL-C и TC/HDL-C по сравнению с субъектами исследования EVOLVE, описанного в Примере 10, которые получали (STATIN) или не получали (NON-STATIN) статиновую терапию одновременно с лечением дозой 2 г Epanova®. (*) обозначает, что величина p составляет менее 0,05, (**) обозначает, что величина p составляет менее 0,01, и (***) обозначает, что величина p составляет менее 0,001.
ФИГ. 39 представляет медиану процентного изменения относительно базового значения для TG, NHDL-C, HDL-C, LDL-C, ТС, VLDL-C и TC/HDL-C для подгруппы субъектов, подвергающихся одновременной статиновой терапии, в указанных подвергаемых лечению группах исследования EVOLVE, дополнительно описанного в Примере 10. (*) обозначает, что величина p составляет менее 0,05, (**) обозначает, что величина p составляет менее 0,01, и (***) обозначает, что величина p составляет менее 0,001.
ФИГ. 40 представляет блок-схему лечения, иллюстрирующую схему исследования ESPRIT, дополнительно описанного в Примере 12.
ФИГ. 41 демонстрирует распределение субъектов в исследовании ESPRIT.
ФИГ. 42А и 42Б демонстрируют медиану процентного изменения LS относительно базового значения для ЕРА (ФИГ. 42А) и DHA (ФИГ. 42Б) в соответствии с исследованием ESPRIT, дополнительно описанном в Примере 12. (*) обозначает, что величина p составляет менее 0,05, (**) обозначает, что величина p составляет менее 0,01, и (***) обозначает, что величина p составляет менее 0,001.
ФИГ. 43 представляет среднее процентное изменение LS относительно базового значения для TG, He-HDL-C и HDL-C. Представленные данные получены в результате исследования ESPRIT, дополнительно описанного в Примере 12. (*) обозначает, что величина p составляет менее 0,05, (**) обозначает, что величина p составляет менее 0,01, и (***) обозначает, что величина p составляет менее 0,001.
ФИГ. 44 представляет среднее процентное изменение LS относительно базового значения для АроВ, LDL-C, VLDL-C и TC/HDL-C. Представленные данные получены в результате исследования ESPRIT, дополнительно описанного в Примере 12. (*) обозначает, что величина p составляет менее 0,05, (**) обозначает, что величина p составляет менее 0,01, и (***) обозначает, что величина p составляет менее 0,001.
ФИГ. 45 представляет медиану процентного изменения относительно базового значения для TG, где субъекты сгруппированы в терцили в соответствии с базовыми уровнями TG для субъектов в исследовании ESPRIT.
ФИГ. 46 представляет медиану процентного изменения относительно базового значения для He-HDL-C, где субъекты сгруппированы в терцили в соответствии с базовыми уровнями He-HDL-C, для субъектов в исследовании ESPRIT.
ФИГ. 47 представляет медиану процентного изменения относительно базового значения для LDL-C, где субъекты сгруппированы в терцили в соответствии с базовыми уровнями LDL-C, для субъектов в исследовании ESPRIT.
ФИГ. 48 представляет медиану процентного изменения относительно базового значения для TG для каждой из подвергаемых лечению групп в исследовании ESPRIT, где субъекты сгруппированы в соответствии с идентичностью статина, принимаемого в одновременной терапии.
ФИГ. 49 представляет медиану процентного изменения относительно базового значения для TG для каждой из подвергаемых лечению групп в исследовании ESPRIT, где субъекты сгруппированы на две группы в соответствии с низкой или высокой эффективностью одновременной статиновой терапии.
ФИГ. 50 представляет медиану процентного изменения относительно базового значения для He-HDL-C для каждой из подвергаемых лечению групп в исследовании ESPRIT, где субъекты сгруппированы в соответствии с низкой или высокой эффективностью одновременной статиновой терапии.
ФИГ. 51 представляет медиану процентного изменения относительно базового значения для LDL-C для каждой из подвергаемых лечению групп в исследовании ESPRIT, где субъекты сгруппированы в две группы в соответствии с низкой или высокой эффективностью одновременной статиновой терапии.
ФИГ. 52 представляет медиану процентного изменения относительно базового значения для TG, для субъектов в каждой из подвергаемых лечению групп исследования ESPRIAT, сгруппированных в три группы в соответствии с высокими базовыми TG, высокими базовыми ЕРА или одновременной терапии розувастатином.
ФИГ. 53 представляет среднее процентное изменение LS в распределении размера частиц относительно базового значения для частиц V-LDL, сгруппированных по размеру, как определили в исследовании ESPRIT. (*) обозначает, что величина p составляет менее 0,05, (**) обозначает, что величина p составляет менее 0,01, и (***) обозначает, что величина p составляет менее 0,001.
ФИГ. 54 представляет среднее процентное изменение LS в распределении размера частиц относительно базового значения для частиц LDL, сгруппированных по размеру для каждой из подвергаемых лечению групп в исследовании ESPRIT. (*) обозначает, что величина p составляет менее 0,05, (**) обозначает, что величина p составляет менее 0,01, и (***) обозначает, что величина p составляет менее 0,001.
ФИГ. 55 представляет медиану LS процентного изменения в размере частиц LDL, где субъекты сгруппированы в три группы в соответствии с уровнями триглицеридов ESPRIT EOT.
ФИГ. 56А представляет базовые уровни в плазме крови арахидоновой кислоты (АА) (в мкг/мл) для субъектов в клиническом исследовании, дополнительно описанном в Примере 11, сгруппированных в соответствии с генотипом по rs174546 SNP. ФИГ. 56Б представляет процентное изменение относительно базового значения в уровнях АА в плазме крови субъектов на 15 сутки лечения посредством Epanova®, сгруппированных в соответствии с генотипом по rs174546 SNP. Для каждого генотипа межквартильный диапазон показан прямоугольником, медиана показана горизонтальной линией внутри межквартильного прямоугольника, и среднее значение представлено ромбом. Выбросы представлены незаштрихованными кружками. «Усы» продолжаются до минимальной и максимальной величины, не являющейся выбросом. Оценка 1 идентифицирует субъектов, которые являются гомозиготами по основному аллелю; оценка 3 идентифицирует субъектов, гомозиготных по минорному аллелю; и оценка 2 представляет гетерозигот.
5. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
5.1 Обзор: Фармацевтические композиции омега-3 полиненасыщенных жирных кислот в форме свободной кислоты, которые неожиданно обогащены DPA, обладают исключительной клинической эффективностью
Включение мочевины путем комплексообразования (образование клатрата) представляет собой стандартную стадию, часто используемую в переработке рыбьего жира для удаления насыщенных и мононенасыщенных длинноцепочечных жирных кислот, таким образом обогащая получающуюся в результате композицию омега-3 полиненасыщенными жирными кислотами с желаемой длинной цепи. Тем не менее, несмотря на длительное использование и исследования, разработанные для того, чтобы охарактеризовать эффекты различных физико-химических параметров этого процесса, та степень, до которой комплексообразование с мочевиной обогащает отдельными видами длинноцепочечных полиненасыщенных жирных кислот, остается непредсказуемой. Ввиду этой остаточной непредсказуемости при комплексообразовании с мочевиной в сочетании с риском получения неприемлемо высоких уровней этилкарбамата, которые приводили бы к необходимости дополнительной обработки, комплексообразование с мочевиной сначала было исключено из способа очистки, применяемого для промышленного изготовления композиций омега-3 PUFA в форме свободных кислот, имеющих определенные желаемые характеристики, для фармацевтического применения.
Тем не менее, как далее описано в Примере 1, ранние попытки разработать способ без использования мочевины в коммерческом масштабе ясно показали, что такие способы не могут достоверно воспроизводить партии композиции, удовлетворяющие необходимым техническим требованиям. Соответственно, искали способ с использованием комплексообразования с мочевиной, и обнаружили, что строгий контроль в композиции над видами PUFA, находящимися в промежуточном исходном сырье сложного этилового эфира, совместно с применением алгоритмически определенного количества мочевины, может достоверно воспроизводить партии, удовлетворяющие необходимым техническим требованиям, и без превышения приемлемых пределов этилкарбамата.
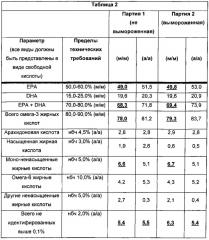
Как описано в Примере 2, четыре иллюстративные производимые партии полиненасыщенных жирных кислот в форме свободной кислоты готовили с использованием стадии комплексообразования с мочевиной. Строгий контроль над композицией применяли к промежуточному сырью сложного этилового эфира применяя только те партии, в которых определенные виды полиненасыщенных жирных кислот находятся в пределах определенного диапазона, и использовали количества мочевины, которые находятся в пределах диапазона, требующегося алгоритмом расчета мочевины. Определили, что все четыре производимые партии фармацевтической композиции удовлетворяли желаемым композиционным техническим требованиям.
Как ожидалось, стадия комплексообразования с мочевиной по существу уменьшала процент насыщенных жирных кислот и мононенасыщенных жирных кислот в получающейся композиции, таким образом, по существу, обогащая ее полиненасыщенными жирными кислотами. Смотри ФИГ. 3А. Тем не менее, неожиданно, что проведение комплексообразования с мочевиной с использованием количеств мочевины, которые находятся в пределах алгоритмически определенного диапазона, оказывает отличающиеся действия на обогащение конкретными видами омега-3 полиненасыщенных жирных кислот и омега-6 полиненасыщенных жирных кислот.
Как описано ниже в примере 3, было обнаружено, что виды омега-3, докозапентаеновая кислота DPA (С22:5 n-3), обогащены, тогда как преобладание соответствующих видов омега-6 с идентичной длиной цепи и степенью ненасыщенности, докозапентаеновой кислоты (С22:5 n-6), уменьшено. Отличающееся действие комплексообразования с мочевиной на обогащение этими двумя изомерами - в сочетании с различиями в их относительных концентрациях сложного этилового эфира, промежуточного сырья - привело в результате к различию логарифмического порядка в их концентрациях в конечной не содержащей кислоту фармацевтической композиции («API»).
Осуществляли дополнительное приготовление партий, и, как описано в Примере 4, композиционный анализ 10 партий API продемонстрировал воспроизводимо повышенные уровни DPA в конечной композиции. Как описано в Примере 5, композиционный анализ 21 партии, приготовленной с использованием комплексообразования с мочевиной, продемонстрировал воспроизводимое 10-кратное различие в концентрации видов омега-3 DPA по сравнению с его омега-6 изомером докозапентаеновой кислотой (С22:5 n-6).
При средней концентрации по меньшей мере приблизительно (а/а, от англ. «at least about») 4,44% для 21 производственной партии, DPA представляет собой третьи наиболее преобладающие виды полиненасыщенной жирной кислоты в API, которые превосходят только ЕРА и DHA. На этом уровне концентрация DPA также приблизительно в 10 раз больше чем концентрация, о которой сообщалось для более ранней фармацевтической композиции омега-3 полиненасыщенных жирных кислот в форме свободной кислоты, названной Purepa, в которой DPA, как сообщалось, присутствовала на уровне 0,5%. Смотри Belluzzl et al., Dig. Dis. Sci. 39(12): 2589-2594 (1994).
Хотя DPA представляет собой промежуточное звено в пути биосинтеза от ЕРА до DHA (смотри ФИГ. 1), удивительно мало известно о специфических биологических эффектах DPA. Для разъяснения потенциального вклада DPA в клиническую эффективность фармацевтической композиции провели эксперименты по профилированию генной экспрессии с использованием клеток гепатокарциномы HepG2.
Как дополнительно описано в Примере 6, эффект DPA на экспрессию генов клеток печени прогнозирует большую клиническую эффективность композиций, обогащенных DPA.
Эксперименты по профилированию генной экспрессии продемонстрировали, что DPA оказывает значительный биологический эффект при релевантных концентрациях in vitro. Эти эффекты заметно отличаются от таковых, наблюдаемых для ЕРА и для DHA.
Обнаружено, что при релевантной концентрации DPA влияет на экспрессию генов в множественных метаболических путях, включающих гены в категориях, которые, как известно, релевантны клиническим эффектам омега-3 полиненасыщенных жирных кислот: гены, вовлеченные в липидный метаболизм, гены, вовлеченные в сердечно-сосудистую физиологию, и гены, вовлеченные в воспаление. Также предсказывают значительные эффекты второго порядка, учитывая изменения, обнаруженные в экспрессии генов, кодирующих белки, которые сами влияют на экспрессию генов, и генов, кодирующих белки, которые влияют на посттранскрипционную модификацию.
Специфические эффекты, оказываемые на экспрессию нескольких генов, вовлеченных в липидный метаболизм, свидетельствуют о том, что DPA в аналогичной концентрации in vivo, должна вносить вклад в улучшение различных клинически релевантных липидных параметров. В частности, обнаруженная зависимая от DPA повышающая регуляция ACADSB, коротко-/разветвлено-цепочечной ацил-СоА дегидрогеназы, прогнозирует более низкий уровень триглицеридов в сыворотке крови; зависимая от DPA понижающая регуляция HMGCR, аналогичная ингибированию статинами кодируемого фермента HMG-СоА-редуктазы, как можно прогнозировать, приведет к благоприятным уменьшениям отношения общий холестерин:HDL; и зависимая от DPA понижающая регуляция SQLE, представляющая собой ограничивающую скорость стадию в синтезе стерола, аналогично прогнозирует уменьшения в общих уровнях холестерина.
Эксперименты по исследованию профиля экспрессии также продемонстрировали порог дозы для эффектов DPA. Более низкая протестированная концентрация, выбранная для того, чтобы имитировать в 10 раз более меньшую концентрацию DPA в более ранней композиции свободной омега-3 кислоты, Purepa, оказала влияние на экспрессию в 10 раз меньшего количества генов, чем более высокая концентрация DPA, выбранная для того, чтобы имитировать воздействие, ожидаемое для фармацевтических композиций, описанных здесь, демонстрируя то, что меньшая концентрация DPA обеспечивает подпороговое воздействие, и, как можно ожидать, обеспечит субтерапевтическую дозу in vivo.
Клинические исследования на людях подтвердили исключительную клиническую эффективность обогащенной DPA фармацевтической композиции омега-3 полиненасыщенных жирных кислот в форме свободной кислоты.
Пример 7 представляет результаты клинического исследования ECLIPSE, представляющего собой рандомизированное четырехстороннее перекрестное открытое исследование разовой дозы, сравнивающее биологическую доступность дозы 4 г Lovaza® с биологической доступностью дозы 4 г обогащенной DPA фармацевтической композиции омега-3 PUFA в описанной здесь форме свободной кислоты (далее «Epanova®») в условиях как диеты с высоким уровнем жира, так и с низким уровнем жира. В соответствии с одобренной FDA инструкцией к продукту каждый 1 грамм капсулы Lovaza содержит по меньшей мере 900 мг этиловых эфиров омега-3 жирных кислот, полученных из рыбьего жира, преимущественно комбинацию этиловых эфиров эйкозапентаеновой кислоты (ЕРА - приблизительно 465 мг) и докозагексаеновой кислоты (DHA - приблизительно 375 мг). Партия Epanova®, использованная в исследовании, содержала 57,3% (а/а) ЕРА, 19,6% (а/а) DHA, и 6,2% (а/а) DPA, ка