Способ получения биоразлагаемого композита на основе алифатических сложных полиэфиров и гидроксиапатита
Иллюстрации
Показать всеИзобретение относится к медицинской химии, а именно к биоразлагаемым фосфатсодержащим полимерным материалам, использующимся в качестве аналогов костной ткани, и раскрывает способ получения биоразлагаемого композита. Способ характеризуется тем, что синтез композита, который включает в себя взаимную прививку полимера и наполнителя, осуществляют в отсутствие органического растворителя одно- или двухстадийным способом, методом совместной механохимической обработки компонентов, проводящейся при комнатной температуре в интервале 3000-7000 об/мин диспергатором при исходном соотношении гидроксиапатит / полилактид 10-90/90-10%. Способ может использоваться для получения композита при комнатной температуре при сниженном времени синтеза. Изобретение позволяет получать биоразлагаемый композит более быстрым, чем в аналогах, синтезом при отсутствии органического растворителя. 12 ил., 7 пр., 1 табл.
Реферат
Область техники
Изобретение относится к способам получения биоразлагаемых фосфатсодержащих полимерных материалов, аналогов костной ткани.
Получаемый композит может быть использован для приготовления различных изделий медицинского назначения:
- крепежных винтов, шпилек, пинов для сращивания поврежденных костей,
- заполнителя костных пустот, генерирующих кальций по мере биоразложения имплантата,
- биоразлагаемых пленок и нитей повышенной прочности по сравнению с ненаполненными материалами,
- основы для выращивания новых тканей,
- лекарств пролонгированного действия,
а также в быту для изделий одноразового использования (бутылок, стаканчиков, тарелок, ножей, ложек, вилок и т.д.).
Создание полностью биоразлагаемых композитных материалов на основе алифатических сложных полиэфиров и фосфатов кальция имеет многоцелевое медицинское назначение, Главнейшее из них - получение достаточно прочных к механическим нагрузкам материалов, пригодных для изготовления крепежных изделий с внутренней, непосредственной фиксацией сложных переломов костей, в том числе плохо поддающихся внешней фиксации с помощью гипса или различных металлических конструкций.
Непосредственное введение фосфата кальция, главного компонента костной ткани, в то место в организме, где необходима срочная ее регенерация, преследует также цель снижения (или даже ликвидации) кальциевого дефицита в месте повреждения. Очень важным при этом становится механизм, по которому происходит разборка поставляемого кальция и последующая сборка его во вновь возникающей (регенерируемой) костной ткани. Оптимизация разборки снижает уровень кислотности, возникающей от резорбируемого композита и отрицательную реакцию окружающих тканей соответственно, оптимизация последующей сборки во многом определяется структурными особенностями конструируемого композита.
Уровень техники
Наиболее интенсивно изучаемыми и, следовательно, особенно перспективными исходными компонентами для создания полностью биоразлагаемых композитов следует принять следующие объекты:
- в качестве биоразлагаемой полимерной матрицы наиболее целесообразной следует считать гомополимеры полилактидного (полигликолидного) или полиоксикислотного типа (алифатические сложные полиэфиры). На втором месте по значимости могут стать сополимеры полилактида с полигликолидом блочного типа с фазово-разделенной микроструктурой, в которой полигликолидные участки являются местами локализации возникающей решетки, обеспечивающей повышенную прочность матрицы и, наконец, индивидуальный полигликолид, обеспечивающий наиболее высокий модуль на изгиб, вследствие высокой кристалличности и до недавнего времени считавшийся наиболее приемлемым для создания крепежных изделий, но проигрывающий полилактиду в сроках биоразложения. Остальные полилактоны могут иметь вспомогательное назначение и применяться только в виде добавок.
- достаточно важными компонентами биоразлагаемой полимерной матрицы следует считать полимеры оксикислот, индивидуального или смешанного типа, получаемые гомо- или совместной поликонденсацией. Целесообразность такого варианта продиктована не только значимостью этих продуктов в качестве возможной замены относительно дорогостоящего лактида, но и в качестве перспективных модификаторов фосфатов кальция, создающих необходимое сродство между органической частью композита и его неорганической составляющей.
- основные фосфатные наполнители - гидроксиапатит Ca10(PO4)6(OH)2 и трикальцийфосфат Са3(РO4)2. Считается, что первый более приемлем, т.к., попадая в живой организм, сразу начинает работать, в отличие от второго, который должен пройти предварительную стадию гидратации. Не исключаются и комбинации с другими фосфатами кальция, в частности с меньшей степенью замещения фосфора, а также соединения кальция вообще не содержащие фосфора типа Са(ОН)2, СаСO3 и т.д. Основное назначение указанных комбинаций - изменение характеристического соотношения Са/Р в диапазоне расширенном с естественного для костной ткани (1,67) до 1,0-1,9.
- состав композита по содержанию наполнителя определяется в основном выбираемым балансом между прочностными характеристиками получаемого композита и сроком его службы. Моделирование живой костной ткани по высокому содержанию наполнителя (70-77%) к настоящему времени имеет смысл только для изделий, не несущих достаточно высоких (необходимых для скрепления) механических нагрузок, например для заполнения костных пустот, скаффолдов и т.д. Преимущественное содержание наполнителя, на которое следует ориентироваться и которое создает необходимый баланс свойств при нынешнем уровне техники, характеризуется на уровне 20%.
- типы совмещения (комбинирования) фосфатных наполнителей и полимерной матрицы. Самый простой из них - экструдерное совмещение через расплав или с помощью растворителя. Однако экструдерный вариант не приводит к достаточно удовлетворительным результатам, т.к. не обеспечивает необходимую дезагрегацию наполнителя и степень его прививки к полимерной матрице. Наиболее часто применяемым в настоящее время следует считать растворный вариант совмещения.
- дисперсность исходного наполнителя и характер его распределения в получаемом композите также весьма важная характеристика, которая в значительной мере определяет прочностные характеристики материала в целом.
Следует отметить, что разработанные к настоящему времени методы синтеза фосфатов (преимущественно мокрые, Баринов С.М., Комлев B.C. Биокерамика на основе фосфатов кальция. Москва. Наука 2005) позволяют реализовать наноуровневый их размер, однако удержать высокую дисперсность при последующем получении композита представляется достаточно сложной задачей, т.к. получаемые нанокристаллы весьма склонны к агрегации. Решение указанной проблемы возможно путем создания максимально возможного сродства наполнителя к матрице, которое достигается химической прививкой фрагментов полимерной матрицы к поверхности наполнителя.
Учитывая вышесказанное, основное внимание при обзоре существующего уровня техники в данной области было направлено на выявление способов получения органоминеральных (фосфатсодержащих) биоразлагаемых композитов с улучшенной совместимостью полимер-наполнитель, которая в свою очередь достигается с помощью обязательной предварительной модификации поверхности наполнителя органической составляющей композита полимеризационными, поликонденсационными или полимераналогичными превращениями, проводимыми в жидкой органической среде, после удаления которой конструируется конечная полимерная матрица с дисперсно расределенным в ней модификатом.
Уровень техники, существующий на данный момент в данной области, может быть представлен следующей подборкой выявленных патентов-аналогов и научных публикаций.
Известен способ модификации гидроксиапатита полилилактидом, осуществляемый полимеризацией лактида в присутствии дисперсии гидроксиапатита. Полимеризацию проводили в растворе ксилола под действием октоата олова (содержание 500-5000 ppm), при температуре 90-120°С, в течение 3-48 часов. Дисперсию гидроксиапатита медленно вводили в раствор лактида при постоянном перемешивании. Полученную дисперсию подвергали далее центрифугированию для отделения ее от не прореагировавшего мономера, промывали несколько раз хлороформом, сушили и приготавливали пластинки для механических испытаний при температуре 180°С и давлении 15 МПа. Реализованная степень прививки на поверхность гидроксиапатита, привела к заметному повышению механических свойств композита даже при относительно низкой молекулярной массе полимерной матрицы (Mw=11645).
Недостатком данного способа полимеризационной модификации наполнителя является многостадийность, длительность проведения процесса, необходимость применения катализатора и растворителей.
(Полимеризационная прививка L-лактида на поверхность нано-кристаллов гидроксиапатита. Z. Hong, X. Qiu, J. Sun, M. Deng, X. Chen, X. Jing. Polymer 45, (2004), 6699-6706).
Известен метод поверхностной 2-х стадийной модификации наночастиц гидроксиапатита с помощью прививки на них L-молочной кислоты и L-лактида. Суть метода заключается в том что молочная кислота на первой стадии прививается на гидроксиапатит в растворе тетрагидрофурана (заменяемым далее на толуол) при 60°С с образованием кальций карбоксилатных и гидроксильных связей на поверхности, а лактид, на второй стадии, только гидроксильных. Расплавная полимеризация лактида в присутствии полученных привитых фосфатов, проводимая под действием октоата олова, приводит к композитам, обладающим при степени модификации 15% наибольшим повышением прочностных характеристик композита (прочность на разрыв повышается с 45 Мпа до 67 МПа и модуль с 1,7 ГПа до 2,1 ГПа).
Недостатком способа является применение двух промежуточных растворителей и связанной с этим многостадийностью процесса, применением катализатора на стадии полимеризации, необходимостью удаления каталитических остатков из композита для применения его в медицинских целях.
(Поверхностно модифицированный L-молочной кислотой гидроксиапатит и его последующая полимеризационная прививка L-лактидом. X. Qiu, Z. Hong, J. Hu, L. Chen, X. Chen, X. Jing. Biomacromolecules, 2005, 6, 1193-1199).
В более поздней аналогичной работе методом предварительной модификации поверхности дисперсного гидроксиапатита с помощью молочной кислоты и последующей полимеризации L-лактида в присутствии полученного модификата синтезированы образцы композитов с содержанием гидроксиапатита 5, 10 и 20 вес %. Модификацию проводили в растворе тетрагидрофурана с последующей добавкой толуола и выдерживанием системы 6-8 часов при температуре 85°С, после чего наполнитель промывали этилацетатом. Полимеризацию осуществляли при температуре 130°С в течение 24 часов. Готовый композит промывали хлороформом и сушили в вакууме. Оптимальная степень наполнения, повышающая прочность на разрыв до 55 МПа, составила 10%. Констатировано и повышение термостабильности композита по сравнению с ненаполненными образцами.
Предложенный способ модификации ГАП характеризуется теми же недостатками, что и предыдущая работа, а именно, применением растворителей (тетрагидрофурана и толуола), выдержкой системы достаточно длительное время при повышенной температуре (85°С), применением этилацетата для очистки композита.
(J. Li, X.L. Lu, Y.F. Zheng. Effect of surface modified hydroxyapatite on the tensile property improvement of HA/PLA composite. Applied Surface Science, 255, (2008), 494-497).
В последующей работе приведены результаты медицинских (in vivo) испытаний, которые тем не менее показали улучшение эксплуатационных свойств предложенного композита.
(Cell responses and hemocompatibility of g-HA/PLA composites.
LI Jia, ZHENG Wei. ZHENG YuFeng, LOU Xia. Sci China Life Sci April (2011) Vol. 54 No. 4.).
Известен способ получения органоминерального биодеградируемого полиэфирного композита с широкой дисперсностью наполнителя от нанометрового до микрометрового уровня, в котором минеральная составляющая - гидроксиапатит, а органическая - полимолочная кислота, получаемая конденсацией молочной кислоты в присутствии толуола или в отсутствие растворителя.
Получение композита начинали с модификации и увеличения поверхности ГАП путем повышения содержания на его поверхности гидроксильных групп, через которые, по мнению авторов, образуется далее ковалентная связь между наполнителем и полимерной матрицей. Увеличение поверхности ГАП и одновременно прививку к нему биоразлагаемого полимера проводили в тетрагидрофуране или толуоле постепенным введением молочной кислоты, лактата кальция или олигомера молочной кислоты. Режим введения 0-80°С, в течение 0,5-5 часов, при постоянном перемешивании. Далее твердый осадок отделяли фильтрованием и проводили дегидратацию с помощью азеотропной отгонки воды с толуолом, в течение 1-48 часов.
Допускалась и непосредственная дегидратация молочной кислоты без участия толуола при температуре 80-120°С и постоянном перемешивании в течение 0,5-5 часов с последующей промывкой привитого полимера тетрагидрофураном или этанолом с целью отделения его от не привитого. Однако количество вводимой кислоты по отношению к ГАП было достаточно большим, что приводило к растворению ГАП в кислоте, отсутствию модификации, вызывало неизбежное слипание и комкование его частиц и не позволяло квалифицировать данный вариант как «сухой».
Получение собственно композита (на второй стадии) с содержанием 0,1-70% ГАП осуществляли растворной или расплавной (solvent free) полимеризацией лактонов биоразлагаемого типа в присутствии модифицированного на первой стадии ГАП, катализатор полимеризации - октоат олова, время полимеризации 12-L-полилактидом нано-гидроксиапатита под действием микроволнового излучения, который осуществлялся без применения каких-либо органических растворителей. Прививку производили в расплаве лактида при температуре 140°С, соотношении гидроксиапатит/лактид, выбранном в интервале 1:50-1:400, при мощности микроволнового излучения 50W и наличии октоата олова в качестве катализатора полимеризации. При этом, в зависимости от выбранных условий, достигаемая степень прививки составляла 14,9-35,9%, а частицы гидроксиапатита уменьшались в размерах по сравнению с первоначальными. Наличие прививки доказано методом ИК-спектроскопии, ТГА- и рентгеновским анализом, а размер частиц исследован методом седиментации в органическом растворителе.
Предложенный процесс прививки гидроксиапатита основан на полимеризационном методе модификации, осуществляемым с помощью микроволнового нагрева системы, характеризуется достаточно высокой температурой (140°С) и продолжительностью (45 мин), достигаемая при этом конверсия мономера не сообщается.
(B. Luo, С. Hsu, J. Yang, C. Zhou. Синтез нано-гидроксиапатита, поверхностно привитого поли-L-лактидом под действием микроволнового излучения. Advanced Materials Reserch Vols. 204-210, 2011, 1929-1933).
Известен способ получения биоразлагаемого высокомодульного композита, состоящего, по крайней мере, из 3-х компонент, фибриллярного наполнителя, привитого на него биоразлагаемого полимера и одноименного, предварительно полученного полимера (полилактида) большой молекулярной массы. Образование привитого полимера катализируется специально вводимым катализатором или реакционными функциональными группами, имеющимися на поверхности фибрилл наполнителя. В качестве катализаторов предложен широкий перечень кислых и основных реагентов, включающий соединения 4-х валентного титана и олова, сульфоновую и серную кислоты, амины, алкоголяты калия или натрия, а также органические основания, цеолиты, индивидуальные или смешанные оксиды металлов (магния и алюминия). Полимерная составляющая - 35% лактида и 65% полилактида, фибриллярный наполнитель - преимущественно очищенная целлюлоза (характеристическое отношение L/D=45), предпочтительная каталитическая группа - октоат олова, трифенилфосфин, изопропоксид титана.
Подчеркивается, что чрезвычайно важным фактором для образования высокомодульного композита является наличие прочной и надежной связи между фибриллами наполнителя и высокомолекулярной полимерной матрицей. Посредником между этими составляющими является привитой, относительно низкомолекулярный полимер, одноименного состава с матрицей. Полезную роль в создании этой связи выполняют также катализаторы, способные к трансэтерификации. Смешение осуществлялось в обычных реакторах промышленного типа или экструдерах, полимеризация при температурах 25-400°С.
Недостатком указанного способа получения биоразлагаемого композита является многокомпонентность, обязательное наличие фибриллярного наполнителя, трудно поддающегося биоразложению и подвергаемого для этого модификации (целлюлоза), гомополимера лактида, приготавливаемого заранее и катализаторов полимеризации.
(Пат. США №8569428. 29.10.2013).
Известны многочисленные примеры модификации поверхности гидроксиапатита агентами, повышающими сродство гидрофобного эфира к гидрофильному наполнителю. Указанные агенты не являются химическими аналогами полиэфира, а лишь выполняют роль посредников между наполнителем и матрицей, улучшающих их совместимость. Посредники не только увеличивают число поверхностно-активных групп наполнителя, но в некоторых случаях активируют их и придают им каталитическую функцию, что позволяет проводить последующее полимеризационное наполнение композита без участия традиционных оловоорганических катализаторов. Следующие примеры иллюстрируют данную тенденцию.
Поверхностная модификация гидроксиапатита додециловым спиртом, проводимая простым гидротермальным нагревом системы, резко увеличивает стабильность его дисперсий в этиловом спирте. Указанный прием достаточно нагляден, но не гарантирует свою полезность при создании биоразлагаемого композита.
(L. Borum-Nicolas, O.C. Wilson Jr. Biomaterials, 24, 2003, 3671-3679).
Способ модификации цинксодержащего гидроксиапатита винной кислотой, проводимый в растворе тетрагидрофурана. Наличие прививки доказано методами ИК- и ЯМР-спектроскопии, которая составляла, в зависимости от соотношения кислота/ГАП 4,8-14,7%.
Недостатком указанной модификации является использование тетрагидрофурана, необходимость применения каталитически активного (цинксодержащего) гидроксиапатита и возможность появления сшитых структур вследствие 4-х функциональности винной кислоты.
(Thouraya Turki, Masseoud Othmani, Christophe Goze Вас, Ferid Rachdi, Khaled Bouzouita. Surface modification of zinc-containing hydroxyapatite by tartaric acid. Applied Surface Science, 284, (2013). 66-71).
Способ модификации гидроксиапатита лимонной кислотой. Модификацию проводили в растворе диметилформамида при 150°С, 11 час, путем медленного введения раствора кислоты в суспендированную дисперсию гидроксиапатита, подвергаемому перемешиванию и ультразвуковой обработке. Последующее компаундирование модификата с полилактидом (или сополимером с гликолидом), осуществляемое через раствор, показало 20%-ое улучшение механических свойств композита при содержании наполнителя в количестве 3%.
Недостатком способа является применение диметилформамида, высокая температура процесса, длительность и применение ультразвуковой обработки композита.
(Effect of new surface-grafting method for nano-hidroxiapatite on the dispersion and mechanical enhancement for poly(lactide-co-glycolide).
L.X Jiang, L.Y. Jiang, L.J, Xu, C.T. Han, C.D. Xiong.
eXPRESS Poymer Letters Vol. 8, №2 (2014) 133-141).
В последнее время все чаще в патентной и научной литературе появляются сообщения, в которых для создания биоразлагаемых кальцийфосфатсодержащих композитов используются азотсодержащие соединения, которые не только выполняют роль посредников между наполнителем и полимерной матрицей, но и являются достаточно активными безметальными катализаторами полимеризации лактонов и поликонденсации оксикислот. Среди таких соединений можно выделить алифатические амины, имины, аминокислоты, производные гуанидина, хитозан и т.д. Следующие примеры иллюстрируют данную тенденцию.
Предложен нано-гидроксиапатит, модифицированный L-лизином и полилактидный композит его содержащий. Модификацию проводили в диметилформамиде при температуре 150°С в течение 9 часов. Полимеризационное наполнение осуществляли лактидом при 140°С в течение 20 часов. Композит, содержащий 10 и 20% отмытого модификата, показал существенное возрастание прочности на изгиб и растяжение по сравнению с ненаполненным материалом (около 20%). Испытания in vitro продемонстрировали улучшенную биосовместимость.
Недостатком указанного предложения, как и в цитированных выше, является применение высококипящего растворителя, высокая температура модификации и длительность процесса.
(Effect of L-lysine-assisted surface grafting for nano-hydroxyapatite on mechanical properties and in vitro bioactivity of poly(lactic acide-co-glycolic acid.
Jiang Liuyun, Jiang Lixin, Xiong Chengdong, Xu Lijuan, Li Ye. Journal of Biomaterials Appications 0(0) 1-9 2015).
В работах китайских авторов активно разрабатывается креатинин (производное гуанидина) в качестве катализатора конденсации молочной кислоты и полимеризации лактида. Показано, что при относительно небольшом содержании указанного соединения (0,1% к мономеру) с помощью двухстадийного процесса (расплавная конденсация и твердофазная деполимеризация) возможно получение высокомолекулярного неокрашенного полимера (Mw=120000), сохраняющего высокую изотактичность (на уровне 98%), что в свою очередь ведет к повышению его термостойкости. Первая, поликонденсационная стадия, несомненно повышает сродство получаемого полимера к гидроксиапатиту с помощью добавки креатинина, однако о последующем создании фосфатсодержащего композита в данном варианте не сообщается.
(Isotactic polycondensation of L-lactic acid with biogenic creatinine. Wei Jiang, Wei Huang, Na Cheng, Yundiao, Xupeng Zong, Hong Li, Quanxing Zhang. Polymer 53 (2012) 5476-5479.
(Syntesis of high molecular weight poly(L-lactic acid) and poly(D-lactic acid) with improved thermal stability via melt/solid polycondensation catalyzed biogenic creatinine. Polymer 55 (2014) 1491-1496).
Среди посредников полимерного типа, улучшающих совместимость, выделяется хитозан, которым модифицируют и гидроксипатит и полиэфир. На основе получаемых модификатов создаются 3-х компонентные аминосодержащие биоразлагаемые композиты. Помимо посреднической функции хитозан может сообщать и ряд других полезных свойств композиту, а именно, ранозаживления, катализатора полимеризации лактонов, дополнительного (совместно с гидроксиапатитом) усиливающего активного наполнителя, пластификатора и т.д. Следующие примеры иллюстрируют сказанное.
Наиболее показательна в этом плане работа китайских авторов, в которой предложен 3-х компонентный биоразлагаемый композит, где в качестве промежуточного слоя между гидроксиапатитом и полилактидом внедрен хитозан. Способ состоит из нескольких стадий:
- первоначальное in situ соосаждение гидроксиапатита совместно с хитозаном путем медленного введения фосфорной кислоты в дисперсию гидроокиси кальция, суспендированную в растворе хитозана,
- очистка и осушка системы,
- прививка полученного порошка молочной кислотой,
- повторная очистка и осушка системы,
- растворное наполнение модифицированного порошка готовым полилактидом.
При высокой степени наполнения (60% и 67%) авторам удалось продемонстрировать реальное повышение физико-механических свойств композита и существенно улучшить его поведение in vitro.
Предложенный способ, так же, как и ранее рассмотренные, характеризуется 2-х стадийной поверхностной модификацией гидроксиапатита через хитозан и неизбежной при этом многостадийностью процесса.
(Fabrication and in Vitro Investigation of Nanohidroxyapatite, Chitosan, Poly(L-lactic acid) Ternary Biocomposite. C.Y. Zhang. C.L. Zhang. J.F. Wang, C.H. Lu, Z. Zhuang, X.P. Wang, Q.F. Fang. J. Appl. Polymer. Sci. 2013, DOI: 10.1002/APP. 37795.).
В работе японских авторов предложен способ получения композита, содержащего пористый гидроксиапатит и сополимер лактида с гликолидом. Исходные пористые таблетки гидроксиапатита, диаметром 2 мм, размером пор 20 ммк и степенью пористости около 40% заполнялись смесью лактида и гликолида, содержащей 2% энзима липазы ММ в качестве катализатора полимеризации. Полимеризация проводилась при температуре 100°С в течение 9 дней, по истечении которых поры гидроксиапатита оказывались полностью заполненными полимером. Прочностные характеристики при этом составили 90-54 МПа сопротивления изгибу и 1,3-0,57 МПа и1/2 сопротивления разлому, что близко к значениям кортикальной кости человека. Способ позволяет получать монолитный композит с высоким содержанием непрерывной фазы наполнителя, но также характеризуется многостадийностью и длительностью процесса получения (9 дней).
(In situ preparation of poly(L-lactic acid-co-glycolic acid)|hydroxyapatite composites as artificial bone materials. Y. Takeoka, M. Hayasyi, N. Sugiyama, M. Yoshizawa-Fujta, M. Aizawa and M. Rikukawa. Polymer Journal, (2015), 47, 164-170).
Известен метод, предложенный Российскими авторами твердофазной «сухой» сополимеризации хитозана и лактида, который осуществили пропуском смеси твердых компонент через 2-х шнековый экструдер при температуре ниже точки плавления лактида 90-120°С. Под действием интенсивного механического воздействия и возникающих при этом механохимических реакций получен амфифильный сополимер хитозана и лактида, который привит на боковые аминогруппы хитозана в количестве от 3 до 10 звеньев. Амфифильность полученного сополимера использована для стабилизации микросфер в системе вода-масло.
Достоинством метода является демонстрация возможности использования механохимических реакций в отсутствии каких либо растворителей для связывания компонент, широко используемых в создании биоразлагаемых композитов, однако о реализации указанной возможности с использованием гидроксиапатита не сообщается.
(Polylactide-based microspheres prepared using-state copolymerized chitosan and d,l-lactide. T.S. Demina, T.A. Akopova, L.V. Vladimirov, A.N. Zelenetskii, E.A. Markvicheva, Ch. Grandfils. Materials Science Engineering С 59, (2016), 333-338).
Французскими авторами аналогичный сополимер получен 2-х вариантным «мокрым» способом. Первый - путем непосредственной поликонденсации молочной кислоты в водно-кислотном растворе хитозана. Реакция катализирована р-толуолсульфокислотой и осуществлена при температуре 80°С в течение 24 часов. Второй вариант - методом раскрытия кольца лактида также в предварительно полученном водно-кислотном растворе хитозана. Реакция катализирована триэтаноламином и проведена при температуре 80°С в течение 24 часов. О выходе обоих типов сополимеров не сообщается, однако ориентировочная степень прививки в обоих вариантах оценена в 46-47%. Оба варианта свидетельствуют в пользу того, что прививка лактида на хитозан возможна и в водной среде.
Недостаток метода состоит в том, что он отражает только возможность получения посредника - сополимера хитозана и полимолочной кислоты (или полилактида) и не затрагивает возможность дальнейшего синтеза фосфатсодержащего композита.
(Different Pla Grafting Techniques on Chitosan. N.E. Suyatma, A. Copinet, E. Legin-Copinet, F. Fricoteax, V. Coma. J. Polym Environ. (2011), 19:166-171).
Известен метод получения хитозана, модифицированного полимолочной кислотой. Модификацию осуществляли через промежуточную вставку 4,4-диизоцианатдифенилметана, вставляемую в полимолочную кислоту и сшивающую ее гидроксильные концевые группы, после чего проводили сшивку концевых карбоксильных групп с помощью хитозана. Степень прививки предлагаемым методом может быть очень высокой, достигающей 30-кратного избытка хитозана по отношению к молочной кислоте.
Недостаток метода аналогичен варианту, цитированному выше.
(Method for preparing chitosan С grafting polylactic acid. CN 101003632 (A) - 2007-07-25).
Наиболее близким техническим решением по отношению к заявляемому является китайский патент CN №102940908 (А) (Absorbable interference screw for repairing interior and posterior cruciate ligaments and preparation method of screw) от 2013-02-27, который принят в качестве прототипа. В указанном прототипе предложен двухстадийный способ получения биоразлагаемого композита и крепежных винтов на его основе, представляющего собой смесь полилактида и предварительно модифицированного олигомером молочной кислоты гидроксиапатита. Предложенный способ состоял из следующих операций:
- на первой стадии получали смешанный раствор олигомера молочной кислоты и ГАП путем смешения ацетонового раствора олигомера и водного золя ГАП. Массовое соотношение олигомера молочной кислоты и ацетона в интервале 1:3(10), олигомера молочной кислоты и ГАП - 1(10):1.
- полученный раствор далее разбавляли водой при перемешивании до соотношения вода : ацетон в пределах 1,5(3):1, фильтровали выпавший осадок и сушили, получая сухой смешанный материал. Для улучшения фильтруемости предпочтительно вызревание смеси в течение 4-24 час.
- после осушки смешанный материал обрабатывался смесью ксилола и ацетона (объемное соотношение 1:1(5), в интервале температур 130-140°С, в течение 24-36 часов. Цель обработки - повышение степени поверхностной прививки ГАП и реализация зернистой структуры модифицируемого материала.
- удаление ксилола центрифугированием с последующей обработкой несколько раз хлороформом и сушкой приводила к искомому продукту, модифицированному ГАП, поверхностно-привитому олигомером молочной кислоты.
Дальнейшие операции включали смешение полученного материала с различными биоразлагаемыми полимерами с варьируемой молекулярной массой в пределах 40000-200000 и характеристической вязкостью в пределах 1-2,5 дл/г. Смешение производили в экструдере с получением прутка при температуре 120-230°. Предпочтительный диаметр прутка 9-14 мм, получение из него винтов 7-12 мм (метрическая резьба М7, М8, М10, M12). Нарезание резьбы производилось с применением охлаждающей жидкости.
Улучшенный вариант модификации ГАП включал применение ультразвука на стадии смешения ацетонового раствора полимолочной кислоты и водного золя ГАП с целью улучшения полноты смешения и однородности раствора. Время облучения 15-30 мин.
Как видно из приведенного описания, в данном патенте реализован метод формирования композита, использующий золь-гель переход системы, который позволяет гибко регулировать размер возникающих частиц. Однако достигается это только применением комбинированных растворителей определенного состава (в данном случае это смесь вода-ацетон), причем возникающая при этом степень прививки не достаточна и вводится дополнительная операция со сменой комбинированного растворителя (ксилол-ацетон) и длительным временем выдерживания системы (24-36 часов) при высокой температуре 130-140°С.
Таким образом, предложенный способ получения композита характеризуется применением смеси органических растворителей, по крайней мере, на стадии модификации, необходимостью их последующего удаления и разделения, длительностью процесса и требует относительно высоких температур для реализации.
Из приведенного обзора уровня техники, отражающего суть заявляемого объекта, можно выделить следующую основную тенденцию, а именно, сближение сродства практически несовместимых компонент композита, минерального фосфатного наполнителя и органической полиэфирной матрицы. Наиболее действенным способом указанного сближения признается создание ковалентных связей между ними. Предложено достаточно большое разнообразие вариантов создания композитов, с помощью которых удается получить не только более тонкое распределение частиц наполнителя в полимерной матрице, но и химическое связывание их, что в свою очередь улучшает физико-механические характеристики композита в целом. Суммируя основные приемы, применяемые объекты и выбираемые условия, можно констатировать что:
- создание химических связей осуществляется преимущественно с помощью функциональных групп наполнителя, имеющихся изначально или создающихся специально путем различных химических превращений,
- полимерная матрица поставляется в виде готового полимера или создается по ходу синтеза композита высокотемпературной катализированной полимеризацией лактонов или поликонденсацией оксикислот,
- совмещение компонент композита осуществляется в большинстве случаев через раствор, реже через расплав полимерной матрицы или комбинированием обоих приемов.
Таким образом, большинство выявленных способов получения композитов, аналогов заявляемого, характеризуются применением органических растворителей и необходимостью их последующего тщательного удаления, достаточно высокой температурой катализированного синтеза полимерной матрицы, многостадийностью и длительностью проведения отдельных операций.
Раскрытие изобретения
Техническим результатом заявленного изобретения является исключение использования органического растворителя при сниженной (по сравнению с однотипными реакциями)температуре проведения способа, уменьшении времени проведения синтеза с использованием однотипного простого оборудования для любых составов компонент.
Технический результат достигается тем, что предложен способ получения биоразлагаемого композита для использования в качестве аналога костной ткани, характеризующийся тем, что гидроксиапатит и полилактид подвергают совместной механохимической обработке путем диспергирования при температуре 20-40°C, в интервале 3000-7000 об/мин диспергатора, при следующем исходном соотношении гидроксиапатит/полилактид % вес: 20-80/90-10.
Изобретение поясняется чертежами:
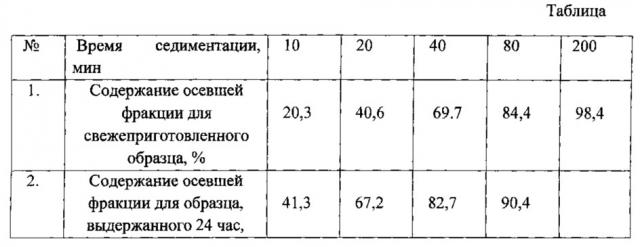
Фиг. 1 Фотографии исходного промышленного полилактида в гранулах (левая верхняя чашка) и продуктов совместного его диспергирования с гидроксиапатитом, разделенных с помощью сита (0,25 мм) где: Первая мелкая фракция (нижняя правая чашка), вторая, более крупная (нижняя левая чашка), изношенные гранулы исходного полимера (верхняя правая чашка).
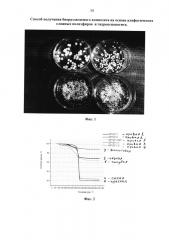
Фиг. 2 ТГА-кривые фракций композита, полученного «сухим» методом из гидроксиапатита и промышленного полилактида при их совместном диспергировании, (кривые обозначены в тексте).
Фиг. 3 ИК-спектры образцов, полученных при «сухой» модификации гидроксиапатита высокомолекулярным полил актидом: фракция диспергированного продукта, прошедшего через сито 0.25 мм (красный); после последующей пятикратной отмывки в хлористом метилене, центрифугирования и сушки (зеленый); индивидуальный гидроксиапатит (синий).
Фиг. 4 ИК-спектр не осаждаемой в центрифуге фракции, выделенной после обработки гидроксиапатита, модифицированного высокомолекулярным полилактидом, хлористым метиленом (фиолетовая кривая). На этом же фигуре приведен ИК-спектр исходного высокомолекулярного полилактида (красная кривая).
Фиг. 5 ТГА-кривая образца модификата гидроксиапатита, полученного «сухим» методом с помощью молочной кислоты (первая часть).
Фиг. 6 ИК-спектры конденсатов молочной кислоты, полученных «сухой» конденсацией на гидроксиапатите в одну и две стадии: порционное введение молочной кислоты, чередуемое с диспергированием (первая стадия, синяя кривая 2), порционная доконденсация образца, полученного на первой стадии, с последующей промывкой его в хлористом метилене, центрифугированием и сушкой (вторая стадия, красная кривая 3); индивидуальный гидроксиапатит (коричневая кривая 1).
Фиг. 7 ИК-спектр конденсата молочной кислоты, полученного при порционном введении гидроксиапатита в кислоту (синяя кривая 1); конденсат, полученный термически в отсутствие катализатора (красная кривая 2).
Фиг. 8 ИК-спектр образца, полученного «сухой» механически активированной полимеризацией лактида в присутствии гидроксиапатита с последующей термообработкой при 150°С и отмывкой хлористым метиленом где:
гидроксиапатит, модифицированный полилактидом (бирюзовая кривая 2);
индивидуальный гидроксиапатит (красная кривая 1).
Фиг. 9 Кривые ТГА продукта где: черная кривая 2 полученного «сухой» модификацией гидроксиапатита винной мезо-кислотой; красная кривая 1 полученного «мокрой» модификацией гидроксиапатита винной мезо-кислотой.
Фиг. 10 ТГА-кривая продукта, полученного «мокрой» модификацией гидроксиапатита лимонной кислотой.
Фиг. 11 ИК-спектр поликонденсата лимонной кислоты, полученного «мокрым» способом на гидроксиапатите (синяя кривая 2); индивидуальный гидроксиапатит (красная кривая 1).
Фиг. 12 ИК-спектр поликонденсата лимонной кислоты в диапазоне 520-950 см-1, полученного «мокрым» способом на гидроксиапатите (синяя кривая 2); индивидуальный гидроксиапатит (красная кривая 1).
В таблице приведена кинетика оседания в воде гидроксиапатита, модифицированного лимонной кислотой «сухим» методом.
Осуществление изобретения
Заявляемый способ получения биоразлагаемого композита основан на двух принципах, не выявленных в патентной и научной литературе применительно к заявляемому объекту. Первый основан на полном отказе от каких либо органических растворителей при синтезе композита и который квалифицируется нами как «сухой». Второй основан на использовании интенсивного механического воздействия на совмещаемые компоненты, провоцируя механохимические реакции между ними. Оба принципа объединены и могут работать одновременно.
Отличительными признаками «сухого» метода являются:
- обязательное использование сухих фосфатов кальция в порошкообразном состоянии различной степени дисперсности, задаваемой его предшествующим синтезом,
- модифицирующий органический биоразлагаемый компонент может быть твердым (полилактид, полигликолид или их сополимеры высокой молекулярной массы 100000-200000), хрупким (относительно низкой молекулярной массы, предпочтительно 5000-10000), жидким олигомером (ММ=1000-3000), кристаллическим (гликолид, лактид) или жидким лактоном ((ε-капролактон). Таким образом, охватывается практически весь диапазон молекулярных масс полимерной сос