Фармацевтические композиции на основе 9-бутиламино-3,3-диметил-3,4-дигидроакридин-1(2н)-она гидрохлорида для коррекции когнитивных и неврологических нарушений
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к фармацевтической композиции для коррекции когнитивных и неврологических нарушений, вызванных острыми повреждениями мозгового кровообращения, содержащей 9-бутиламино-3,3-диметил-3,4-дигидроакридин-1(2Н)-она гидрохлорида и фармацевтически приемлемый носитель. Предлагаемая фармацевтическая композиция является эффективной при корректировании когнитивных и неврологических нарушений, вызванных острыми повреждениями мозгового кровообращения, в частности инсультом, а также обладает низкой токсичностью. 6 з.п. ф-лы, 4 табл., 14 пр.
Реферат
Изобретение относится к области медицины и фармакологии и основано на применении 9-бутиламино-3,3-диметил-3,4-дигидроакридин-1(2Н)-она гидрохлорида в качестве самостоятельного или комбинированного терапевтического средства для коррекции когнитивных и неврологических нарушений.
9-бутиламино-3,3-Диметил-3,4-дигидроакридин-1(2Н)-она гидрохлорид
Поиск средств коррекции когнитивных и неврологических нарушений остается одной из наиболее актуальных проблем современной медицины. Важность этой проблемы обусловлена большой значимостью когнитивных и неврологических функций в процессах жизнедеятельности организма человека и тем, что их нарушение может привести к драматическим последствиям. Частота когнитивных нарушений возрастает в пожилом возрасте. По статистике от 3 до 20% лиц старше 65 лет имеют лые когнитивные нарушения в виде деменции.
Современная тенденция к увеличению продолжительности жизни и соответственно к возрастанию доли пожилых лиц в популяции, естественно увеличивает частоту рассматриваемых патологий.
Необходимо отметить, что такие нарушения могут быть вызваны не только факторами, связанными со старением организма, но и быть следствием повреждения головного мозга в результате нарушений мозгового кровообращения, например инсультов или травм. Значительное число инсультов заканчивается серьезными последствиями, в частности нарушениями памяти, речи и двигательных функций. В год в России регистрируется 450000 инсультов, из них больше 200000 требуют реабилитации.
Следует особо отметить, что в настоящее время отсутствуют достаточно эффективные средства для коррекции когнитивных и неврологических нарушений. Большинство средств лишь облегчает состояние больных и не всегда приводят к восстановлению.
Известны психотропные, антиамнестические и липидрегулирующие свойства производных 9-аминоакридина (патент РФ №2024509).
Известны антиамнестические свойства 9-бутиламино-3,3-Диметил-3,4-дигидроакридин-1(2Н)-она гидрохлорида (ж. Экспериментальная и клиническая фармакология, год изд. 2013, №11, с. 3-6, статья «Антиамнестическое действие веществ с ноотропной активностью у крыс», авт. Яснецов В.В., Крылова И.Н.)
Известны фармацевтические композиции, содержащие 9-бутиламино-3,3-Диметил-3,4-дигидроакридин-1(2Н)-она гидрохлорида и обладающие ноотропной и антихолестеразной активностью (патенты UA 93755, UA 46077).
Применение 9-бутиламино-3,3-Диметил-3,4-дигидроакридин-1(2Н)-она гидрохлорида для корректирования когнитивных и неврологических нарушений в известном уровне техники отсутствует.
Проводимые исследования впервые обнаружили, что 9-бутиламино-3,3-Диметил-3,4-дигидроакридин-1(2Н)-она гидрохлорид способен корректировать когнитивные и неврологические нарушения, наблюдаемые при различных патологических состояниях.
Задача, решаемая предлагаемым изобретением, - создание эффективной фармацевтической композиции для коррекции когнитивных и неврологических нарушений на основе 9-бутиламино-3,3-Диметил-3,4-дигидроакридин-1(2Н)-она гидрохлорида, в виде различных лекарственных форм.
Технический результат от использования предлагаемого изобретения заключается в создании фармацевтической композиции, обладающей высокой эффективностью при корректировании когнитивных и неврологических нарушений.
Указанный технический результат достигается предлагаемой фармацевтической композицией, содержащей 9-бутиламино-3,3-диметил-3,4-дигидроакридин-1(2Н)-она гидрохлорид и фармацевтически приемлемый носитель.
Предпочтительно, что предлагаемая фармацевтическая композиция содержит от 0,1 до 1,0 мас. % 9-бутиламино-3,3-диметил-3,4-дигидроакридин-1(2Н)-она гидрохлорида и фармацевтически приемлемый носитель, позволяющий выполнить ее в форме раствора для инъекций, содержащий стабилизатор и наполнитель.
Предпочтительно, что предлагаемая фармацевтическая композиция содержит от 1,0 до 10,0 мас. % 9-бутиламино-3,3-диметил-3,4-дигидроакридин-1(2Н)-она гидрохлорида (далее соединение I) и фармацевтически приемлемый носитель, позволяющий выполнить ее в форме таблетки, или гранулы, или пеллеты, содержащий связующее, дезинтегратор, лубрикант, наполнитель.
Предпочтительно, что предлагаемая фармацевтическая композиция выполненная в виде таблеток, или гранул, или пеллет, покрыта оболочкой на основе целлюлозных производных, или повидонов, или цетилового спирта, или акрилатов.
Предпочтительно, что масса оболочки по отношению к массе ядра составляет не менее 1,0 мас. %.
Предпочтительно, что некоторое количество пеллет или гранул может быть помещено в фармацевтически приемлемую твердую капсулу для перорального введения.
Предпочтительно, что капсула заполнена пеллетами или гранулами в таком количестве, что содержание в них действующего вещества эквивалентно терапевтической дозе.
Предположительно фармакологическое действие соединения I основано на его способности оказывать комплексное воздействие на структуры головного мозга, которое приводит к торможению патологических процессов. Во-первых, это способность избирательно модулировать калиевые каналы, приводящее к стабилизации мембранного потенциала и снижению возбудимости нейронов. С другой стороны, соединение I способно уменьшать микровязкость мембран, активируя мембраносвязанные процессы и пролонгируя продолжительность жизни нейрона.
Технический результат, достигаемый предлагаемой композицией, обусловлен новыми свойствами соединения I, обнаруженными при проведении доклинических исследований.
Соотношение компонентов в предлагаемой композиции подобрано экспериментальным путем и является оптимальным, что позволяет получить технический результат соответствующий поставленной задаче.
Способ получения предлагаемой композиции в виде раствора.
Предлагаемую лекарственную форму в виде раствора для инъекций получают путем постепенного растворения компонентов в воде для инъекций с последующей фильтрацией и расфасовкой полученного раствора.
Примеры конкретного получения предлагаемого раствора.
Пример 1. Раствор для инъекций 0,1%.
К 400 мл воды для инъекций добавляют 0,1 г динатрия эдетата и перемешивают. К полученному раствору добавляют 1,0 г соединения I и перемешивают до получения прозрачного раствора. Раствор переносят в мерную колбу вместимостью 1 л и доводят объем раствора до 1 л водой для инъекций. Полученный раствор фильтруют, расфасовывают в стерильные флаконы вместимостью 1 мл и стерилизуют. Полученный раствор соответствует требованиям Госфармакопей XI и XII изд.
Пример 2. Раствор для инъекций 0,5%
К 400 мл воды для инъекций добавляют 0,5 г динатрия эдетата и перемешивают. К полученному раствору добавляют 5,0 г соединения I и перемешивают до получения прозрачного раствора. Раствор переносят в мерную колбу вместимостью 1 л и доводят объем раствора до 1 л водой для инъекций. Полученный раствор фильтруют, расфасовывают в стерильные флаконы вместимостью 1 мл и стерилизуют. Полученный раствор соответствует требованиям Госфармакопей XI и XII изд.
Пример 3. Раствор для инъекций 1,0%
К 400 мл воды для инъекций добавляют 1,0 г динатрия эдетата и перемешивают. К полученному раствору добавляют 10,0 г соединения I и перемешивают до получения прозрачного раствора. Раствор переносят в мерную колбу вместимостью 1 л и доводят объем расвора до 1 л водой для инъекций. Полученный раствор фильтруют, расфасовывают в стерильные флаконы вместимостью 1 мл и стерилизуют. Полученный раствор соответствует требованиям Госфармакопей XI и XII изд.
Способ получения предлагаемой композиции в виде таблеток.
К расчетному количеству соединения I добавляют фармацевтически приемлемый наполнитель и дезинтегратор, перемешивают, вводят в смесь скользящее и лубриканты и вновь перемешивают. Полученную массу таблетируют методом прямого прессования. На таблетки может быть нанесена желудочно-растворимая оболочка, составляющая не менее 1,0 мас. % от массы таблетки.
Способ получения предлагаемой композиции в виде гранул или пеллет.
К расчетному количеству соединения I добавляют фармацевтически приемлемый наполнитель и дезинтегратор, перемешивают, вводят в смесь скользящее и лубриканты и вновь перемешивают. Из полученной массы получают пеллеты или гранулы. На пеллеты или гранулы может быть нанесена желудочно-растворимая оболочка, составляющая не менее 1,0 мас. % от массы пеллеты или гранулы.
Полученные пеллеты или гранулы могут быть помещены в желудочно-растворимые твердые капсулы, например выполненные из желатина, в таком количестве, что содержание в них действующих веществ эквивалентно терапевтической дозе.
В описанных способах получения предлагаемой композиции в форме таблетки, или пеллеты, или гранулы использовано соединение I, соответствующее требованиям фармакопеи.
В качестве наполнителя может быть использована, в частности, или смесь микрокристаллической целлюлозы (МКЦ) и крахмала, или смесь лактозы и крахмала, или смесь МКЦ, лактозы и крахмала, или карбонат кальция, или карбонат магния; в качестве лубриканта может быть использована, в частности, или стеариновая кислота, или магния стеарат, или кальция стеарат, или тальк, или кремния диоксид коллоидный, или их смеси; в качестве дезинтегратора может быть использован, в частности, или производные крахмала, или кросповидон; в качестве скользящего может быть использован, в частности, кремния диоксид коллоидный; в качестве желудочно-кишечной оболочки может быть использована оболочка выполненная, в частности, или на основе целлюлозных производных, или повидонов, или цетилового спирта, или акрилатов.
Ниже приведены конкретные примеры изготовления предлагаемой композиции в виде таблеток.
Пример 1
К 1,0 г (1,11%) соединения I добавляют 43,8 г (48,67%) крахмала кукурузного прежелатинизированного, 43,8 г (48,67%) целлюлозы микрокристаллической и перемешивают. К полученной смеси добавляют 0,5 г (0,55%) кремния диоксида коллоидного, 0,3 г (0,33%) магния стеарата, 0,6 г (0,67%) стеариновой кислоты. Смесь тщательно перемешивают и таблетируют. В результате получают таблетку массой 0,09 г с содержанием соединения I 1,11%. Полученные таблетки соответствуют требованиям Госфармакопей XI и XII изд.
Пример 2
К 5,0 г (5%) соединения I добавляют 47,0 г (47,0%) крахмала кукурузного прежелатинизированного, 46,5 г (46,5%) целлюлозы микрокристаллической и перемешивают. К полученной смеси добавляют 0,5 г (0,5%) кремния диоксида коллоидного, 0,3 г (0,3%) магния стеарата, 0,7 г (0,7%) стеариновой кислоты. Смесь тщательно перемешивают и таблетируют. В результате получают таблетку массой 0,1 г с содержанием соединения I 5%. Полученные таблетки соответствуют требованиям Госфармакопей XI и XII изд.
Пример 3
К 20,0 г (10%) соединения I добавляют 88,5 г (44,25%) крахмала кукурузного прежелатинизированного, 88,5 г (44,25%) целлюлозы микрокристаллической и перемешивают. К полученной смеси добавляют 1,0 г (0,5%) кремния диоксида коллоидного, 0,6 г (0,3%) магния стеарата, 1,4 г (0,7%) стеариновой кислоты. Смесь тщательно перемешивают и таблетируют. В результате получают таблетку массой 0,2 г с содержанием соединения I 10%. Полученные таблетки соответствуют требованиям Госфармакопей XI и XII изд.
Пример 4
Осуществляется как пример 1, только таблетку массой 0,09 г покрывают полимерной оболочкой на основе акрилатов. При этом масса оболочки составляет 0,9 мг (1,0%) от массы ядра.
Пример 5
Осуществляется как пример 2, только таблетку массой 0,1 г покрывают полимерной оболочкой на основе целлюлозных производных. При этом масса оболочки составляет 3,6 мг (3,6%) от массы ядра.
Пример 6
Осуществляется как пример 3, только таблетку массой 0,2 г покрывают полимерной оболочкой на основе повидонов. При этом масса оболочки составляет 4,6 мг (2,3%) от массы ядра.
Пример 7
Осуществляется как пример 3, только таблетку массой 0,2 г покрывают полимерной оболочкой на основе цетилового спирта. При этом масса оболочки составляет 4,6 мг (2,3%) от массы ядра.
Ниже приведены конкретные примеры изготовления предлагаемой композиции в виде гранул и пеллет.
Пример 8
К 1,0 г (1,11%) соединения I добавляют 43,8 г (48,67%) крахмала кукурузного прежелатинизированного, 43,8 г (48,67%) целлюлозы микрокристаллической и перемешивают. К полученной смеси добавляют 0,5 г (0,55%) кремния диоксида коллоидного, 0,3 г (0,33%) магния стеарата, 0,6 г (0,67%) стеариновой кислоты. Смесь тщательно перемешивают. Из полученной смеси получают пеллеты или гранулы. Полученные ядра высушивают и калибруют. В результате получают гранулы или пеллеты с содержанием соединения I 1,11%.
Пример 9
К 5,0 г (5%) соединения I добавляют 47,0 г (47,0%) крахмала кукурузного прежелатинизированного, 46,5 г (46,5%) целлюлозы микрокристаллической и перемешивают. К полученной смеси добавляют 0,5 г (0,5%) кремния диоксида коллоидного, 0,3 г (0,3%) магния стеарата, 0,7 г (0,7 %) стеариновой кислоты. Смесь тщательно перемешивают. Из полученной смеси получают пеллеты или гранулы. Полученные ядра высушивают и калибруют. В результате получают гранулы или пеллеты с содержанием соединения 15%.
Пример 10
К 20,0 г (10%) соединения I добавляют 88,5 г (44,25%) крахмала кукурузного прежелатинизированного, 88,5 г (44,25%) целлюлозы микрокристаллической и перемешивают. К полученной смеси добавляют 1,0 г (0,5%) кремния диоксида коллоидного, 0,6 г (0,3%) магния стеарата, 1,4 г (0, 7%) стеариновой кислоты. Смесь тщательно перемешивают. Из полученной смеси получают пеллеты или гранулы. Полученные ядра высушивают и калибруют. В результате получают гранулы или пеллеты с содержанием соединения 110%.
Пример 11
Осуществляется как пример 8, только гранулу или пеллету массой 1,5 мг покрывают полимерной оболочкой на основе акрилатов. При этом масса оболочки составляет 0,15 мг (10,0%) от массы ядра.
Пример 12
Осуществляется как пример 9, только гранулу или пеллету массой 1,5 мг покрывают полимерной оболочкой на основе целлюлозных производных. При этом масса оболочки составляет 0,15 мг (10,0%) от массы ядра.
Пример 13
Осуществляется как пример 10, только гранулу или пеллету массой 1,5 мг покрывают полимерной оболочкой на основе повидонов. При этом масса оболочки составляет 0,15 мг (10,0%) от массы ядра.
Пример 14
Осуществляется как пример 10, только гранулу или пеллету массой 1,5 мг покрывают полимерной оболочкой на основе цетилового спирта. При этом масса оболочки составляет 0,15 мг (10,0%) от массы ядра.
Были проведены исследования по изучению влияния физических факторов, таких как температура и свет на фармацевтические композиции, описанные в примерах 1-14.
После проведения исследований было установлено, что наилучшие условия хранения для таблеток: в сухом месте при температуре не выше 25°С; для капсул: в сухом месте при температуре не выше 20°С.
Испытание на микробиологическую чистоту таблеток и инъекционного раствора проводят в соответствии с требованиями ГФ XI, вып.2, с. 193 и Изменения №3 (категория 2). Полученные результаты соответствуют нормативным требованиям.
С целью изучения эффективности предлагаемой фармацевтической композиции на основе соединения I были проведены ее доклинические испытания на модели геморрагического инсульта мозга.
Исследования проводили на белых беспородных крысах самцах согласно «Руководству по проведению доклинических исследований лекарственных средств», (Воронина Т.А. и соавт. 2012 с использованием сертифицированной методики инсульта, вызванного интрацеребральной посттравматической гематомой (модель геморрагического инсульта, ГИ).
Животные были разделены на несколько групп:
I группа - интактные крысы (n=10);
II группа - ложнооперированные животные (ЛОЖ) (n=10);
III группа - группа животных с ГИ, контроль (n=20);
IV группа - крысы с ГИ, получившие предлагаемую фармацевтическую композицию на основе соединения I в дозе 1,0 мг/кг/7 дней (n=10);
V группа - крысы с ГИ, получившие предлагаемую фармацевтическую композицию на основе соединения I в дозе 2,5 мг/кг/7 дней (n=10).
Динамику развития нарушений, вызванных посттравматической гематомой наблюдали в течение 14 суток после операции с регистрацией показателей поведения на 1-, 7- и 14-е сутки после операции.
Регистрировали гибель животных, неврологический и моторный дефициты, степень изменения когнитивных функций. Гибель животных оценивали на 1- и 7- и 14- сутки после создания геморрагического инсульта.
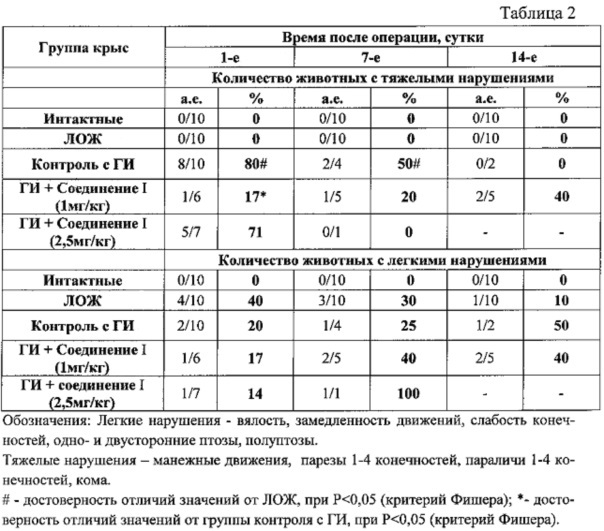
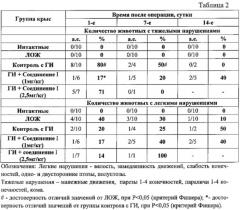
Неврологический дефицит у животных определяли по шкале Stroke-index McGrow в модификации. Отмечали количество крыс с легкой симптоматикой (вялость движений, слабость конечностей, одно- и двусторонний полуптоз/птоз) и с тяжелыми проявлениями неврологических нарушений (манежные движения, парезы 1-4 конечностей, параличи нижних конечностей, боковое положение, кома).
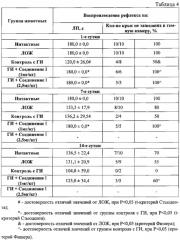
Когнитивные функции исследовали на модели условного рефлекса пассивного избегания (УРПИ) в установке Passive avoidance, Lafauette Instrument Co (США).
Результаты проведенных исследований представлены в таблицах 1-4.
Влияние предлагаемой фармацевтической композиции на основе соединения I в разных дозировках на гибель животных с геморрагическим инсультом.
Полученные результаты свидетельствуют о том, что предлагаемая фармацевтическая композиция на основе соединения I в дозе 1 мг/кг при введении через 3 часа после геморрагического инсульта и далее в течение 6-ти дней достоверно (Р<0,05) уменьшает (на 40%) показатель гибели крыс по сравнению с контролем (крысы с геморрагическим инсультом), в течение 14 суток после ГИ.
Влияние предлагаемой фармацевтической композиции на основе соединения I в различных дозировках на показатели неврологического дефицита у животных с геморрагическим инсультом.
Полученные результаты показывают, что предлагаемая фармацевтическая композиция на основе соединения I в дозе 1 мг/кг в первые сутки после геморрагического инсульта статистически достоверно ослабляют проявления неврологического дефицита (по шкале Stroke-index McGrow).
Влияние предлагаемой фармацевтической композиции на основе соединения I в различных дозировках на развитие моторного дефицита у крыс после ГИ в тесте вращающегося стержня.
Приведенные данные свидетельствуют о том, что предлагаемая фармацевтическая композиция на основе соединения I в дозе 1 мг/кг при введении через 3 часа после инсульта, однократно предотвратило появление моторных нарушений на 100% через 24 часа регистрации показателей в тесте вращающегося стержня Повторное введение композиции (6 дней) снизило выраженность моторного дефицита на 7-е и 14-е сутки, но статистически недостоверно. Предлагаемая фармацевтическая композиция на основе соединения I в дозе в дозе 2,5 мг/кг не оказывала положительного влияния на моторные нарушения.
Влияние предлагаемой фармацевтической композиции на основе соединения I в различных дозировках на воспроизведение УРПИ у крыс с когнитивным дефицитом, вызванным геморрагическим инсультом
Из таблицы видно, что предлагаемая фармацевтическая композиция на основе соединения I в дозах 1 и 2,5 мг/кг корректировало когнитивные нарушения, вызванные ГИ. В дозе 1 мг/кг, антиамнестический эффект наблюдался как через сутки, так и через 7 суток после обучения УРПИ, а в дозе 2,5 мг/кг - через сутки после обучения.
Суммируя вышесказанное можно констатировать, что предлагаемая фармацевтическая композиция на основе соединения I в дозе 1 мг/кг и слабее в дозе 2,5, обладает способностью уменьшать выраженность неврологических и когнитивных нарушений и увеличивать выживаемость животных после геморрагического инсульта. Данные исследования были взяты за основу для определения терапевтической дозы активного вещества.
1. Фармацевтическая композиция для коррекции когнитивных и неврологических нарушений, вызванных острыми нарушениями мозгового кровообращения, содержащая 9-бутиламино-3,3-диметил-3,4-дигидроакридин-1(2Н)-она гидрохлорид и фармацевтически приемлемый носитель.
2. Фармацевтическая композиция по п. 1, содержащая от 0,1 до 1,0 мас. % 9-бутиламино-3,3-диметил-3,4-дигидроакридин-1(2Н)-она гидрохлорида и фармацевтически приемлемый носитель, позволяющий выполнить ее в форме раствора для инъекций, содержащий стабилизатор и наполнитель.
3. Фармацевтическая композиция по п. 1, содержащая от 1,0 до 10,0 мас. % 9-бутиламино-3,3-диметил-3,4-дигидроакридин-1(2Н)-она гидрохлорида и фармацевтически приемлемый носитель, позволяющий выполнить ее в форме таблетки, или гранулы, или пеллеты, содержащий дезинтегратор, скользящее, лубрикант, наполнитель.
4. Фармацевтическая композиция по п. 3, где таблетки, или гранулы, или пеллеты могут быть покрыты желудочно-растворимой оболочкой на основе целлюлозных производных, или повидонов, или цетилового спирта, или акрилатов.
5. Композиция по п. 4, отличающаяся тем, что масса оболочки по отношению к массе ядра составляет не менее 1,0 мас. %.
6. Композиция по пп. 3-5, отличающаяся тем, что некоторое количество пеллет или гранул может быть помещено в желудочно-растворимую фармацевтически приемлемую твердую капсулу для перорального введения.
7. Композиция по п. 6, отличающаяся тем, что капсула может быть заполнена пеллетами или гранулами в таком количестве, что содержание в них действующего вещества эквивалентно терапевтической дозе.