Способы модуляции проводимости устьица и растительные экспрессионные конструкции для их осуществления
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к способу снижения проводимости устьица растения. Также раскрыты способы эффективности использования воды у растения, усиления выносливости растения к засухе, увеличения биомассы, усиления выносливости растения к биотическому стрессу. Изобретение позволяет увеличить урожайность растения даже при ограниченном водоснабжении. 5 н. и 2 з.п. ф-лы, 18 ил., 2 табл., 17 пр.
Реферат
Согласно настоящей заявке испрашивается приоритет по статье 35 U.S.С. § 119(e) в соответствии с предварительной заявкой на выдачу патента США с серийным №61/569251, поданной 11 декабря 2011 г., содержание которой включено в настоящий документ посредством ссылки во всей своей полноте.
Область техники
Настоящее изобретение согласно некоторым его вариантам осуществления относится к способам модуляции проводимости устьица и к растительным экспрессионным конструкциям для их осуществления.
Уровень техники
Устьица - это динамические поры в непроницаемой защитной кутикуле, которая покрывает надземные части сухопутных растений, развившиеся, главным, образом для сохранения воды. Устьице, состоящее из двух замыкающих клеток и поры, которую они окружают, открывается на рассвете для того, чтобы обеспечить поступление атмосферного диоксида углерода (СО2) для фотосинтеза за счет экстенсивной транспирационной потери воды. Устьице закрывается, когда фиксация и использование углерода менее эффективны, для того, чтобы снизить потерю воды в результате транспирации (Assmann, 1993). На механистическом уровне устьице открывается в ответ на повышение осмолярности замыкающих клеток. За этим повышением осмолярности следует движение воды в замыкающие клетки, что увеличивает их объем и открывает устьице (Taiz и Zeiger, 1998). Закрытие устьица происходит противоположным образом; по мере того, как осмолярность замыкающих клеток снижается, их объем уменьшается.
Нехватка воды является серьезной проблемой, которая будет обостряться по причине глобального изменения климата. Абиотические стрессы, особенно засуха и повышенная засоленность, являются основными причинами потери урожая во всем мире. Более того, в настоящее время сельское хозяйство использует свыше 70% (86% в развивающихся странах) доступной пресной воды. Один из подходов, который может быть принят в сельском хозяйстве для сохранения воды, заключается в получении растений, использующих меньше воды и при этом сохраняющих высокую урожайность в условиях нехватки воды. Поскольку растения теряют свыше 95% своей воды путем транспирации через устьица, управление активностью устьица представляет собой многообещающий подход для снижения потребности культур в воде и повышения продуктивности в стрессовых условиях.
Cominelli et al., Transcription. 2010 Jul-Aug; 1(1): 41-45, представляют обзор последних разработок по идентификации регуляторов транскрипции, регулирующих движения устьица и вовлеченных в закрытие устьица.
Дополнительные документы из уровня техники включают в себя:
патентный документ США 7423203, излагающий способ увеличения урожайности растений с помощью экспрессии грибной гексокиназы под действием специфичного для семени промотора;
заявку на выдачу патента США №20090265812, излагающую способ усиления выносливости растения к высокотемпературному стрессу с помощью экспрессии гексокиназы под действием специфичного для пыльцы промотора.
Сущность изобретения
Согласно аспекту некоторых вариантов осуществления настоящее изобретение относится к растительной экспрессионной конструкции, содержащей последовательность нуклеиновой кислоты, кодирующую гексокиназу при транскрипционном регулировании специфичного по отношению к замыкающей клетке действующего в цис-положении регуляторного элемента.
Согласно аспекту некоторых вариантов осуществления настоящее изобретение относится к растительной экспрессионной конструкции, содержащей последовательность нуклеиновой кислоты, кодирующую средство нуклеиновую кислоту для сайленсинга экспрессии гексокиназы, при этом экспрессия средства нуклеиновой кислоты находится под транскрипционным регулированием специфичного по отношению к замыкающей клетке действующего в цис-положении регуляторного элемента.
Согласно некоторым вариантам осуществления настоящего изобретения специфичный по отношению к замыкающей клетке действующий в цис-положении регуляторный элемент является индуцибельным.
Согласно некоторым вариантам осуществления настоящего изобретения специфичный по отношению к замыкающей клетке действующий в цис-положении регуляторный элемент является конститутивным.
Согласно некоторым вариантам осуществления настоящего изобретения специфичный по отношению к замыкающей клетке действующий в цис-положении регуляторный элемент является специфичным по отношению к замыкающей клетке промотором.
Согласно некоторым вариантам осуществления настоящего изобретения, специфичный по отношению к замыкающей клетке промотор является промотором KST1.
Согласно аспекту некоторых вариантов осуществления настоящее изобретение относится к способу регулирования проводимости устьица растения, при этом способ включает модуляцию у растения уровня и/или активности гексокиназы специфичным по отношению к замыкающей клетке образом с регулированием тем самым проводимости растения.
Согласно некоторым вариантам осуществления настоящего изобретения модуляцией является повышающая регуляция.
Согласно некоторым вариантам осуществления настоящего изобретения повышающую регуляцию обеспечивают введением конструкции нуклеиновой кислоты по п. 1 в растение.
Согласно некоторым вариантам осуществления настоящего изобретения модуляцией является понижающая регуляция.
Согласно некоторым вариантам осуществления настоящего изобретения понижающую регуляцию обеспечивают введением в растение средства нуклеиновой кислоты для сайленсинга при транскрипционном регулировании специфичного по отношению к замыкающей клетке действующего в цис-положении регуляторного элемента.
Согласно аспекту некоторых вариантов осуществления настоящее изобретение относится к способу снижения проводимости устьица растения, при этом способ включает введение в клетку конструкции нуклеиновой кислоты растения со снижением тем самым проводимости устьица растения.
Согласно аспекту некоторых вариантов осуществления настоящее изобретение относится к способу увеличения эффективности использования воды растением, при этом способ включает введение в клетку растения конструкции нуклеиновой кислоты с увеличением тем самым эффективности использования воды растением.
Согласно аспекту некоторых вариантов осуществления настоящее изобретение относится к способу увеличения выносливости растения к засухе, засоленности или температурному стрессу, при этом способ включает введение в клетку растения конструкции нуклеиновой кислоты с увеличением тем самым выносливости растения к засухе, засоленности или температурному стрессу.
Согласно аспекту некоторых вариантов осуществления настоящее изобретение относится к способу увеличения биомассы, мощности или урожайности растения, при этом способ включает введение в клетку растения конструкции нуклеиновой кислоты с увеличением тем самым биомассы, мощности или урожайности растения.
Согласно аспекту некоторых вариантов осуществления настоящее изобретение относится к способу усиления выносливости растения к биотическому стрессу, при этом способ включает введение в клетку растения конструкции нуклеиновой кислоты с усилением тем самым выносливости растения к биотическому стрессу.
Согласно аспекту некоторых вариантов осуществления настоящее изобретение относится к трансгенному растению или к его части, содержащей растительную экспрессионную конструкцию.
Согласно аспекту некоторых вариантов осуществления настоящее изобретение относится к выделенной растительной клетке или культуре растительных клеток, содержащей растительную экспрессионную конструкцию.
Согласно некоторым вариантам осуществления настоящего изобретения частью трансгенного растения является семя.
Согласно некоторым вариантам осуществления настоящего изобретения частью трансгенного растения является лист.
Согласно некоторым вариантам осуществления настоящего изобретения семенем является гибридное семя.
Согласно некоторым вариантам осуществления настоящего изобретения способ дополнительно включает выращивание растения в условиях дефицита воды.
Согласно некоторым вариантам осуществления настоящего изобретения, способ дополнительно включает выращивание растения при засоленности.
Если не указано иное, все технические и/или научные термины, используемые в настоящем документе, имеют те же значения, что обычно подразумеваются специалистом в области, к которой относится настоящее изобретение. Хотя при осуществлении или тестировании вариантов осуществления настоящего изобретения могут быть использованы способы и материалы, подобные или эквивалентные описанным в настоящем документе, ниже описываются иллюстративные способы и/или материалы. В случае конфликта контролем будет служить описание настоящего изобретения, в том числе определения. Кроме того, материалы, способы и примеры являются исключительно иллюстративными и не предназначены в обязательном порядке быть ограничивающими.
Краткое описание чертежей
Некоторые варианты осуществления настоящего изобретения описываются в настоящем документе исключительно в качестве примера со ссылкой на прилагаемые графические материалы. Далее следует конкретная ссылка на графические материалы в подробностях, следует подчеркнуть, что детали показаны в качестве примера и с целью иллюстративного рассмотрения вариантов осуществления настоящего изобретения. В связи с этим, описание вместе с графическими материалами для специалистов в данной области делает очевидной реализацию вариантов осуществления настоящего изобретения.
В графических материалах:
На фиг. 1А-С изображены графики, показывающие, что сахароза стимулирует закрытие устьица посредством гексокиназы. На фиг. 1А представлены репрезентативные, полученные с помощью световой микроскопии изображения устьица, взятого из эпидермальных отпечатков через 3 часа после обработки 100 мМ сорбитом или 100 мМ сахарозой (белая полоска = 20 мкм). На В представлена реакция устьица на сахарозу у дикого типа (WT) и у растений, экспрессирующих AtHXK1 (НК4), оценивали на интактных листьях, погруженных на 3 часа в искусственный апопластический сок (Wilkinson и Davies, 1997), содержащий 100 мМ сорбита (в качестве осмотического контроля), 100 мМ сахарозы или 100 мМ сахарозы вместе с 20 мМ ингибитора гексокиназы N-ацетилглюкозамина (NAG). Затем брали эпидермальные отпечатки и измеряли щель устьица. На С представлены реакции устьица у растений WT на различные комбинации Сахаров, которые оценивали, как описано в фиг. 1В с 200 мМ маннитом, служащим в качестве дополнительного осмотического контроля. Данные, показанные на фиг. 1 В, С представляют собой среднее значение 300 устьиц из шести независимых биологических повторов ± SE. Различные буквы обозначают значимое различие (t-критерий, Ρ<0,05).
На фиг. 2A-D показано, что повышенная экспрессия гексокиназы усиливает закрытие устьица и снижает транспирацию. Щель устьица (фиг. 2А) и проводимость устьица (фиг. 2В) определяли для контрольных (WT) и трансгенных растений, экспрессирующих различные уровни AtHXK1 (НК38>НК4>НК37) (Dai et al., 1999). Данные по щели представляют собой среднее значение 200 устьиц из четырех независимых повторов ± SE. Данные проводимости устьица представляют собой среднее значение шести независимых повторов ± SE. Различные буквы обозначают значимое различие (t-критерий, Ρ<0,05). На фиг. 2С показано, как скорость транспирации, нормализованную на общую площадь листьев отслеживали одновременно и непрерывно на протяжении суток, и данные представлены как среднее значение ± SE для каждой 10-й точки забора образцов (n=6). На фиг. 2D показано, что отрицательную корреляцию наблюдали между относительной суточной транспирацией всего растения и относительной активностью гексокиназного фосфорилирования. Данные транспирации нормализовали на общую площадь листьев и на количество воды, впитываемое каждый день погруженным рядом тампоном фиксированного размера, которое принимали за 100%. Активность гексокиназы WT принимали за 100%.
На фиг. 3А-Е показано, что AtHXKl снижает транспирацию преимущественно при экспрессии в листьях. Процедуры реципрокной прививки (фиг. 3A) и тройной прививки (фиг. 3D) выполняли на стадии проростков, фотографировали растения и использовали для измерений транспирации приблизительно через 4 недели после прививки. Желтые стрелки и скобки указывают на локализацию привоев. На фиг. 3В показана относительная суточная транспирация всего растения реципрокно привитых растений. Данные нормализовали на общую площадь листьев и на количество воды, впитываемое каждый день погруженным рядом тампоном фиксированного размера, которое принимали за 100%. Данные представлены в виде среднего значения четырех независимых повторов ± SE. Различные буквы обозначают значимое различие (t-критерий, Ρ<0,05). На фиг. 3С показано, что скорость транспирации, нормализованную на общую площадь листьев реципрокно привитых растений, отслеживали одновременно и непрерывно на протяжении суток. Данные представлены в виде среднего значения ± SE для каждой 10-й точки забора образцов (n=4). На фиг. 3Е показана относительная суточная транспирация всего растения с тройной прививкой, рассчитанная как на (фиг. 3В).
На фиг. 4А-В представлены графики, показывающие, что супрессия НХК ингибирует закрытие устьица в ответ на сахарозу. На фиг. 4А представлены количественные измерения в реальном времени экспрессии генов томата LeHXK1-3 у томата дикого типа (WT) и у двух независимых линий томатов с антисмысловой супрессией НХК, аНК1 и аНК2. Данные представляют собой среднее значение трех независимых биологических повторов ± SE. Звездочки обозначают значимые различия по сравнению с WT (t-критерий, Ρ<0,05). На фиг. 4В представлен ответ устьица на сахарозу у WT, двух линий с антисмысловой супрессией (аНК1 и аНК2) и линии, экспрессирующей AtHXK1 (НК4), который оценивали на интактных листьях, погруженных на 3 часа в искусственный апопластический сок (Wilkinson и Davies, 1997), содержащий 100 мМ сахарозы. Данные представлены как среднее значение 400 устьиц из восьми независимых биологических повторов ± SE. Различные буквы обозначают значимое различие (t-критерий, Ρ<0,05).
На фиг. 5 представлен график, показывающий, что глюкоза (Glc) и сахара, которые могут быть фосфорилированы, но не метаболизированы, стимулируют закрытие устьица. Ответы устьица на различные сахара оценивали на интактных листьях растений дикого типа. Листья погружали на 3 часа в искусственный апопластический сок (Wilkinson и Davies, 1997), содержащий маннит (в качестве осмотического контроля), глюкозу, 2-дезоксиглюкозу (2-dG) или маннозу. Затем брали эпидермальные отпечатки и измеряли щель устьица. Данные представлены как среднее значение 400 устьиц из восьми независимых биологических повторов ± SE. Различные буквы обозначают значимое различие (t-критерий, Ρ<0,05).
На фиг. 6A-F показано, что сахароза стимулирует АВА-зависимое продуцирование NO в замыкающих клетках, которое опосредовано НХК. На фиг. 6А-В показано, как уровни оксида азота (NO) отслеживали в замыкающих клетках из эпидермальных оболочек растений дикого типа (WT) и растений, экспрессирующих AtHXK1 (НК4), с использованием флуоресцентного индикатора NO - красителя DAF-2DA. Относительные уровни флуоресценции замыкающих клеток (белые столбики) и щелей устьица (черные столбики) определяли через 30 минут обработки буфером MES (контроль) или MES, содержащим либо 100 мМ сахарозы, либо 100 мМ сорбита в качестве осмотического контроля. Типичные изображения флуоресценции представлены над столбиками флуоресценции (полоска = 10 мкм). Данные представлены как среднее значение ± SE 90 устьиц (фиг. 6А) или 60 устьиц (фиг. 6В) для каждого типа обработки с тремя или четырьмя независимыми биологическими повторами для каждой обработки. На фиг. 6С показано, как относительные уровни флуоресценции замыкающих клеток WT определяли через 30 минут обработки буфером MES (контроль), MES, содержащим 20 мМ ингибитора гексокиназы - тΝ-ацетилглюкозамина (NAG), или 100 мМ сахарозы с 20 мМ NAG или без такового. Типичные изображения флуоресценции представлены над столбиками флуоресценции (полоска = 10 мкм). Данные представлены как среднее значение 60 устьиц из трех независимых биологических повторов на обработку ± SE. На фиг. 6D представлены конфокальные изображения продуцирования NO в замыкающих клетках эпидермальных оболочек, обработанных только 20 мМ NAG (слева), через 30 минут после добавления 100 мМ сахарозы (в середине) и через 30 минут после отмывки NAG 100 мМ сахарозой (справа). Анализ проводили одновременно с фотографированием того же узкого длинного кусочка эпидермиса (полоска = 20 мкм). На фиг. 6Е показаны относительные уровни флуоресценции замыкающих клеток из узкого длинного кусочка эпидермиса, обработанного как на фиг. 6D. Данные представлены как среднее значение 40-60 устьиц ± SE. На фиг. 6F представлены конфокальные изображения продуцирования NO в замыкающих клетках эпидермальных слоев Sitiens (ΑΒΑ-дефицитные мутанты) через 30 минут после обработки буфером MES, содержащим либо 100 мМ сахарозы (слева), либо 100 мМ ABA (справа); полоска = 10 мкм. Различные строчные буквы на фиг. 6А-С, Ε обозначают значимое различие между обработками для данных флуоресценции, а различные прописные буквы на фиг. 6А обозначают значимое различие между обработками для данных по щели устьица (t-критерий, Ρ<0,05).
На фиг. 7А-Е показано, что экспрессия GFP под контролем промотора KST1 специфична для замыкающих клеток. На фиг. 7А представлены конфокальные изображения дикого типа (WT) (панели 1-4) и листьев томата трансгенных растений (панели 5-8) со специфичной по отношению к замыкающей клетке экспрессией GFP (обозначены GCGFP) под контролем промотора KST1. Панели 1 и 5 - это изображения флуоресценции GFP (зеленое окрашивание), панели 2 и 6 - это аутофлуоресценция хлорофилла (окрашивание фуксином), панели 3 и 7 - это изображения в белом свете, и панели 4 и 8 - это совмещенные изображения. На В-Е представлены конфокальные изображения растений WT (слева) и трансгенных растений Arabidopsis GCGFP (справа). Изображения были сделаны на листьях (фиг. 7В и С, полоски = 50 мкм и 5 мкм, соответственно), гипокотилях (фиг. 7D, полоска = 100 мкм) и корнях (фиг. 7Е, полоска = 50 мкм). Все панели являются совмещенными изображениями в белом свете, аутофлуоресценции хлорофилла (фуксин) и флуоресценции GFP (зеленый).
На фиг. 8A-F показано, что специфичная по отношению к замыкающей клетке экспрессия AtHXK1 индуцирует закрытие устьица и снижает транспирацию у растений томата и Arabidopsis. На фиг. 8А показаны типичные изображения дикого типа (WT) и двух независимых трансгенных линий томата, экспрессирующих AtHXK1 в особенности в замыкающих клетках (GCHXK7 и 12). На фиг. 8В и С показана проводимость устьица (gs,) и относительная суточная транспирация всего растения у WT и двух независимых трансгенных линий томата (GCHXK7 и 12). Данные проводимости устьица представлены в виде среднего значения четырех независимых повторов ± SE. Данные транспирации нормализовали на общую площадь листьев и на количество воды, впитываемое каждый день погруженным рядом тампоном фиксированного размера, которое принимали за 100%. Представлены данные трех последовательных дней. Данные для каждого дня представлены в виде среднего значения четырех независимых повторов ± SE. На фиг. 8D представлены типичные изображения Arabidopsis WT (экотип Col.) и двух независимых трансгенных линий, экспрессирующих AtHXK1 специфично в замыкающих клетках (GCHXK1 и 2). Фиг. 8Е и F - Проводимость устьица и измерения транспирации у WT, двух независимых трансгенных линий Arabidopsis, GCHXK1 и GCHXK2 (экотипа Col.) и gin 2-1 (нулевого мутанта AtHXKl, экотипа Ler.). Стрелки указывают на возрастание или снижение проводимости и транспирации по сравнению с WT. Данные представлены как среднее значение (± SE) 8 и 12 независимых повторов для линий GCHXK и gin2-l, соответственно. Звездочки обозначают значимые различия по сравнению с WT (t-критерий, Ρ<0,05).
На фиг. 9 показано, что экспрессия GFP под контролем промотора FBPase специфична по отношению к мезофильным клеткам. Конфокальные изображения листьев растений трансгенного томата и Arabidopsis с мезофильной специфичной экспрессией GFP (обозначенной MCGFP) под контролем промотора FBPase. Изображения являются совмещением флуоресценции GFP (зеленое окрашивание) и изображений в белом свете (полоска = 100 мкм). Флуоресценция является специфичной по отношению к мезофильным клеткам.
На фиг. 10A-D представлены графики, демонстрирующие, что повышенная экспрессия гексокиназы в замыкающих клетках снижает транспирацию, в то время как фотосинтез остается неизменным, с улучшением, таким образом, текущей эффективности использования воды. Газообменный анализ растений GCHXK и WT проводили с использованием портативной газообменной системы Li-6400 (LI-COR), проводимость устьица (фиг. 10А), транспирацию (фиг. 10В), фотосинтез (фиг. 10С) и текущую эффективность использования воды (IWUE, Фиг. 10D) измеряли и рассчитывали при благоприятных условиях роста. Данные представлены как среднее значение ± SE (n=10 для WT и n=20 для 10 разных трансгенных линий, по два измерения для каждой). Звездочка обозначает значимое различие (t-критерий, Ρ<0,05).
На фиг. 11А-С показано, что повышенная экспрессия гексокиназы в замыкающих клетках снижает транспирацию целого растения и повышает эффективность использования воды. На фиг. 11А-В показано, как относительную суточную транспирацию целого растения (RDT) анализировали с использованием широкомасштабной лизиметрической системы, как описано в примере 1. WT и две трансгенные линии GCHXK (GCHXK7, GCHXK12) помещали на весы. Транспирацию и общую массу растения регистрировали каждые 3 минуты во время эксперимента, при котором растения выращивали при нормальных условиях в течение 10 дней, затем подвергали стрессу засухи в течение 3 дней с последующим восстановительным орошением в течение дополнительных 7 дней. Данные нормализовали на общую массу растения и на количество воды, впитанное каждый день погруженным рядом тампоном фиксированного размера, которое принимали за 100% и которое служило в качестве эталона для временных вариаций потенциальной транспирации. На фиг. 11А показана по дням относительная суточная транспирация во время всего эксперимента. Данные представлены как среднее значение четырех независимых повторов ± SEM. На фиг. 11В показана относительная суточная транспирация выборочных дней для каждого типа обработки. Данные представлены как среднее значение четырех независимых повторов ± SEM. Звездочка обозначает значимое различие (t-критерий, Ρ<0,05). На фиг. 11С показано, как эффективность использования воды рассчитывали по отношению между наращиванием массы растения и потерей воды растением каждый день для каждого растения. Данные представлены как среднее значение четырех независимых повторов ± SEM. Звездочка обозначает значимое различие (t-критерий, Ρ<0,05). (A-увеличено) RDT растений WT и GCHXK в период перехода от нормального орошения (10-й день) к условиям засухи (11-й день). Красные и зеленые стрелки указывают на снижение RDT (представленное наклоном) у растений WT и GCHXK, соответственно, после воздействия на растения засухой.
На фиг. 12A-F показано, что повышенная экспрессия гексокиназы в замыкающих клетках снижает транспирацию и проводимость устьиц на протяжении суток при демонстрации нормального роста. Относительную скорость транспирации целого растения (фиг. 12А) и проводимость устьиц (gs, фиг. 12В) анализировали с использованием широкомасштабной лизиметрической системы, как описано в способах. WT и две GCHXK трансгенные линии помещали на весы. Скорость транспирации, gs, интенсивность света (фиг. 12Е), дефицит давления пара (VPD, фиг. 12F) регистрировали одновременно каждые 3 минуты во время эксперимента, при котором растения выращивали при нормальных условиях. Данные для фиг. 12А и В нормализовали на общую площадь листьев и на количество воды, впитанное каждый день погруженным рядом тампоном фиксированного размера, которое принимали за 100% и которое служило в качестве эталона для временных вариаций потенциальной транспирации. На фиг. 12С показана общая площадь листьев растения, на фиг. 12D показана общая масса растения.
На фиг. 13 показана скорость транспирации растений WT и GCHXK в условиях засухи. Скорость транспирации всего растения анализировали с использованием широкомасштабной лизиметрической системы, как описано в примере 1. WT (голубой) и трансгенные линии GCHXK (зеленый) помещали на весы. Скорость транспирации регистрировали в течение 9 дней после воздействия на растения условий постепенно усиливающейся засухи до полного прекращения орошения. Скорость транспирации, нормализованную на общую площадь листьев, отслеживали одновременно и непрерывно в течение суток. Данные представлены как среднее значение ± SE для каждой точки забора образцов. Данные нормализовали на общую площадь листьев и на количество воды, впитанное каждый день погруженным рядом тампоном фиксированного размера, которое принимали за 100% и которое служило в качестве эталона для временных вариаций потенциальной транспирации. Звездочка обозначает день, в который произошел переход транспирации между WT и GCHXK.
На фиг. 14А-В показана урожайность трансгенных растений, экспрессирующих гексокиназу специфично в замыкающих клетках. На фиг. 14А показано количество плодов, собранных с растений WT и GCHXK (4 независимые линии). На фиг. 14В представлены типичные изображения растений дикого типа (WT) и трансгенных томатов, экспрессирующих AtHXKl специфично в замыкающих клетках (GCHXK7).
На фиг. 15А-С показана урожайность трансгенных растений, экспрессирующих гексокиназу специфично в замыкающих клетках в условиях ограниченного водоснабжения. На фиг. 15А показано, как растения выращивали в контролируемых условиях коммерческой теплицы согласно инструкциям эксперта относительно процедур выращивания (система почв, орошение, удобрение и т.д.). Проростки высаживали вперемешку по всему ряду посадки и в каждом ряду сохраняли одинаковый порядок. Каждый ряд орошали по-разному: либо полностью (100%), либо частично (режимы орошения на 75%, 50% и 25%). После первоначальной стадии бланжевого плода плоды собирали, подсчитывали и взвешивали для каждого растения индивидуально в течение 4 недель. Затем совокупную массу плодов (фиг. 15В) и число плодов (фиг. 15С) растений WT (голубой) и GCHXK (зеленый) усредняли для каждого режима орошения. Голубые и зеленые стрелки указывают на уменьшение массы плодов растений WT и GCHXK, соответственно, при переходе с 75%-ного на 50%-ное орошение.
На фиг. 16A-F показано, что специфичная по отношению к замыкающей клетке экспрессия AtHXK1 индуцирует закрытие устьиц, снижает транспирацию и повышает температуру листьев, не снижая фотосинтеза или мезофильной проводимости для СО2, и увеличивает, таким образом, эффективность использования воды растениями Arabidopsis. Проводимость устьица (фиг. 16А), транспирацию (фиг. 16В), фотосинтез (фиг. 16С) и мезофильную проводимость для СО2 (gm, фиг. 16D) измеряли у растений WT и трансгенных растений Arabidopsis, экспрессирующих AtHXK1 специфично в замыкающих клетках (GCHXK). На фиг. 16Е показана текущая эффективность использования воды (IWUE) растений WT и GCHXK. На фиг. 16F показано, как температуру листьев (более теплые листья - закрытие устьиц) растений WT и GCHXK определяли с использованием программного обеспечения ThermaCam researcher pro 2.10. Точки данные представляют собой среднее значение ± SE 6 биологических повторов на фиг. 16А-Е и 12 биологических повторов на фиг. 16F. Звездочка обозначает значимое различие по сравнению с диким типом (t-критерий, Ρ<0,05).
На фиг. 17А-В представлены схематические карты бинарного вектора pGreeNO029, содержащего промотор KST1, кДНК AtHXK1 (фиг. 17А) или GFP (фиг. 17В) и терминатор. Вектор также содержит гены nos-Kan и неомицин-фосфотрансферазы II (NptII) в качестве селектируемых маркеров на трансформацию бактерий и растений.
Подробное описание изобретения
Согласно некоторым вариантам осуществления настоящее изобретение относится к способам модуляции проводимости устьица и к растительным экспрессионным конструкциям для их осуществления.
Перед подробным объяснением по меньшей мере одного варианта осуществления настоящего изобретения, следует учесть, что настоящее изобретение не обязательно ограничивается при его применении подробностями, изложенными в следующем описании или иллюстрировании с помощью примеров. Имеются и другие варианты осуществления настоящее изобретения, или оно осуществляется или выполняется различными путями.
Вода является основным фактором, ограничивающим рост и развитие многих наземных растений. Устьица, состоящие из двух замыкающих клеток, являются главными каналами, контролирующими потерю воды растениями. Открытие устьиц контролируется многими стимулами окружающей среды и физиологическими стимулами, но все они функционируют посредством регуляции осмолярности замыкающих клеток. Повышение осмолярности замыкающих клеток приводит к открытию устьица, а понижение осмолярности вызывает закрытие устьица. Господствующая парадигма заключается в том, что сахароза действует в качестве осмолита в замыкающих клетках, способствуя, таким образом, открытию устьица.
В процессе разработки настоящего изобретения авторы настоящего изобретения обнаружили, что вопреки господствующей парадигме сахароза закрывает устьице через механизм, отличный от осмотического (см. пример 2). Кроме того, ответ замыкающих клеток на сахарозу зависит от чувствительного к сахару фермента гексокиназы (НХК), которая запускает путь передачи сигнала абсцизовой кислоты в замыкающих клетках, что приводит к закрытию устьица.
Таким образом, в процессе доведения настоящего изобретения до осуществления авторы настоящего изобретения обнаружили, что модуляция активности или экспрессии гексокиназы коррелирует с устьичной щелью.
Как проиллюстрировано в настоящем документе ниже и в нижеследующем разделе Примеры, авторы настоящего изобретения надэкспрессировали НХК в устьице растений томата (специфичным по отношению к замыкающей клетке образом). Удивительно, что при сохранении фотосинтеза неизмененным (фиг. 10С) устьичная проводимость (указывающая на устьичную щель, фиг. 10В) и транспирация (фиг. 10А) были снижены. Подобные результаты были получены при мониторинге тех же параметров на протяжении суток (фиг. 12A-D). Важно, что измеряя общую площадь листьев и массу растения (фиг. 12С и 12D, соответственно), авторы настоящего изобретения открыли, что даже несмотря на то, что растения потребляли меньше воды (фиг. 12А), рост не ухудшался, а даже улучшался. Сохранение воды без влияния на рост растения улучшает эффективность использования воды растением. Повышенная экспрессия гексокиназы в замыкающих клетках улучшает получение урожая (фиг. 14А-В) даже при ограниченном водоснабжении (фиг. 15А-С). Подобные результаты получали на Arabidopsis. Эти результаты демонстрируют, что одинаковая трансгенная вставка гексокиназы под специфичный по отношению к замыкающей клетке промотор, используемый в случае с томатом (семейство Solanaceae), универсально применима для воздействия на устьица, а также повышает эффективность использования воды в случае с Arabidopsis (семейство Brassicaceae), и что эта методика может быть внедрена также и на других видах.
В отличие от предыдущих исследований, которые основывались на корреляциях между содержанием сахарозы и устьичной щелью, в данном исследовании предпринят функциональный подход для изучения эффектов сахарозы и продуктов ее расщепления на поведение устьица. На данный момент доказано, что сахароза стимулирует специфичный по отношению к замыкающей клетке ответ, который опосредуется НХК и ABA и приводит к закрытию устьица. Без углубления в теорию предполагают, что этот ответ представляет естественный механизм обратной связи, нацеленный на снижение транспирации и консервирование воды при избыточном фотосинтезе и осуществляющий, таким образом, координацию между фотосинтезом и транспирацией.
Таким образом, аспект настоящего изобретения относится к способу регулирования проводимости устьица растения, при этом способ включает модуляцию у растения уровня и/или активности гексокиназы специфичным по отношению к замыкающей клетке образом с регулированием тем самым проводимости устьица и транспирации растения.
Используемая в настоящем документе фраза «проводимость устьица» относится к газовому обмену через поровый комплекс устьица. Проводимость устьица регулируется устьичной щелью. Устьичная проводимость влияет на транспирацию растения, и, поэтому, методом в соответствии с настоящим изобретением согласно этому аспекту настоящего изобретения также регулируют транспирацию растения.
Используемая в настоящем документе фраза «регулирование проводимости устьица растения» относится к повышению или уменьшению проводимости устьица. Повышение или уменьшение может составлять по меньшей мере 2%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или более 90% или 100% (например, 20-40%).
Используемый в настоящем документе термин «гексокиназа», сокращенно НХК, называемая в настоящем документе «трансгеном» или «полипептидом», относится к ферменту, который, как правило, фосфорилирует гексозы (сахара с шестью углеродами) с образованием фосфата гексозы и имеет номер 2.7.1.1 по Е.С. Используемая в настоящем документе НХК также относится к подобному белку гексокиназе (HKL), который связывает гексозу и предает сигнал, независимый от его киназной активности (фосфорилирование гексозы).
Размер гексокиназ согласно идеям настоящего изобретения может составлять приблизительно 100 кДа у большинства многоклеточных организмов (например, млекопитающих и растений). Они состоят из двух половинок (N- и С-концевой), которые обладают существенной гомологией последовательностей. Это указывает на эволюционное происхождение путем дубликации и слияния 50-кДа подобных предковых гексокиназ.
Гексокиназа может быть естественного происхождения или может содержать синтетическую последовательность/состоять из синтетической последовательности (т.е. искусственной), пока она сохраняет гексокиназную активность.
Вследствие своего высокого уровня консервативности гексокиназа в соответствии с настоящим изобретением может быть растительного или животного происхождения. Согласно конкретному варианту осуществления гексокиназой является растительная гексокиназа.
Гексокиназы могут быть разделены на категории в соответствии с их клеточной локализацией. Таким образом, НХК могут быть ассоциированы с митохондриями, ассоциированы с пластидами или находиться внутри пластид или присутствовать в цитозоле. На данный момент было обнаружено, что все исследованные НХК двудольных имеют либо пластидный сигнальный пептид (тип А), либо N-терминальный мембранный якорный домен (тип В), однако, цитозольные гексокиназы также рассматриваются для применения в соответствии с идеями настоящего изобретения. Согласно конкретному варианту осуществления гексокиназой является НХК типа В (ассоциированная с митохондриями).
Используемая в настоящем документе фраза «гексокиназная активность» относится к способности фермента регулировать проводимость устьица. Фермент может связывать гексозу и стимулировать путь абсцизовой кислоты (ABA), который регулирует проводимость устьица. Активность может не зависеть от киназы.
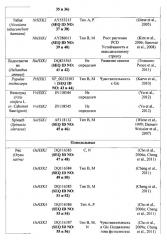
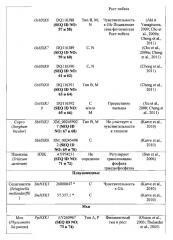
Неограничивающие примеры гексокиназ, которые предполагаются идеями настоящего изобретения, представлены в таблице 1 в настоящем документе ниже.
Как упоминалось, последовательность НХК может быть естественного происхождения или искусственно созданной (например, кодон-оптимизированной) в соответствии с намеченным применением.
Согласно конкретному варианту осуществления модуляция активности или экспрессии НХК относится к повышающей регуляции активности или экспрессии, которая приводит к снижению устьичной проводимости. Повышающая регуляция может составлять, по меньшей мере, 5%, 10%, 20,%, 30%, 40%, 50%, 60%, 70% 80% или больше, скажем 90% или даже 100% по сравнению с экспрессией или активностью гексокиназы в аналогичных клетках того же вида растений, условиях ро