Связывающие белки, содержащие по меньшей мере две повторяющиеся области-антагонисты her2
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к рекомбинантному связывающему HER2 белку, содержащему по меньшей мере первую и вторую области анкириновых повторов, каждая из которых связывает внеклеточную область HER2. При этом первая область анкиринового повтора связывает область II HER2, а вторая область анкиринового повтора связывает область IV HER2, первая и вторая области анкиринового повтора находятся в одном и том же полипептиде, первая область анкиринового повтора находится на N-конце второй области анкиринового повтора. Также раскрыта нуклеиновая кислота, кодирующая вышеуказанный связывающий белок. Изобретение также относится к фармацевтической композиции, содержащей вышеуказанный связывающий белок, а также к способу лечения рака, характеризующегося амплификацией кодирующего HER2 гена и/или сверхэкспрессией кодирующего HER2 гена, с ее использованием. Изобретение позволяет эффективно лечить рак, характеризующийся амплификацией кодирующего HER2 гена и/или сверхэкспрессией кодирующего HER2 гена. 6 н. и 26 з.п. ф-лы, 7 ил., 3 табл., 8 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится, к связывающим белкам, содержащим, по меньшей мере, две повторяющиеся области, специфически связывающие рецептор эпидермального фактора роста человека 2-го типа (HER2), а также к нуклеиновым кислотам, кодирующим такие связывающие HER2 белки, фармацевтическим композициям, содержащим такие белки, и применению таких белков при лечении болезней.
Предпосылки создания изобретения
Рецептор эпидермального фактора роста человека 2-го типа (HER2, зарегистрированный под номером Р04626 в базе данных UniProtKB/Swiss-Prot), также известный как ErbB2, является белком, который в организме человека кодируется геном ERBB2. Поскольку доказано, что амплификация или сверхэкспрессия этого гена играет важную роль в патогенезе и развитии рака определенных типов, за последние годы он превратился в важный биомаркер и мишень при лечении болезней. HER2 является трансмембранной рецепторной тирозинкиназой (RTK) и относится к более обширному семейству рецепторов ErbB (Bublil, Е.М. и Yarden, Y. Curr. Opin. Cell Biol. 19(2), 124-34, 2007). Рецепторы семейства ErbB встречается у позвоночных, и в него также входит рецептор-основатель семейства ErbBl (также называемый рецептором эпидермального фактора роста (EGFR) или HER1; зарегистрирован под номером Р00533 в базе данных UniProKB/Swiss-Prot белков человека) и обнаруженные в последнее время рецептор HER3 (также называемый ЕrbB3; зарегистрирован под номером Р21860 в базе данных UniProKB/Swiss-Prot белков человека) рецептор HER4 (также называемый ЕrbВ4; зарегистрирован под номером Q15303 в базе данных UniProKB/Swiss-Prot белков человека). Все рецепторы семейства ErbB имеют общие обширные гомологии последовательностей и областей и образуют функциональные гомодимеры (например, ErbBl-ErbBl, HER2-HER2 и HER4-HER4) и гетеродимеры во всех сочетаниях. Гомо- и гетеродимеризация рецепторов происходит после связывания связывание лиганда или сверхэкспрессии рецепторов, что в свою очередь вызывает активацию внутриклеточных областей рецепторов киназы путем автофосфорилирования. Затем инициируется внутриклеточный нисходящий сигнальный путь и биологические реакции. В отличие от остальных рецепторов ErbB, HER2 не имеет известного лиганда и способен образовывать димеры, что ярко проявляется после его сверхэкспрессии, в результате чего он активируется без предшествующего связывания лиганда. Что важно, HER3 не имеет активной внутриклеточной области киназы, и активируется посредством гетеродимеризации с другими рецепторами семейства ErbB, что приводит к передаче очень мощных сигналов по нисходящему пути. Такая гетеродимеризация и активация HER3 происходит после связывания с ним лиганда или в случае сильной сверхэкспрессии рецептора-партнера, такого как HER2.
HER2, а также все остальные рецепторы семейства ErbB состоят из четырех внеклеточных областей, которые последовательно именуются областями I, II, III и IV, при этом область IV является ближайшей к клеточной мембране, а область I наиболее удаленной от нее. В условиях отсутствия лигандов в областях I и III рецепторов ErbB происходят общее внутримолекулярное взаимодействие, которое закрывает область II. В результате этого предотвращается гомо-/гетеродимеризация рецепторов и передача сигналов, поскольку для димеризации требуется взаимодействие между областями II двух соседних рецепторов ErbB (Burguess A.W. и др., Mol. Cell 12(3), 541-552, 2003). Связывание лиганда нарушает взаимодействие между областями I и III, в результате чего происходит конформационное изменение рецепторов из связанной формы в растянутую, и область II остается открытой. Это заставляет рецептор делать случайный выбор при димеризации с другими расширенными рецепторами ErbB и инициировать передачу сигналов. Интересно, что, поскольку HER2 является единственным конститутивным рецептором семейства ErbB при растянутой конформации, область II постоянно открыта и доступна для гомо- и гетеродимеризации.
Димеризация и автофосфорилирование рецепторов ErbB приводит к активации множества ключевых молекул в нисходящем сигнальном пути, вовлеченных как в нормальные физиологические процессы, так и патологические процессы. Природа таких активируемых сигнальных молекул до некоторой степени зависит от состава димеризованных активных рецепторов ErbB. Например, гомодимеры HER1-HER1 и HER2-HER2 предпочтительно активируют нисходящий сигнальный путь и пролиферацию регулируемой внеклеточными сигналами киназы (ERK), тогда как гетеродимеры HER2-HER3 также активируют сигнальный путь PI3K (включая активацию киназы АКТ нисходящего сигнального пути) и тем самым выживание клеток. По существу, активация АКТ посредством сигнального пути HER2-HER3 в опухолевых клетках способствует их выживанию и делает опухолевые клетки резистентными к лекарствам, нацеленным на HER2, таким как моноклональное. антитело трастузумаб (Berns К. и др., Cancer Cell 12, 395-402, 2007). Интересно, что ингибирование опосредованного HER2-HER3 сигнального пути PI3K-AKT в этих клетках становится ограничивающим выживаемость фактором и приводит к некрозу клеток. Помимо пролиферации и выживаемости клеток сигнальный путь HER2 также участвует в других процессах, таких как развитие кровеносных сосудов и миграция.
Приблизительно в 20% случаев рака молочной железы всех типов наблюдается сверхэкспрессия HER2. С учетом своей клинической значимости HER2 стал первым RTK, против которого была разработан нацеленный биологический препарат, а именно, трастузумаб (Herceptin®; Genentech). Это антитело связывает область IV HER2 и ингибирует сигнальный путь HER2 посредством нескольких механизмов, которые еще не до конца поняты. В их число входит индуцирование интернализации рецепторов в опухолевых клетках, что вызывает снижение уровней экспрессии и подавление сигнального пути HER2 и приводит к ослаблению опухолеобразующего фенотипа. Трастузумаб продлил жизнь и повысил качество жизни десятков тысяч женщин с раком молочной железы. Тем не менее, поскольку трастузумаб в основном противодействует пролиферации клеток, опухоли на поздних стадиях заболевания могут не поддаваться такому лечению. В попытке создания более эффективных средств лечения было получено новое антитело, которое распознает область II или HER2, а именно, пертузумаб (Omnitarg®, Perjeta®; Genentech). В отличие от трастузумаба это антитело имеет целью не снижение уровней мембранной экспрессии HER2, а противодействие образованию гомо- и гетеродимеров HER2 путем связывания и закрытия области II димеризации рецептора. Эффективность лечения пертузумабом в качестве единственного средства является неожиданно низкой in vitro и in vivo, но его сочетание с трастузумабом обладает синергетическим эффектом. Соответственно, сочетание обоих антител может стать стандартной схемой терапии при лечении пациентов с раком молочной железы (Capelan M. и др., Ann. Oncol., 24, 273-82, 2013).
Успех доклинических и клинических испытаний сочетания трастузумаба и пертузумаба дал толчок идее, согласно которой для достижения более высокой противоопухолевой эффективности требуется двойное нацеливание на области II и IV в HER2. Эта идея подтверждается другими молекулами, созданными в последнее время с целью одновременного нацеливания на области II и IV в HER2. Например, датской компанией Symphogen ведется разработка смешанных антител к областям II и IV HER2, которые продемонстрировали несколько более высокую эффективность (т.е. более высокую, чем у трастузумаба в отдельности) при доклинических испытаниях на моделированных на мышах опухолях.
Аналогичным образом, из US 2011/033460 известно, что сочетание антител, связывающих область I и область IV HER2, обладает синергетическим эффектом в отношении синтеза ДНК и жизнеспособности клеток ВТ474. Кроме того, в US 2011/033460 также описаны биспецифические антитела, которые связывают два различных эпитопа HER2, один из которых находится в области IHER2, а другой - в области IV HER2.
В WO 2009/068625 описана разработка бипаратопных моделей антител, содержащих первую область, которая конкурирует с трастузумабом за связывание HER2, и вторую область, которая связывает отличающийся эпитоп или часть HER2. Интересно, что, некоторые модели являются антагонистами пролиферации клеток SKBR3, а другие модели обладают агонистическим действием. В частности, в WO 2009/068625 описана разработка бипаратопных моделей антител, содержащих первую область, которая конкурирует с трастузумабом за связывание HER2 (т.е. связывание области IV Неr2), и вторую область, которая конкурирует с пертузумабом за связывание HER2 (т.е. связывание области II HER2). Модели, в которых связывающая область IV область антитела клонирована как N-конец связывающей область II области антитела, блокируют активацию МАР-киназы, тогда как такое блокирование не наблюдается при другой ориентации (т.е. при нахождении связывающей область II области антитела на N-конце). В целом, в WO 2009/068625 описаны разнообразные модели бипаратопных антител, нацеленных на HER2, которые обладают различными степенями действия (агонистического или антагонистического) на пролиферации или сигнальный путь клеток SKBR3, но не описано цитотоксическое или апоптическое действие.
Также известны бивалентные связывающие белки, такие как бивалентные молекулы димерных или аффинных антител, нацеленные на HER2 (Nielsen, U.B. и др., Cancer Res., 60, 6434-6440, 2000; Steffen, А-С, Cancer Biother. Radiopharmaceut. 20, 239-248, 2005). Поскольку в таких молекулах дважды повторена одна связывающая область, они отличаются от бипаратопных молекул, которые содержат две связывающие области, каждая из которых связывает отличающийся эпитоп в одной молекуле-мишени.
В качестве альтернативы средствам на основе антител и SMI, известны новые связывающие белки или связывающие области, которые могут применяться для специфического связывания молекулы-мишени (например, Binz, Н.К., Amstutz, Р. и Plückthun, Α., Nat. Biotechnol. 23, 1257-1268, 2005) и тем самым действовать как антагонист. Основой связывающих белков или связывающих области одного такого нового класса, не обладающих Fс, являются сконструированные повторяющиеся белки или сконструированные повторяющиеся области (WO 2002/020565; Binz, Н.К., Amstutz, P., Kohl, Α., Stumpp, M.T., Briand, С, Forrer, P., Grütter, M.G. и Plückthun, Α., Nat. Biotechnol. 22, 575-582, 2004; Stumpp, M.T., Binz, H.K и Amstutz, P., Drug Discov. Today 13, 695-701,2008).
В WO 2002/020565 описано создание крупных библиотек повторяющихся белков и их общее применение. В таких сконструированных повторяющихся областях используется модульная природа повторяющихся белков, и они могут обладать N-концевыми и С-концевыми кэппирующими модулями для предотвращения агрегации повторяющихся областей путем экранирования гидрофобной сердцевины области (Forrer, P., Stumpp, М.Т., Binz, H.K. и Plückthun, Α., FEBS letters 539, 2-6, 2003). В этот новый класс связывающих белков входят сконструированные анкириновые повторы (DARPins). В литературе описано моноспецифическое связывание HER2 посредством DARPins (например, Steiner, D., Forrer, Р. и Plückthun, Α., J. Mol. Biol. 382, 1211-1227, 2008; Zahnd, С, Pecorari, F., Straumann, Ν., Wyler, Ε. и Plückthun, Α., J. Biol. Chem. 281(46), 35167-35175, 2006).
Недавно описан биспецифический сконструированный анкириновый повтор, нацеленный на HER2 (Jost, Ch. и др., Structure 21, 1-13, 2013). Авторами показано, что при связывании двумя областями анкириновых повторов, соединенными коротким линкером (более длинные линкеры неэффективны), одна из которых нацелена на область I Her2, а другая на область IV Her2, обеспечивается более сильное цитотоксическое действие на клетки ВТ474, чем в случае только трастузумаба, который нацелен на область IV Her2. Этот бипаратопный повторяющийся белок действует путем внутримолекулярного сшивания двух молекул Her2, т.е. он соединяет две мембраносвязанные молекулы HER2, деформируя их таким образом, что лишить их способности образовывать обеспечивающие сигнальный путь димеры с каким-либо рецептором семейства EGFR, что предотвращает димеризацию киназы и тем самым обеспечивает наблюдаемое цитотоксическое действие.
Несмотря на то, что из уровня техники известны выгоды нацеливания на HER2 при лечении таких болезней, как рак, существует явная потребность с создании связывающих белков, с более высокой эффективностью нацеленных на HER2.
Задача изобретения
В основу настоящего изобретения положена задача создания новых антагонистов Her2.
Другой задачей настоящего изобретения является создание нового механизма ингибирования связанного с HER2 клеточного сигнального пути.
Еще одной задачей настоящего изобретения является создание нового подхода к ингибированию опосредованной HER2 пролиферации клеток и/или индуцированию апоптоза в клетке (например, опухолевой клетке), ткани, органе или организме пациента.
Еще одной задачей настоящего изобретения является создание монотерапии, нацеленной на две области Her2, путем использования бипаратопных повторяющихся белков.
Еще одной задачей настоящего изобретения является создание новых возможностей лечения рака.
Еще одной задачей настоящего изобретения является создание средства лечения неоплазий с высокой эффективностью и/или незначительными побочными эффектами.
Еще одной задачей настоящего изобретения является создание альтернативного средства лечения неоплазий, которые не реагируют (или только частично реагируют) или являются резистентными к известным из уровня техники терапиям.
Краткое изложение сущности изобретения
Решение этих задач достигается за счет объекта независимых пунктов формулы изобретения, при этом в зависимых пунктах и в описании раскрыты дополнительные предпочтительные варианты осуществления.
Хотя изобретение проиллюстрировано на чертежах и подробно описано далее, такие чертежи и описание следует считать иллюстрирующими или поясняющими, а не ограничивающими изобретение, которое не ограничено раскрытыми вариантами осуществления. При практическом применении заявленного изобретения специалисты в данной области техники, изучившие чертежи, описание и прилагаемую формулу изобретения, могут предложить и реализовать другие разновидности раскрытых вариантов осуществления. Термин "содержащий" в формуле изобретения не исключает другие элементы или стадии, а неопределенный артикль не исключает множественного числа. Тот факт, что некоторые признаки содержатся в различных пунктах формулы изобретения, не означает невозможность выгодного применения сочетания этих признаков. Приведенные в формуле изобретения ссылочные позиции не следует трактовать как ограничение ее объема.
Краткое описание чертежей
Фиг. 1
Связывание HER2 областями DARPin
Испытали связывание моновалентными DARPins внеклеточной области HER2 (областей I-IV) методом конкурентного твердофазного иммуноферментного анализа (ИФА) с использованием областей очищенного HER2 (области I, областей III-IV или областей I-III) в качестве конкурентов, как показано на фиг. 1А и 1В. В присутствии 500 нМ области I Her2 DARPin # 51 и DARPin # 52 больше не способны связывать HER2 (область I-IV), что говорит о том, что они связывают эпитоп в области I. DARPin # 7, DARPin # 53 и DARPin # 54 связывают область II, поскольку ни 500 нМ области I Her2, ни 500 нМ областей III-IV Her2 не способны предотвратить связывание ими Her2 (областей I-IV) по всей длине. На фиг. 1С показано, что моновалентные DARPins способны связывать предварительно сформированный комплекс НЕR2-пертузумаб и, соответственно, эпитоп, который они связывают, отличается от эпитопа, который связывает пертузумаб в области II HER2. Смотри далее определения DARPins. OD означает оптическую плотность при концентрации 450 нМ минус OD при концентрации 620 нм; С означает контрольный DARPin, который не связывает HER2; d1 означает область I HER2; d1-3 означает области I-III HER2; d3-4 означает области III-IV HER2.
Фиг. 2
Ингибирование пролиферации клеток ВТ474 моновалентными и бипаратопными связывающими белками
Определили ингибирование пролиферации клеток ВТ474 моновалентными DARPins (т.е. DARPin # 1 и DARPin # 18) в виде нековалентной смеси этих моновалентных DARPins и бипаратопных связывающих белков, содержащих эти моновалентные DARPins с различными ориентациями (DARPin # 41 и DARPin # 49). На фиг. 2А показано ингибирование пролиферации клеток бипаратопными DARPins в различных концентрациях, и представлены соответствующие подогнанные кривые ингибирования для отдельного единичного эксперимента. Затем вычислили показатель IC50 для DARPin #41, который составил около 2 нм. В Таблице 2 приведены показатели IC50 для отдельных DARPins. На диаграмме на фиг. 2А показана оптическая плотность (OD) при концентрации 450 мн минус OD при концентрации 620 нм в зависимости от концентрации (С) DARPins в нМ. По шкале X отложена логарифмическая шкала. На фиг. 2В показано ингибирование пролиферации бипаратопными DARPins в виде смеси как моновалентных DARPins, так и отдельных соответствующих моновалентных DARPins в концентрации 100 нМ. По оси Y отложена OD. Ингибирование пролиферации отобржено низкой OD. Смотри далее определения DARPins. #41 означает DARPin # 41; # 49 означает DARPin # 49; # 18 означает DARPin # 18; # 1 означает DARPin # 1; п. с. означает отрицательный контроль.
Фиг. 3
Ингибирование пролиферации клеток ВТ474 различными бипаратопными DARPins
Показано ингибирование пролиферации клеток ВТ474 подмножеством бипаратопных DARPins (# 23, # 24, # 33, # 37, # 43, # 44 и # 41), содержащих различные N-концевые и/или С-концевые области анкириновых повторов. Показаны кривые ингибирования пролиферации DARPins в различных концентрациях и соответствующие подогнанные кривые ингибирования для каждого отдельного единичного эксперимента. В Таблице 2 приведены показатели IC50 для отдельных DARPins. На фиг. 3А показано ингибирование бипаратопными DARPins с DARPin # 15 на N-конце, а на фиг. 3В показано ингибирование бипаратопными DARPins с DARPin # 18 на С-конце. На фиг. 3С показано ингибирование бипаратопными DARPins с DARPin # 51 на N-конце и DARPin # 18 на С-конце, а на фиг. 3D показано ингибирование бипаратопными DARPins с DARPin #51 на N-конце и DARPin # 21 на С-конце. На диаграмме показана оптическая плотность (OD) при концентрации 450 мн минус OD при концентрации 620 нм в зависимости от концентрации (С) DARPins в нМ. По шкале X отложена логарифмическая шкала. Смотри далее определения DARPins. # 23 означает DARPin # 23; # 24 означает DARPin # 24; # 33 означает DARPin # 33; # 37 означает DARPin # 37; # 41 означает DARPin # 41; # 43 означает DARPin # 43; # 44 означает DARPin # 44.
Фиг. 4
Ингибирование пролиферации клеток различных линий бипаратопными DARPin #41
Определили ингибирование пролиферации клеток NCI-N87 (фиг. 4А), ZR75-30 (фиг. 4В) и MDA-MB175 (фиг. 4С) DARPin # 41 и трастузумабом. Показано ингибирование пролиферации DARPins в различных концентрациях и соответствующие подогнанные кривые ингибирования для каждого отдельного единичного эксперимента. В Таблице 3 приведены показатели IC50 для отдельных линий клеток. На диаграмме показана оптическая плотность (OD) при концентрации 450 мн минус OD при концентрации 620 нм в зависимости от концентрации (С) DARPins в нМ. По шкале X отложена логарифмическая шкала. Смотри далее определения DARPins и эталонных молекул. #41 означает DARPin # 41; Τ означает трастузумаб.
Фиг. 5
Индуцирование апоптоза бипаратопными DARPin # 41 в различных линиях клеток.
Определили индуцирование апоптоза в клетках ВТ474 (фиг. 5А), NCI-N87 (фиг. 5 В) и MDA-MB175 (фиг. 5С) DARPin # 41 и трастузумабом. Показано индуцирование апоптоза DARPins в различных концентрациях и соответствующие подогнанные кривые ингибирования для каждого отдельного единичного эксперимента. В Таблице 3 приведены показатели IC50 для отдельных линий клеток. В диаграмме на фиг. 5А показана оптическая плотность (OD) при концентрации 450 нМ минус OD при концентрации 490 нМ в зависимости от концентрации (С) DARPins или трастузумаба в нМ. В диаграмме на фиг. 5В и 5С показаны относительные световые единицы (RLU) в зависимости от концентрации (С) DARPins или трастузумаба в нМ. По шкале X отложена логарифмическая шкала. Смотри далее определения DARPins. Τ означает трастузумаб; #41 означает DARPin #41.
Фиг. 6
Сравнение эффективности DARPin # 41 с эталонами при ингибировании пролиферации клеток и индуцировании апоптоза
Определили ингибирование пролиферации (фиг. 6А) и индуцирование апоптоза (фиг. 6В) в клетках ВТ474 для DARPin #41, используемых в качестве эталонов трастузумаба и пертузумаба и сочетания 100 нМ трастузумаба и титрованного пертузумаба. На фиг. 6А показано ингибирование пролиферации клеток DARPin в различных концентрациях и эталонами в соответствующих концентрациях, и показаны соответствующие подогнанные кривые ингибирования для каждого отдельного единичного эксперимента. В Таблице 3 приведены показатели IC50 для отдельных линий клеток. На диаграмме показана оптическая плотность (OD) при концентрации 450 нМ минус OD при концентрации 620 нМ в зависимости от концентрации (С) DARPin/эталонов в нМ. По шкале X отложена логарифмическая шкала. На фиг. 6 В показано индуцирование апоптоза DARPin в различных концентрациях, эталонами в соответствующих концентрациях, и показаны соответствующие подогнанные кривые активации для каждого отдельного единичного эксперимента. В Таблице 3 приведены показатели IC50 для отдельных линий клеток. На диаграмме показаны относительные световые единицы (RLU) в зависимости от концентрации (С) DARPin/эталоном в нМ. По шкале X отложена логарифмическая шкала. Смотри далее определения DARPins. Τ означает трастузумаб; Ρ означает пертузумаб; # 41 означает DARPin # 41.
Фиг. 7
Ингибирование пролиферации клеток ВТ474 бипаратопными связывающими белками различных форматов
Показано ингибирование пролиферации клеток ВТ474 бипаратопными DARPins различных форматов с DARPin # 1 на N-конце и DARPin # 18 на С-конце. На фиг. 7А показано ингибирование пролиферации бипаратопными DARPins в различных концентрациях с длительным периодом полураспада в сыворотке, и показаны соответствующие подогнанные кривые ингибирования для отдельного единичного эксперимента. Бипаратопный DARPin # 63 имеет пэгилированный цистеиновый остаток на С-конце, а бипаратопные DARPins # 64 и # 65 содержат область анкиринового повтора, связывающую сывороточный альбумин. На фиг. 7 В показано ингибирование пролиферации бипаратопными DARPins в различных концентрациях, содержащими отличающиеся линкеры между повторяющимися областями, связывающими HER2, и показаны соответствующие подогнанные кривые ингибирования для отдельного единичного эксперимента. В Таблице 2 приведены показатели IC50 для DARPins. На диаграмме показана оптическая плотность (OD) при концентрации 450 мН минус OD при концентрации 620 нм в зависимости от концентрации (С) DARPins в нМ. По шкале X отложена логарифмическая шкала. Смотри далее определения DARPins. # 66 означает DARPin # 66, который содержит короткий GS-линкер длиной в две аминокислоты между двумя повторяющимися областями; # 67 означает DARPin # 67, который содержит GS-линкер длиной в пять аминокислот между двумя повторяющимися областями; #41 означает DARPin #41, который содержит GS-линкер длиной в десять аминокислот между двумя повторяющимися областями; # 68 означает DARPin # 68, который содержит РТ-линкер длиной в 24 аминокислоты между двумя повторяющимися областями.
Подробное описание изобретения
В одном из вариантов осуществления изобретения предложен рекомбинантный связывающий белок, содержащий, по меньшей мере, первую и вторую повторяющиеся области, каждая из которых связывает внеклеточную область HER2, при этом повторяющиеся области ковалентно связаны.
Было неожиданно обнаружено, что связывание внеклеточной части HER2 рекомбинантным связывающим белком, содержащим, по меньшей мере, два ковалентно связанные повторяющиеся области, каждая из которых обладает специфичностью к внеклеточной области HER2, оказывает выгодное и неожиданное действие по сравнению с рассмотренными выше известными из техники подходами, согласно которым HER2 связывают отдельные связующие (например, сочетание трастузумаба и пертузумаба; фиг. 6).
HER2 человека состоит из 1255 аминокислот с 21 аминокислотной сигнальной последовательностью, 631 аминокислотной внеклеточной областью (например, эктообластью, содержащей области I-IV), 23 аминокислотными трансмембранными областями и 580 аминокислотными цитоплазматическими областями.
Упомянутое связывание внеклеточной области HER2 рекомбинантным связывающим белком предпочтительно представляет собой синхронное или одновременное связывание повторяющимися областями внеклеточной области HER2. Кроме того, повторяющиеся области предпочтительно связывают два различных эпитопа внеклеточной области HER2. Помимо этого, повторяющиеся области предпочтительно связывают два различных и не перекрывающих друг друга эпитопа внеклеточной области HER2.
Эта повышенная эффективности может объясняться тем, что рекомбинантный связывающий белок согласно изобретению индуцирует до сих пор не описанную связанную конформацию внеклеточной области HER2, которое, вероятно, является следствием внутримолекулярного взаимодействия бипаратопного связывающего белка согласно изобретению с двумя различными эпитопами во внеклеточной области HER2 (Пример 8); т.е. обе повторяющиеся области связывающего белка, вероятно, одновременно связывают различные эпитопы в одной и той же молекуле HER2 и тем самым побуждают внеклеточную область HER2 перейти к этой новой связанной конформации. Такая связанная конформация не известна из техники. Важно, что эти две повторяющиеся области должны быть связаны за счет присутствия в одном и том же связывающем белке, т.е. простая смесь двух повторяющихся областей неэффективна (фиг. 2 В). Кроме того, бивалентное связывание внеклеточной области HER2 таким связывающим белком может создавать синергетический эффект связывания за счет повышения авидности, т.е. совокупной силы синхронного связывания различных эпитопов мишени. Авидность отличается от сродства, которое соответствует силе отдельного связывающего взаимодействия. В целом, этим специфическим взаимодействием связывающего белка с HER2 может объясняться высокоэффективное ингибирование пролиферации и индуцирования апоптоза такими молекулами, как показаны в примерах.
Согласно этой теории две повторяющиеся области в одном и том же белке взаимно усиливают связывание своего соответствующего эпитопа и тем самым обеспечивают усиление общего сродства к мишени.
В результате связывания первой повторяющейся областью своего эпитопа в HER2 вторая повторяющаяся область занимает энергетически и/или пространственно выгодное положение, которое облегчает связывание ей своего соответствующего эпитопа в HER2.
Как показано в примерах, ковалентная связь первой и второй повторяющихся областей, вероятно, усиливает их биологическую активность.
В одном из предпочтительных вариантов осуществления рекомбинантного связывающего белка согласно изобретению первая повторяющаяся область связывает область II HER2, а вторая повторяющаяся область связывает область IV HER2.
Важно понимать, что фраза "связывает область II" означает, что соответствующая повторяющаяся область связывает в основном область II HER2. Тем не менее, это определение не исключает того, что части упомянутой повторяющейся области могут связывать или перекрывать другие области. То же самое относится к выражению "связывает область IV".
Одновременное нацеливание на области II и IV HER2 бипаратопного связывающего белка согласно настоящему изобретению обеспечивает конкретные неожиданные эффекты, не известные из уровня техники. Реакция клеток на ингибирование пролиферации и индуцирования апоптоза такими связывающими белками является значительно более выраженной, чем при использовании известных антител. Например, степень такой реакции оказалась большей, чем при использовании эталонных клинических антител, таких как сочетание трастузумаба и пертузумаба, нацеленное на области IV и II HER2, соответственно (фиг. 4, 5 и 6). Интересно, что, некоторые бипаратопные белки, связывающие область I и область IV HER2, не обладают таким неожиданным действием (фиг. 3С и 3D).
Способы идентификации внеклеточной области HER2, которую связывает повторяющаяся область, например, как показано в Примере 3, хорошо известны специалистам в данной области техники (например, Jost и др., в процитированном месте).
Полученные заявителем данные имеют большое значение для лечения обусловленного HER2 рака у людей в том смысле, что нацеливание бипаратопного связывающего белка согласно настоящему изобретению одновременно на области II и IV HER2 могло бы стать более эффективной альтернативой существующим подходам к нацеливанию антител.
Соответственно, связывающий белок согласно настоящему изобретению предпочтительно является бипаратопным связывающим белком, т.е. содержит две области повтора антигена, распознающие два различных эпитопа или области (например, области II и IV) в одном и том же белке-мишени (а именно, HER2). Тем не менее, в объем изобретения входят полипептиды, которые являются мультипаратопными, т.е. содержащими области повтора антигена, распознающие три, четыре или более эпитопов в одном и том же белке-мишени, а также полипептиды, которые являются би- или мультипаратопными и многовалентными, т.е. также содержат области повтора антигена, распознающие один или несколько других белков-мишеней.
Используемым термином HER2 обозначается рецептор эпидермального фактора роста человека 2-го типа, также известный как Neu, ErbB-2, CD340 (группа дифференциации 340) или р185. HER2 входит в семейство рецепторов эпидермального фактора роста (EGFR/ErbB). В организме человека HER2 кодируется ERBB2, известным протоонкогеном, который содержится в длинном плече хромосомы 17 (17ql2) человека. HER2 зарегистрирован под номером Р04626 в базе данных UniProtKB/Swiss-Prot.
В одном из предпочтительных вариантов осуществления изобретения первая и вторая повторяющиеся области находятся в одном и том же полипептиде, при этом повторяющаяся область, нацеленная на область II HER2, находится на N-конце повторяющейся области, нацеленной на область IV HER2.
Эти варианты осуществления проиллюстрированы, например, на фиг. 2А и в соответствующем описании. Авторами изобретения неожиданно обнаружено, что связывающий белок, у которого повторяющаяся область, нацеленная на область II HER2, находится на С-конце повторяющейся области, нацеленной на область IV HER2, значительно менее эффективен, чем связывающий белок, у которого повторяющаяся область, нацеленная на область II HER2, находится на N-конце повторяющейся области, нацеленной на область IV HER2.
Первая повторяющаяся область, связывающая область II HER2, предпочтительно не конкурирует с пертузумабом за связывание HER2. Такие повторяющиеся области, которые не конкурирует с пертузумабом за связывание HER2, показаны, например, на фиг. 1С. Аналогичным образом, вторая повторяющаяся область, связывающая IV HER2, не конкурирует с трастузумабом за связывание HER2. Например, повторяющиеся области с DARPins # 18-20 не конкурирует с трастузумабом за связывание HER2. Специалистам в данной области техники хорошо известно, как определять, конкурирует ли повторяющаяся область с трастузумабом или пертузумабом за связывание HER2, например, как показано в Примере 3.
Это означает, что в первом предпочтительном варианте осуществления первая повторяющаяся область и пертузумаб связывают не один и тот же эпитоп области II HER2. Аналогичным образом, во втором предпочтительном варианте осуществления вторая повторяющаяся область и трастузумаб связывают не один и тот же эпитоп области IV HER2. Вне связи с теорией авторы объясняют этим, по меньшей мере, часть эффектов, продемонстрированных в экспериментальном разделе.
В другом предпочтительном варианте осуществления изобретения первой повторяющейся областью является область анкиринового повтора или сконструированная область анкиринового повтора, и второй повторяющейся областью является область анкиринового повтора или сконструированная область анкиринового повтора.
Области анкириновых повторов или сконструированные области анкириновых повторов предпочтительно содержат от 70 до 300 аминокислот, в частности, от 90 до 200 аминокислот.
Повторяющейся областью согласно изобретению также предпочтительно является область анкиринового повтора сконструированная область анкиринового повтора, описанная в WO 2002/020565. Примеры сконструированных областей анкириновых повторов со специфичностью бипаратопного связывания различных областей Her2 приведены в Примерах.
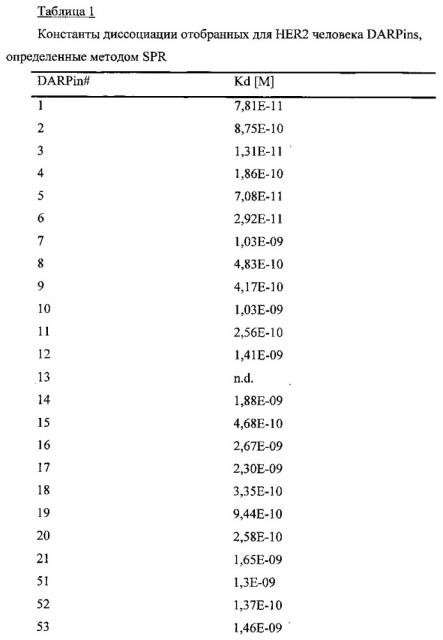
В одном из предпочтительных вариантов осуществления изобретения первая повторяющаяся область связывает внеклеточную область HER2 в PBS при Kd менее 10-7 M, а вторая повторяющаяся область связывает внеклеточную область HER2 в PBS при Kd менее 10-7 М.
Kd означает константу диссоциации, которая пояснена далее в тексте. Kd менее 10-7 M требуется для обеспечения достаточного сродства повторяющейся области к ее мишени. Повторяющиеся области предпочтительно связывают свои области-мишени в PBS при Kd менее 10-8М, 10-9М, 10-10М, наиболее предпочтительно менее 10-11М.
Рекомбинантные связывающие белки, представляющие собой белки, связывающие область II и/или область IV Her2 в PBS при Kd менее 10-7М, показаны в Примере 2.
В одном из предпочтительных вариантов осуществления связывающий белок ингибирует стимулированную пролиферацию клеток ВТ474 при показателе концентрации полумаксимального ингибирования (IC50) менее 100 нМ. Связывающий белок предпочтительно ингибирует стимулированную пролиферацию клеток ВТ474 при показателе IC50 менее 90, 80, 70, 60, 50, 40, 30, 20 или 10 нМ. Кроме того, связывающий белок предпочтительно ингибирует стимулированную пролиферацию клеток ВТ474, по меньшей мере, на 100%, 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20% или 10%.
Для определения функциональной способности связывающих белков согласно изобретению ингибировать пролиферацию стандартными средствами, известными специалистам в данной области техники, например, как показано в Примере 4 могут использоваться клетки ВТ474. Для определения функциональной способности соединений согласно изобретению ингибировать пролиферацию предпочтительно могут использоваться клетки ВТ474, SKBR-3, NCI-N87, ZR75-30, НСС1419 или MDA-MB175, например, как показано в Примере 5.
Рекомбинантные связывающие белки, которые ингибируют стимулированную пролиферацию клеток ВТ474 при показателе IC50 менее 100 нМ, описаны и рассмотрены в Примере 4.
В другом предпочтительном варианте осуществления связывающий белок индуцирует апоптоз в клетках ВТ474 при показателе полумаксимальной эффективной концентрации (ЕС50) менее 100 нМ. Связывающий белок предпочтительно индуцирует апоптоз в клетках ВТ474 при показателе ЕС50 менее 90, 80, 70, 60, 50, 40, 30, 20 или 10 нМ.
Для определения функциональной способности связывающих белков согласно изобретению индуцировать апоптоз стандартными средствами, известными специалистам в данной области техники, например, как показано в Примере 5, могут использоваться клетки ВТ474. Для определения функциональной способности соединений согласно изобретению индуцировать апоптоз предпочтительно могут использоваться клетки ВТ474, SKBR-3, NCI-N87, ZR75-30, НСС1419 или MDA-MB175, например, как показано в Примере 5.
Рекомбинантные связывающие белки, которые вызывают апоптоз в клетках ВТ474 при показателе ЕС50 менее 100 нМ, описаны и рассмотрены в Примере 5.
В одном из предпочтительных вариантов осуществления первая и вторая повторяющиеся области соединены полипептидным линкером.
Такой полипептидный линкер может, например, быть реализован путем простого генетического слияния кодирующих кДНК соответствующих областей для слияния. В варианте осуществления такого типа слитым пептидом считается белок с двумя различными повторяющимися областями.
Линкер может состоять, например, из олигопептида, содержащего аминокислоты G и S или Ρ и Т, соответственно, согласно последовательностям SEQ ID 7-12. В другом предпочтительном варианте осуществления может использоваться описанный далее "способный к мультимеризации фрагмент". В качестве альтернативы, две повторяющиеся области могут быть связаны друг с другом, например, посредством химических линкеров не пептидной основе.
Рекомбинантный связывающий белок и/или повторяющаяся область предпочтительно имеет среднюю температуру денатурации (Tm) выше 45°С, более предпочтительно выше 50°С, еще более предпочтительно выше 55°С, наиболее предпочтительно выше 60°С после теплового разворачивания в PBS при рН 7,4. Связывающий белок или повторяющаяся область согласно изобретению обладает заданной вторичной и третичной структурой в физиологических условиях. В результате теплового разворачивания такой полипептид теряет свою вторичную и третичную структуру, после чего могут осуществляться, например, измерения циркулярного дихроизма (CD). Средняя температура денатурации связывающего белка или повторяющейся области после теплового разворачивания соответствует температуре в срединной точке кооперативного перехода в физиологическом буфером после тепловой денатура