Гидройодная соль 7-метил-2'-дезоксигуанозина в качестве субстрата для получения 2'-дезоксинуклеозидов методом ферментативного трансгликозилирования
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и фармацевтической химии. Предложено применение гидройодной соли 7-метил-2'-дезоксигуанозина для получения 2'-дезоксинуклеозидов по ферментативной реакции трансгликозилирования. Смешивают гидройодную соль 7-метил-2'-дезоксигуанозина и основание B в присутствии дигидрофосфата калия и нуклеозидфосфорилаз Е. coli. Основание В представляет собой , в котором R1=Н, F, Cl, NH2, R2=NHR или OR, где R=Н, метил, бензил, фенилэтил и другие заместители; или, где R=Н, F, метил, этил, изопропил или другие заместители. В качестве нуклиозодфосфорилаз используют пуриннуклеозидфосфорилазу (ПНФ) Е. coli и тимидинфосфорилазу (ТФ) Е. coli. Для получения пиримидиновых 2'-дезоксирибонуклеозидов используют смесь ферментов ПНФ и ТФ, а для получения пуриновых 2'-дезоксирибонуклеозидов - фермент ПНФ. Причем гидройодную соль 7-Me-dGuo используют в количестве 1,5 эквивалента по отношению к основанию В, а дигидрофосфат калия - в количестве 0,2-0,7 эквивалента по отношению к основанию В. Изобретение позволяет получать разнообразные 2'-дезоксирибонуклеозиды, в том числе терапевтически важные нуклеозиды, и довести выходы целевых нуклеозидов практически до количественных по данным ВЭЖХ и по меньшей мере до 80% после выделения и хроматографической очистки. 4 ил., 1 табл., 7 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области биотехнологии (применение ферментов для получения природных нуклеозидов и их аналогов) и фармацевтической химии (применение ферментов для получения лекарственных веществ на основе нуклеозидов).
Анализ источников новых лекарств за период с 1981 по 2010 год показал, что только 36% новых биологически активных веществ были обнаружены без использования природных соединений в качестве родоначальных структур (М.Е. Maier. Design and synthesis of analogues of natural products. Org. Biomol. Chem. 13, 5302-5343, 2015).
Структура природных нуклеозидов является одной из наиболее плодотворных в разработке новых лекарственных веществ. В настоящее время в клинической практике используется ряд современных препаратов, созданных на основе модифицированных нуклеозидов и обладающих широким спектром биологической активности: противоопухолевой (Кладрибин, Флударабин, Пентостатин, Неларабин, Видаза, Децитабин и др.), противовирусной (гепатит С, герпес, ВИЧ и др. - Рибавирин, Видарабин, Зидовудин, Ламивудин и др) (W.B. Parker. Enzymology of Purine and Pyrimidine Antimetabolites Used in the Treatment of Cancer. Chem. Rev. 109, 2880-2893, 2009; E De Clercq, G. Li. Clinical Microbiology Reviews, Approved antiviral drugs over the past 50 years, 29, 695-747, 2016). Применение известных лекарственных препаратов в терапевтической практике и поиск новых биологически активных веществ в ряду аналогов природных нуклеозидов тесно связаны с разработкой новых методов синтеза нуклеозидов. В последние годы в развитых странах активно развивается так называемая "зеленая" химия, целью которой является замена традиционного химического синтеза различными каталитическими методами без использования токсичных органических растворителей. Альтернативой химическому синтезу является ферментативный синтез, который позволяет получать как природные нуклеозиды, так и лекарственные препараты нуклеозидной природы (кладрибин, 5-фтордезоксиуридин, флударабин, неларабин, видарабин и др.) и имеет промышленное значение. Для получения практически важных нуклеозидов активно разрабатываются и применяются технологии, основанные на ферментативных реакциях трансгликозилирования - переноса углеводного остатка с одного гетероциклического основания на другое. В настоящем изобретении предлагается новый способ получения ряда 2'-дезоксинуклеозидов из субстрата 7-метил-2'-дезоксигуанозина гидройодида, основанный на ферментативной реакции трансгликозилирования.
Уровень техники
В настоящее время в клинической практике используется ряд современных препаратов, созданных на основе модифицированных нуклеозидов и обладающих широким спектром биологической активности: противоопухолевой (Кладрибин, Флударабин, Пентостатин, Неларабин, Видаза, Децитабин и др.), противовирусной (гепатит С, герпес, ВИЧ и др.- Рибавирин, Видарабин, Зидовудин, Ламивудин и др) (W.B. Parker. Enzymology of Purine and Pyrimidine Antimetabolites Used in the Treatment of Cancer. Chem. Rev. 109, 2880-2893, 2009; E De Clercq, G. Li. Clinical Microbiology Reviews, Approved antiviral drugs over the past 50 years, 29, 695-747, 2016).
Существуют два основных метода получения аналогов нуклеозидов. Первый метод основан на модификации природных соединений (M.S. Drenichev, V.E. Oslovsky, S.N. Mikhailov. Cytokinin Nucleosides - Natural compounds with a unique spectrum of biological activities. Current Topics in Medicinal Chemistry, 16, 2562-2576, 2016).
Во втором сначала получают производные гетероциклических оснований и моносахаридных производных, а затем получают нуклеозиды (С.Н. Михайлов, Ю.П. Лысов, Г.И. Яковлев. Применение функционально-компетентных аналогов нуклеозидов и нуклеотидов для изучения фермент-субстратных взаимодействий. Молекулярная биология, 33, 393-407, 1999). В этом методе ключевой стадией синтеза является создание N-гликозидной связи. К настоящему времени разработаны удобные и эффективные методы получения рибонуклеозидов, исходя из триметилсилильных производных гетероциклических оснований и полностью ацилированной рибофуранозы в присутствии кислот Льюиса. (, С. Ruh-Pohlenz. Handbook of nucleoside synthesis (Vol. 60). John Wiley & Sons, 2001). Стереоселективность реакции определяется 2-О-ацильной группой, участвующей в образовании ацилоксониевого иона, продуктами этих реакций являются природные β-нуклеозиды, в которых гетероциклическое основание находится в транс-положении по отношению к 2-О-ацильной группе. Когда эта группа отсутствует, как в случае 2-дезоксирибозы, образуется смесь α,β-изомеров, что существенно затрудняет выделение и очистку искомых соединений. При гликозилировании производных D-арабинозы образуются α-нуклеозиды, в которых гетероциклическое основание находится в транс-положении по отношению 2-O-ацильной группе.
Ферментативные методы синтеза существенно дополняют химические и, в ряде случаев, имеют несомненные преимущества (I.A. Mikhailopulo, A.I. Miroshnikov, Biologically important nucleosides: modern trends in biotechnology and application. Mendeleev Commun., 2011, 21, 57-68). В последние годы в промышленно развитых странах активно развивается так называемая «зеленая» химия, целью которой является замена традиционного химического синтеза различными каталитическими методами без использования токсичных органических растворителей. Для получения нуклеозидов используют нуклеозидфосфорилазы (НФ): ферменты, катализирующие обратимый фосфоролиз нуклеозидов с образованием α-D-пентафуранозо-1-фосфата и гетероцикличекого основания: нуклеозид + Pi ↔ основание + α-D-пентафуранозо-1-фосфат.
Нуклеозидфосфорилазы играют ключевую роль в метаболизме нуклеозидов. Эти ферменты обнаружены почти у всех организмов, при этом отличия их первичной структуры сравнительно невелики. Наиболее специфичным ферментом является тимидинфосфорилаза (ТФ) (КФ 2.4.2.4), субстратами которого являются тимидин и 2'-дезоксиуридин. Помимо этих нуклеозидов, уридинфосфорилаза (УФ) (КФ 2.4.2.3) осуществляет фосфоролиз и уридина. Субстратами пуриннуклеозидфосфорилазы (ПНФ) (КФ 2.4.2.1) являются пуриновые нуклеозиды как рибо-, так и 2'-дезоксириборяда (M.J. Pugmire, S.E. Ealick, Structural analyses reveal two distinct families of nucleoside phosphorylases. Biochemical Journal, 361, 1-25, 2002). Равновесие этих реакций сдвинуто в сторону образования нуклеозидов, причем в случае пуриновых более значительно (Goldberg RN, Tewari YB, Bhat TN, "Thermodynamics of Enzyme-Catalyzed Reactions -a Database for Quantitative Biochemistry", Bioinformatics 2004, 20, 2874-2877). На этой особенности и основана эффективность ферментативной реакции трансгликозилирования, в ходе которой происходит перенос углеводного остатка от пиримидинового нуклеозида (B-Nuc) на пуриновое гетероциклическое основание (В') (И.А. Михайлопуло, А.И. Мирошников. Biologically important nucleosides: modern trends in biotechnology and application. Mendeleev Commun., 21, 57-68, 2012; L.E. Iglesias, E.S. Lewkowicz, R. Medici, P. Bianchi, A.M. Iribarren. Biocatalytic approaches applied to the synthesis of nucleoside prodrugs. Biotechnology Advances 33, 412-434, 2015).
Анализ литературных данных позволяет заключить, что ферментативные методы создания гликозидной связи могут конкурировать с химическими при получении фармацевтически важных 2'-дезоксирибонуклеозидов (кладрибин) и β-D- арабинофуранозилнуклеозидов (флударабин и неларабин) (Фиг. 1).
НФ катализируют реакции расщепления N-гликозидной связи в присутствии фосфата с образованием гетероциклического основания (В1) и α-D-(2-дезокси)рибофуранозо-1-фосфата (Фиг. 2, стадия 1). В процессе используются ферменты: тимидинфосфорилаза, уридинфосфорилаза и пуриннуклеозидфосфорилаза. На следующей стадии (Фиг. 2, стадия 2) происходит перенос углеводного остатка от одного гетероциклического основания (В1) на другое (В2). Анализ реакции трансгликозилирования показал, что выходы искомых нуклеозидов зависят от соотношения констант равновесия реакций фосфоролиза нуклеозидов (Kp1/Kp2). Максимального выхода можно достичь, если равновесие стадии 1 сильно сдвинуто в сторону образования α-D-рибофуранозо-1-фосфата или α-D-(2-дезокси)рибофуранозо-1-фосфата, а равновесие стадии 2 сдвинуто в сторону целевого нуклеозида (Nuc-2). Поэтому α-D-пентафуранозо-1-фосфаты являются оптимальными субстратами для достижения максимального выхода целевого нуклеозида. α-D-рибофуранозо-1-фосфат и α-D-(2-дезокси)рибофуранозо-1-фосфат являются коммерчески доступными соединениями, а также могут быть получены тремя путями:
1. Химический синтез (Н. Komatsu, Н. Awano. First stereoselective synthesis of 2-deoxy-α-D-ribofuranosyl-1-phosphate: novel application of crystallization-induced asymmetric transformation. J. Org. Chem., 2002, 67, 5419-5421).
2. Ферментативный фосфоролиз тимидина в присутствии ТФ (I.V. Fateev, М.I. Kharitonova, K.V. Antonov, I.D. Konstantinova, V.N. Stepanenko, R.S. Esipov, F. Seela, K.W. Temburnikar, K.L. Seley-Radtke, V.A. Stepchenko, Y.A. Sokolov, A.I. Miroshnikov, I.A. Mikhailopulo. Recognition of Artificial Nucleobases by E. coli Purine Nucleoside Phosphorylase versus its Ser90Ala Mutant in the Synthesis of Base-Modified Nucleosides. Chemistry-A European Journal, 21, 13401-13419, 2015)
3. Ферментативный синтез из D-(2-дезокси)рибофуранозо-5-фосфата (I.A. Mikhailopulo, A.I. Miroshnikov, Biologically important nucleosides: modern trends in biotechnology and application. Mendeleev Commun., 2011, Tischer W., Ihlenfeldt H. - G., Barzu O., Sakamoto H., Pistotnik E., Marliere P., Pochet S. Enzymatic Synthesis of Deoxyribonucleosides. US Patent 7,229,797, Jun. 12, 2007).
4. Фосфоролиз 7-метилгуанозина и его аналогов в присутствии НФ (W.J. Hennen, C.H. Wong. A new method for the enzymic synthesis of nucleosides using purine nucleoside phosphorylase. J. Org. Chem. 54, 4692-4695, 1989; C.-H. Wong; W.J. Hennen, process for the enzymatic synthesis of nucleosides US Patent 5075225, Dec. 24, 1991).
α-D-Рибофуранозо-1-фосфат (или α-D-(2-дезокси)рибофуранозо-1-фосфат) далее вводится в реакцию с гетероциклическим основанием В2 в присутствии НФ с образованием нуклеозида Nuc-2. Для получения нуклеозидов как рибо-, так и 2'-дезоксириборяда можно использовать соответствующие продажные пентафуранозо-1-фосфаты (Т. Araki, I. Ikeda, K. Matoishi, R. Abe, Т. Oikawa, Y. Matsuba, H. Ishibashi, K. Nagahara, Y. Fukuiri. Method for producing cytosine nucleoside compounds. US Patent 7,629,457 B2 Dec. 8, 2009).
Методы 1 и 3 достаточно трудоемки, а коммерчески доступные пентафуранозо-1-фосфаты имеют высокую стоимость, что, безусловно, отражается на себестоимости целевых продуктов. Поэтому получение пентафуранозо-1-фосфатов фосфоролизом 7-метилгуанозина и его аналогов является наиболее простым и экономически эффективным методом. Достоинством этого метода также является возможность совмещения стадий 1 и 2 (Фиг. 2) без выделения промежуточного лабильного пентафуранозо-1-фосфата.
7-Метилгуанозин используется для получения пуриновых рибонуклеозидов (W.J. Hennen, C.H. Wong. A new method for the enzymic synthesis of nucleosides using purine nucleoside phosphorylase. J. Org. Chem. 54, 4692-4695, 1989; C.-H. Wong; W.J. Hennen, Process for the enzymatic synthesis of nucleosides US Patent 5075225, Dec. 24, 1991; D. Ubiali, C.F. Morelli, M. Rabuffetti, G. Cattaneo, I. Serra, T. Bavaro, G. Speranza. Substrate Specificity of a Purine Nucleoside Phosphorylase from Aeromonas hydrophila. Toward 6-Substituted Purines and its Use as a Biocatalyst in the Synthesis of the Corresponding Ribonucleosides. Curr. Org. Chem. 19, 2220-2225, 2015).
Было показано, что фосфоролиз 7-метилгуанозина ПНФ протекает количественно с образованием α-D-рибофуранозо-1-фосфата (E. Kulikowska, A. Bzowska, J. Wierzchowski, D. Shugar. Properties of two unusual, and fluorescent, substrates of purine-nucleoside phosphorylase: 7-methylguanosine and 7-methylinosine. Biochimica et Biophysica Acta,, 874, 355-363, 1986), т.е. равновесие стадии 1 полностью сдвинуто в сторону образования 7-метилгуанина. Таким образом, 7-метилгуанозин является недорогой альтернативой α-D-рибофуранозо-1-фосфату. Мы предположили, что фосфоролиз 7-метил-2'-дезоксигуанозина будет протекать аналогично.
Использование 7-метил-2'-дезоксигуанозина для ферментативного синтеза нуклеозидов не освещено в литературе, что, по-видимому, связано с его термолабильностью и достаточно низкой устойчивостью в водных растворах (J.W. Jones, R.K. Robins, Purine nucleosides. III. Methylation studies of certain naturally occurring purine nucleosides. J. Am. Chem. Soc, 1963, 85, 193-201).
Раскрытие сущности изобретения
Сущность изобретения заключается в применении гидройодной формы 7-метил-2'-дезоксигуанозина для получения 2'-дезоксинуклеозидов (в том числе - лекарственного препарата - кладрибина) по ферментативной реакции транс-гликозилирования в присутствии нуклеозидфосфорилаз НФ (тимидинфосфорилазы Е. coli - ТФ и пуринуклеозидфосфорилазы Е. coli - ПНФ)
Изобретение решает задачу получения 2'-дезоксинуклеозидов исходя из гидройодной формы 7-метил-2'-дезоксигуанозина (7-Me-dGuo). Применение этого соединения в качестве субстрата ПНФ в реакции трансгликозилирования позволяет получать 2'-дезоксинуклеозиды с высоким выходом, используя небольшой избыток гидройодной формы 7-Me-dGuo (1.5 эквивалента к пуриновому или пиримидиновому основанию) и недостаток фосфата (0.2-0.7 эквивалентов к пуриновому или пиримидиновому основанию). Ближайшими прототипами являются цитированные выше патент и публикация (W.J. Hennen, C.H.Wong. A new method for the enzymic synthesis of nucleosides using purine nucleoside phosphorylase. J. Org. Chem. 54, 4692-4695, 1989; C. - H. Wong; W.J. Hennen, Process for the enzymatic synthesis of nucleosides US Patent 5075225, Dec. 24, 1991).
Для успешного проведения ферментативной реакции трансгликозилирования необходимо использование исходных субстратов высокой степени чистоты. Метилирование 2'-дезоксигуанозина (J.W. Jones, R.K. Robins, Purine nucleosides. III. Methylation studies of certain naturally occurring purine nucleosides. J. Am. Chem. Soc, 1963, 85, 193-201) протекает с частичным разложением образующегося продукта, что подтверждается тонкослойной хроматографией (ТСХ). Для повышения чистоты и стабильности выделяемого 7-метил-2'-дезоксигуанозина этот метод был модифицирован. Добавление в реакционную смесь карбоната бария приводило к заметной стабилизации образующего продукта в условиях реакции. Замена диметилсульфоксида на более низкокипящий растворитель диметилформамид (ДМФА) позволила точнее контролировать протекание химической реакции, что важно при получении лабильных соединений. Продукт выделяли из реакционной смеси фильтрацией от карбоната бария с последующим высаживанием в трихлорметане. Чистота 7-метил-2'-дезоксигуанозина в виде гидройодной формы составляет >98% согласно 1Н-ЯМР спектроскопии. Методика позволяет получать нуклеозид в виде гидройодной формы в граммовых количествах (10-100 грамм).
Гидройодная форма 7-метил-2'-дезоксигуанозина стабильна в твердом агрегатном состоянии при хранении в морозильной камере при температуре ниже 0°С (при -20°С), что согласуется с литературными данными (J.W. Jones, R.K. Robins, Purine nucleosides. III. Methylation studies of certain naturally occurring purine nucleosides. J. Am. Chem. Soc, 1963, 85, 193-201). Хорошая растворимость (примерно 30 мМ) гидройодной формы 7-Me-dGuo делает ее использование в ферментативной реакции предпочтительным, чем его цвиттер-ионной формы, которая плохо растворима в воде, диметилсульфоксиде и водно-спиртовых смесях.
7-Метилпроизводные гуанозина достаточно стабильны в водных растворах при высокой температуре (t≤90°C) в диапазоне значений рН 2<рН<6. При нагревании до 90°С в кислой среде (рН<2) происходит расщепление N-гликозидной связи, а в основной среде (рН>7) - раскрытие имидазольного цикла (М. Lahti, Н. Santa, Е. Darzynkiewicz, Н. pH-Independent depurination of 7-alkylguanosines and their 5'-monophosphates. Acta Chemica Scandinavica, 1990, 44, 636-638). 7-Метил-2'-дезоксигуанозин существенно менее стабилен в водных растворах по сравнению с 7-метилгуанозином. α-D-(2-дезокси)рибофуранозо-1-фосфат неустойчив в кислых условиях (Н. Komatsu, Н. Awano. First stereoselective synthesis of 2-deoxy-α-D-ribofuranosyl-1-phosphate: novel application of crystallization-induced asymmetric transformation. J. Org. Chem., 2002, 67, 5419-5421) и при повышенной температуре (30-60°С) (Н.Г. Панова, Е.В. Щевелёва, К.С. Алексеев, В.Г. Мухортов, А.Н. Зуев, С.Н. Михайлов, Р.С. Есипов, Д.В. Чувиковский, А.И. Мирошников. Использование 4-тиоуридина и 4-тиотимидина для изучения пиримидиннуклеозидфосфорилаз. Молекулярная биология, 38(5), 907-913, 2004).
Свойства 7-метил-2'-дезоксигуанозина и α-D-(2-дезокси)рибофуранозо-1-фосфата определяют выбор условий проведения ферментативных реакций. Раствор гидройодной соли 7-Me-dGuo в 50 мМ Трис-HCl буфере (рН 7,5) хорошо хранится при +8°С в течение недели (гидролиз - 5% через неделю по данным ВЭЖХ). Согласно данным УФ-спектроскопии и ВЭЖХ-анализа, раствор гидройодной соли 7-Me-dGuo в 50 мМ Трис-HCl буфере (рН 7,5) достаточно устойчив при 20°С (по данным ВЭЖХ гидролиз незначителен через час, меньше 10% через сутки и 30% через двое суток). Гидройодная соль 7-Me-dGuo неустойчива в водных растворах при рН 4,1 и 20°С.
Таким образом, общая схема реакции ферментативного трансгликозилирования (Фиг. 2) существенно упрощается - стадия 1 является необратимой. 7-Метил-2'-дезоксигуанозин, как и 7-метилгуанозин, практически необратимо подвергается фосфоролизу в присутствии ПНФ Е. coli с выходом, близким к количественному (Фиг. 3). Образование пуриновых нуклеозидов протекает в присутствии одного фермента - ПНФ, образование пиримидиновых нуклеозидов протекает в присутствии двух ферментов - ПНФ и ТФ. ПНФ обладает широкой специфичностью, что позволяет получать пуриновые 2'-дезоксинуклеозиды, содержащие атомы хлора, фтора, аминогруппу в положении 2 пуринового основания и группы метиламино-, этиламино-, бензиламино-, фенилэтиламино-, метокси-, этокси-, бензилокси- и другие заместители в положении 6 пуринового основания. ТФ также обладает широкой специфичностью, что дает возможность получать производные 2'-дезоксиуридина, содержащие в 5-м положении атомы водорода (урацил), фтора (5-фторурацил), метил-радикал (тимин), этил-радикал (5-этилурацил), изопропил-радикал (5-изопропилурацил) и другие заместители.
Использование небольшого избытка (1,5 экв.) 7-метил-2'-дезоксигуанозина по отношению к основанию и недостатка фосфата (0,2-0,7 экв.) позволяет довести выходы целевых нуклеозидов практически до количественных по данным ВЭЖХ и примерно до 80% (а иногда и до 93-94%) после выделения и хроматографической очистки (таблица 1). Использование небольших избытков упрощает выделение и очистку целевых продуктов хроматографией на силикагеле, также снижает их стоимость.
Контроль за протеканием ферментативных реакций проводится с помощью ВЭЖХ (Фиг. 4). В момент времени t0 (Фиг. 4, А) в смеси присутствует сигнал исходного основания - 5-этилурацила. При ВЭЖХ на обращенно-фазном сорбенте Luna® C18 7-метил-2'-дезоксигуанозин дает сигнал в виде очень широкого пика (иногда RT ~ 4.00-5.50 мин, практически всегда детекция сигнала при указанных выше условиях невозможна), который трудно интегрировать, поэтому реакцию трансгликозилирования удобнее контролировать по соотношению сигналов 5-этилурацила и 5-этил-2'-дезоксиуридина. После установления равновесия в реакции транс-гликозилирования (Фиг. 4, В) наблюдается образование 7-метилгуанина и целевого продукта, а интенсивность сигнала 5-этилурацила заметно снижается.
Таким образом, предлагаемый нами метод позволяет получать разнообразные 2'-дезоксирибонуклеозиды, в том числе терапевтически важные нуклеозиды 5-фтор-2'-дезоксиуридин и 2-хлоро-6-аминопурин-2'-дезоксирибозид (противоопухолевый препарат кладрибин). Достоинствами данного метода являются: использование гидройодной соли 7-метил-2'-дезоксигуанозина в качестве донора углеводного остатка, возможность получения с высоким выходом как пуриновых, так и пиримидиновых 2'-дезоксинуклеозидов исходя из соответствующих гетероциклических оснований.
Краткое описание фигур и таблиц
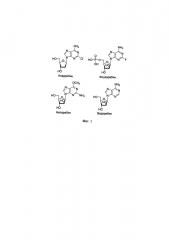
Фиг. 1. Кладрибин, флударабин, неларабин и видарабин - фармацевтически важные нуклеозиды. На фигуре приведены структуры лекарственных препаратов нуклеозидной природы кладрибина, флударабина, неларабина и видарабина, широко используемых в медицинской практике;
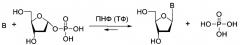
Фиг. 2. Реакции ферментативного фосфоролиза нуклеозидов и реакции трансгликозилирования. NP1, NP2 - нуклеозидфосфорилазы, B1 и В2 - гетероциклические основания, R - Н или ОН. На фигуре приведены основные стадии трансгликозилирования;
Фиг. 3. Получение 2'-дезоксирибонуклеозидов методом трансгликозилирования в трис-HCl буфере (рН 7.5) при 20°С. Реагенты и условия. ПНФ Е. coli + ТФ Е. coli (для пиримидиновых оснований), 24 ч, 79-94%. Фигура иллюстрирует получение 2'-дезоксирибонуклеозидов из гидройодида в качестве субстрата в присутствии нуклеозидфосфорилаз по реакции трансгликозилирования;
Фиг. 4. Ферментативный синтез 5-этил-2'-дезоксиуридина методом трансгликозилирования (ВЭЖХ-анализ смеси на обращенно-фазном сорбенте Luna® С18). Фигура иллюстрирует пример ВЭЖХ - анализа протекания реакции ферментативного синтеза 5-этил-2'-дезоксиуридина. А - до добавления ферментов (момент времени t0), В - после установления равновесия (момент времени teq - 24 ч). 1-5-этилурацил, 2-7-метилгуанин, 3-5-этил-2'-дезоксиуридин.
Табл. 1. Выходы нуклеозидов, полученных по реакции трансгликозилирования (Трис-HCl буфер, рН 7,5, 20°С, 24 ч). В таблице приведено описание выходов нуклеозидов, полученных по реакции трансгликозилирования.
Осуществление изобретения
Структура заявленных соединений подтверждена методами УФ и ЯМР-спектроскопии. ЯМР-спектры регистрируют на приборе Bruker АМХ 300 (Германия). Химические сдвиги (δ) в 1H-ЯМР приводят в миллионных долях (м.д.) и измеряют относительно остаточного сигнала растворителя: DMSO-d6 - 2,50 м.д., D2O - 4,79 м.д. Величины констант спин - спинового взаимодействия (J) измеряют в герцах (Гц). При описании спектров 1Н-ЯМР принимают следующие сокращения: с - синглет, ус - уширенный синглет, д - дублет, т - триплет, м - мультиплет. УФ-спектры регистрируют в воде на приборе Cary 300 UV/VIS (Varian, Австралия). Тонкослойную хроматографию проводят на пластинках Kieselgel 260 F (Merck) с УФ-детекцией (λ=254 нм). ВЭЖХ анализ транс-гликозилирования проводят на хроматографической колонке 4,6×150 мм (диаметр частиц 5 мкм, обращенно-фазный сорбент Luna® C18(2), диаметр пор 100 , каталожный номер 00F-4252-EC, производитель Phenomenex (США)), оснащенной защитной предколонкой стандарта ЕС (4,0×3,0 мм, диаметр частиц 5 мкм, обращенно-фазный сорбент C18 каталожный номер AJ0-4287, производитель Phenomenex (США)) в линейном градиенте ацетонитрила от 2 до 12% за 10 минут в деионизированной воде, скорость потока - 1 мл/мин, УФ-детекцию проводят при длине волны 260 нм. ВЭЖХ анализ устойчивости гидройодной формы 7-метил-2'-дезоксигуанозина проводят на хроматографической колонке 4,6×250 мм (диаметр частиц 5 мкм, сорбент Luna® NH2, диаметр пор 100 , каталожный номер 00G-4378-E0, производитель Phenomenex (США)), оснащенной защитной предколонкой стандарта ЕС (4,0×3,0 мм, диаметр частиц 5 мкм, сорбент Luna® NH2 каталожный номер AJ0-4302, производитель Phenomenex (США)) в линейном градиенте ацетонитрила от 2 до 12% за 10 минут в деионизированной воде, скорость потока - 1 мл/мин, УФ-детекцию проводят при длине волны 280 нм. Колоночную хроматографию проводят на силикагеле Kieselgel (0,040-0,063 мм, Merck). Очистку растворителей проводят по стандартным методикам. Для проведения трансгликозилирования используют ферментные препараты пуриннуклеозидфофорилазы E. coli (80 ед.акт./мл, 3,99 мг/мл) и тимидинфосфорилазы E. coli (1200 ед.акт./мл, 7,78 мг/мл).
Пример 1. Синтез 7-Метил-2'-дезоксигуанозина гидройодида.
К раствору 5 г (17,5 ммоль) дезоксигуанозина моногидрата в 100 мл сухого ДМФА присыпают 6,9 г (35 ммоль) карбоната бария. К полученной суспензии при интенсивном перемешивании прикапывают 10,9 мл (175 ммоль) йодометана. Реакцию проводят при перемешивании в плотно закрытой колбе при температуре 20°С в течение 5,5 ч. Затем реакционную смесь выдерживают 30 мин на открытом воздухе и фильтруют через целит (Hyflo Super Cel, диаметр фильтра - 40 мм, толщина уплотненного слоя целита - 20 мм). Целит промывают 50 мл ДМФА, полученный отфильтрованный раствор разбавляют 2 л хлороформа и выдерживают при 0°С в течение 16 ч. Выпавший осадок отфильтровывают, промывают этиловым спиртом (100 мл), хлороформом (100 мл) и сушат 1 ч на масляном насосе. Выход 5,37 г (75%) в виде белого порошка. Rƒ 0,095 (метиленхлорид - этанол, 1:1, v/v). 1Н ЯМР (300 МГц, DMSO-d6): 11,63 ус (1Н, NH 7-Me-Gua), 9,27 с (1H, Н8 7-Me-Gua), 7,15 ус (2Н, NH2 7-Me-Gua), 6,19 т (1Н, J1'2'a=J1'2'b=6,0, H1'), 5,50-5,25 м (1Н, ОН), 5,25-4,75 м (1Н, ОН), 4,37 ддд (1Н, J3'2'a=5.0, J3'2'b=4,8, J3'4'=3,9, Н3'), 4,00 с (3Н, СН3), 3,92 тд (1Н, J4'3'=3,9, J4'5'a=4,2, J4'5'b=4,2, Н4'), 3,62 дд (1Н, J5'a4'=4,2, J5'a5'b=-12,0, Н5'а), 3,57 дд (1H, J5'b5'a=4,2, J5'b5'a=-12,0, Н5'b), 2,55-2,45 м (1Н, Н2'а), 2,40 ддд (1Н, J2'b2'a=-13,4, J2'b1'=6,0, J2'b3'=4,8, H2'b). УФ (H2O, рН 4,1): λmax (ε)=256 нм (11000); λmax (ε)=281 нм (7600); УФ (Трис-HCl буфер, рН 7,5): λmax (ε)=256 нм (7100); λmax (ε)=281 нм (7600).
Пример 2. Изучение стабильности 7-метил-2'-дезоксигуанозина гидройодида в воде.
Для изучения стабильности 7-метил-2'-дезоксигуанозина гидройодида при 20°С используют водный раствор с концентрацией 1 мМ. Через 1 час, 1, 2, 3, 4 и 7 дней из раствора отбирают аликвоты, разбавляют в 50 раз деионизированной водой (μQ) и анализируют методами УФ-спектроскопии и ВЭЖХ при 20°С. 7-Метил-2'-дезоксигуанозин гидройодид гидролизуется на 73% через двое суток и на 96% через неделю при +20°С по данным ВЭЖХ (время удерживания 7-метилгуанина - RT-6,50 мин., 7-метилдезоксигуанозина - RT 3,10 мин.).
Пример 3. Изучение стабильности 7-метил-2'-дезоксигуанозина гидройодида в трис-HCl буфере (рН 7,5).
Для изучения стабильности 7-метил-2'-дезоксигуанозина гидройодида при +20°С и при +8°С используют раствор в Tris-HCl буфере (рН 7,5) с концентрацией 1 мМ. Через 1 час, 1, 2, 3, 4 и 7 дней из раствора отбирают аликвоты, разбавляют в 50 раз Tris-HCl буфером (рН 7,5) и анализируют методами УФ-спектроскопии и ВЭЖХ при 20°С. 7-метил-2'-дезоксигуанозин гидройодид устойчив в 50 мМ Трис-HCl буфере (гидролиз <5% через час и <30% через двое суток и 60% через неделю по данным ВЭЖХ). Раствор гидройодной соли 7-Me-dGuo хорошо хранится при +8°С в течение недели (гидролиз - 5% через неделю по данным ВЭЖХ). Время удерживания 7-метилгуанина - RT-6,50 мин., 7-метилдезоксигуанозина - RT 3,10 мин.
Пример 4. Синтез 5-фтор-2'-дезоксиуридина (5-F-dUrd)
5-Фторурацил (227 мг, 1,75 ммоль) растворяют при нагревании в 100 мл 50 мМ Tris-HCl буфера (рН 7,5). К полученному раствору добавляют 119 мг (0,875 ммоль - 0,5 эквивалента к основанию) дигидрофосфата калия, 1,074 г (2,62 ммоль - 1,5 эквивалента к основанию) 7-метил-2'-дезоксигуанозина гидройодида и разбавляют 50 мМ Tris-HCl буфером (рН 7,5) до объема 250 мл. К раствору добавляют 10 мкл раствора ПНФ Е. coli с активностью 80 ед.акт./мл и 10 мкл раствора тимидинфосфорилазы Е. coli с активностью 1200 ед.акт./мл, медленно перемешивают в течение 10 мин. и оставляют при комнатной температуре на 20 ч без перемешивания. Выход по ВЭЖХ - 95%. Реакционную смесь фильтруют через мембрану Phenomenex (0,2 μ, 47 mm) и упаривают в вакууме до объема ~ 50 мл. Выпавший осадок 7-метилгуанина отфильтровывают через мембрану Phenomenex (0,2 μ, 47 mm). Отфильтрованный раствор упаривают в вакууме, полученный остаток растворяют в этиловом спирте (50 мл), добавляют 20 мл силикагеля, упаривают досуха, соупаривают с этиловым спиртом (2×50 мл) и сухой остаток наносят на колонку для разделения (диаметр колонки - 40 мм, объем сорбента - 150 мл). Колонку промывают системой метиленхлорид : этанол (95:5) (200 мл), продукт элюируют в системах метиленхлорид : этанол (90:10) и метиленхлорид : этанол (85:15). Фракции, содержащие продукт, упаривают в вакууме досуха. Полученный остаток подвергают повторной хроматографической очистке (диаметр колонки 20 мм, объем сорбента - 50 мл). Колонку промывают метиленхлоридом (100 мл) и системой метиленхлорид : этанол (95:5) (100 мл). Продукт элюируют в системе метиленхлорид : этанол (90:10). Выход 349 мг (81%) в виде кристаллов. Выход по ВЭЖХ - 95%. Полученный 5-фтор-2'-дезоксиуридин по физико-химическим свойствам сравним с продажным препаратом. Rƒ 0,23 (метиленхлорид - этанол, 90:10, v/v). 1Н ЯМР (300 МГц, D2O): 8,09 д (1H, 3JH-F=6,5, Н6 5-F-Ura), 6,32 тд (1Н, J1'2'a=J1'2'b=6,6, 5JH-F=6,6, H1'), 4,51 ддд (1H, J3'2'a=6,5, J3'2'b=4,2, J3'4'=4,8, Н3'), 4,10 ддд (1Н, J4'3'=4,8, J4'5'a=3,5, J4'5'b=4,9, Н4'), 3,92 дд (1Н, J5'a4'=3,5, J5'a5'b=-12,5, Н5'а), 3,82 дд (1H, J5'b5'a=4,9, J5'b5'a=-12,5, Н5'b), 2,48 ддд (1Н, J2'b2'a=-14,2, J2'b1'=6,6, J2'b3'=4,2, H2'b), 2,38 ддд (J2'a2'b=-14,2, J2'a1'=6,6, J2'a3'=6,5, Н2'а). УФ (H2O): рН 2-7: λmax(ε)=269 нм (8200); рН 13: λmax(ε)=269 нм (6300).
Пример 5. Синтез 5-этил-2'-дезоксиуридина (5-Et-dUrd)
Вещество получают аналогично примеру 4, исходя из 245 мг (1,75 ммоль) 5-этилурацила. Выход по ВЭЖХ - 90% Выход 363 мг (81%) в виде пены. Rƒ 0,31 (метиленхлорид - этанол, 90:10, v/v). 1Н ЯМР (300 МГц, D2O): 7,68 т (1Н, 4J=1,1, Н6 5-Et-Ura), 6,36 т (1Н, 7 J1'2'а=J1'2'b=6,7, H1'), 4,53 тд (1Н, J3'2'a=J3'2'b=5,5, J3'4'=4,4 Н3'), 4,09 ддд (1Н, J4'5'а=3,5, J4'5'b=4,7, J4'5'b=4,4, Н4'), 3,91 дд (1H, J5'a5'b=- 12,5, J5'a4'=3,5, Н5'а), 3,83 дд (1Н, J5'b5'a=-12,5, J5'b4'=4,7, H5'b), 2,44 дд (2Н, J2'a1'=J2'b1'=6,7, J2'a3'=J2'b3'=5,5, Н2'), 2,37 кд (2Н, 3J=7,5, 4J=1,1, СН2), 1,14 т (3Н, 3J=7,5, СН3). УФ (H2O): рН 2-7: λmax (ε)=266 нм (9800); рН 13: λmax (ε)=266 нм (7400).
Пример 6. Синтез 2-хлор-2'-дезоксиаденозина (кладрибин)
Вещество получают аналогично примеру 4 в присутствии ПНФ, исходя из 296 мг (1,75 ммоль) 2-хлор-6-аминопурина. Выход по ВЭЖХ - 88%. Выход 395 мг (79%) в виде белого порошка. Полученный кладрибин по физико-химическим свойствам сравним с продажным препаратом. Rƒ0,35 (метиленхлорид - этанол, 90:10, v/v). 1Н ЯМР (300 МГц, D2O): 8,27 с (1Н, Н8 - 2-Cl-Ade), 6,38 дд (1Н, J1'2'a=7,4, J1'2'b=6,6, H1'), 4,68 ддд (1Н, J3'2'a=6,2, J3'2'b=3,4, J3'4'=3,0, Н3'), 4,22 ддд (1Н, J4'3'=3,0, J4'5'a=3,3, J4'5'b=4,3 Н4'), 3,90 дд (1Н, J5'a5'b=-12,6, J5'a4'=3,3, Н5'а), 3,82 дд (1Н, J5'b5'a=-12,6, J5'b4'=4,3, Н5'b), 2,81 ддд (1Н, J2'a2'b=-13,9, J2'a1'=7,4, J2'a3'=6,2, Н2'а), 2,60 ддд (1Н, J2'b2'а=-13,9, J2'b1'=6,6, J2'b3'=3,4, Н2'b). УФ (H2O): рН 2: λmax (ε)=265 нм (13600); рН 7-13: λmax (ε)=265 нм (14100).
Пример 7. Синтез O6-Бензил-2'-дезоксиинозина (R1=H, R2=OCH2C6H5)
Вещество получают аналогично примеру 4 в присутствии ПНФ, исходя из 395 мг (1,75 ммоль) 6-бензилоксипурина. Выход по ВЭЖХ - 91%. Выход 479 мг (80%) в виде белого порошка. Rƒ0,35 (метиленхлорид - этанол, 90:10, v/v). 1Н ЯМР (300 МГц, DMSO-d6: D2O - 4:1 v/v): 8,60 с (1H, H2), 8,31 с (1Н, Н8), 7,50-7,30 м (5Н, Ph), 5,98 т (1Н, J1'2'a= J1'2'b=6,7, H1'), 5,20 с (2Н, СН2), 3,85 тд (1H, J3'2'a= J3'2'b=5,5, J3'4'=4,4 Н3'), 4,41 ддд (1H, J4'5'a=3,5, J4'5'b=4,7, J4'5'b=4,4, Н4'), 3,61 дд (1Н, J3'a5'b=-12,5, J5'a4'=3,5, Н5'а), 3,54 дд (1Н, J5'b5'a=-12,5, J5'b4'=4,7, H5'b), 2,50-2,31 м (2Н, Н2').
* данные для ВЭЖХ на обращенно-фазном сорбенте Luna® C18 (диаметр частиц 5 мкм, диаметр пор ) в линейном градиенте ацетонитрила от 2 до 12% за 10 минут в деионизированной воде, скорость потока - 1 мл/мин, детекция при длине волны λ=260 нм.
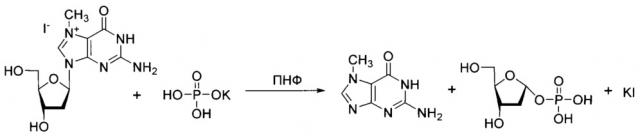
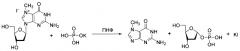
Применение гидройодной соли 7-метил-2'-дезоксигуанозина (7-Me-dGuo) в качестве субстрата для получения 2'-дезоксирибонуклеозидов методом трансгликозилирования:
где основание В представляет собой
, в котором R1=Н, F, Cl, NH2, R2=NHR или OR, где R=Н, метил, бензил, фенилэтил или другие заместители;
или
, где R=Н, F, метил, этил, изопропил или другие заместители;
и где ПНФ - фермент пуриннуклеозидфосфорилаза Е. coli, ТФ - фермент тимидинфосфорилаза Е. coli;
причем гидройодную соль 7-Me-dGuo используют в количестве 1,5 эквивалента по отношению к основанию В, а дигидрофосфат калия - в количестве 0,2-0,7 эквивалента по отношению к основанию В;
для получения пиримидиновых 2'-дезоксирибонуклеозидов используют смесь ферментов ПНФ и ТФ; а для получения пуриновых 2'-дезоксирибонуклеозидов - фермент ПНФ.