Новые радиоиммуноконъюгаты и их применения
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к радиоиммуноконъюгату, связывающему человеческий CD37, который включает антитело к CD37, хелатообразующий линкер и радионуклид, выбранный из группы, состоящей из 177Lu, 212Pb, 225Ac, 227Th и 90Y. Также раскрыта фармацевтическая композиция для лечения В-клеточных неоплазий, включающая вышеуказанный радиоиммуноконъюгат. Изобретение также относится к набору для изготовления радиоиммуноконъюгата, который связывает человеческий CD37, включающему вышеуказанное антитело, а также два или более флаконов, где один флакон содержит конъюгат, включающий хелатор, присоединенный к антителу к CD37, а второй флакон содержит радионуклид, выбранный из группы, состоящей из 177Lu, 212Pb, 225Ac, 227Th и 90Y. Изобретение позволяет эффективно осуществлять лечение В-клеточных неоплазий. 3 н. и 11 з.п. ф-лы, 8 ил., 5 табл., 10 пр.
Реферат
Область техники изобретения
Настоящее изобретение относится к радиоиммунотерапии гематологической раковой опухоли меченным радиоактивным изотопом моноклональным антителом с неожиданно высокой цитотоксичностью.
Предпосылки изобретения
Терапия с помощью меченных радиоактивным изотопом антител была введена в отношении неходжкинской лимфомы (NHL), и в настоящее время она является одобренным способом. На рынке имеется два продукта, Zevalin™ и Bexxar™, и мишенями для обоих служит CD20-антиген (Jacene et al., 2007).
Также CD20-антиген служит мишенью для иммунотерапевтического средства ритуксимаб (Rituxan™/Mabthera™). Одной проблемой обработки в отношении одной и той же мишени является вероятность иммунофенотипического дрейфа в ходе течения болезни (Ngo et al., 2009), который может служить причиной ослабленных эффектов терапии, направленной на CD20, как в случае повторяемой в течение продолжительного времени терапии ритуксимабом, или если радиоиммунотерапию (RIT), основанную на CD20, вводят вслед за продолжительной терапией ритуксимабом.
Большое число пациентов, получающих CD20-направленную терапию, со временем будут переживать рецидив (Buchegger et al., 2006; Gordon et al 2004). Т.о., для NHL-пациентов существует значительная необходимость в RIT, мишенью для которой служит другой антиген, отличный от CD20.
На раннем этапе развития RIT два антигена, CD37 и CD20, расценивались в качестве мишеней (Press et al., 2001). Был сделан вывод, что CD20-нацеленная RIT является более подходящей и, следовательно, развитие CD37-направленной RIT было оставлено. Т.о., в уровне техники известно, что моноклональные антитела являются подходящими для применения в RIT в отношении лимфомы, но что радиоиммуноконъюгат (RIC), мишенью которого служит CD20, превосходит RIC, с мишенью CD37 (Press et al., 2001).
В последние годы CD37 привлек некоторый новый интерес (Heider et al., 2009; Grosmaire, 2007), главным образом, как мишень для иммунотерапии с применением химерных или гуманизированных конструктов антител. Эти работы не рекомендуют применение традиционных мышиных IgG моноклональных антител, т.к. мышиные антитела могут индуцировать у пациентов выработку человеческого антитела к мыши (НАМА), которые могут служить причиной дискомфорта и уменьшают эффективность иммунотерапии.
Для RIT традиционные мышиные моноклональные антитела по-прежнему считаются интересными, т.к. обычно применяемые дозы белков снижены, и нет необходимости в повторении лечения в таком же объеме, как при иммунотерапии. Также клиренс мышиного IgG, как правило, немного быстрее, чем у гуманизированных или химерных версий того же IgG, что может быть более подходящим в отношении радиационного воздействия на все тело в результате RIT, по меньшей мере в некоторых параметрах. Необходимо отметить, что оба Bexxar и Zevalin имеют в основе мышиные антитела.
Настоящее изобретение обеспечивает мышиное антитело HH1 к CD37, в качестве носителя радиоизотопа. Оригинальный клон гибридомы, производящий мышиное антитело HH1 к CD37, разработали в 1980-х (Smeland et al., 1985), а антитело HH1 имелось в продаже для in vitro применения в иммуногистохимии в течение нескольких лет.
HH1 не оценивался прежде в отношении радиоиммунотерапии в плане поиска тканей-мишеней и клеточной цитотоксичности. Текущая работа, следовательно, предпринималась для оценки пригодности HH1 в радиоиммунотерапии. В отличие от предыдущих клинических и доклинических исследований RIC к CD37, применявших непосредственное мечение радиоактивным изотопом 131I остатков тирозина с применением способов с хлораминомТ/Иодогеном, HH1 метили радиоактивным изотопом через хелатор с применением металлического радионуклида вместо галогена.
Применение металлического радионуклида, меченного через хелатор-линкер, может иметь преимущество, т.к. применение антитела, меченного 131I, связано с облучением щитовидной железы различными количествами йода, высвобождаемого из RIC.
В предыдущем исследовании, чтобы оценить подходит ли HH1 для получения радиоиммуноконъюгата, к HH1 конъюгировали CHX-A-DTPA и конъюгат метили 205,206Bi для целей in vitro моделирования (Henriksen et al., 1997).
Поглощение в клеточной линии Raji сравнили для висмута, конъюгированного с HH1, и стрептавидина. В последнем случае клетки были предварительно насыщены биотинилированным-HH1.
Обнаружено, что число хелаторов, требуемых для обеспечения функционального RIC, при мечении 212Bi или 213Bi было лимитирующим фактором. Следовательно, было предложено применять биотинилированный HH1 вместо RIC, основанных на HH1. Биотинилированный HH1, после того как присоединен к клеткам, может затем служить мишенью для меченного радиоактивным изотопом стрептавидина.
Т.о., исследование предполагает, что HH1, меченный радионуклидом, излучающим альфа-частицы, был менее пригодным из-за недостаточной специфической активности при концентрациях хелатора, которые считаются приемлемыми для того, чтобы HH1 сохранял достаточную способность к связыванию.
В статье также указывается, что бета-излучатель будет даже менее пригодным для конструирования функционального RIC по сравнению с альфа-излучателем (Henriksen et al, 1997), поскольку авторы утверждают, что нацеленная радиотерапия с бета-излучателем должна быть менее эффективна при диссеминированном поражении, потому что для получения достаточного эффекта необходимо глубинно-сфокусированное облучение.
Т.о., цитированная выше работа не рекомендует применение в радиоиммунотерапии непосредственно хелатированного HH1, а также применение HH1 в RIC, основанном на бета-излучателе.
Краткое описание изобретения
Настоящее изобретение относится к радиоиммуноконъюгату, который связывает человеческий CD37, включающий мышиное моноклональное антитело HH1, линкер и радионуклид, выбранный из группы, состоящей из 211At, 213Bi, 212Bi, 212Pb, 225Ac, 227Th, 90Y, 186Re, 188Re, 199Au, 194Ir, 166Ho, 159Gd, 153Sm, 149Pm, 142Pr, 111Ag, 109Pd, 77As, 67Cu, 47Sc и 177Lu.
В варианте осуществления настоящего изобретения линкер представляет собой хелатообразующий линкер, а радионуклид представляет собой 177Lu.
Аспект настоящего изобретения относится к фармацевтической композиции, включающей радиоиммуноконъюгат настоящего изобретения и фармацевтически приемлемый носитель.
В варианте осуществления настоящего изобретения фармацевтическая композиция настоящего изобретения включает одно или более дополнительных антител или радиоиммуноконъюгатов.
В другом варианте осуществления настоящего изобретения для одного или более дополнительных антител или радиоиммуноконъюгатов мишенью служит CD20.
Дополнительный вариант осуществления настоящего изобретения относится к фармацевтической композиции настоящего изобретения для обработки неопластических В-клеток, экспрессирующих CD37-антиген.
В варианте осуществления настоящего изобретения фармацевтическая композиция для лечения неходжкинской лимфомы и хронического лимфолейкоза.
Аспект настоящего изобретения относится к применению радиоиммуноконъюгата настоящего изобретения для обработки B-клеточных неоплазий.
Вариант осуществления настоящего изобретения относится к применению радиоиммуноконъюгата настоящего изобретения, вводимого в комбинации с или в дополнение к другой терапии.
В варианте осуществления настоящего изобретения терапию выбирают из предварительного лечения, химиотерапии, терапии моноклональными антителами, хирургического вмешательства, радиотерапии и/или фотодинамической терапии.
В другом варианте осуществления настоящего изобретения терапия включает предварительную обработку с применением моноклонального антитела к CD20 и/или к CD37 перед началом обработки радиоиммуноконъюгатом настоящего изобретения.
Аспект настоящего изобретения относится к способу обработки B-клеточной неоплазий, выбранной из неходжкинской лимфомы и хронического лимфолейкоза, включающему введение эффективного количества фармацевтической композиции настоящего изобретения.
Другой аспект настоящего изобретения относится к набору для изготовления радиоиммуноконъюгата настоящего изобретения, включающему два или больше флаконов, где один флакон содержит конъюгат, включающий хелатор, присоединенный к мышиному моноклональному антителу HH1; а второй флакон содержит радионуклид.
Вариант осуществления настоящего изобретения относится к набору по настоящему изобретению, где содержимое одного или более флаконов или лиофилизировано, или в растворе.
В другом варианте осуществления настоящего изобретения радиоиммуноконъюгат образуется путем смешивания содержимого двух флаконов.
Краткое описание фигур
Фигура 1
Антитело, связанное с клеткой, непосредственно (A) и через 96 часов (B) после промывки при инкубации клеток Raji, Rael и Daudi с 111In-HH1, 111In-ритуксимабом, 125I-HH1 и 125I-ритуксимабом.
Фигура 2
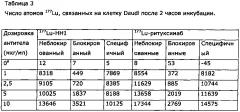
Активность после связывания с клетками Daudi после инкубации с 177Lu-HH1 или 177Lu-ритуксимабом в течение 2 ч. (A) и 18 ч. (B). Блокированные клетки блокировали с помощью 100 мкг/мл немеченого антитела.
Фигура 3
Рост клеток Daudi, инкубированных с 177Lu-HH1 (A) или 177Lu-ритуксимабом (B) в течение 2 ч. перед промывкой.
Фигура 4
Рост клеток Daudi, инкубированных с 177Lu-HH1 (A) или 177Lu-ритуксимабом (B) в течение 18 ч. перед промывкой.
Фигура 5
Поиск тканей-мишеней HH1, 111In-меченным через хелатор, у мышей с ксенотрансплантатами Daudi.
Фигура 6
FITC-гистограммы немеченых клеток Daudi, клеток Daudi, меченных только вторичным антителом, или меченных HH1, ON.108, IPO.24 или 6D263.
Фигура 7
Поиск тканей-мишеней 177Lu- у самок голых мышей с опухолью Daudi.
Фигура 8
Терапия мышей с в/в инъецированными клетками Daudi. Выживание мышей, обработанных 50 и 100 МБк/кг 177Lu-HH1, не содержащим радиоактивных веществ HH1, не содержащим радиоактивных веществ ритуксимабом и NaCl.
Подробное описание изобретения
Настоящее изобретение относится к применению антитела HH1 в радиоиммунотерапии.
Комбинация металлического радионуклида, линкера и моноклонального антитела к CD37 показала, что меченное радиоактивным изотопом HH1 имеет релевантный поиск тканей-мишеней и поглощение опухолью в модели ксенотрансплантат/голая мышь.
Это является важной информацией, которая указывает на пригодность для применения в радиоиммунотерапии.
Радиоиммуноконъюгаты
Настоящее изобретение показывает, что радиоиммуноконъюгат 177Lu-HH1 демонстрировал значительную цитотоксичность на диссеминированных опухолевых клетках, и что 177Lu-HH1 был более цитотоксичным, чем 177Lu-ритуксимаб в отношении опухолевых клеток для данной дозировки.
Это открытие было неожиданным, т.к. больше радиоактивности связывалось на клетку, а также удержание связанного радионуклида было подобным или лучшим для 177Lu-ритуксимаба.
Это противоречит известному знанию в области техники, свидетельствующему, что для радиоиммунотерапии антитело к CD20 лучше, чем антитело к CD37. Кроме того, настоящая работа отличается от предыдущей точки зрения, заключающейся в том, что для бета-излучателя, глубинно-сфокусированное облучение, которое невозможно получить в случае диссеминированных клеток, должно быть необходимым для получения достаточного эффекта (Henriksen et al., 1997).
Причина наблюдаемого эффекта неясна. Данные из экспериментов с различными дозировками немеченного HH1 и ритуксимаба не показали каких-либо эффектов со стороны немеченых антител в использованном анализе роста.
Одним возможным объяснением может быть то, что имеется меньшее число клеток с очень низкой антигенной плотностью CD37 по сравнению с CD20, даже, несмотря на то, что CD20 в среднем более сильно экспрессируется на использованной клеточной линии.
Данные удержания не означали лучшего удержания из-за интернализации CD37, что напротив может быть возможным объяснением, т.к. интернализация сообщалась для СР37-антигена (Press et al, 2001).
Т.о., настоящее изобретение относится к радиоиммуноконъюгату, который связывает человеческий CD37, включающему мышиное моноклональное антитело HH1, линкер и радионуклид, выбранный из группы, состоящей из 211At, 213Bi, 212Bi, 212Pb, 225Ac, 227Th, 90Y, 186Re, 188Re, 199Au, 194Ir, 166Ho, 159Gd, 153Sm, 149Pm, 142Pr, 111Ag, 109Pd, 77As, 67Cu, 47Sc и 177Lu.
В одном варианте осуществления настоящего изобретения линкер представляет собой хелатообразующий линкер.
В другом варианте осуществления настоящего изобретения радионуклид представляет собой 177Lu.
В еще одном варианте осуществления радионуклид представляет собой или бета-излучатель, или альфа-излучатель.
Настоящее изобретение предполагает, с in vitro данными, что меченный радиоактивным изотопом HH1 связывается более эффективно с CD37-антигеном, чем меченный радиоактивным изотопом ритуксимаб связывается с CD20-антигеном, т.е., он достигал максимального связывания с антигеном, требуя меньшего количества циркулирующего антитела (таблица 2, фигура 2).
Ему также требовалось меньше времени для достижения максимального связывания (фигура 2). Это может быть важными свойствами in vivo, также потому, что это означает, что опухолевые клетки могут улавливать RIC даже при более низкой концентрации циркулирующих антител, в ситуации, которая может иметь место в менее доступных участках солидных опухолей и для отдельных опухолевых клеток и микрометастазов, расположенных в удаленных участках нормальных тканей.
Это значительно отличается от предыдущих данных, указывающих, что более высокая концентрация антитела требовалась для насыщения антигена и получения благоприятного поиска тканей-мишеней при использовании другого антитела к CD37, нежели HH1 (Bernstein et al., 1990), также по сравнению с использованием антитела к CD20 (Press et al., 1993).
К тому же настоящее изобретение показывает, что HH1 имеет несколько отличающиеся свойства связывания антигена по сравнению с набором из трех различных антител к CD37 - несмотря на то, что все антитела, главным образом, связываются с одним и тем же эпитопом.
Блокирующие эксперименты, т.е., с применением клеток предварительно насыщенных немеченым антителом, показали, что на живых клетках HH1 будет блокировать CD37 от связывания с меченным радиоактивным изотопом HH1 значительно лучше, чем три другие антитела к CD37.
В клеточном анализе, сравнивающем меченные радиоактивным изотопом антитела, HH1 показал намного лучшую иммунореактивную долю по сравнению с тремя другими антителами. Под иммунореактивной долей подразумевают долю антитела, которая может связываться с антигеном, если имеется неограниченный избыток антигенов. Различные антитела могут иметь различную способность сохранять иммунореактивность после прохождения через процедуру мечения. Результаты в примере 6, эксперименте IV, таблице 5 показывают, что иммунореактивность HH1 лучше сохранялась, чем иммунореактивность трех коммерчески доступных антител.
С другой стороны иммуногистохимические анализы показали, что три антитела окрашивали срезы ткани из образцов фиксированных опухолей, заключенных в парафин, тогда как HH1 не окрашивало. Различия во взаимодействиях антитело-антиген не поддались обнаружению с помощью проточной цитометрии.
Гистограммы проточной цитометрии были подобными для HH1 и трех других антител к CD37 (фигура 6). В целом эти данные показывают, что HH1 имеет выраженное индивидуальное взаимодействие с антигеном, которое в некоторых аспектах не может быть предсказано из работ с другими антителами к CD37.
Новый радиоиммуноконъюгат к CD37 с сильными цитотоксическими свойствами, описанный в настоящем документе, состоит из мышиного моноклонального антитела HH1, хелатообразующего линкера и бета-излучателя 177Lu.
Радионуклид может присоединяться к антителу сначала проведением реакции бифункционального хелатора, например, p-SCN-bn-DOTA (Macrocyclics, Техас, США), с антителом, с последующей очисткой для удаления неконъюгированного хелатора, и затем реакцией конъюгата хелатор-антитело с радионуклидом, с последующей очисткой для удаления любого неконъюгированного радионуклида.
Альтернативно, хелатор и радионуклид можно комбинировать в первую очередь, и впоследствии конъюгировать к антителу.
Хелатообразующие линкеры как, например, p-SCN-bn-DOTA, можно применять для конъюгирования к HH1 других металлических радионуклидов точно так же, как описано для 177Lu.
Можно применять любой тип линкера с достаточной способностью к комплексообразованию и функциональной группой, обеспечивающей прямую или непрямую конъюгацию к белку или пептиду. Примеры таких линкеров описываются в литературе (например, Brechbiel, 2008; Liu, 2008). Некоторые применимые примеры представляют собой бифункциональные циклические хелаторы, как p-SCN-bn-DOTA, DOTA-NHS-сложный эфир; бифункциональные линейные хелаторы, как p-SCN-Bn-DTPA и CHX-Aʺ-DTPA.
Радионуклиды в настоящем изобретении будут предпочтительно конъюгировавать с молекулой-мишенью с применением бифункциональных хелаторов.
Они могут представлять собой циклические, линейные или разветвленные хелаторы. Особого упоминания заслуживают полиаминополикислотные хелаторы, включающие линейный, циклический или разветвленный полиазаалкановый скелет с кислотными (например, карбоксиалкильными) группами, присоединенными к азотам скелета.
Примеры подходящих хелаторов включают производные DOTA, такие как p-изотиоцианатобензил-1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота (p-SCN-Bz-DOTA), и производные DTPA, такие как p-изотиоцианатобензил-диэтилентриаминпентауксусная кислота (p-SCN-Bz-DTPA), первые представляют собой циклические хелаторы, последние - линейные хелаторы.
Металлирование комплексообразующей части можно осуществлять до или после конъюгации комплексообразующей части с нацеливающей частью.
Процедура мечения радиоактивным изотопом в общем будет удобнее в плане затраченного времени и т.д., если хелатор конъюгируют с антителом перед тем, как происходит мечение радиоактивным изотопом.
Принципы приготовления меченных радиоактивным изотопом конъюгатов с применением хелаторов, прикрепляемых к антителам шире описывается в, например, Liu, 2008.
Т.о., HH1 можно применять для приготовления радиоиммуноконъюгатов с отличиями в радиационных свойствах и эффективными периодами полураспада.
Например, радиоиммуноконъюгат к CD37, состоящий из мышиного моноклонального антитела HH1, хелатообразующего линкера и бета- или альфа-излучающего радионуклида, включающий, но без ограничений, 177Lu, 211At, 213Bi, 212Bi, 212Pb, 225Ac, 227Th, 90Y, 186Re, 188Re, 199Au, 194Ir, 166Ho, 1S9Gd, 153Sm, 149Pm, 142Pr, 11lAg, 109Pd, 77As, 67Cu, 47Sc, можно приготавливать и применять для приготовления фармацевтических препаратов, а также применять в терапевтических целях.
Фармацевтические композиции
Радиоиммунотерапевтический продукт на основе HH1, обычно будет обеспечиваться как фармацевтическая композиция, состоящая из радионуклида по описанию выше, присоединенного через хелатор к мышиному моноклональному антителу HH1, растворенного в буферном растворе, который в существенной степени поддерживает химическую целостность радиоиммуноконъюгата и является физиологически приемлемым для инфузии в пациентов.
Т.о., аспект настоящего изобретения относится к фармацевтической композиции, включающей радиоиммуноконъюгат настоящего изобретения, а также фармацевтически приемлемый носитель и/или наполнитель.
Приемлемые фармацевтические носители включают, но без ограничений, нетоксичные буферы, заполнители, изотонические растворы и т.д. Более конкретно, фармацевтический носитель может представлять собой, но без ограничений, нормальный солевой раствор (0,9%), полунормальный солевой раствор, лактат Рингера, 5% декстрозу, 3,3% декстрозу/0,3% солевой раствор. Физиологически приемлемый носитель может включать радиолитический стабилизатор, например, аскорбиновую кислоту, которая защищает целостность радиофармацевтического средства во время хранения и транспортировки.
Один вариант осуществления настоящего изобретения включает фармацевтическую композицию настоящего изобретения, а также один или несколько дополнительных антител или радиоиммуноконъюгатов. Антитела включают, но без ограничений, Ритуксимаб, Эпратузумаб, L19, F8, F16, Галиксимаб, Торализумаб, Алемтузумаб, Офатумумаб, Велтузумаб, Афутузумаб, Тозитумомаб, Редитукс и Ибритумомаб. Радиоиммуноконъюгаты включают, но без ограничений, Zevalin и Bexxar.
В другом варианте осуществления настоящего изобретения для одного или нескольких дополнительных антител или радиоиммуноконъюгатов мишенью служит CD20. Антитела включают, но без ограничений, Ритуксимаб, Велтузумаб, Офатумумаб, Афутузумаб, Тозитумомаб, Редитукс и Ибритумомаб. Радиоиммуноконъюгаты включают, но без ограничений, Zevalin и Bexxar.
Дополнительный вариант осуществления настоящего изобретения относится к фармацевтической композиции настоящего изобретения для обработки неопластических В-клеток, экспрессирующих CD37-антиген.
В варианте осуществления настоящего изобретения фармацевтическая композиция предназначена для лечения неходжкинской лимфомы и хронического лимфолейкоза.
Идентичность последовательности
Как определяется обычно, “идентичность” в настоящем документе определяется, как идентичность последовательности между генами или белками на нуклеотидном или аминокислотном уровне, соответственно.
Т.о., в настоящем контексте “идентичность последовательности” представляет собой меру идентичности между белками на аминокислотном уровне и меру идентичности между нуклеиновыми кислотами на нуклеотидном уровне.
Идентичность последовательности белка можно определять, сравнивая аминокислотную последовательность в данном положении в каждой последовательности, когда последовательности выровнены.
Подобным образом, идентичность последовательности нуклеиновой кислоты можно определять, сравнивая нуклеотидную последовательность в данном положении в каждой последовательности, когда последовательности выровнены.
Для определения процента идентичности двух последовательностей нуклеиновой кислоты или аминокислотных последовательностей, последовательности выравнивают для целей оптимального сравнения (например, могут вводиться гэпы в последовательность первой аминокислотной последовательности или последовательность нуклеиновой кислоты для оптимального выравнивания со второй аминокислотной последовательностью или последовательностью нуклеиновой кислоты). Затем сравниваются остатки аминокислот или нуклеотиды в соответствующих аминокислотных или нуклеотидных положениях.
Когда положение в первой последовательности занимает тот же аминокислотный остаток или нуклеотид, как в соответствующем положении во второй последовательности, тогда молекулы являются идентичными по данному положению. Процент идентичности между двумя последовательностями представляет собой функцию числа идентичных положений, общих для последовательностей (т.е., % идентичности = кол-во идентичных положений/общее кол-во положений (например, перекрывающихся положений) ×100). В одном варианте осуществления две последовательности имеют одинаковую длину.
Можно вручную выравнивать последовательности и подсчитывать число идентичных нуклеиновых кислот или аминокислот. Альтернативно, выравнивание двух последовательностей для определения процента идентичности можно осуществлять с применением математического алгоритма. Такой алгоритм внедрен в программы NBLAST и XBLAST. Поиски нуклеотидов BLAST можно осуществлять с помощью программы NBLAST, оценка =100, длина «слова» =12, для получения нуклеотидных последовательностей, гомологичных молекулам нуклеиновой кислоты настоящего изобретения. Поиски белков BLAST можно осуществлять с помощью программы XBLAST, оценка =50, длина «слова» =3, для получения аминокислотных последовательностей, гомологичных молекуле белка настоящего изобретения.
Для получения выравниваний с гэпами для целей сравнения, может быть полезен Gapped BLAST. Альтернативно, PSI-Blast можно применять для осуществления итеративного поиска, который обнаруживает отдаленные взаимоотношения между молекулами. При использовании программ NBLAST, XBLAST и Gapped BLAST можно применять параметры по умолчанию соответствующих программ. См. http://www.ncbi.nlm.nih.gov. Альтернативно, идентичность последовательности можно рассчитывать после того, как последовательности были выровнены, например, с помощью программы BLAST в базе данных EMBL (www.ncbi.nlm.gov/cgi-bin/BLAST).
В основном, для выравнивания можно применять установки по умолчанию в отношении, например, «матрицы замен» и «штрафа за гэп». В контексте настоящего изобретения установки по умолчанию BLASTN и PSI BLAST могут быть предпочтительными.
Процент идентичности между двумя последовательностями можно определить с применением методов, подобных описанным выше, допуская или не допуская гэпы. При расчете процента идентичности подсчитываются только точные пары.
Вариант осуществления настоящего изобретения относится к изолированной нуклеиновой кислоте, включающей последовательность, разделяющую 80% идентичности последовательности с последовательностью VH (SEQ ID NO: 1) и/или последовательностью VL (SEQ ID NO: 3) антитела HH1.
Вариант осуществления настоящего изобретения относится к изолированной нуклеиновой кислоте, включающей последовательность с последовательностью VH (SEQ ID NO: 1) и/или последовательностью VL (SEQ ID NO: 3) антитела HH1.
В другом варианте осуществления настоящего изобретения изолированная нуклеиновая кислота включает последовательность, разделяющую по меньшей мере 90% идентичности последовательности с последовательностью VH (SEQ ID NO: 1) и/или последовательностью VL (SEQ ID NO: 3) антитела HH1, как например, 90% идентичности, 91% идентичности, 92% идентичности, 93% идентичности, 94% идентичности, 95% идентичности, 96% идентичности, 97% идентичности, 98% идентичности или 99% идентичности.
Другой вариант осуществления настоящего изобретения относится к антителу, включающему полипептидную последовательность, разделяющую 80% идентичности последовательности с последовательностью VH (SEQ ID NO: 2) и/или последовательностью VL (SEQ ID NO: 4) антитела HH1.
Другой вариант осуществления настоящего изобретения относится к антителу, включающему полипептидную последовательность с последовательностью VH (SEQ ID NO: 2) и/или последовательностью VL (SEQ ID NO: 4) антитела HH1.
В другом варианте осуществления настоящего изобретения антитело включает последовательность, разделяющую по крайне мере 90% идентичности последовательности с последовательностью VH (SEQ ID NO: 2) и/ил и последовательностью VL (SEQ ID NO: 4) антитела HH1, как, например, 90% идентичности, 91% идентичности, 92% идентичности, 93% идентичности, 94% идентичности, 95% идентичности, 96% идентичности, 97% идентичности, 98% идентичности или 99% идентичности.
Генетическая изменчивость
Генетическая изменчивость обусловлена изменением в порядке оснований в нуклеотидах в генах. Эта изменчивость обуславливает мутации в генах и впоследствии в белках, кодируемых такими генами.
Эти мутации могут быть как смысловыми, так и миссенс-мутациями или заменами.
Вариант осуществления настоящего изобретения относится к изолированной последовательности нуклеиновой кислоты VH-цепи (SEQ ID NO: 1) и/или VL-цепи (SEQ ID NO: 3) моноклонального антитела HH1, которая включает по меньшей мере 50, как например 20, как например 10, как например 5, как например 4, как например 3, как например 2, как например 1 смысловую мутацию.
Другой вариант осуществления настоящего изобретения относится к изолированной последовательности нуклеиновой кислоты VH-цепи (SEQ ID NO: 1) и/или VL-цепи (SEQ ID NO: 3) моноклонального антитела HH1, которая включает 0-50, как например 1-50, как например 0-20, как например 1-20, как например 0-10, как например 1-10, как например 0-5, как например 1-5, как например 3, как например 1 смысловую мутацию.
Миссенс-мутация (тип несинонимичной мутации) представляет собой точечную мутацию, при которой меняется один нуклеотид, что приводит к кодону, кодирующему отличающуюся аминокислоту (мутации, которые меняют аминокислоту на стоп-кодон, рассматриваются скорее как нонсенс-мутации, а не миссенс-мутации). Миссенс-мутация может переводить в нефункциональное состояние получающийся в результате белок.
Однако не все миссенс-мутации ведут к заметным изменениям белка. Аминокислота может замещаться аминокислотой с очень похожими химическими свойствами, в этом случае белок может, тем не менее, функционировать нормально; это называется нейтральной, «тихой» или консервативной мутацией.
Альтернативно, замена аминокислоты может происходить в участке белка, который не влияет значительно на вторичную структуру или функцию белка. Когда аминокислота может кодироваться более чем одним кодоном (так называемый «вырожденный код»), мутация в кодоне может не производить никакого изменения в трансляции; это будет синонимичная мутация (форма молчащей мутации), а не миссенс-мутация.
Вариант осуществления настоящего изобретения относится к антителу, включающему полипептидную последовательность VH-цепи (SEQ ID NO: 1) и/или VL-цепи (SEQ ID NO: 3) моноклонального антитела HH1, которая включает по меньшей мере 50, как например 20, как например 10, как например 5, как например 4, как например 3, как например 2, как например 1 миссенс-мутацию.
Вариант осуществления настоящего изобретения относится к антителу, включающему полипептидную последовательность VH-цепи (SEQ ID NO: 1) и/или VL-цепи (SEQ ID NO: 3) моноклонального антитела HH1, которая включает 0-50, как например 1-50, как например 0-20, как например 1-20, как например 0-10, как например 1-10, как например 0-5, как например 1-5, как например 3, как например 1 миссенс-мутацию.
Консервативная замена представляет собой замену одной аминокислоты на другую с, главным образом, похожими свойствами так, чтобы, скорее всего, не повлиять серьезно на общее функционирование.
В другом варианте осуществления настоящего изобретения миссенс-мутации представляют собой консервативные мутации или замены.
Дополнительный вариант осуществления настоящего изобретения относится к изолированной последовательности нуклеиновой кислоты или полипептидной последовательности с 80% идентичности последовательности к вариабельной тяжелой цепи (SEQ ID NO: 2) и/или вариабельной легкой цепи (SEQ ID NO: 4) последовательностей HH1, где изменчивость последовательности представляет собой консервативные замены.
В другом варианте осуществления настоящего изобретения идентичность последовательности является 80% идентичности, как например 90% идентичности, 91% идентичности, 92% идентичности, 93% идентичности, 94% идентичности, 95% идентичности, 96% идентичности, 97% идентичности, 98% идентичности или 99% идентичности, а изменчивость последовательности представляет собой консервативные замены.
С целью улучшения этапа мечения радиоактивным изотопом может быть полезным введение дополнительного лизина в, например, Fc-фрагмент HH1. Это может снижать вероятность прикрепления хелаторов, связывающих лизин, в антиген-комбинирующие участки на антителе, таким образом, снижая риск подвергания опасности иммунореактивности во время мечения радиоактивным изотопом.
Способы для введения лизина в, например, Fc-фрагмент HH1 известны в уровне техники, например, Hemminki et al., 1995.
Вариант осуществления настоящего изобретения относится к радиоиммуноконъюгату настоящего изобретения, который был модифицирован 10 Lys в Fc-фрагменте HH1, как например 8 Lys, как например 6 Lys, как например 5 Lys, как например 4 Lys, как например 3 Lys, как например 2 Lys, как например 1 Lys.
Обработка
Терапевтическое применение фармацевтического раствора по настоящему изобретению может быть для обработки неопластических клеток, экспрессирующих CD37-антиген, включающих, но без ограничений, неходжкинскую лимфому и хронический лимфолейкоз.
Другими применениями может быть лечение аутоиммунных заболеваний и лечение эффектов, связанных с трансплантацией. Терапия может основываться на, но без ограничений, излучении бета-частиц или излучении альфа-частиц или их комбинации.
Терапию можно вводить или в виде монотерапии, или в комбинации с другими терапиями, преимущественно стандартными обработками. Такие другие терапии могут представлять собой предварительное лечение, хирургическое вмешательство, химиотерапию, иммунотерапию, фотодинамическую терапию, радиоиммунотерапию или комбинацию двух или большего числа из них. Под введением подразумевают внутривенную инфузию или внутривенную инъекцию. Более конкретно, радиоиммуноконъюгат настоящего изобретения можно вводить непосредственно в вену с помощью периферической канюли, присоединенной к капельнице, которая предотвращает воздушную эмболию и позволяет оценить скорость потока в пациента.
В одном варианте осуществления радиоиммуноконъюгат можно вводить многократно.
В другом варианте осуществления настоящего изобретения радиоиммуноконъюгат можно вводить многократно, но с различными радионуклидами, например, за бета-радиоиммунотерапией может следовать альфа-радиоиммунотерапия, или наоборот.
Аспект настоящего изобретения относится к применению радиоиммуноконъюгата настоящего изобретения для обработки В-клеточных неоплазий.
Вариант осуществления настоящего изобретения относится к применению радиоиммуноконъюгата настоящего изобретения, вводимого в комбинации с или в дополнение к другой терапии.
В варианте осуществления настоящего изобретения другие терапии выбирают из предварительного лечения, химиотерапии, терапии моноклональными антителами, хирургического вмешательства, радиотерапии и/или фотодинамической терапии.
В другом варианте осуществления настоящего изобретения другими терапиями являются пересадка костного мозга или пересадка стволовых клеток и/или терапия.
Другой вариант осуществления настоящего изобретения включает терапевтическую предварительную обработку с применением моноклонального антитела к CD20 и/или к CD37 перед началом обработки радиоиммуноконъюгатом настоящего изобретения.
Аспект настоящего изобретения относится к способу обработки В-клеточной неоплазий, выбранной из неходжкинской лимфомы и хронического лимфолейкоза, включающему введение эффективного количества фармацевтической композиции настоящего изобретения.
В одном варианте осуществления настоящего изобретения дозировка антитела составляет 1-1000 мг на пациента, более предпочтительно 5-50 мг на пациента, a 177Lu в размере 1-200 МБк/кг, более предпочтительно 10-100 МБк/кг веса тела.
Наборы
Аспект настоящего изобретения относится к набору для изготовления радиоиммуноконъюгата настоящего изобретения, включающему два или более флаконов, где один флакон содержит конъюгат, включающий хелатор, присоединенный к мышиному моноклональному антителу HH1; а второй флакон содержит радионуклид.
В случае набора перед инфузией может потребоваться осуществление некоторых процедур, например, мечения радиоактивным изотопом и/или очистки.
Вариант осуществления настоящего изобретения относится к набору настоящего изобретения, где содержимое одного или нескольких флаконов или лиофилизировано, или в растворе.
Конечный продукт появится при смешивании содержимого двух флаконов для образования радиоиммуноконъюгата. Т.о., в другом варианте осуществления настоящего изобретения радиоиммуноконъюгат образуется путем смешивания содержимого двух флаконов.
Может потребоваться очистка этого продукта перед применением.
Примеры
Пример 1 - мечение HH1 радиоактивным изотопом
Йодирование: Антитела метили 125I посредством непрямого йодирования, с применением пробирок для йодирования предварительно покрытых IODOGEN (Pierce, Рокфорд, Иллинойс) в соответствии с описанием производителя.
Мечение 111In и 177Lu: Антитела вначале приводили в реакцию с хелатором (p-SCN-Bn-DTPA или p-SCN-Bn-DOTA).
Хелатор DTPA или DOTA растворяли в 0,05 М HCl и затем добавляли к антителу, pH которого доводили до приблизительно 8 промывкой карбонатным буфером, в соотношении 5:1. Затем снова проверяли pH и, при необходимости, доводили. Раствор встряхивали в течение 60 мин. при комнатной температуре, и затем реакцию останавливали добавлением 50 м