Способ получения оксидаз curvularia geniculata вкм f-3561, активных с фенольными соединениями в нейтральных условиях среды
Иллюстрации
Показать всеИзобретение относится к биотехнологии и касается способа получения оксидаз штамма Curvularia geniculata ВКМ F-3561. Способ предусматривает погруженное культивирование гриба Curvularia geniculata ВКМ F-3561 в минеральной среде с добавлением, по крайней мере, одного компонента, выбранного из ряда: горох, картофель, томатная паста, пшеница, ячмень, гречиха, рис, овес, кукуруза. Штамм культивируют до получения максимальной активности лакказ в культуральной жидкости. Изобретение позволяет повысить выход лакказ. 4 з.п. ф-лы, 12 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к биотехнологии, а именно к способу получения оксидаз гриба Curvularia geniculata F-3561, показана способность культуральной жидкости указанного штамма окислять фенольные соединения в среде с нейтральным рН.
Возможно применение оксидаз, продуцируемых штаммом гриба, предлагаемым способом в технологиях, требующих нейтральных условий среды, в частности, как в клеточных технологиях, так и in vitro для модификации фенольных соединений и получения с их помощью ряда ценных биологически активных соединений, таких как биополимеры, антиоксиданты, противоопухолевые препараты, антибиотики, стероиды.
Уровень техники
Медьсодержащие оксидазы (МСО: лакказы, аскорбат оксидазы, тиразиназы, билирубин оксидазы, и др.) - класс ферментов с высоко гомологичной купредоксинподобной структурой, содержащих 4 иона меди, собранных в двух активных центрах, осуществляют восстановление молекулярного кислорода до воды с сопутствующим окислением молекулы субстрата.
Лакказы и лакказоподобные оксидазы (представители медьсодержащих оксидаз) - широко распространенные в природе ферменты, участвующие в разложении лигнина и большого спектра органических соединений, что делает их в свою очередь привлекательными для пищевой, текстильной, косметической промышленностей, для детоксикации ксенобиотиков и создания биосенсоров, для синтеза и модификации широкого спектра соединений (биополимеров, антибиотиков, антиоксидантов, цитостатиков, стероидов и др.).
Основным природным продуцентом лакказ считаются лигнолитические базидиальные грибы, осуществляющие с помощью внеклеточных лакказ разложение растительного лигнина (1-3). В незначительной степени лакказы экспрессируются аскомицетами, дейтеромицетами, а также найдены у прокариот и растений (4-6). Грибные внеклеточные лакказы обладают повышенной стабильностью (7-8), имеют высокий редокс-потенциал, и как следствие, широкий спектр атакуемых субстратов, однако активность грибных лакказ наблюдается, как правило, в кислой области рН (1-2, 9). У бактерий, напротив, лакказоподобные оксидазы продуцируются внутриклеточно, имеют более узкий спектр атакуемых субстратов, меньшую стабильность и максимальную активность в нейтрально-щелочной области рН (10).
Для ряда клеточных биотехнологий, осуществляемых в цитоплазме клетки, применение и поиск грибных лакказ с широким спектром атакуемых субстратов, активных, как и бактериальные лакказоподобные ферменты, в нейтральной области рН, является приоритетной задачей (11).
В настоящее время найдено несколько грибов, продуцирующих лакказы, наиболее активные в нейтрально-щелочной среде. Так, у лакказы из базидиомицета Rhizoctonia praticola максимальная активность с сирингалдазином наблюдалась при рН 6.0-7.0 (12), у лакказы из базидиального гриба Moniliophthora perniciosa FA553 - при рН 7.5 (7). Лакказа из аскомицета Acremonium murorum была наиболее активна с сирингалдазином при 8.5-9.0 (13), лакказа из аскомицета Melanocarpus albomyces - при рН 6.0-7.0 (14), а из Myceliophthora thermophila - при рН 6.0-7.0 (15). Лакказа из аскомицета Myrothecium verrucaria 24G-4 наиболее активно катализировала реакцию полимеризации 4-аминоантипирина при рН 9.0 (16).
Фенилпропаноиды - органические соединения ароматического ряда, синтезируемые в растениях шикиматным путем, преимущественно через аминокислоту фенилаланин (17). Полимеры фенилпропаноидов - лигнаны обладают широким спектром действия на биологические объекты и востребованы в фармацевтике (11, 18-21). Такие представители фенилпропаноидов как монолигнолы (n-кумаровый спирт, конифериловый спирт, синаповый спирт), а также их предшественники (n-кумаровая, феруловая и синаповая кислоты) малоизучены в качестве субстратов грибных лакказ и бактериальных лакказоподобных ферментов. Наиболее изучены такие соединения в качестве субстратов растительных лакказ, но количество публикаций на эту тему ограничено (22-25). Чаще всего в качестве субстрата для грибных лакказ используют феруловую кислоту и конифериловый спирт, и практически всегда активность грибных лакказ с этими соединениями ниже активности с АБТК (25-27).
В большинстве работ, опубликованных на данный момент, субстратную специфичность известных лакказ в отношении фенилпропаноидов измеряли в более кислой области рН (4.0-6.7) (Таблица 1). Информация о лакказной активности грибных штаммов с фенилпропаноидами при рН>7.0 отсутствует.
В результате анализа литературных источников, касающихся лакказ грибов рода Curvularia, найдено только 2 публикации, в которых имеется скудная информация о продукции и свойствах лакказ грибов Curvularia trifold (31) и Curvularia sp. (32). Так, для гриба Curvularia trifold отсутствует информация о способе погруженного культивирования с целью получения лакказной активности, а также об уровне лакказной активности гриба, достигаемого в процессе культивирования гриба (31). Выделенная лакказа проявляла наибольшую активность с АБТК при рН 2.6, при этом не было измерено активности фермента с другими известными субстратами лакказы.
С целью получения лакказной активности мицелий гриба Curvularia sp. культивировали в течение 5 суток в жидкой среде (50 мл), содержащей 1% дрожжевой экстракт, 1% пептон и 1% декстрозу при 30°C и рН 4,0 (32). К сожалению, лакказная активность гриба измерялась в реакции с гваяколом в качестве субстрата в колориметрических единицах, что не позволяет провести корректное сравнение с активностью других лакказ, выраженной в принятых единицах активности. Выделенная из культуральной жидкости гриба Curvularia sp. лакказа имела наибольшую активность с гваяколом при рН 5,2-6,0. Данных о рН-оптимумах окисления лакказой других субстратов (АБТК, сирингалдазина, 2,6-диметоксифенола, фенилпропаноидов и т.д.) не приводится.
Совсем недавно появилась информация о первичной аминокислотной последовательности лакказы штамма Curvularia lunata (GenBank accession number: AFH53063), но ее биохимические и кинетические свойства еще не описаны.
Ранее штамм Curvularia geniculata F-3561 был использован в работе Коллерова с соавт. (2015) для скрининга мицелиальных грибов, активно трансформирующих стероид 21-ацетат 6α-фтор-16α-метил-дезоксикортикостерон (33), не являющийся типичным субстратом лакказ и не относящийся к объектам исследования настоящей работы. Согласно полученным Колеровым с соавт. Результатам, гриб Curvularia geniculata F-3561 не имел активности в отношении к тестируемому стероиду. В работе Колерова с соавт. нет какого-либо упоминания о способности всех тестируемых грибов, в том числе гриба Curvularia geniculata F-3561, продуцировать лакказы или оксидазы.
Таким образом, полученные в настоящей работе результаты, касающиеся способа получения оксидаз гриба Curvularia geniculata F-3561, активных с фенольными соединениями в нейтральных условиях среды, имеют абсолютную новизну и не представлены в каких либо ранее опубликованных работах.
Сущность изобретения
Технической задачей, на решение которой направлено предлагаемое изобретение, является разработка способа получения оксидаз штамма гриба Curvularia geniculata F-3561, активных в нейтральных условиях среды, с целью получения оксидазного препарата, окисляющего фенилпропаноиды и другие ароматические соединения. Это обеспечивает возможность последующего определения рН-оптимумов и субстратной избирательности доминирующих оксидаз культуральной жидкости указанного штамма.
Предложен способ получения оксидаз штамма гриба Curvularia geniculata F-3561, активных в нейтрально-щелочных условиях среды, характеризующийся тем, что погруженное культивирование штамма гриба Curvularia geniculata F-3561 проводят в минеральной среде, с добавлением в качестве натурального источника углерода и энергии, по крайней мере, одного компонента, выбранного из ряда: картофель, томатная паста, горох, пшеница, ячмень, гречиха, рис, овес, кукуруза до получения максимальной активности лакказ в культуральной жидкости, полученную культуральную жидкость гриба отделяют от мицелия.
Натуральные источники углерода и энергии берут в следующих концентрациях (г/л): горох 5-40, пшеница 5-40, картофель 20, томатная паста 20, ячмень 20, гречиха 20, рис 20, овес 20, кукуруза 20, смесь 6 зерновых культур (ячмень, гречиха, рис, овес, кукуруза, пшеница в равных долях) 20. Преимущественно в качестве натурального источника углерода и энергии применяют горох.
При этом культивирование мицелия гриба осуществляют в минеральной среде следующего состава (г/л): NH4NO3 - 0,2; KН2РO4 - 0,2; K2НРO4 - 0,02; MgSO4 × 7Н2O - 0,12. Культуральную жидкость гриба отделяют от мицелия центрифугированием.
Используемый в качестве продуцента оксидаз штамм гриба Curvularia geniculata F-3561 получен из коллекции ВКМ ИБФМ РАН.
Контроль за ходом культивирования штамма проводят по лакказной активности культуральной жидкости, которую определяют по степени окисления 1 мкМ АБТК (ε436=29300 M-1см-1) в 20 мМ Na-ацетатном буфере, рН 5.0 (34). Измерения проводят в кварцевой кювете (1 см) при 25°С на спектрофотометре Shimadzu UV-160 (Япония) при 436 нм. За единицу активности лакказы принимают скорость превращения 1 мкМ субстрата 1 мл культуральной жидкости за 1 мин.
Культивирование проводят в 100 мл минеральной среды в медицинских колбах объемом 750 мл при 29°С и перемешивании (200 об/мин) в течение 2 суток с конечным выходом лакказной активности в культуральной жидкости гриба 114 ед/мг в среде, содержащей 40 г/л размельченных семян гороха.
Авторами было показано, что полученные оксидазы гриба С. geniculata F-3561 проявляют максимальную активность в нейтральной среде: с 2,6-диметоксифенолом - при рН 7.0, с сирингалдазином - при рН 7.0, с конифериловым спиртом - при рН 6.5, с n-кумаровым спиртом - рН 7.0, с феруловой кислотой - рН 7.5 (Таблица 2).
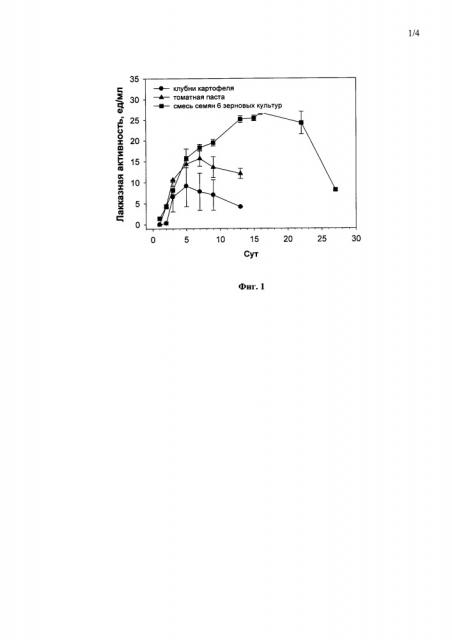
Исходя из того, что грибы рода Curvularia являются патогенами растений, тестирование природных ростовых субстратов в концентрации 20 г/л (свежие мелко-натертые клубни картофеля, томатная паста или смесь семян 6 зерновых культур (пшеница, овес, ячмень, гречиха, рис и кукуруза)) в ходе погруженного культивирования гриба С. geniculata F-3561 позволило выявить лучший источник углерода и энергии для получения лакказной активности гриба (26.7 ед/мл) - размельченные семена зерновых культур (Фиг. 1).
Наиболее оптимальными источниками углерода и энергии из 7 протестированных зерновых культур (пшеница, овес, ячмень, гречиха, рис, кукуруза или горох) в концентрациях 20 г/л для лакказной активности гриба Curvularia geniculata F-3561 при погруженном культивировании были горох (38.0 ед/мл, 5-е сутки) и пшеница (19.0 ед/мл, 14-е сутки) (Фиг. 2).
Наилучшими концентрациями гороха и пшеницы, при которых в ходе погруженного культивирования штамма гриба С. geniculata F-3561 наблюдался максимальный выход лакказ, были 40 г/л гороха (114.0 ед/мл, на 2-е сутки культивирования (Фиг. 3)) и 40 г/л пшеницы (68.0 ед/мл, на 21-е сутки культивирования (Фиг. 4)). Дальнейшее повышение содержания гороха или пшеницы в среде приводило к значительному повышению вязкости культуральной жидкости и, как следствие, невозможности отбора проб.
Проведенная в настоящей работе оптимизация условий погруженного культивирования гриба С. geniculata F-3561 в присутствии натуральных источников углерода и энергии не имеет аналогов для других представителей рода Curvularia.
В описании известных способов (31, 32) нет совпадений со способом, предлагаемым авторами изобретения, в том числе используются и иные штаммы грибов.
Культуральная жидкость гриба С. geniculata F-3561 с максимальной лакказной активностью (114,0 ед/мл), полученная в ходе погруженного культивирования мицелия в присутствии 40 г/л гороха в качестве единственного источника углерода и энергии в минеральной среде, использовалась для исследования рН-оптимума лакказной активности и субстратной специфичности (Таблица 2).
рН-оптимум окисления АБТК оксидазами культуральной жидкости гриба С. geniculata F-3561 находился в области рН 2.5. Максимальная активность оксидаз гриба с 2,6-диметоксифенолом наблюдалась при рН 7.0. С сирингалдазином оксидазы культуральной жидкости гриба были наиболее активны при рН 7.0. рН-оптимум окисления кониферилового спирта культуральной жидкостью гриба находился в районе рН 6.5. Максимальное окисление n-кумарового спирта оксидазами осуществлялось при рН 7.0. Оксидазы культуральной жидкости гриба были наиболее активны в отношении феруловой кислоты при рН 7.5.
Показано, что оксидазы гриба С. geniculata F-3561 проявляли в нейтральных условиях среды максимальную активность в отношении всех замещенных фенолов, в том числе фенилпропаноидов (феруловой кислоты, кониферилового и n-кумарового спиртов), за исключением АБТК, по сравнению с активностью оксидаз, наблюдаемой в кислых условиях (Таблица 2).
При рН 7.2 наибольшая активность оксидаз культуральной жидкости гриба наблюдалась с сирингалдазином и феруловой кислотой (81.7 и 39.3 ед/мл; 1201.5 и 577.9% от активности с АБТК при рН 7.2 или 79.2 или 38.1% от активности с АБТК при рН5.0).
Наименьшая активность оксидаз культуральной жидкости гриба (1.0 ед/мл - 14.2% от активности с АБТК при рН 7.2 или 1.0% от активности с АБТК при рН 5.0) наблюдалась в реакции с n-кумаровым спиртом. В кислых условиях среды оксидазы культуральной жидкости гриба не окисляли n-кумаровый спирт. Также слабая активность оксидаз наблюдалась при рН 5.0 в реакции окисления 2,6-диметоксифенола (2.5 ед/мл), кониферилового спирта (8.2 ед/мл) и феруловой кислоты (8.3 ед/мл).
Оксидазы культуральной жидкости гриба С. geniculata F-3561 в нейтральных условиях рН (7.2) показала самые высокие значения скорости окисления кониферилового спирта и феруловой кислоты по сравнению с известными на сегодняшний день скоростями окисления данных соединений лакказами Pyricularia orizae и Acer pseudoplatanus (Таблица 1), измеренных в условиях близких к нейтральной области рН (рН=6.7).
В настоящей работе впервые показана способность представителя рода Curvularia (Curvularia geniculata F-3561) продуцировать внеклеточные оксидазы, проявляющие активность в отношении фенилпропаноидов в условиях нейтрального рН, а также подробно исследованы рН-оптимумы и субстратная специфичность продуцируемых грибом оксидаз, оптимизированы условия погруженного культивирования гриба с целью повышения выхода алкалофильной оксидазной активности.
Перечень фигур
Фиг. 1 Динамика лакказной активности гриба Curvularia geniculata F-3561 при погруженном культивировании в присутствии свежих мелко-натертых клубней картофеля, томатной пасты или смеси семян 6 зерновых культур в концентрации 20 г/л.
Фиг. 2 Динамика лакказной активности штамма Curvularia geniculata F-3561 при погруженном культивировании в присутствии семян различных зерновых культур в концентрации 20 г/л.
Фиг. 3 Динамика лакказной активности гриба Curvularia geniculata F-3561 при погруженном культивировании в присутствии различных концентраций размельченных семян гороха.
Фиг. 4 Динамика лакказной активности гриба Curvularia geniculata F-3561 при погруженном культивировании в присутствии различных концентраций размельченных семян пшеницы.
Сведения, подтверждающие возможность осуществления изобретения.
Пример 1. Культивирование гриба Curvularia geniculata F-3561 с использованием 20 г/л свежих мелко-натертых клубней картофеля в качестве источника углерода и энергии с целью повышения лакказной активности гриба.
С целью хранения культуру гриба поддерживали в пробирках со скошенным глюкозо-картофельным агаром (глюкоза - 10 г/л, свежий мелко-натертый картофель 200 г/л, агар - 20 г/л) и хранили при 4°С.
Инокулят грибной культуры С.geniculata F-3561 выращивали в колбах объемом 750 мл, содержащих 100 мл стерильной среды (г/л: NH4NO3 - 0.2; KН2РO4 - 0.2; K2НРO4 - 0.02; MgSO4 × 7Н2O - 0.12, мальт-экстракт - 20). 4 Суточный мицелий (3 кусочка диаметром 0.7 см), выращенный на глюкозо-картофельном агаре, вносили в колбы и инкубировали при 29°С в течение 5 суток при перемешивании (200 об/мин). Полученный инокулят гомогенизировали фарфоровыми бусами. Инокулят вносили из расчета 10 мл гомогенизированного мицелия на 100 мл жидкой минеральной среды (NH4NO3 - 0,2; KН2РO4 - 0,2; K2НРO4 - 0,02; MgSO4 × 7 Н2O - 0,12 г/л), содержащей исследуемый источник углерода и энергии (свежие мелконатертые клубни картофеля). Погруженное культивирование гриба осуществляли в медицинских колбах объемом 750 мл при активном перемешивании (200 об/мин) и 29°С.
Максимальная лакказная активность гриба (9,0 ед/мл) достигалась на 5-е сутки погруженного культивирования (Фиг. 1).
Пример 2. Культивирование гриба Curvularia geniculata F-3561 с использованием 20 г/л томатной пасты в качестве источника углерода и энергии с целью повышения лакказной активности гриба.
Культивирование гриба проводили, как описано в примере 1, в присутствии 20 г/л томатной пасты 7 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 16,0 ед/мл (Фиг. 1).
Пример 3. Культивирование гриба Curvularia geniculata F-3561 с использованием 20 г/л размельченных семян 6 зерновых культур в качестве источника углерода и энергии с целью повышения лакказной активности гриба.
Культивирование гриба проводили, как описано в примере 1, в присутствии 20 г/л смеси размельченных семян 6 зерновых культур (гречихи, ячменя, овса, пшеницы, риса, кукурузы в равных долях) 7 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 26,7 ед/мл (Фиг. 1).
Пример 4. Культивирование штамма гриба Curvularia geniculata F-3561 с использованием 20 г/л размельченных семян ячменя в качестве источника углерода и энергии.
Культивирование гриба проводили, как описано в примере 1, в присутствии 20 г/л размельченных семян ячменя 14 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 8,5 ед/мл (Фиг. 2).
Пример 5. Культивирование штамма гриба Curvularia geniculata F-3561 с использованием 20 г/л размельченных семян гречихи в качестве источника углерода и энергии.
Культивирование гриба проводили, как описано в примере 1, в присутствии 20 г/л размельченных семян гречихи 12 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 13,7 ед/мл (Фиг. 2).
Пример 6. Культивирование штамма гриба Curvularia geniculata F-3561 с использованием 20 г/л размельченных семян риса в качестве источника углерода и энергии.
Культивирование гриба проводили, как описано в примере 1, в присутствии 20 г/л размельченных семян риса 2 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 2,0 ед/мл (Фиг. 2).
Пример 7. Культивирование штамма гриба Curvularia geniculata F-3561 с использованием 20 г/л размельченных семян овса в качестве источника углерода и энергии.
Культивирование гриба проводили, как описано в примере 1, в присутствии 20 г/л размельченных семян овса 5 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 15,0 ед/мл (Фиг. 2).
Пример 8. Культивирование штамма гриба Curvularia geniculata F-3561 с использованием 20 г/л размельченных семян кукурузы в качестве источника углерода и энергии.
Культивирование гриба проводили, как описано в примере 1, в присутствии 20 г/л размельченных семян кукурузы 2 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 3,5 ед/мл (Фиг. 2).
Пример 9. Культивирование штамма гриба Curvularia geniculata F-3561 с использованием различных концентраций размельченных семян гороха в качестве источника углерода и энергии.
Погруженное культивирование грибного мицелия осуществляли в минеральной среде, как описано в Примере 1, с добавлением размельченных семян гороха в качестве источника углерода и энергии в различной концентрации:
1) в присутствии 5 г/л - 3 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 22,0 ед/мл (Фиг. 3).
2) в присутствии 10 г/л - 4 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 39,0 ед/мл (Фиг. 3).
3) в присутствии 20 г/л - 2 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 67,0 ед/мл (Фиг. 3).
4) в присутствии 40 г/л - 2 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 114,0 ед/мл (Фиг. 3).
Пример 10. Культивирование гриба Curvularia geniculata F-3561 с использованием различных концентраций размельченных семян пшеницы в качестве источника углерода и энергии.
Погруженное культивирование грибного мицелия осуществляли в минеральной среде, как описано в Примере 1, с добавлением размельченных семян пшеницы в качестве источника углерода и энергии в различной концентрации:
1) в присутствии 5 г/л - 4 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 18,0 ед/мл (Фиг. 4).
2) в присутствии 10 г/л - 13 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 16,5 ед/мл (Фиг. 4).
3) в присутствии 20 г/л - 21 сутки до достижения максимальной лакказной активности в культуральной жидкости гриба - 37,5 ед/мл (Фиг. 4).
4) в присутствии 40 г/л - 21 сутки до достижения максимальной лакказной активности в культуральной жидкости гриба - 68,0 ед/мл (Фиг. 4).
Пример 11. Определение рН-оптимума оксидаз культуральной жидкости гриба Curvularia geniculata F-3561.
Измеряли спектрофотометрически на спектрофотометре UV-160 («Shimadzu», Япония) рН-оптимум культуральной жидкости штамма гриба в кварцевой кювете с длиной оптического пути 10 мм при 25°C в универсальном Бриттон-Робинсон буфере (35) в интервале рН от 2,5 до 9,0. Бриттон-Робинсон буфер был получен смешиванием 0,1 М борной, 0,1 М ортофосфорной и 0,1 М уксусной кислот.
В качестве субстратов использовали АБТК, сирингалдазин, n-кумаровый спирт, конифериловый спирт, феруловую кислоту.
Активность культуральной жидкости гриба с субстратами определяли по скорости образования продуктов с использованием коэффициентов молярной экстинкции (для АБТК - ε436=29300 М-1см-1 (34), для 2,6-диметоксифенола - ε470=35645 М-1см-1 (29), сирингалдазина - ε525=65000 М-1см-1 (36)) или по скорости окисления субстрата (n-кумаровый спирт - ε259=13210 М-1см-1 (22); конифериловый спирт - ε263=13400 M-1см-1 (29); феруловая кислота - ε287=12483 M-1см-1 (22)).
За единицу активности лакказы принимали среднюю скорость превращения 1 мкМ субстрата в минуту 1 мл культуральной жидкости.
Реакцию начинали добавлением в реакционную смесь культуральной жидкости гриба Curvularia geniculata F-3561.
Для исследования рН-оптимума лакказной активности и субстратной избирательности использовалась культуральная жидкость гриба Curvularia geniculata F-3561, полученная при погруженном культивировании мицелия в присутствии 40 г/л гороха в качестве единственного источника углерода и энергии в минеральной среде (Таблица 2).
рН-оптимум окисления АБТК оксидазами культуральной жидкости гриба С. geniculata F-3561 находился в области рН 2.5.
Максимальная активность оксидаз гриба с 2,6-диметоксифенолом наблюдалась при рН 7.0.
С сирингалдазином оксидазы культуральной жидкости гриба были наиболее активны при рН 7.0.
рН-оптимум окисления кониферилового спирта культуральной жидкостью гриба находился в районе рН 6.5.
Максимальное окисление n-кумарового спирта оксидазами осуществлялось при рН 7.0.
Оксидазы культуральной жидкости гриба были наиболее активны в отношении феруловой кислоты при рН 7.5.
Пример 12. Определение субстратной избирательности культуральной жидкости гриба Curvularia geniculata F-3561 в зависимости от рН среды.
Субстратную избирательность культуральной жидкости измеряли спектрофотометрически на спектрофотометре UV-160 («Shimadzu», Япония) в кварцевой кювете с длиной оптического пути 10 мм при 25°С в двух буферах: 20 мМ Na-ацетатном буфере с рН 5.0 и 50 мМ трис-HCl с рН 7.2. В качестве субстратов использовали АБТК, 2,6-диметоксифенол, сирингалдазин, n-кумаровый спирт, конифериловый спирт и феруловую кислоту в концентрации 0.1 мМ в кювете.
Активность культуральной жидкости гриба с субстратами определяли по скорости образования продуктов или окисления субстратов (Пример 11). Реакцию начинали добавлением в реакционную смесь культуральной жидкости гриба. Измерение проводили как минимум в трех повторностях. За единицу активности лакказы принимали среднюю скорость превращения 1 мкМ субстрата в минуту 1 мл культуральной жидкости.
Субстратную избирательность оценивали по скорости окисления того или иного субстрата оксидазами гриба Curvularia geniculata F-3561, выраженную в процентах от скорости окисления АБТК при рН 5.0 и рН 7.2.
Культуральная жидкость гриба С. geniculata F-3561, полученная по предлагаемому способу, проявляла максимальную активность со всеми замещенными фенолами, в том числе фенилпропаноидами (феруловая кислота, конифериловый и n-кумаровый спирты), за исключением АБТК, при рН 7.2 по сравнению с рН 5.0 (Таблица 2).
Наибольшая активность оксидаз культуральной жидкости гриба наблюдалась с сирингалдазином (1201.5% от активности с АБТК при рН 7.2 или 79.2% от активности с АБТК при рН 5.0), с феруловой кислотой (577.9% от активности с АБТК при рН 7.2 или 38.1% от активности с АБТК при рН 5.0) и с 2,6-диметоксифенолом (379.4% от активности с АБТК при рН 7.2 или 25.0% от активности с АБТК при рН 5.0).
Меньшая активность (14.7% от активности с АБТК при рН 7.2 или 1.0% от активности с АБТК при рН 5.0) наблюдалась в реакции с n-кумаровым спиртом. При рН 7.2 конифериловый спирт окислялся оксидазами культуральной жидкости гриба со скоростью 214.7% от активности с АБТК при рН 7.2 или 14.2% от активности с АБТК при рН 5.0.
Таким образом, на примере гриба С. geniculata F-3561 впервые показана способность оксидаз представителей рода Curvularia окислять фенилпропаноиды, сирингалдазин и 2,6-диметоксифенол, при этом максимальная скорость окисления субстратов максимальна в нейтральных условиях среды.
Таким образом, показано, что предлагаемый способ получения лакказ гриба Curvularia geniculata F-3561, основанный на применении натуральных источников углерода и энергии, без использования дорогостоящих компонентов среды (глюкозы, аспарагина, тиамина), индукторов лакказ (солей меди, марганца, кальция, лития, ароматических соединений) и органических растворителей, обеспечивает высокую активность лакказ указанного штамма гриба.
Сравнительный анализ полученных в настоящей работе данных с литературными данными свидетельствует о том, что активность оксидаз, полученных по предлагаемому способу культивирования гриба Curvularia geniculata F-3561, с фенилпропаноидами при рН 7.2 превышает аналогичные показатели лакказной активности других организмов, измеренные при более низких значениях рН, и приближается к уровню активности лакказ растительного штамма Populus euramericana (24), непосредственно принимающих участие в модификации природных фенилпропаноидов в растительных клетках.
В настоящей работе впервые для представителей рода Curvularia представлены данные о возможности окисления фенилпропаноидов (n-кумарового и кониферилового спиртов, феруловой кислоты) оксидазами культуральной жидкости гриба С. geniculata F-3561 в нейтральных условиях среды, а также подробно исследована субстратная избирательность полученной по предлагаемому способу культуральной жидкости С. geniculata F-3561 в отношении фенилпропаноидов, сирингалдазина и 2,6-диметоксифенола.
В тексте использованы следующие сокращения:
АБТК - 2,2-Азино-бис(3-этилбензотиазолин 6-сульфоновая кислота)
ВКМ ИБФМ РАН - Всероссийская Коллекция Микроорганизмов Института Биохимии и Физиологии Микроорганизмов им. Г.К. Скрябина Российской Академии Наук
Работа поддержана Министерством образования и науки РФ (Субсидия №14.616.21.0001, RFMEFI61614X0001)
Использованная литература
1. Baldrian P. Fungal laccases-occurrence and properties. FEMS Microbiol. Rev. 2006, Vol.30, P. 215-242.
2. Riva S. Laccases: blue enzymes for green chemistry. Trends Biotechnol. 2006, Vol.24, P. 219-226.
3. Giardina P., Faraco V., Pezzella C, Piscitelli A., Vanhulle S., Sannia G. Laccases: a never-ending story. Cell. Mol. Life Sci. 2010, Vol.67, P. 369-385.
4. Polak J., Jarosz-Wilkolazka A. Fungal laccases as green catalysts for dye synthesis. Process Biochem. 2012, Vol.47, P. 1295-1307.
5. Hilden K., Hakala Т.К., Lundell T. Thermotolerant and thermostable laccases. Biotechnol. Lett. 2009, Vol.31, P. 1117-1128.
6. Kudanga T.G., Nyanhongo S., Guebitz G.M., Burton S. Potential applications of laccase-mediated coupling and grafting reactions: a review. Enz. Microbiol. Technol. 2011, Vol.48, P. 195-208.
7. Liu H., Tong C, Du В., Liang S., Lin Y. Expression and characterization of LacMP, a novel fungal laccase of Moniliophthora perniciosa FA553. Biotechnol. Lett., 2015, DOI 10.1007/s10529-015-1865-6.
8. Tian Y.-S., Xu H., Peng R.-H., Yao Q.-H. and Wang R.-T. Heterologous expression and characterization of laccase 2 from Coprinopsis cinerea capable of decolourizing different recalcitrant dyes. Biotech. Biotechnol. Equipment, 2014, Vol.28, No. 2, P. 248-258.
9. Ballesteros A.O., Camarero S., Alcalde M. Laboratory evolution of high-redox potential laccases. Chem. Biol. 2013, Vol.17, P. 1030-1041.
10. Martins L.O., Brissos V., Lindley P.F. Laccases of prokaryotic origin: enzymes at the interface of protein science and protein technology. Cell. Mol. Life Sci. 2015, Vol.72, P. 911-922.
11. Marienhagen J., Bott M. Metabolic engineering of microorganisms for the synthesis of plant natural products. J. Biotechnol. 2013, Vol. 163, P. 166-178.
12. Rogalski J., Janusz G., Legiec D., Cho N.-S., Shin S.-J., Ohga S. Purification of extracellular laccase from Rhizoctonia praticola. J. Fac. Agr. Kyushu Univ. 2011, Vol. 56, P. 1-7.
13. Gouka R.J., van der Heiden M., Swarthoff Т., Verrips C.T. Cloning of a phenol oxidase gene from Acremonium murorum and its expression in Aspergillus awamori. Appl. Environ. Microbiol. 2001, Vol.67, P. 2610-2616.
14. Kiiskinen L.-L., Viikari L., Kruus K. Purification and characterisation of a novel laccase from the ascomycete Melanocarpus albomyces. Appl. Microbiol. Biotechnol. 2002, Vol.59, P. 198-204.
15. Berka R.M., Schneider P., Golightly E.J., Brown S.H., Madden M., Brown K.M., Halkier Т., Mondorf K., Xu F. Characterization of the gene encoding an extracellular laccase of Myceliophthora thermophila and analysis of the recombinant enzyme expressed in Aspergillus oryzae. Appl. Environ. Microbiol. 1997, Vol.63, P. 3151-3157.
16. Sulistyaningdyah W.T., Ogawa J., Tanaka H., Maeda C, Shimizu S. Characterization of alkaliphilic laccase activity in the culture supernatant of Myrothecium verrucaria 24G-4 in comparison with bilirubin oxidase. FEMS Microbiol. Lett. 2004, Vol.230, P. 209-214.
17. Cunha W.R., Andrade e Silva M.L., Veneziani S., Ambrosio R.C., Bastos S.R., J.K. Lignans: Chemical and biological properties. Phytochemicals - a global perspective of their role in nutrition and health, Dr Venketeshwer Rao (Ed.), 2012. -ISBN: 978-953-51-0296-0 - http://www.intechopen.com/books/phytochemicals-a-global-perspective-of-their-role-innutrition-andhealth/lignans-chemical-and-biological-properties
18. Suzuki S., Umezawa T. Biosynthesis of lignans and norlignans. J. Wood Sci. 2007, Vol.53, P. 273-284.
19. Ionkova I. Anticancer lignans-from discovery to biotechnology. Mini Rev. Med. Chem. 2011, Vol.11, P. 843-856.
20. Lu M., Xu H. Recent advances in semisynthesis, biosynthesis, biological activities, mode of action, and structure-activity relationship of podophyllotoxins: an update (2008-2010). Mini Rev. Med. Chem. 2011, Vol.11, P. 901-909.
21. Wang Y., Halls C, Zhang J., Matsuno M., Zhang Y., Yu O. Stepwise increase of resveratrol biosynthesis in yeast Saccharomyces cerevisiae by metabolic engineering. Metab. Eng. 2011, Vol.13, P. 455-463.
22. Sterjiades R., Dean J.F.D., Eriksson K.-E.L. Laccase from Sycamore maple {Acer pseudoplatanus) polymerizes monolignols. Plant Physiol. 1992, Vol.99, P. 1162-1168.
23. Sterjiades R., Dean J.F.D., Gamble G., Himmelsbach D.S., Eriksson K.-E.L. Extracellular laccases and peroxidases from Sycamore maple (Acer pseudoplatanus) cell-suspension cultures. Planta 1993, Vol.190, P.75-87.
24. Ranocha P., McDougall G., Hawkins S., Sterjiades R., Borderies G., Stewart D., Macheteau M.C., Boudet A.-M., Goffher D. Biochemical characterization, molecular cloning and expression of laccases - a divergent gene family in poplar. Eur. J. Biochem. 1999, Vol.259, P. 485-495.
25. Dwivedi U.N., Singh P., Pandey V.P., Kumar A. Structure-function relationship among bacterial, fungal and plant laccases. J. Mol. Catal. B: Enzymatic 2011, Vol.6, P. 117-128.
26. Robles A., Lucas R., de Cienfuegos G.A., Galvez A. Phenol-oxidase (laccase) activity in strains of the hyphomycete Chalara paradoxa isolated from olive mill wastewater disposal ponds. Enz. Microbial. Technol. 2000, Vol.26, P. 484-490.
27. Iyer G., Chattoo B.B. Purification and characterization of laccase from the rice blast fungus, Magnaporthe grisea. FEMS Microbiol. Lett. 2003, Vol.227, P. 121-126.
28. Ai M.-Q., Wang F.-F., Huang F. Purification and characterization of a thermostable laccase 1 from Trametes trogii 2 and its ability in modification of kraft lignin. J. Microbiol. Biotechnol. 2015, Apr 15, PMID: 25876603.
29. Eggert C., Temp U., Eriksson K.E. The ligninolytic system of the white rot fungus Pycnoporus cinnabarinus: purification and characterization of the laccase. Appl. Environ. Microbiol., 1996, Vol.62, P. 1151-1158.
30. Min K.-L., Kim Y.-H., Kim Y.W., Jung H.S., Hah Y.C. Characterization of a novel laccase produced by the wood-rotting fungus Phellinus ribis. Arch. Biochem. Biophys. 2001, Vol.392, P. 279-286.
31. Zhang J., Ren J., Yu Y., Wang B. Purification and characterization of laccase from Curvularia trifold. Adv. Mat. Res. 2010, Vol.113-114, P. 2215-2219.
32. Banerjee U.C., Vohra R.M. Production of laccase by Curvularia sp.. Folia Microbiol. 1991, Vol.36, P. 343-346.
33. Колеров В.В., Фокина В.В., Суходольская Г.В., Шутов А.А., Донова М.В. 11β-Гидроксилирование 21-ацетата 6α-фтор-16α-метил-дезоксикортикостерона мицелилальными грибами. Прикладная Биохимия и Микробиология, 2015, Т. 51, No. 2, с. 161-173.
34. Perez J., Jeffries T.W. Mineralization of C-ring-labeled synthetic lignin correlates with the production of lignin peroxidase, not of manganese peroxidase or laccase. Appl. Environ. Microbiol. 1990, Vol.56, P. 1806-1812.
35. Xu F. Oxidation of phenols, anilines, and benzenethiols by fungal laccases: correlation between activity and redox potentials as well as halide inhibition. Biochemistry. 1996, Vol.35, P. 7608-7614.
36. Leonowicz A., Grzywnowicz K. Quantitative estimation of laccase forms in some white-rot fungi using syringaldazine as a substrate. Enz. Microb. Technol. 1981, Vol.3, P. 55-58.
37. Huynh V.-B., Crawford R. Comparison of ligninase-I and peroxidase-M2 from the white-rot fungus Phanerochaete chrysosporium. Arch. Biochem. Biophys. 1986, Vol.244, P. 750-765.
1. Способ получения оксидаз штамма гриба Curvularia geniculata ВКМ F-3561, активных в нейтральных условиях среды, характеризующийся тем, что погруженное культивирование гриба Curvularia geniculata ВКМ F-3561 проводят в минеральной среде с добавлением в качестве натурального источника углерода и энергии, по крайней мере, одного компонента, выбранного из ряда: горох, картофель, томатная паста, пшеница, ячмень, гречиха, рис, овес, кукуруза до получения максимальной активности лакказ в культуральной жидкости, полученную культуральную жидкость гриба отделяют от мицелия.
2. Способ по п. 1, отличающийся тем, что натуральный источник углерода и энергии применяют в следующих концентрациях (г/л): горох 5-40, пшеница 5-40, картофель 20, томатная паста 20, ячмень 20, гречиха 20, рис 20, овес 20, кукуруза 20, смесь 6 зерновых культур: ячмень, гречиха, рис, овес, кукуруза и пшеница в равных долях 20.
3. Способ по п. 2, отличающийся тем, что применяют в качестве натурального источника углерода и энергии преимущественно горох.
4. Способ по п. 1, отличающийся тем, что погруженное культивирование гриба Curvularia geniculata ВКМ F-3561 проводят в минеральной среде следующего состава (г/л): NH4NO3 - 0,2; KН2РO4 - 0,2; K2НРO4 - 0,02; MgSO4 × 7Н2О - 0,12.
5. Способ по п. 1, отличающийся тем, что культуральную жидкость гриба отделяют от мицелия центрифугированием.