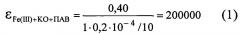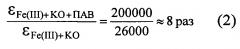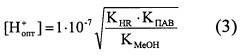Способ фотометрического определения железа (iii)
Иллюстрации
Показать всеИзобретение относится к области аналитической химии, а именно к фотометрическому методу анализа, и может быть использовано для определения содержания железа (III) в растворах чистых солей, содержащих железо (III) в очень малой концентрации. Способ фотометрического определения железа (III) включает переведение железа (III) в комплексное соединение с органическим реагентом – ксиленоловым оранжевым и поверхностно-активным веществом в слабокислой среде, добавление дистиллированной воды до 10 мл объема с нагреванием на водяной бане при температуре 60-80°C и последующим фотометрированием полученного раствора после его охлаждения, отличающийся тем, что к (0,8-2)·10-4 М раствору железа (III) с pH, равным 3,5-4,0, создаваемым введением 3,0 мл ацетатного буферного раствора, добавляют 0,5 мл 1·10-2 М раствора ксиленолового оранжевого и 0,1 мл 4·10-3 М раствора поверхностно-активного вещества в виде этоксилата изодецилового спирта, при этом нагревание на водяной бане осуществляют в течение 10 мин, а фотометрирование производят при длине волны, равной 440 нм, и толщине кюветы, равной 1 см. Изобретение позволяет сократить время проведения анализа, улучшить его воспроизводимость, а также повысить устойчивость окраски полученного комплексного соединения. 2 табл., 9 ил.
Реферат
Изобретение относится к области аналитической химии, а именно к фотометрическому методу анализа, и может быть использовано для определения содержания железа Fe(III) в растворах чистых солей, содержащих Fe(III) в очень малой концентрации.
В молекулярной спектроскопии можно исследовать однокомпонентные (окрашенные реагенты или ионы металлов), бинарные (ион металла с органическим реагентом), трехкомпонентные (ион металла с двумя органическими реагентами) и др. Последние интересны тем, что в присутствии третьего компонента некоторые трехкомпонентные фотометрические системы обладают повышенной чувствительностью по сравнению с соответствующими бинарными.
Известно бинарное комплексное соединение Fe(III) с ксиленоловым оранжевым (КО) [1, 2]. Изучению трехкомпонентных фотометрических систем посвящены работы [3-8].
Влияние поверхностно-активного вещества (ПАВ) - этоксилата изодецилового спирта на чувствительность определения Fe(III) с КО не изучено.
Наиболее близким по технической сущности к заявляемому изобретению является способ фотометрического определения Fe(III) в растворах чистых солей, который включает переведение Fe(III) в комплексное соединение с органическим реагентом и ПАВ в слабокислой среде, нагревание на водяной бане и последующее фотометрирование полученного раствора, при этом к раствору Fe(III) с pH 3,9-5,2 добавляют 50-кратное количество органического реагента, в качестве которого используют ксиленоловый оранжевый, 1,8-2,2 мл раствора ПАВ в виде 2%-ного раствора ETHAL LA-7, и воды до 10 мл объема с последующим нагреванием на водяной бане при температуре 60-80°C в течение 15 мин и добавление в полученный раствор 1 мл ацетона [9].
Недостатками известного способа являются низкая устойчивость окраски раствора (2 час), длительное время нагревания (15 мин), необходимость наличия дополнительно органического растворителя - ацетона, отрицательно влияющего на организм человека, а также дорогостоящего французского ПАВ - ETHAL LA-7.
Технический результат заключается в сокращении времени проведения анализа, улучшении его воспроизводимости, повышении устойчивости окраски полученного комплексного соединения, за счет использования ПАВ в виде этоксилата изодецилового спирта и фотометрирования в кювете с толщиной слоя равной 1 см.
Сущность изобретения заключается в том, что в способе фотометрического определения железа(III) производят переведение Fe(III) в комплексное соединение с органическими реагентами - КО и ПАВ в слабокислой среде. К (0,8-2)⋅10-4 М раствору Fe(III) с pH равным 3,5-4,0, создаваемым введением 3,0 мл ацетатного буферного раствора, добавляют 0,5 мл 1⋅10-2 М раствора КО и 0,1 мл 4⋅10-3 М раствора ПАВ в виде этоксилата изодецилового спирта. Доводят дистиллированной водой до 10 мл объема с нагреванием на водяной бане при температуре 60-80°C в течение 10 мин и фотометрируют полученный раствор при длине волны равной 440 нм и толщине кюветы, равной 1 см.
В изобретении используют следующие реагенты.
1. ПАВ - этоксилат изодецилового спирта:
С10Н21-О-(СН2-СНОН-)n-Н, где n=7.
Этоксилат изодецилового спирта применяют в качестве адъювата в гербицидных препаратах. Вещество уменьшает поверхностное натяжение побегов растений, обеспечивает образование однородной пленки на поверхности листьев, что уменьшает адгезию гербицида и его адсорбцию листвой. За счет этого повышается гербицидный эффект и скорость воздействия препарата, что особенно важно в период замедленного роста (связанного с сухой и/или холодной погодой).
2. Стандартный 1⋅10-2 М раствор Fe(III) готовят растворением рассчитанной навески сульфата Fe(III) (х.ч.) в воде при подкислении раствором серной кислоты (H2SO4) для предотвращения гидролиза. Точную концентрацию полученного раствора определяют гравиметрическим методом. Для изучения оптимальных условий комплексообразования Fe(III) с КО рабочий раствор Fe(III) 1⋅10-3 М получают разбавлением исходного раствора дистиллированной водой.
3. 1⋅10-2 М раствор КО готовят растворением соответствующей навески в дистиллированной воде. КО - органический реагент, применяемый при комплексонометрическом титровании. Температура плавления 222°C; растворим в воде, не растворим в этаноле, диэтиловом эфире. Получают аминометилированием крезолового красного действием CH2O и иминодиуксусной кислоты в СН3СООН.
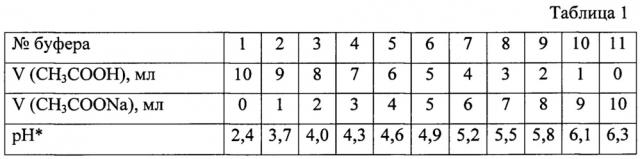
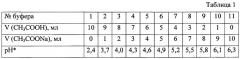
4. Для создания необходимой кислотности среды применяют ацетатные буферные растворы, которые готовят из 1 М раствора СН3СООН и 1 М раствора CH3COONa согласно данным табл. 1.
* - pH приготовленных буферных растворов измеряют на pH-метре (индикаторный электрод - стеклянный, сравнения - каломельный), оптическую плотность - на спектрофотометре «СФ ПЭ 5300 ВН».
Пример. Определение оптимальных условий комплексообразования Fe(III) с КО в присутствии ПАВ - этоксилата изодецилового спирта.
В градуированные пробирки помещают по 0,2 мл 1⋅10-4 М раствора Fe(III) с pH=3,7, по 3,0 мл ацетатных буферных растворов с переменным значением pH, по 0,5 мл 1⋅10-2 М раствора КО, по 0,1 мл 4⋅10-3 М раствора ПАВ. Ионную силу растворов для хорошей воспроизводимости анализа равную 0,6 поддерживают постоянной добавлением рассчитанного количества раствора нитрата калия (KNO3). Общий объем раствора доводят до 10 мл дистиллированной водой. Реакционную смесь нагревают 10 мин на водяной бане при температуре 60-80°C, по охлаждении фотометрируют относительно растворов сравнения. На фиг. 1 показаны спектры светопоглощения комплекса Fe(III)+КО+ПАВ (1) и КО+ПАВ (2); фиг. 2 - зависимость А - pH комплекса Fe(III)+КО+ПАВ; фиг. 3 - зависимость А - VПАВ, мл, для комплекса Fe(III)+КО+ПАВ; фиг. 4 - зависимость А - VКО, мл, для комплекса Fe(III)+КО+ПАВ.
Линейность градуировочного графика для системы Fe(III)+КО+ПАВ (λmax=440 нм; pHопт=3,7; VПАВ=0,1 мл 4⋅10-3 М; VКО=0,7 мл 10-2 М) соблюдается в интервале концентраций (0,8-2)⋅10-4 М Fe(III).
Расчет величины молярного коэффициента светопоглощения комплексного соединения Fe(III)+КО+ПАВ:
Температуру и продолжительность нагревания устанавливают опытным путем. Интенсивность окраски полученных комплексных соединений сохраняется в течение 6 час.
При сравнении:
величина молярного коэффициента светопоглощения в присутствии ПАВ в 8 раз выше той же величины в отсутствие ПАВ и в 2 раза выше предельно известной (100000) величины.
Величина молярного коэффициента светопоглощения трехкомпонентного комплексного соединения превысила ту же величину по сравнению с бинарной в 8 раз. Если предельная величина молярного коэффициента светопоглощения, известная из литературы равна 100000, то заявляемый способ фотометрического определения Fe(III) с КО в присутствии ПАВ увеличивает величину молярного коэффициента светопоглощения в 2 раза, а это позволяет определять железо(III) в растворах при меньших концентрациях.
Как известно, чувствительность фотометрируемого комплексного соединения иона металла с органическим реагентом может возрастать за счет увеличения числа донорно-акцепторных связей, а за счет них и количества 5-ти- и 6-ти-членных циклов.
Для выяснения предполагаемого строения комплекса Fe(III)+КО+ПАВ фотометрическим методом определяют pKПАВ.
Определение pKПАВ:
для ПАВ pK определяют фотометрическим методом. В пробирки помещают по 1,0 мл 4⋅10-3 М раствора ПАВ, по 5,0 мл ацетатных буферных растворов с переменным значением pH, воду до объема 10 мл, нагревают на кипящей водяной бане 10 мин. По охлаждении фотометрируют относительно растворов сравнения, при λmax=350 нм и На фиг. 5 показан спектр светопоглощения ПАВ; фиг. 6 - зависимость А - pH для ПАВ.
Согласно расчету методом Хона рКПАВ=3,7.
Определение соотношения компонентов Me:R в трехкомпонентной системе Fe(III)+КО+ПАВ:
Метод изомолярных серий: готовят трехкомпонентные системы: Fe(III)+КО одинаковой концентрации, смешивают их в разных соотношениях при одном и том же оптимальном количестве ПАВ, pHmax и нагревании для получения комплекса. Соотношение Me:R в присутствии ПАВ равно 1:3.
Какие функциональные группы реагентов и ионные формы металла вступают в реакцию комплексообразования, при каком соотношении компонентов Me:R идет реакция могут показать расчеты pHопт комлексообразования.
Для определения соотношения Me:R используют расчетный метод для бинарных комплексных соединений. При взаимодействии гидролизующихся ионов металла с реактивами слабокислого характера выход продукта реакции зависит от pH раствора. При повышении pH происходит увеличение концентрации иона реагента, из-за усиления гидролиза уменьшается концентрация иона металла. При понижении pH гидролиз подавляется, но увеличивается протонизация реагента. При некотором pH оптимальном (pHопт) наблюдается максимальный выход продукта реакции.
Определяют, какие ионные формы металла и реагента вступают в реакцию расчетом pHопт раствора. Для расчета pHопт учитывают основные процессы, протекающие в растворе.
Образование фотометрируемого соединения:
mMe+nR↔MmRn.
Образование гидроксокомплексов иона металла:
Ме++qH2O↔Me(OH)q+qH+.
Образование ионных форм органического реагента:
HR↔H++R-.
Образование ионных форм ПАВ:
HK↔Н++K-.
В водных растворах солей ионы металлов (вследствие гидролиза вблизи pH осаждения их гидроксидов при pHопт комплексообразования) могут присутствовать в виде различных ионных форм.
pH начала осаждения Fe(OH)3 равен 2,3, то есть в реакцию с КО и ПАВ вступает гидролизованная форма Fe(III) - Fe(OH)2+ или FeOH2+. Гидролизованными формами ионов Fe(III) могут быть (в скобках указаны их pK): [FeOH(H2O)5]2+ (2,2); [Fe2(OH)2(H2O)8]4+ (2,9); [Fe(OH)2(H2O)4]+ (3,26). Ионизированные формы КО имеют следующие значения pK: H6Ind (1,2); H5Ind (2,6); H4Ind (3,2); H3Ind (6,4); H2Ind (10,4); Hind (12,3) [2], рКПАВ=3,7.
В очень сильно кислой среде (в интервале значений функции кислотности Гаммета) и щелочной среде Fe(III) с органическим реагентом окрашенного комплексного соединения не образует, поэтому pK1, pK5, pK6 для КО в расчетах при определении соотношения Me:R не используют.
Формулы расчетного метода для бинарных систем преобразовывают для трехкомпонентных при соотношении Me:R=1:1:
при соотношении Me:R=1:2:
при соотношении Me:R=1:3:
Для вычисления соотношения Me:R расчетным методом используют рКПАВ, РКко, рКFe(III) для компонентов комплекса. В табл. 2 показан пример, данные для расчета.
Результаты вычислений представлены графически (фиг. 7), из которых видно, что в присутствии ПАВ образуется комплекс с соотношением компонентов Me:R=1:3, где Fe(III) присутствует в виде двух ионных форм FeOH2+(1') и [Fe2(OH)2]4+(1''), КО ионизированным по третьей ступени. Результаты остальных расчетов соотношения Me:R не даны, так как полученные графики параллельны оси абсцисс (расчеты не приведены).
Из фиг. 7 видно, что, предположительно, шесть атомов азота (по два из каждой молекулы КО) трех молекул КО образуют донорно-акцепторные связи. Возникают три восьмичленных цикла за счет сближения двух бензольных колец в каждой из молекул КО.
На фиг. 8 показана вероятная структурная формула комплексного соединения Fe(III) с КО в присутствии ПАВ, где Fe(III) в ионной форме FeOH2+(1'); фиг. 9 - вероятная структурная формула комплексного соединения Fe(III) с КО в присутствии ПАВ, где Fe(III) в ионной форме [Fe2(OH)2]4+(1'').
Вероятно, аналогично действию ПАВ на растения (уменьшает поверхностное натяжение побегов растений) при добавлении ПАВ к комплексному соединению Fe(III) с КО происходит следующее: ПАВ уменьшает расстояние между КО и Fe(III), сильнее притягивает их в трехкомпонентном комплексе, чем в бинарном, а за счет избытка КО свободные молекулы КО плотнее окружают Fe(III), образуя дополнительные донорно-акцепторные связи, увеличивая число и членность компонентов циклов между металлом и КО. Это ведет к увеличению соотношения Me:R (если в бинарном оно равно 1:1, то в трехкомпонентном 1:3). А это, как известно, повышает чувствительность определения иона металла, что и подтверждают расчеты. Величина молярного коэффициента светопоглощения в присутствии ПАВ в 2 раза выше предельно известной (100000) величины.
По сравнению с известным бинарным комплексным соединением Fe(III) с КО предлагаемое позволяет повысить чувствительность способа фотометрического определения железа(III) за счет использования органического реагента КО в присутствии ПАВ - этоксилата изодецилового спирта. Молярный коэффициент светопоглощения предлагаемого способа в 8 раз превышает эту величину в соответствующем бинарном комплексном соединении Fe(III) с КО и в 2 раза превышает предельной этой величины известной из литературы, что позволяет определять Fe(III) в растворах чистых солей в очень малой концентрации.
Кроме того по сравнению с прототипом толщина кюветы равная 1 см быстро заполняется, время нагревания на водяной бане комплексного соединения для получения максимальной интенсивности окраски сокращено на 5 мин, соответственно для анализа требуется меньше времени. У предлагаемого способа хорошая воспроизводимость анализа, образующийся комплекс более устойчив (окраска сохраняется в течение 6 час), комплексное соединение не выпадает в осадок, а реакция его образования идет в водной среде, поэтому отсутствует необходимость в органических растворителях, отрицательно влияющих на организм человека.
Источники информации:
1. Булатов М.И., Калинкин И.П., Практическое руководство по фотоколориметрическим и спектрофотометрическим методам анализа. - «Химия», 1976. - С. 244, 406.
2. Индикаторы. Э. Бишоп. - М.: Мир, 1976. Т. 1. - С. 402.
3. Hiroto Watanabe. Spektrophotometric determination of cobalt with 1-(2-pyridilazo-2 naftanol and surfact-ants. - Talanta, Vol. 21 pp. 295-302, 1974 / Хирото Ватанабе. Спектрофотометрическое определение кобальта с 1-(2-пиридилазо)-2-нафтанолом и поверхностно-активными веществами. - Таланта, 1974. Вып. 21, - С. 295-302.
4. RU 2312338, МПК G01N 31/22, G01N 21/78, опубл. 10.12.2007.
5. RU 2312339, МПК G01N 31/22, G01N 21/78, опубл. 10.12.2007.
6. RU 2298171, МПК G01N 21/78, опубл. 27.04.2007.
7. RU 2331875, МПК G01N 31/22, G01N 21/78, опубл. 20.08.2008.
8. RU 2333487, МПК G01N 31/22, G01N 21/78, опубл. 10.09.2008.
9. RU 2531053, МПК G01N 31/22, G01N 21/78, опубл. 20.10.2014.
Способ фотометрического определения железа (III), включающий переведение железа (III) в комплексное соединение с органическим реагентом – ксиленоловым оранжевым и поверхностно-активным веществом в слабокислой среде, добавление дистиллированной воды до 10 мл объема с нагреванием на водяной бане при температуре 60-80°C и последующим фотометрированием полученного раствора после его охлаждения, отличающийся тем, что к (0,8-2)·10-4 М раствору железа (III) с pH, равным 3,5-4,0, создаваемым введением 3,0 мл ацетатного буферного раствора, добавляют 0,5 мл 1·10-2 М раствора ксиленолового оранжевого и 0,1 мл 4·10-3 М раствора поверхностно-активного вещества в виде этоксилата изодецилового спирта, при этом нагревание на водяной бане осуществляют в течение 10 мин, а фотометрирование производят при длине волны, равной 440 нм, и толщине кюветы, равной 1 см.