Преобразование карбоната металла в хлорид металла
Иллюстрации
Показать всеИзобретение может быть использовано в химической промышленности. Хлорид металла Mx+Clx- получают взаимодействием карбоната металла в виде твердого вещества с фосгеном, дифосгеном и/или трифосгеном. Металл М выбирают из группы щелочных металлов, щелочноземельных металлов, Al и Zn, «х» соответствует валентности катиона металла. В качестве реагента дополнительно добавляют металл, который отличается от металла М карбоната или соответствует ему. 3 н. и 20 з.п. ф-лы, 1 табл., 17 ил.
Реферат
Настоящее изобретение относится к способу получения хлорида металла Mx+Clx-, в котором карбонат металла в виде твердого вещества взаимодействует с фосгеном, дифосгеном и/или трифосгеном с образованием хлорида металла Mx+Clx-, причем металл М выбирается из группы щелочных металлов, щелочноземельных металлов, Al и Zn, предпочтительно Li и Mg, в особенности предпочтительно Li, и «х» соответствует валентности катиона металла, а также к устройству для исполнения способа.
В патентных документах WO2012/038330 и WO2013/156476 описывается, как дымовые газы/отходящие газы могут быть обработаны электроположительными металлами литием или магнием, чтобы получить ценные вещества и высококачественную тепловую энергию, и тем самым снизить загрязнение атмосферы.
В патентном документе WO2012/038330 продемонстрировано, что СО2 с литием реагирует с образованием ценных веществ, таких как монооксид углерода или ацетилен, которые впоследствии могут быть преобразованы в метанол или прочие ценные вещества. Высвобождающаяся тепловая энергия может быть использована для того, чтобы стимулировать разделение метанола и СО2, или даже для производства пара.
При этом существенными являются следующие реакции и соображения:
2Li+CO2→Li2O+CO-314,9 кДж/моль (сравнение: C+О2→CО2-393,5 кДж/моль)
4Li+CО2→2Li2О+C-803,94 кДж/моль
C+CO2→2CO+172,5 кДж/моль; который может быть преобразован в метанол
2C+2Li → Li2C2; который может быть преобразован в ацетилен (соотношение CО2:Li)
Li2CO3+4C→Li2C2+3CO
Li2O+CO2→Li2CO3; Li2CO3→Li2O+CO2 при соответственных температурах около 1500°С
Энтальпии образования (298K): Li2O=-597,90 кДж/моль;
Li2CO3=-1215,87 кДж/моль.
2Li+2CO2→Li2CO3+CO-539 кДж
После гидролиза получается высокощелочная суспензия Li2CO3.
Li2C2+H2O→HC=CH+2LiOH
Li2O+CO2→Li2CO3
В патентном документе WO2013/156476 представлено, что обработки дымового газа/отходящего газа с использованием высокой растворимости солей на основе лития и серы и низкой растворимости карбоната лития могут предусматривать также обессеривание:
6Li+SО2→Li2S+2Li2О
8Li+SО3→Li2S+3Li2О
Li2О+SО2→Li2SО3-438,7 кДж/моль
Затем должна быть разделена образованная после сгорания СО2 и SO2 с принудительным окислением суспензия, которая содержит Li2CO3 и Li2SO4. К счастью, все сернолитиевые соли хорошо растворимы в воде (например, сульфат лития с 350 г/л при комнатной температуре (около 25°С)). В отличие от Na2S2O5, Li2S2O5 или Li2SO3 имеют высокую растворимость. Это значит, что все сернистые соединения остаются в растворе, тогда как Li2CO3 (растворимость 13 г/л) образуется в виде осадка и может быть получен для повторного использования в виде довольно чистого продукта (см. патентный документ WO2010/000681). Хорошая растворимость сульфата лития при этом отличает его от CaSO4 (2 г/л), который получается в процессе обессеривания согласно прототипу.
Все эти последовательности технологических стадий завершаются слегка влажным, довольно чистым карбонатом лития. Восстановление карбоната лития до металлического лития может быть достигнуто, например, преобразованием карбоната в хлорид, и последующим электролизом эвтектической смеси хлорида калия/лития.
1. Li2CО3+2HCl→2LiCl+H2О+CО2 (энтальпия реакции: -96 кДж/моль. 2. Li2CО3+Cl2→2LiCl+1/2О2+CО2 (энтальпия реакции: ~5 кДж/моль)
Обычно в способе приготовления хлорида лития для получения лития либо карбонат лития, либо гидроксид лития вводится в реакцию с хлороводородной кислотой (соляной кислотой) в водном растворе. После выпаривания и кристаллизации кристаллы выделяются и высушиваются, чтобы получить очень гигроскопичный безводный хлорид лития, как описано автором Jürgen Deberitz в работе «Lithium, Die Bibliothek der Wissenschaft» («Литий, библиотека науки»), том 2, стр. 37, 2006 (ISBN-13: 978-3-937889-36-8). Наибольшую трудность в таком процессе, какой описан в патенте США № 6,048,507, представляет высокое энергопотребление, теоретически 30×103 кДж/кг. До сих пор источнику энергии, который применяется для химического превращения, не уделялось никакого внимания.
Дополнительный способ, который описан в патентных документах CA 2340528 АI и US 20130001097 AI, состоит в том, что карбонат лития вводится в реакцию с газообразным хлором, чтобы получить безводный хлорид лития. Приготовление безводного хлорида лития из порошкообразного карбоната лития в реакторе с псевдоожиженным слоем описано в патентном документе WO2014/005878.
Кроме того, существует потребность в усовершенствованном способе получения хлорида металла из карбоната металла, в частности, из энергетических соображений.
Теперь же было обнаружено, что эффективное получение, в частности, также с энергетической точки зрения, хлорида металла из карбоната металла возможно в таком случае, что для взаимодействия применяется фосген, дифосген и/или трифосген, который поставляет энергию для процесса. Путем взаимодействия с фосгеном, «аддуктом» хлора и монооксида углерода, и, соответственно, с производными дифосгеном и/или трифосгеном, из которых может выделяться фосген, в форме непосредственного хлорирования, прямое хлорирование карбоната металла может быть подразделено на частичные реакции, например, на две, которые являются электрохимически благоприятными.
Кроме того, согласно изобретению была найдена эффективная последовательность химических реакций, чтобы получить хлорид металла и в конечном итоге металл М из карбоната металла.
Кроме того, благодаря протекающим экзотермическим реакциям может быть обеспечено более быстрое течение реакций, что может приводить к более высокой производительности, и также может быть использована высвобождающаяся энергия, например, для производства электроэнергии.
Согласно одному аспекту, настоящее изобретение относится к способу получения хлорида металла Mx+Clx-, в котором карбонат металла в виде твердого вещества взаимодействует с фосгеном, дифосгеном и/или трифосгеном с образованием хлорида металла Mx+Clx-, причем металл М выбирается из группы щелочных металлов, щелочноземельных металлов, Al и Zn, предпочтительно Li и Mg, в особенности предпочтительно Li, и «х» соответствует валентности катиона металла.
Согласно одному дополнительному аспекту, настоящее изобретение относится к устройству для проведения реакции карбоната металла в виде твердого вещества с фосгеном, дифосгеном и/или трифосгеном с образованием хлорида металла Mx+Clx-, причем металл М выбирается из группы щелочных металлов, щелочноземельных металлов, Al и Zn, предпочтительно Li и Mg, в особенности предпочтительно Li, и «х» соответствует валентности катиона металла, включающему
первый реактор для взаимодействия карбоната металла и фосгена, дифосгена и/или трифосгена;
первое загрузочное устройство для карбоната металла, которое конфигурировано для введения карбоната металла в виде твердого вещества в первый реактор;
второе загрузочное устройство для фосгена, дифосгена и/или трифосгена, которое конфигурировано для подачи фосгена, дифосгена и/или трифосгена в первый реактор;
первое разгрузочное устройство для хлорида металла, которое конфигурировано для выведения хлорида металла из первого реактора; и
второе разгрузочное устройство для газообразных продуктов взаимодействия карбоната металла и фосгена, дифосгена и/или трифосгена, которое конфигурировано для выведения из первого реактора газообразных продуктов реакции карбоната металла с фосгеном, дифосгеном и/или трифосгеном.
Кроме того, согласно одному дополнительному аспекту, изобретение относится к устройству для взаимодействия карбоната металла в виде твердого вещества с фосгеном, дифосгеном и/или трифосгеном с образованием хлорида металла Mx+Clx-, причем металл М выбирается из группы щелочных металлов, щелочноземельных металлов, Al и Zn, предпочтительно Li и Mg, в особенности предпочтительно Li, и «х» соответствует валентности катиона металла, причем в качестве реагента дополнительно добавляется металл М, включающему
первый реактор для взаимодействия карбоната металла и фосгена, дифосгена и/или трифосгена;
первое загрузочное устройство для карбоната металла, которое конфигурировано для введения карбоната металла в виде твердого вещества в первый реактор;
второе загрузочное устройство для хлора, которое конфигурировано для подачи хлора в первый реактор;
первое разгрузочное устройство для хлорида металла, которое конфигурировано для выведения хлорида металла из первого реактора;
необязательно, по меньшей мере одно седьмое загрузочное устройство для монооксида углерода и/или фосгена, дифосгена и/или трифосгена, которое предназначено для введения монооксида углерода и/или фосгена, дифосгена и/или трифосгена в первый реактор; и
второе разгрузочное устройство для газообразных продуктов взаимодействия карбоната металла и фосгена, дифосгена и/или трифосгена, которое предназначено для выведения из первого реактора газообразных продуктов реакции карбоната металла с фосгеном, дифосгеном и/или трифосгеном,
кроме того, включающему третье загрузочное устройство для металла М, которое предназначено для подачи металла М в первый реактор.
О дополнительных аспектах настоящего изобретения можно заключить из зависимых пунктов формулы изобретения и подробного описания.
Сопроводительные чертежи призваны наглядно показать варианты осуществления настоящего изобретения и содействовать дополнительному пониманию их. В связи с описанием, они служат для разъяснения концепций и принципов изобретения. Другие варианты исполнения и многие из указанных преимуществ выявляются с учетом чертежей. Элементы чертежей не обязательно представлены в масштабе относительно друг друга. Одинаковые, функционально сходные и одинаково действующие элементы, признаки и компоненты в фигурах чертежей в каждом случае снабжены теми же самыми обозначениями, если не оговорено иное.
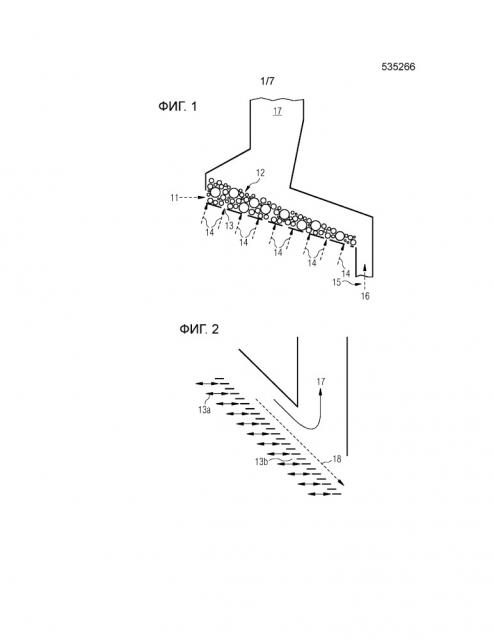
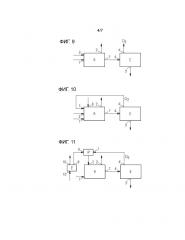
Фигура 1 схематически показывает реактор с колосниковой решеткой, который может быть использован в соответствующем изобретению способе и соответствующем изобретению устройстве.
Фигура 2 схематически показывает подробный вид реактора с колосниковой решеткой в одном примере исполнения, который может быть применен в соответствующем изобретению способе и соответствующем изобретению устройстве
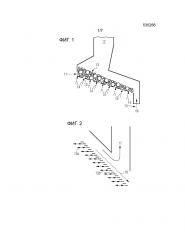
Фигура 3 схематически показывает циклонный реактор, который может быть использован в соответствующем изобретению способе и соответствующем изобретению устройстве.
Фигура 4 схематически показывает дополнительный циклонный реактор, который может быть использован в соответствующем изобретению способе и соответствующем изобретению устройстве.
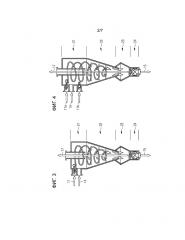
Фигура 5 схематически показывает один пример осуществления настоящего изобретения.
Фигура 6 схематически показывает один дополнительный пример осуществления настоящего изобретения.
Фигура 7 схематически показывает еще один дополнительный пример осуществления настоящего изобретения.
Фигура 8 представляет, в добавление к этому, один дополнительный пример осуществления настоящего изобретения.
Фигура 9 схематически показывает один пример осуществления настоящего изобретения, который дополнительно включает электролизное устройство.
Фигура 10 иллюстрирует один дополнительный пример осуществления настоящего изобретения, который дополнительно включает электролизное устройство.
Фигура 11 схематически показывает один пример осуществления настоящего изобретения, который дополнительно включает электролизное устройство, второе электролизное устройство и третий реактор.
Фигура 12, в добавление к этому, представляет один дополнительный пример осуществления настоящего изобретения, который дополнительно включает электролизное устройство и второе электролизное устройство.
Фигура 13 схематически показывает один пример осуществления настоящего изобретения, который дополнительно включает второй реактор.
Фигура 14 схематически показывает один пример осуществления настоящего изобретения, который дополнительно включает электролизное устройство и второй реактор.
Фигура 15 схематически показывает один дополнительный пример осуществления настоящего изобретения, который дополнительно включает электролизное устройство и второй реактор.
Фигура 16 иллюстрирует один дополнительный пример осуществления настоящего изобретения, который дополнительно включает электролизное устройство и второй реактор.
Фигура 17, в дополнение к этому, представляет один дополнительный пример осуществления настоящего изобретения, который дополнительно включает электролизное устройство и и второй реактор.
В рамках изобретения указывается на то, что приведенные в порядке примера уравнения представляют суммарные уравнения, и протекающие химические процессы могут быть явно более сложными.
Настоящее изобретение в первом аспекте относится к способу получения хлорида металла Mx+Clx-, в котором карбонат металла в виде твердого вещества взаимодействует с фосгеном, дифосгеном и/или трифосгеном с образованием хлорида металла Mx+Clx-, причем «х» соответствует валентности катиона металла (например, 1 для Li, 2 для Mg, 3 для Al). В таком способе металл М выбирается из группы щелочных металлов, предпочтительно Li, Na, К, Rb, Cs, щелочноземельных металлов, предпочтительно Mg, Са, Sr, Ва, а также Al и Zn. Согласно определенным вариантам исполнения, металл представляет собой Li или Mg, и предпочтительно Li. Возможны также смеси металлов, соответственно карбонатов металлов и хлоридов металлов. В процессе взаимодействия карбоната металла с фосгеном, дифосгеном и/или трифосгеном при этом может выделяться энергия, так что не требуется введение никакой дополнительной энергии, как это может иметь место при взаимодействии с другими хлорирующими реагентами. При этом фосген, дифосген и/или трифосген, согласно определенным вариантам исполнения, могут быть образованы во внешнем реакторе или in-situ. Согласно определенным вариантам исполнения, фосген, дифосген и/или трифосген формируются в одном дополнительном реакторе, прежде чем они вводятся в первый реактор для взаимодействия с карбонатом металла. При этом выделившаяся при образовании фосгена, дифосгена и/или трифосгена энергия уже там может быть отведена подходящим путем.
Например, при взаимодействии карбоната лития и фосгена происходит следующая экзотермическая реакция:
Li2CO3+O=CCl2→2LiCl+2CO2 (ΔΗr=-167,46 кДж/моль)
Для дифосгена и/или трифосгена получаются подобные энергии, так как из них, например, при нагревании, может выделяться фосген. Согласно определенным вариантам исполнения, в соответствующем изобретению способе, а также в соответствующем изобретению устройстве применяется фосген без дифосгена и/или трифосгена.
В дальнейшем, как и в рамках заявки, термин «фосген» тем самым также включает дифосген и/или трифосген, если это по-иному не очевидно из контекста.
Согласно определенным вариантам исполнения, фосген, дифосген и/или трифосген могут быть приготовлены in-situ, например, из монооксида углерода и хлора, для чего монооксид углерода и хлор подаются в первый реактор, в котором также происходит взаимодействие с карбонатом металла. При этом может быть преимуществом то, что монооксид углерода и хлор более удобны в обращении, или же являются более легкодоступными. Количества подаваемых фосгена, дифосгена и/или трифосгена, и/или монооксида углерода и хлора могут быть надлежащим образом отрегулированы на основе простых стехиометрических и технологических соображений сообразно количеству вводимого карбоната металла.
Согласно определенным вариантам исполнения, металл М дополнительно вводится как реагент. Благодаря этому можно из карбоната металла образовать монооксид углерода, который затем может объединяться с хлором так, что фосген, дифосген и/или трифосген могут быть использованы в реакторе «in-situ» для взаимодействия с дополнительным карбонатом металла и/или продуктами реакции металла М и карбоната металла, например, оксидом металла. При этом также могут сами по себе поддерживаться экзотермические реакции. Кроме того, благодаря приготовлению фосгена, дифосгена и/или трифосгена in-situ можно избежать подачи фосгена, дифосгена и/или трифосгена, и вместо этого подводить хлор, который может быть более простым и удобным в обращении.
Кроме того, согласно определенным вариантам исполнения, металл М вводится вместе с карбонатом металла так, что уже происходит реакция металла с карбонатом металла, прежде чем подается, например, хлор. Также возможно, что хлор и монооксид углерода получаются иным путем, нежели монооксид углерода из такого in-situ взаимодействия металла М и карбоната металла, то есть, любым путем, например, так, что дополнительно подается монооксид углерода. Он может подаваться также дополнительно к введению металла М, например, когда в результате реакции карбоната металла с металлом М монооксид углерода не может быть образован в достаточном количестве, чтобы удовлетворить потребность в СО для полного преобразования в реакции. Но вместо монооксида углерода могут подаваться дополнительно сами фосген, дифосген и/или трифосген, когда в ходе реакции карбоната металла с металлом М не может быть образовано достаточное количество монооксида углерода.
Согласно определенным вариантам исполнения, подаваемый дополнительно металл М также может быть металлом, который отличается от катиона металла в карбонате металла. Так, например, при использовании карбоната лития в качестве карбоната металла могут подаваться литий, натрий, калий, кальций и/или магний. Как правило, может подаваться такой металл, который позднее не является вредным при электролизе хлорида металла. Согласно определенным вариантам исполнения, такой металл, который отличается от металла в карбонате металла, также может быть благоприятным, когда, например, может образовываться эвтектическая смесь для электролиза хлорида металла. Согласно определенным вариантам исполнения, металл М соответствует металлу в карбонате металла.
Для лития в качестве металла получаются, например, следующие уравнения реакций.
Li2CO3 смешивается с металлическим литием. При этом образуются Li2O и CO:
Li2CO3+2Li→2Li2O+CO ΔΗr=-90,29 кДж/моль
Эта реакция уже экзотермична, и тем самым может быть самоподдерживающейся.
В том же реакторе оксид лития может далее реагировать с CO и Cl2 и, соответственно, фосгеном, с образованием хлорида лития:
Cl2+CO→O=CCl2 (фосген) ΔΗr=-109,55 кДж/моль
Из фосгена или, альтернативно, из монооксида углерода и хлора, могут быть непосредственно образованы также дифосген и/или трифосген.
Фосген затем может далее реагировать с карбонатом лития, как было описано выше, или также с оксидом лития:
Li2O+O=CCl2→2LiCl+CO2 ΔHr=-392,08 кДж/моль
Фосген, дифосген и/или трифосген тем самым могут образовываться in-situ непосредственно при впрыскивании лития на карбонат лития в сочетании с атмосферой хлора.
Согласно изобретению также возможно, что в реакцию не подводится никакая дополнительная тепловая энергия, например, с помощью нагревательных устройств, причем, однако, может быть необходимым зажигание реактантов для инициирования реакции с использованием подходящих устройств, таких как электрическая дуга, лазер и т.д. Из способа также может быть получена тепловая энергия, например, с помощью одного или многих теплообменников, которая затем может быть применена для производства электроэнергии, например, получением пара для привода паровых генераторов, и/или для подогревания карбоната металла и/или металла М, когда он подается, что может облегчать обработку. Величины энтальпии реакций могут быть настолько высокими, что они, как показано выше, достаточны для использования в производстве электроэнергии (подобно мусоросжигательной установке). Аналогичные уравнения получаются для других применимых металлов М, причем М выбирается из группы щелочных металлов, предпочтительно Li, Na, K, Rb, Cs, щелочноземельных металлов, предпочтительно Mg, Са, Sr, Ва, а также Al и Zn. Согласно определенным вариантам исполнения, металл представляет собой Li, К или Mg, и предпочтительно представляет собой Li или К, в особенности предпочтительно Li.
Согласно определенным вариантам исполнения, металл М, когда он вводится, регулируется в таком весовом соотношении «металл/карбонат металла», чтобы образовывалось количество монооксида углерода, достаточное для взаимодействия, предпочтительно полностью, с подаваемым хлором, причем здесь также могут быть подводиться дополнительно фосген, дифосген и/или трифосген, или чтобы при дополнительной подаче монооксида углерода образовывалось настолько много монооксида углерода, что совокупное количество монооксида углерода было достаточным для взаимодействия, предпочтительно полного, с подаваемым хлором. Количества образующегося монооксида углерода, по обстоятельствам подводимого монооксида углерода, подаваемого хлора и, при необходимости подаваемых фосгена, дифосгена и/или трифосгена, могут быть надлежащим образом легко определены на основе стехиометрических и технологических соображений сообразно подаваемым количествам карбоната металла и металла.
Когда, например, имеется достаточное количество металла М, который, например, получен электролизом хлорида металла с использованием избыточной энергии из возобновляемых источников энергии, может быть также внесено большее количество металла М, например, в моменты времени, в которые избыточная энергия из возобновляемых источников энергии не имеется, так что тогда из выделяемой в соответствующем изобретению способе тепловой энергии может быть дополнительно производен ток. Тогда при этом металл М представляет собой своеобразный аккумулятор энергии, который получен с использованием избыточной энергии из возобновляемых источников энергии, и затем возмещает энергию, когда это потребуется.
Согласно определенным вариантам исполнения, металл М в соответствующем изобретению способе может быть внесен вместе с карбонатом металла. Этим путем можно тем самым упростить способ, и поэтому также устройство для исполнения способа. При введении металла М и карбоната металла через одно отверстие в первом реакторе также обеспечивается возможность того, что может быть надлежащим образом оптимизировано выделение энергии в результате смешения металла М и карбоната металла. Металл М может быть введен в разнообразных формах, например, в виде твердого вещества, например, в форме частиц, и/или как жидкость в форме расплава, причем при этом в случае частиц или жидкости он также может быть распылен.
В соответствующем изобретению способе фосген может быть введен газообразным, после охлаждения при необходимости жидким, или, соответственно, в виде раствора в подходящем растворителе, или в другой форме, однако предпочтительна подача газообразного или жидкого, в особенности предпочтительно газообразного. Дифосген и/или трифосген могут быть добавлены жидкими или, соответственно, в виде твердого вещества, но также в форме газа. Так, хлор и, соответственно, монооксид углерода подводятся для in-situ приготовления фосгена, дифосгена и/или трифосгена, они могут быть введены в подходящей форме, предпочтительно газообразной.
Согласно определенным вариантам исполнения, происходит преобразование/взаимодействие карбоната металла, по обстоятельствам металла М и фосгена, дифосгена и/или трифосгена, то есть, не применяется никакой растворитель, и предпочтительно в первый реактор вводятся и преобразуются только карбонат металла, по обстоятельствам металл М и фосген, дифосген и/или трифосген, и/или при необходимости монооксид углерода и хлор. Кроме того, согласно определенным вариантам исполнения, в реакционный цикл не вносятся никакие дополнительные вещества, которые затем опять должны быть отделены.
При взаимодействии карбоната металла и металла М с фосгеном, дифосгеном и/или трифосгеном могут образовываться газообразные продукты, например, такие как СО2, СО и т.д. Они могут быть выпущены в атмосферу, например, через разгрузочное устройство, и/или запасены как ценные продукты, и/или направлены на дополнительное реагирование. Так, например, избыточный СО может быть введен в реакции с водородом с образованием алканов, алкенов, спиртов и т.д.
Вводимый при необходимости монооксид углерода может происходить из любых источников. В промышленном масштабе необходимый монооксид углерода получается, например, согласно следующей реакции:
CO2→CO+1/2O2 ΔΗr=282,97 кДж/моль
Образованию монооксида углерода благоприятствует высокая температура или избыток кислорода. Согласно уравнению Будуара, образующийся также при горении диоксид углерода реагирует с углеродом с образованием монооксида углерода:
CO2+C→2CO ΔΗr=172,45 кДж/моль
Однако предпочтительным является электрохимическое получение СО, который образуется электролитическим путем.
Это имеет то преимущество, что возникающий на аноде кислород легко отделяется и может быть использован повторно. Кроме того, согласно определенным вариантам исполнения, вместе с электролизом хлорида металла, в этом случае могут протекать эндотермические реакции, то есть, для получения хлора, монооксида углерода и металла, которые протекают с использованием избыточной энергии, тогда как из этих реагентов затем может быть выделена энергия в экзотермических реакциях, например, в моменты времени, где не имеется избыточная энергия, и/или где требуется дополнительна энергия.
В способе с непосредственным взаимодействием с хлором в газовой зоне реактора образуется кислород, и должен быть отделен от остаточных газов дорогостоящим путем. Суммарная реакция протекала бы очень медленно, поскольку превращение энергии очень мало:
Li2CO3+Cl2→2LiCl+1/2O2+CO2
(энтальпия реакции:: -5 кДж/моль)
Сообразно соответствующему изобретению способу, в первом реакторе протекают только экзотермические реакции, тогда как эндотермические частичные реакции проводятся электрохимическим путем, например, таким, как также происходящий согласно определенным вариантам исполнения электролиз хлорида металла до металла М и хлора.
Электрохимическое получение монооксида углерода, например, электролизом, не является особенно ограниченным, и может быть выполнено согласно работе автора Y. Hori, «Electrochemical CO2 reduction on metal electrodes» («Электрохимическое восстановление СО2 на металлических электродах»), в издании: C. Vayenas, и др. (редакторы.), Modern Aspects of Electrochemistry («Современные аспекты электрохимии»), издательство Springer, Нью-Йорк, 2008, стр. 89-189, на каковой документ делается ссылка в отношении электролиза диоксида углерода.
Для электролиза СО2, как правило, применяются металлы в качестве катализаторов, из которых, например, могут быть использованы металлы из следующей Таблицы 1, заимствованной из работы автора Y. Hori, «Electrochemical CO2 reduction on metal electrodes», в издании: C. Vayenas, и др. (редакторы.), Modern Aspects of Electrochemistry, издательство Springer, Нью-Йорк, 2008, стр. 89-189.
В Таблице приведены типичные фарадеевские коэффициенты полезного действия на различных металлических электродах. Так, например, СО2 на Ag, Au, Zn, Pd, Ga почти исключительно восстанавливается в СО, тогда как на меди можно наблюдать многочисленные углеводороды как продукты восстановления. Тем самым для получения монооксида углерода могут быть надлежащим образом выбраны металлические электроды.
| Таблица 1 | ||||||||
| Фарадеевские коэффициенты полезного действия для диоксида углерода на различных металлических электродах | ||||||||
| Электрод | СН4 | С2Н4 | С2Н5ОН | С3Н7ОН | СО | НСОО- | Н2 | В целом |
| Cu | 33,3 | 25,5 | 5,7 | 3,0 | 1,3 | 9,4 | 20,5 | 103,5 |
| Au | 0,0 | 0,0 | 0,0 | 0,0 | 87,1 | 0,7 | 10,2 | 98,0 |
| Ag | 0,0 | 0,0 | 0,0 | 0,0 | 81,5 | 0,8 | 12,4 | 94,6 |
| Zn | 0,0 | 0,0 | 0,0 | 0,0 | 79,4 | 60,1 | 9,9 | 95,4 |
| Pd | 2,9 | 0,0 | 0,0 | 0,0 | 28,3 | 2,8 | 26,2 | 60,2 |
| Ga | 0,0 | 0,0 | 0,0 | 0,0 | 23,2 | 0,0 | 79,0 | 102,0 |
| Pb | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 97,4 | 5,0 | 102,4 |
| Hg | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 99,5 | 0,0 | 99,5 |
| In | 0,0 | 0,0 | 0,0 | 0,0 | 2,1 | 94,9 | 3,3 | 100,3 |
| Sn | 0,0 | 0,0 | 0,0 | 0,0 | 7,1 | 88,4 | 4,6 | 100,1 |
| Cd | 1,3 | 0,0 | 0,0 | 0,0 | 13,9 | 78,4 | 9,4 | 103,0 |
| Tl | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 95,1 | 6,2 | 101,3 |
| Ni | 1,8 | 0,1 | 0,0 | 0,0 | 0,0 | 1,4 | 88,9 | 92,4 |
| Fe | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 94,8 | 94,8 |
| Pt | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 0,1 | 95,7 | 95,8 |
| Ti | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 99,7 | 99,7 |
При этом в нижеследующих уравнениях реакций представлены в качестве примеров реакции на аноде и катоде для восстановления на серебряном электроде. Характеристики восстановления на других металлах получаются аналогично этим.
Катод: 2CO2+4e-+4H+→2CO+2H2O
Анод: 2H2O→O2+4H++4e-
Нижеследующее уравнение реакции представляет для этого обобщенную реакцию, а также стандартную энтальпию образования:
CO2→CO+ ½ O2 ΔΗr=282,97 кДж/моль
Подходящие электролизные устройства/электролитические ячейки для проведения электролиза диоксида углерода, включающие пригодные аноды, катоды, при необходимости мембраны, и т.д., могут быть надлежащим образом выбраны, а также не является ограниченными в отношении их типа.
В качестве электролита могут быть применены водные системы с КНСО3 или подобными солями. Одной из преимущественных проблем при этом электролизе является то, что электролит должен иметь очень высокую электропроводность, чтобы создавать небольшое падение напряжения, и одновременно должен обладать хорошей способностью растворять СО2, чтобы обеспечивать достаточное количество СО2 на электроде для восстановления. Это является затруднительным вследствие незначительной растворимости СО2 в воде (~3 г СО2 на литр при давлении 1 бар (0,1 МПа) и температуре 20°С). Как раз при высоких плотностях тока в водных системах, как правило, преобладает разложение воды, так как на катоде наличествует недостаточное количество молекул СО2 для восстановления.
Применение ионных жидкостей для восстановления СО2 до сих пор было мало описано в литературе. Далее приведены две публикации, которые имеют дело с известным соединением [EMIM]BF4 (формула показана ниже):
- восстановление CO2 до CO на серебряном электроде: B. A. Rosen, A. Salehi-Khojin, M. R. Thorson, W. Zhu, D. T. Whipple, P. J. A. Kenis, и R. I. Masel, Science, том 334, стр. 643-644 (2011).
- восстановление CO2 до CO на электроде из висмута:
J. L. DiMeglio, и Rosenthal Joel, Journal of the American Chemical Society, том 135, стр. 8798-8801 (2013).
Тетрафторборат 1-этил-3-метилимидазолия ([EMIM] BF4)
Согласно определенным вариантам исполнения, катодное пространство и анодное пространство при электролизе диоксида углерода не являются конкретно ограниченными. При электролизе диоксид углерода может присутствовать в электролите в растворенной форме и/или в газообразном состоянии.
С позиции технологий охраны окружающей среды в определенных вариантах исполнения предпочтительно, чтобы электролит к тому же наличествовал в виде водного раствора. При этом электролит не является конкретно ограниченным, пока он обеспечивает растворение (по обстоятельствам физическое) диоксида углерода. Например, он может включать KCl, K2SO4, KHCO3 или их смеси. В принципе в качестве солей, повышающих электропроводность раствора, могут служить все комбинации катионов и анионов, которые позволяют создавать требуемые плотности тока для электролиза СО2.
Согласно определенным вариантам исполнения, электролиз может быть проведен с катализатором восстановления СО2 в качестве катода, и/или с катализатором окисления в качестве анода. При этом реакция на стороне катода зависит от материала катода, и не является ограниченной, пока образуется СО. В качестве катодного материала пригодны, например, золото, серебро, цинк, палладий, галлий, кадмий, а также смеси или сплавы материалов. Анодн