Композиции для лечения ревматоидного артрита и способы их применения
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к ревматологии, и может быть использовано для лечения ревматоидного артрита (РА). Для этого пациенту вводят эффективное количество антитела и метотрексата, где указанное антитело включает вариабельный участок тяжелой цепи последовательности SEQ ID NO: 2 и вариабельный участок легкой цепи последовательности SEQ ID NO: 3 и указанное антитело вводят в дозе от 100 мг до 200 мг раз в две недели и где указанного пациента ранее лечили от ревматоидного артрита путем введения метотрексата и ранее неэффективно лечили от РА путем введения антагониста TNF-α, выбранного из группы, состоящей из этанерцепта, инфликсимаба, адалимумаба, голимумаба и/или сертолизумаба пегол. Способ позволяет повысить эффективность лечения РА и облегчить его симптомы за счет специфического связывания антитела или его антиген-связывающего фрагмента с рецептором человеческого интрлейкина-6 (hIL-6R). 9 з.п. ф-лы,3 ил., 1 табл., 2 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области терапевтического лечения ревматоидного артрита. Точнее, изобретение относится к применению антагонистов рецептора интерлейкина-6 (IL-6R), таких как анти-IL-6R антитела, в комбинации с модифицирующими заболевание антиревматическими лекарственными средствами для лечения ревматоидного артрита.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Оценивают, что приблизительно 0,5-1% взрослой популяции Северной Америки и Европы страдают от ревматоидного артрита (РА (RA)). РА в два раза чаще поражает женщин, чем мужчин, и наиболее часто женщин в возрасте старше 40 лет.
РА характеризуется персистирующим синовитом и прогрессирующей деструкцией хряща и кости во множестве суставов. Принципиальной особенностью заболевания является симметричный полиартрит, характерно вовлекающий мелкие суставы кистей и стоп. Воспалительный процесс также может поражать другие органы, особенно костный мозг (анемия), глаза (склерит, эписклерит), легкие (интерстициальный пневмонит, плеврит), сердце (перикардит) и кожу (узлы, лейкоцитокластический васкулит). Системное воспаление характеризуется лабораторными нарушениями, такими как анемия, повышенная скорость оседания эритроцитов, фибриноген и C-реактивный белок (CRP), и клиническими симптомами слабости, потери массы тела, мышечной атрофии в области пораженных суставов. Наличие высоких титров поликлональных ревматоидных факторов и антител к антициклическому цитруллинированному пептиду (анти-CCP) обеспечивает свидетельства иммунной дисрегуляции. По оценке от 65% до 70% пациентов с РА имеют прогрессирующее заболевание, которое приводит к деструкции суставов, инвалидизации и преждевременной смерти.
В области техники существует необходимость в улучшенных схемах лечения для облегчения симптомов, ассоциированных с РА.
СУЩНОСТЬ
Настоящее описание представляет способ лечения ревматоидного артрита у пациента, нуждающегося в этом. Способ включает введение пациенту эффективного количества сарилумаба (SAR153191) и члена группы, состоящей из лефлуномида, сульфасалазина и гидроксихлорохина. В определенных вариантах осуществления изобретения пациента ранее неэффективно лечили от ревматоидного артрита путем введения антагониста TNF-α. В частности, пациент мог получать лечение антагонистом TNF-α в течение, по меньшей мере, трех месяцев или мог не переносить антагонист TNF-α. Антагонистом TNF-α может быть этанерцепт, инфликсимаб, адалимумаб, голимумаб или цертолизумаб. В других вариантах осуществления изобретения пациента ранее неэффективно лечили от ревматоидного артрита путем введения метотрексата.
Сарилумаб можно вводить в дозе от 50 до 150 мг в неделю или от 100 до 200 мг раз в две недели.
В определенных специфических вариантах осуществления изобретения пациенту вводят сарилумаб и лефлуномид. Лефлуномид можно вводить перорально. Лефлуномид также можно вводить пациенту в дозе от 10 до 20 мг в сутки.
В других специфических вариантах осуществления изобретения пациенту вводят сарилумаб и сульфасалазин. Сульфасалазин можно вводить перорально. Сульфасалазин также можно вводить пациенту в дозе от 1000 до 3000 мг в сутки.
В других специфических вариантах осуществления изобретения пациенту вводят сарилумаб и гидроксихлорохин. Гидроксихлорохин можно вводить перорально. Гидроксихлорохин также можно вводить пациенту в дозе между 200 и 400 мг в сутки.
В некоторых вариантах осуществления изобретения в результате лечения пациент достигает 20% или 50% улучшения по шкале основного заболевания Американской Коллегии Ревматологов после 12 недель лечения. В других вариантах осуществления изобретения в результате лечения пациент достигает 20%, 50% или 70% улучшения по шкале основного заболевания Американской Коллегии Ревматологов после 24 недель лечения.
В некоторых вариантах осуществления изобретения в результате лечения пациент достигает более низкого балла активности заболевания после 12 недель лечения, чем пациент имел до лечения. Балл активности заболевания может быть меньше или равным 2,6 через 12 недель. Балл активности заболевания может снижаться более чем на 1,2 от начала лечения к 12 неделям. Балл активности заболевания может быть меньше или равным 3,2 через 12 недель. Балл активности заболевания может снижаться более чем на 0,6 от начала лечения к 12 неделям. Балл активности заболевания может быть меньше или равным 5,1 через 12 недель.
В некоторых вариантах осуществления изобретения в результате лечения после около 24 недель лечения пациент достигает более низкого балла активности заболевания, чем имел до лечения. Балл активности заболевания может быть меньше или равным 2,6 через 24 недели. Балл активности заболевания может снижаться более чем на 1,2 от начала лечения к 24 неделям. Балл активности заболевания может быть меньше или равен 3,2 через 24 недели.
Балл активности заболевания может снижаться более чем на 0,6 от начала лечения к 24 неделям. Балл активности заболевания может быть меньше или равным 5,1 через 24 недели.
Настоящее описание также представляет способ лечения ревматоидного артрита у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества сарилумаба и метотрексата, где пациента ранее неэффективно лечили от ревматоидного артрита путем введения анти-TNF-α препарата. В определенных вариантах осуществления изобретения пациента ранее неэффективно лечили от ревматоидного артрита путем введения метотрексата. Метотрексат можно вводить пациенту в дозе от 10 до 25 мг в неделю.
В определенных вариантах осуществления изобретения пациентом является млекопитающее. Млекопитающим может быть человек. В определенных вариантах осуществления изобретения человек происходит из Азии или Тихоокеанского региона. Людям, происходящим из Азии или Тихоокеанского региона, можно вводить от 6 до 25 мг метотрексата в неделю.
В определенных вариантах осуществления изобретения пациента ранее неэффективно лечили от ревматоидного артрита путем введения антагониста TNF-α. В частности, пациента могли лечить в течение, по меньшей мере, трех месяцев с помощью антагониста TNF-α или он мог не переносить антагонист TNF-α. Антагонистом TNF-α может быть этанерцепт, инфликсимаб, адалимумаб, голимумаб или цертолизумаб. В других вариантах осуществления изобретения пациента ранее неэффективно лечили от ревматоидного артрита путем введения метотрексата.
Сарилумаб можно вводить в дозе от 50 до 150 мг в неделю или от 100 до 200 мг раз в две недели.
В некоторых вариантах осуществления изобретения в результате лечения пациент достигает 20% или 50% улучшения по основной шкале заболевания Американской Коллегии Ревматологов после 12 недель лечения. В других вариантах осуществления изобретения в результате лечения пациент достигает 20%, 50% или 70% улучшения по основной шкале заболевания Американской Коллегии Ревматологов после 24 недель лечения.
В некоторых вариантах осуществления изобретения в результате лечения в течение 12 недель пациент достигает более низкого балла активности заболевания, чем имел до лечения. Балл активности заболевания может быть меньше или равным 2,6 через 12 недель. Балл активности заболевания может снижаться более чем на 1,2 между началом лечения и 12 неделями. Балл активности заболевания может быть меньше или равным 3,2 через 12 недель. Балл активности заболевания может снижаться на более чем 0,6 между началом лечения и 12 неделями. Балл активности заболевания может составлять менее чем или равняться 5,1 через 12 недель.
В некоторых вариантах осуществления изобретения в результате лечения пациент достигает более низкого балла активности заболевания после 24 недель лечения, чем пациент имел до начала лечения. Балл активности заболевания может быть меньше или равным 2,6 через 24 недели. Балл активности заболевания может снижаться на более чем 1,2 между началом лечения и 24 неделями. Балл активности заболевания может быть меньше или равным 3,2 через 24 недели. Балл активности заболевания может снижаться более чем на 0,6 между началом лечения и 24 неделями. Балл активности заболевания может быть меньше или равным 5,1 через 24 недели.
Описание также представляет фармацевтическую композицию, включающую эффективное количество сарилумаба и члена группы, состоящей из лефлуномида, сульфасалазина и гидроксихлорохина. Сарилумаб может присутствовать в количестве от 50 до 150 мг на дозу или от 100 до 200 мг на дозу.
В определенных специфических вариантах осуществления изобретения композиция включает сарилумаб и лефлуномид. Лефлуномид может присутствовать в пероральной лекарственной форме. Лефлуномид может присутствовать в композиции в количестве от 10 до 20 мг на дозу.
В других специфических вариантах осуществления изобретения композиция включает сарилумаб и сульфасалазин. Сульфасалазин может присутствовать в пероральной лекарственной форме. Сульфасалазин может присутствовать в композиции для пациента в количестве от 1000 до 3000 мг в сутки.
В других специфических вариантах осуществления изобретения композиция включает сарилумаб и гидроксихлорохин.
Гидроксихлорохин может присутствовать в пероральной лекарственной форме. Гидроксихлорохин может присутствовать в композиции для пациента в дозе от 200 до 400 мг в сутки.
Примеры вариантов осуществления изобретения перечислены ниже.
Вариант осуществления изобретения 1: Способ лечения ревматоидного артрита у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества сарилумаба (SAR153191) и члена группы, состоящей из лефлуномида, сульфасалазина и гидроксихлорохина.
Вариант осуществления изобретения 2: Способ по варианту осуществления изобретения 1, где пациента ранее неэффективно лечили от ревматоидного артрита путем введения антагониста TNF-α.
Вариант осуществления изобретения 3: Способ по варианту осуществления изобретения 2, где антагонист TNF-α является биологическим антагонистом анти-TNF-α.
Вариант осуществления изобретения 4: Способ по варианту осуществления изобретения 2 или 3, где пациента лечили антагонистом TNF-α в течение, по меньшей мере, трех месяцев.
Вариант осуществления изобретения 5: Способ по варианту осуществления изобретения 2 или 3, где пациент не переносит антагонист TNF-α.
Вариант осуществления изобретения 6: Способ по варианту осуществления изобретения 2 или 3, где антагонист TNF-α выбирают из группы, состоящей из этанерцепта, инфликсимаба, адалимумаба, голимумаба и сертолизумаба.
Вариант осуществления изобретения 7: Способ по варианту осуществления изобретения 2 или 3, где пациента ранее лечили от ревматоидного артрита путем введения метотрексата.
Вариант осуществления изобретения 8: Способ по варианту осуществления изобретения 1, где сарилумаб вводят в дозе от 50 до 150 мг в неделю.
Вариант осуществления изобретения 9: Способ по варианту осуществления изобретения 1, где сарилумаб вводят в дозе от 100 до 200 мг один раз в две недели.
Вариант осуществления изобретения 10: Способ по варианту осуществления изобретения 1, где пациенту вводят сарилумаб и лефлуномид.
Вариант осуществления изобретения 11: Способ по варианту осуществления изобретения 10, где лефлуномид вводят перорально.
Вариант осуществления изобретения 12: Способ по варианту осуществления изобретения 10, где лефлуномид вводят пациенту в дозе от 10 до 20 мг в сутки.
Вариант осуществления изобретения 13: Способ по варианту осуществления изобретения 1, где пациенту вводят сарилумаб и сульфасалазин.
Вариант осуществления изобретения 14: Способ по варианту осуществления изобретения 13, где сульфасалазин вводят перорально.
Вариант осуществления изобретения 15: Способ по варианту осуществления изобретения 13, где сульфасалазин вводят пациенту в дозе от 1000 до 3000 мг в сутки.
Вариант осуществления изобретения 16: Способ по варианту осуществления изобретения 1, где пациенту вводят сарилумаб и гидроксихлорохин.
Вариант осуществления изобретения 17: Способ по варианту осуществления изобретения 16, где гидроксихлорохин вводят перорально.
Вариант осуществления изобретения 18: Способ по варианту осуществления изобретения 16, где гидроксихлорохин вводят пациенту в дозе от 200 до 400 мг в сутки.
Вариант осуществления изобретения 19: Способ по любому из вариантов осуществления изобретения 1-18, где пациент достигает 20% улучшения по основной шкале заболевания Американской Коллегии Ревматологов после 12 недель лечения.
Вариант осуществления изобретения 20: Способ по любому из вариантов осуществления изобретения 1-18, где пациент достигает 50% улучшения по основной шкале заболевания Американской Коллегии Ревматологов после 12 недель лечения.
Вариант осуществления изобретения 21: Способ по любому из вариантов осуществления изобретения 1-18, где пациент достигает 20% улучшения по основной шкале заболевания Американской Коллегии Ревматологов после 24 недель лечения.
Вариант осуществления изобретения 22: Способ по любому из вариантов осуществления изобретения 1-18, где пациент достигает 50% улучшения по основной шкале заболевания Американской Коллегии Ревматологов после 24 недель лечения.
Вариант осуществления изобретения 23: Способ по любому из вариантов осуществления изобретения 1-18, где пациент достигает 70% улучшения по основной шкале заболевания Американской Коллегии Ревматологов после 24 недель лечения.
Вариант осуществления изобретения 24: Способ по любому из вариантов осуществления изобретения 1-18, где пациент достигает более низкого балла активности заболевания после 12 недель лечения, чем пациент имел до лечения.
Вариант осуществления изобретения 25: Способ по любому из вариантов осуществления изобретения 1-18, где балл активности заболевания меньше или равен 2,6 через 12 недель.
Вариант осуществления изобретения 26: Способ по любому из вариантов осуществления изобретения 1-18, где балл активности заболевания снижается на более чем 1,2 от начала лечения до 12 недель.
Вариант осуществления изобретения 27: Способ по любому из вариантов осуществления изобретения 1-18, где балл активности заболевания меньше или равен 3,2 через 12 недель.
Вариант осуществления изобретения 28: Способ по любому из вариантов осуществления изобретения 1-18, где балл активности заболевания снижается более чем на 0,6 от начала лечения до 12 недель.
Вариант осуществления изобретения 29: Способ по любому из вариантов осуществления изобретения 1-18, где балл активности заболевания меньше или равен 5,1 через 12 недель.
Вариант осуществления изобретения 30: Способ по любому из вариантов осуществления изобретения 1-18, где пациент достигает более низкого балла активности заболевания через 24 недели лечения, чем пациент имел до лечения.
Вариант осуществления изобретения 31: Способ по любому из вариантов осуществления изобретения 1-18, где балл активности заболевания меньше или равен 2,6 через 24 недели.
Вариант осуществления изобретения 32: Способ по любому из вариантов осуществления изобретения 1-18, где балл активности заболевания снижается на более чем 1,2 от начала лечения до 24 недель.
Вариант осуществления изобретения 33: Способ по любому из вариантов осуществления изобретения 1-18, где балл активности заболевания меньше или равен 3,2 через 24 недели.
Вариант осуществления изобретения 34: Способ по любому из вариантов осуществления изобретения 1-18, где балл активности заболевания снижается на более чем 0,6 от начала лечения до 24 недель.
Вариант осуществления изобретения 35: Способ по любому из вариантов осуществления изобретения 1-18, где балл активности заболевания меньше или равен 5,1 через 24 недели.
Вариант осуществления изобретения 36: Способ лечения ревматоидного артрита у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества сарилумаба и метотрексата, где пациента ранее неэффективно лечили от ревматоидного артрита путем введения антагониста анти-TNF-α.
Вариант осуществления изобретения 37: Способ по варианту осуществления изобретения 36, где пациента ранее неэффективно лечили от ревматоидного артрита путем введения метотрексата.
Вариант осуществления изобретения 38: Способ по варианту осуществления изобретения 36, где метотрексат вводят пациенту в дозе от 10 до 25 мг в неделю.
Вариант осуществления изобретения 39: Способ по варианту осуществления изобретения 36, где пациентом является млекопитающее.
Вариант осуществления изобретения 40: Способ по варианту осуществления изобретения 37, где млекопитающим является человек.
Вариант осуществления изобретения 41: Способ по варианту осуществления изобретения 38, где человек происходит от уроженцев Азии или Тихоокеанского региона.
Вариант осуществления изобретения 42: Способ по варианту осуществления изобретения 39, где людям, происходящим от уроженцев Азии или Тихоокеанского региона, вводят от 6 до 25 мг метотрексата в неделю.
Вариант осуществления изобретения 43: Способ по варианту осуществления изобретения 36, где пациента лечили антагонистом TNF-α в течение, по меньшей мере, трех месяцев.
Вариант осуществления изобретения 44: Способ по варианту осуществления изобретения 36, где пациент не переносит антагонист TNF-α.
Вариант осуществления изобретения 45: Способ по варианту осуществления изобретения любого из вариантов осуществления изобретения 36-44, где антагонистом TNF-α является биологический антагонист анти-TNF-α.
Вариант осуществления изобретения 46: Способ по варианту осуществления изобретения 44, где антагонист TNF-α выбирают из группы, состоящей из этанерцепта, инфликсимаба, адалимумаба, голимумаба и сертолизумаба.
Вариант осуществления изобретения 47: Способ по варианту осуществления изобретения 36, где сарилумаб вводят в дозе от 50 до 150 мг в неделю.
Вариант осуществления изобретения 48: Способ по варианту осуществления изобретения 36, где сарилумаб вводят в дозе от 100 до 200 мг раз в две недели.
Вариант осуществления изобретения 49: Способ по любому из вариантов осуществления изобретения 36-48, где пациент достигает 20% улучшения по основной шкале заболевания Американской Коллегии Ревматологов после 12 недель лечения.
Вариант осуществления изобретения 50: Способ по любому из вариантов осуществления изобретения 36-48, где пациент достигает 50% улучшения по основной шкале заболевания Американской Коллегии Ревматологов после 12 недель лечения.
Вариант осуществления изобретения 51: Способ по любому из вариантов осуществления изобретения 36-48, где пациент достигает 20% улучшения по основной шкале заболевания Американской Коллегии Ревматологов после 24 недель лечения.
Вариант осуществления изобретения 52: Способ по любому из вариантов осуществления изобретения 36-48, где пациент достигает 50% улучшения по основной шкале заболевания Американской Коллегии Ревматологов после 24 недель лечения.
Вариант осуществления изобретения 53: Способ по любому из вариантов осуществления изобретения 36-48, где пациент достигает 70% улучшения по основной шкале заболевания Американской Коллегии Ревматологов после 24 недель лечения.
Вариант осуществления изобретения 54: Способ по любому из вариантов осуществления изобретения 36-48, где пациент достигает более низкого балла активности заболевания после 12 недель лечения, чем пациент имел до лечения.
Вариант осуществления изобретения 55: Способ по любому из вариантов осуществления изобретения 36-48, где балл активности заболевания меньше или равен 2,6 через 12 недель.
Вариант осуществления изобретения 56: Способ по любому из вариантов осуществления изобретения 36-48, где балл активности заболевания снижается более чем на 1,2 между началом лечения и 12 неделями.
Вариант осуществления изобретения 57: Способ по любому из вариантов осуществления изобретения 36-48, где балл активности заболевания меньше или равен 3,2 через 12 недель.
Вариант осуществления изобретения 58: Способ по любому из вариантов осуществления изобретения 36-48, где балл активности заболевания снижается более чем на 0,6 от начала лечения до 12 недель.
Вариант осуществления изобретения 59: Способ по любому из вариантов осуществления изобретения 36-48, где балл активности заболевания меньше или равен 5,1 через 12 недель.
Вариант осуществления изобретения 60: способ по любому из вариантов осуществления изобретения 36-48, где пациент достигает более низкого балла активности заболевания после 24 недель лечения, чем пациент имел до лечения.
Вариант осуществления изобретения 61: Способ по любому из вариантов осуществления изобретения 36-48, где балл активности заболевания меньше или равен 2,6 через 24 недели.
Вариант осуществления изобретения 62: Способ по любому из вариантов осуществления изобретения 36-48, где балл активности заболевания снижается более чем на 1,2 между началом лечения и 24 неделями.
Вариант осуществления изобретения 63: Способ по любому из вариантов осуществления изобретения 34-45, где балл активности заболевания меньше или равен 3,2 через 24 недели.
Вариант осуществления изобретения 64: Способ по любому из вариантов осуществления изобретения 34-45, где балл активности заболевания снижается более чем на 0,6 между началом лечения и 24 неделями.
Вариант осуществления изобретения 65: Способ по любому из вариантов осуществления изобретения 34-4 5, где балл активности заболевания меньше или равен 5,1 через 24 недели.
Вариант осуществления изобретения 66: Фармацевтическая композиция, включающая эффективное количество сарилумаба и члена группы, состоящей из лефлуномида, сульфасалазина и гидроксихлорохина.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
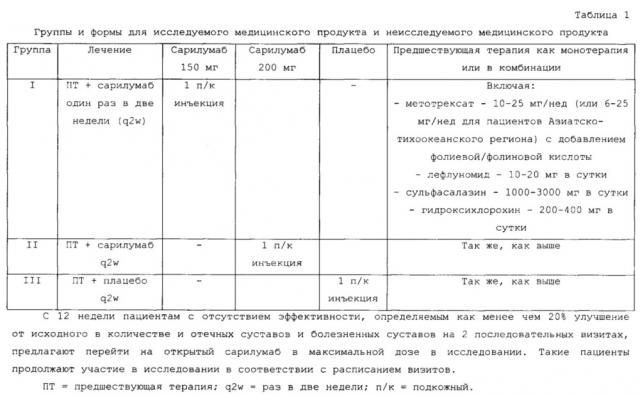
На фигуре 1 приведена схема многоцентрового, двойного слепого, плацебоконтролируемого 12-недельного исследования, включавшего введение в параллельных шести группах SAR153191 или плацебо, которые применяли еженедельно подкожно с сопутствующей терапией МТХ.
На фигуре 2 приведена диаграмма, показывающая ACR20 ответ (%) на проводимое лечение на 12 неделе.
На фигуре 3 приведена диаграмма, показывающая ACR50 и ACR70 ответы (%) на проводимое лечение на 12 неделе.
ПОДРОБНОЕ ОПИСАНИЕ
Описание обеспечивает фармацевтические композиции и способы применения таких композиций для лечения ревматоидного артрита (РА) и облегчения, по меньшей мере, одного симптома РА. Такие композиции включают, по меньшей мере, одно антитело, которое специфически связывается с человеческим рецептором интерлейкина-6 (hlL-6R) и, по меньшей мере, одно антиревматическое лекарственное средство, модифицирующее заболевание (DMARD).
AHTM-hlL-6R антитела
Настоящее описание включает способы, которые включают введение пациенту человеческого антитела или его антиген-связывающего фрагмента, которые специфически связываются с hlL-6R. Как используется в настоящем описании, термин "hlL-6R" обозначает рецептор человеческого цитокина, который специфически связывается с человеческим интерлейкином-6 (IL-6). В определенных вариантах осуществления изобретения антитело, которое вводят пациенту, специфически связывается с внеклеточным доменом hlL-6R. Внеклеточный домен hlL-6R показан в последовательности аминокислот SEQ ID NO: 1.
Если специфически не указано иначе, термин «антитело», как используется в настоящем описании, необходимо понимать как охватывающий молекулы антител, включающие две тяжелые цепи иммуноглобулина и две легкие цепи иммуноглобулина (т.е. "полные молекулы антител"), а также их антиген-связывающие фрагменты. Термины "антиген-связывающая часть" антитела, "антиген-связывающий фрагмент" антитела и подобные, как используются в настоящем описании, включают любые естественные, ферментативно получаемые, синтетические или генетически модифицированные полипептиды или гликопротеины, которые специфически связывают антиген с образованием комплекса. Антиген-связывающие фрагменты антител могут быть получены, например, из целых молекул антител с использованием любых подходящих стандартных методик, таких как протеолитическое расщепление или рекомбинантные методики генной инженерии, включающие манипуляции и экспрессию ДНК, кодирующей вариабельный и (необязательно) постоянный домен антитела. Такие ДНК известны и/или легко доступны из, например, коммерческих источников, библиотек ДНК (включая, например, библиотеки фагов-антител), или могут быть синтезированы. ДНК может быть секвенирована и обработана химически или с использованием методик молекулярной биологии, например, для расположения одного или более вариабельных и/или постоянных доменов в подходящей конфигурации, или для внесения кодонов, создания цистеиновых остатков, модификации, добавления или удаления аминокислот и др.
Неограничивающие примеры антиген-связывающих фрагментов включают: (i) Fab фрагменты; (ii) F(abʹ)2 фрагменты; (iii) Fd фрагменты; (iv) Fv фрагменты; (v) одноцепочечные молекулы Fv (scFv); (vi) dAb фрагменты; и (vii) минимальные распознаваемые единицы, состоящие из остатков аминокислот, которые имитируют гипервариабельный участок антитела (например, выделенный участок, определяющий комплементарность (CDR)). Другие инженерные молекулы, такие как диатела, триотела, тетратела и минитела, также охвачены выражением "антиген-связывающий фрагмент", как используется в настоящем описании.
Антиген-связывающий фрагмент антитела обычно включает, по меньшей мере, один вариабельный домен. Вариабельный домен может быть любого размера или состава аминокислот и обычно включает, по меньшей мере, один CDR, который соседствует или находится внутри рамки считывания с одной или более каркасными последовательностями. В антиген-связывающих фрагментах, имеющих VH домен, ассоциированный с VL доменом, VH и VL домены могут быть расположены относительно друг друга в любом подходящем порядке. Например, вариабельный участок может быть димерным и содержать димеры VH-VH, VH-VL или VL-VL. Альтернативно, антиген-связывающий фрагмент антитела может содержать мономерный VH или VL домен.
В определенных вариантах осуществления изобретения антиген-связывающий фрагмент антитела может содержать, по меньшей мере, один вариабельный домен, ковалентно связанный с одним постоянным доменом. Неограничивающие, примерные конфигурации вариабельных и постоянных доменов, которые могут быть обнаружены в рамках антиген-связывающего фрагмента антитела по настоящему изобретению, включают: (i) VH-CH1; (ii) VH-CH2; (iii) VH-H3; (iv) VH-CH1-CH2; (V) VH-CH1-CH2-CH3; (vi) VH-CH2-CH3; (vii) VH-CL; (viii) VL-CH1; (ix) VL-CH2; (x) VL-CH3; (xi) VL-CH1-CH2; (xii) VL-CH1-CH2-CH3; (xiii) VL-CH2-CH3; и (xiv) VL-CL. В любой конфигурации вариабельного и постоянного доменов, включая любую примерную конфигурацию, перечисленную выше, вариабельные и постоянные домены могут быть непосредственно связаны друг с другом или могут быть связаны посредством полного или частичного петлевого или линкерного участка. Петлевой участок может состоять из, по меньшей мере, 2 (например, 5, 10, 15, 20, 40, 60 или более) аминокислот, что дает гибкое или полугибкое соединение между соседними вариабельными и/или постоянными доменами в одиночной молекуле полипептида. Более того, антиген-связывающий фрагмент антитела по настоящему изобретению может включать гомодимер или гетеродимер (или другой мультимер) любого из вариабельных и постоянных доменов конфигураций, перечисленных выше, в нековалентной ассоциации друг с другом и/или с одним или более мономерными VH или VL доменами (например, посредством дисульфидной связи(ей)).
Термин "специфически связывается" обозначает, что антитело или его антиген-связывающий фрагмент образуют комплекс с антигеном, который является относительно стабильным в физиологических условиях. Специфическое связывание может быть охарактеризовано константой диссоциации, по меньшей мере, около 1×10-6 M или меньше. В других вариантах осуществления изобретения, константа диссоциации составляет, по меньшей мере, около 1×10-7 M, 1×10-8 M или 1×10-9 M. Методы для определения, будут ли две молекулы специфически связываться, хорошо известны в области техники и включают, например, равновесный диализ, поверхностный плазмонный резонанс и подобные.
Как целые молекулы антител, антиген-связывающие фрагменты могут быть моноспецифическими или мультиспецифическими (например, биспецифическими). Мультиспецифический антиген-связывающий фрагмент антитела обычно включает, по меньшей мере, два различных вариабельных домена, где каждый вариабельный домен способен специфически связываться с отдельным антигеном или с различными эпитопами того же антигена. Любые мультиспецифические форматы антител, включая примерные форматы биспецифических антител, описанные в настоящем описании, могут быть адаптированы для применения в контексте антиген-связывающего фрагмента антитела по настоящему изобретению с использованием рутинных методик, доступных в области техники.
В специфическом варианте осуществления изобретения антитело или фрагмент антитела для использования в способе по изобретению, может быть мультиспецифическим антителом, которое может быть специфичным к различным эпитопам одного целевого полипептида или может содержать антиген-связывающие домены, специфические к эпитопам более чем одного целевого полипептида. Примерный формат биспецифического антитела, который может быть использован в контексте настоящего изобретения, включает применение первого домена иммуноглобулина (Ig) CH3 и второго домена Ig CH3, где первый и второй домены Ig CH3 отличаются друг от друга на, по меньшей мере, одну аминокислоту и где, по меньшей мере, отличие одной аминокислоты уменьшает связывание биспецифического антитела с белком A по сравнению с биспецифическим антителом, не имеющим различий аминокислот. В одном варианте осуществления изобретения первый домен Ig CH3 связывает белок A и второй домен Ig CH3 содержит мутацию, которая снижает или прекращает связывание белка A, такую как модификация H95R (по нумерации экзонов IMGT; H435R по EU нумерации). Второй CH3 может дополнительно включать модификацию Y96F (по IMGT; Y436F по EU). Дополнительные модификации, которые могут быть обнаружены во втором CH3, включают: D16E, L18M, N44S, K52N, V57M и V82I (по IMGT; D356E, L358M, N384S, K392N, V397M и V422I по EU) в случае антител IgG1; N44S, K52N и V82I (IMGT; N384S, K392N и V422I по EU) в случае антител IgG2; и Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (по IMGT; Q355R, N384S, K392N, V397M, R409K, E419Q и V422I по EU) в случае антител IgG4. Вариации формата биспецифических антител, описанных выше, предусматриваются в рамках настоящего изобретения.
В других специфических вариантах осуществления изобретения антителом является сарилумаб (SAR153191). Вариабельный участок тяжелой цепи сарилумаба показан ниже как SEQ ID NO: 2.
Вариабельный участок легкой цепи сарилумаба показан ниже как SEQ ID NO: 3.
"Нейтрализующее" или "блокирующее" "антитело, как используется в настоящем описании, относится к антителу, чье связывание с hlL-6R приводит к ингибированию биологической активности hlL-6. Такое ингибирование биологической активности hlL-6 может быть оценено путем измерения одного или более индикаторов биологической активности hlL-6, известных в области техники, таких как клеточная активация, индуцированная hlL-б, и hlL-6 связывание с hlL-6R (см. примеры ниже).
Полностью человеческие анти-IL-GR антитела, описанные в настоящем описании, могут включать одну или более замен, вставок и/или делеций аминокислот в каркасе и/или CDR участках вариабельных доменов тяжелой и легкой цепи по сравнению с соответствующими исходными последовательностями. Такие мутации могут быть легко определены путем сравнения последовательностей аминокислот, описанных в настоящем описании, с исходными последовательностями, доступными из, например, общественных баз данных последовательностей антител. Настоящее изобретение включает антитела и их антиген-связывающие фрагменты, которые получают из любой последовательности аминокислот, описанных в настоящем описании, где одна или более аминокислот в одном или более каркасе и/или участков мутирована к первоначальному виду соответствующего исходного остатка(ов) или к замене консервативной аминокислоты (натуральной или ненатуральной) соответствующего исходного остатка(ов) (такие изменения последовательности называют в настоящем описании как "исходные мутации к первоначальному виду"). Обычный специалист в области техники, начиная с последовательностей вариабельного участка тяжелых и легких цепей, описанных в настоящем описании, может легко получить множество антител и антител-связывающих фрагментов, которые включают одну или более отдельных исходных мутаций к первоначальному виду или их комбинаций. В определенных вариантах осуществления изобретения, все каркасы и/или остатки CDR в доменах VH и/или VL мутированы обратно в исходную последовательность. В другом варианте осуществления изобретения, только определенные остатки мутированы обратно в исходную последовательность, например, только мутированные остатки, обнаруженные среди первых 8 аминокислот FR1 или среди последних 8 аминокислот FR4, или мутированные остатки обнаруживаются только в рамках CDR1, CDR2 или CDR3. Более того, антитела по настоящему изобретению могут содержать любую комбинацию двух или более исходных мутаций к первоначальному состоянию в рамках каркаса и/или участков CDR, т.е., где определенные отдельные остатки мутированы обратно в исходную последовательность, тогда как другие определенные остатки, которые отличаются от исходной последовательности, сохраняются. При получении антитела и антиген-связывающие фрагменты, которые содержат одну или более исходных мутаций к первоначальному состоянию, могут быть легко исследованы в отношении одного или более желаемых свойств, таких как улучшенная специфичность связывания, улучшенная афинность связывания, улучшенные или усиленные антагонистические или агонистические биологические свойства (какие могут быть), сниженная иммуногенность и др. Антитела и антиген-связывающие фрагменты, полученные таким обычным способом, охватываются настоящим изобретением.
Термин "эпитоп" относится к антигенной детерминанте, которая взаимодействует со специфическим участком связывания антигена в вариабельном участке молекулы антитела, известном как паратоп. Один антиген может иметь более чем один эпитоп. Эпитопы могут быть или конформационными или линейными. Конформационный эпитоп получают путем частичной юкстапозиции аминокислот из различных сегментов линейной полипептидной цепи. Линейный эпитоп представляет собой таковой, полученный из соседних остатков аминокислот в полипептидной цепи. В определенных обстоятельствах эпитоп может содержать на антигене фрагменты сахаридов, фосфорильные группы или сульфонильные группы.
Анти-hlL-6R может быть сарилумаб (SAR153191). В одном варианте осуществления изобретения сарилумаб определяют как антитело, включающее вариабельный участок тяжелой цепи SEQ ID NO: 2 и вариабельный участок легкой цепи SEQ ID NO: 3.
DMARD
Антиревматические лекарственные средства, модифицирующие заболевание (DMARD), включают метотрексат, сульфасалазин, гидроксихлорохин и лефлуномид. В соответствии с композициями и методами по описанию, DMARD можно вводить, как указано далее. Метотрексат можно вводить от 10 до 25 мг в неделю перорально или внутримышечно. В другом варианте осуществления изобретения, метотрексат вводят в дозе от 6 до 25 мг/неделю перорально или внутримышечно пациентам Азиатско-Тихоокеанского региона или таким, которые имеют происхождение от лиц Азиатско-Тихоокеанского региона. Азиатско-Тихоокеанский регион включает Тайвань, Южную Корею, Малайзию, Филиппины, Таиланд и Индию. В определенном варианте осуществления изобретения метотрексат вводят в дозе между 6 и 12, 10 и 15, 15 и 20 и 20 и 25 мг в неделю. В другом варианте осуществления изобретения, метотрексат вводят в дозе 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 мг в неделю. Лефлуномид можно вводить в дозе от 10 до 20 мг перорально в сутки. В определенном варианте осуществления изобретения, лефлуномид можно вводить в дозе между 10 и 12, 12 и 15, 15 и 17 и 18 и 20 мг в сутки. В другом варианте осуществления изобретения, лефлуномид вводят в дозе 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 мг в сутки. Сульфасалазин можно вводить в дозе от 1000 до 3000 мг перорально в сутки. В опред