Полученные из бактерий интактные мини-клетки для доставки лекарственных средств к опухолям мозга
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к онкологии, и может быть использована у субъекта для лечения опухоли мозга, имеющей кровеносные сосуды с отверстиями в своих стенках. Для этого осуществляют системное введение субъекту с опухолью терапевтически эффективного количества композиции, состоящей из интактных, полученных из бактерий мини-клеток с диаметром 400 нм ±50 нм. При этом каждая мини-клетка содержит антитело, которое специфически распознает антиген опухолевых клеток. Каждая мини-клетка содержит антинеопластическое средство. Мини-клетки пассивно вытекают через отверстия в стенках кровеносных сосудов. Также предложено применение композиции, содержащей указанные мини-клетки, для получения лекарственного средства для лечения опухоли мозга. Группа изобретений обеспечивает лечение опухолей мозга путем накопления мини-клеток, содержащих антинеопластическое средство, в микроокружении опухоли мозга и доставки антинеопластического средства непосредственно к опухолевым клеткам, без эндотелиального эндоцитоза/трансцитоза через гематоэнцефалический барьер. 2 н. и 42 з.п. ф-лы, 2 табл., 13 ил., 10 пр.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет предварительной патентной заявки США с серийным №61/569907, поданной 13 декабря 2011 г., полное содержание которой включено в настоящий документ посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
Первичные опухоли мозга состоят из различных групп новообразований, происходящих из клеток множества различных линий дифференцировки. В соответствии с классификацией Всемирной организации здравоохранения (Louis et al., 2007), опухоли центральной нервной системы подразделяются на астроцитарные, олигодендроглиальные или смешанные (олигоастроцитарные). Эти опухоли дополнительно подразделяются на подтипы и классифицируются на основании гистологических показателей на степени I-IV, при этом опухоли IV степени являются наиболее агрессивными. Мультиформная глиобластома (GBM), наиболее агрессивная форма первичной злокачественной опухоли мозга, составляет примерно от 45% до 50% всех первичных опухолей мозга (Wrensch et al., 2002; Behin et al., 2003) и является второй по масштабности причиной смерти от рака у взрослых в возрасте до 35 лет (Allard et al., 2009).
Несмотря на многочисленные терапевтические усилия, включая циторедуктивную хирургию, радиотерапию и химиотерапию, прогноз для пациентов с глиомой остается очень неблагоприятным (Stewart, 2002; Stupp et al., 2005). У большинства из них в конечном итоге развивается рецидивирующее и прогрессирующее заболевание, после чего медиана выживаемости составляет около 6 месяцев (Wong et al., 1999; Lamborn et al., 2008). Медиана выживаемости для пациентов с GBM составляет примерно 12-14 месяцев (Stupp et al., 2005).
Кроме того, метастазы в мозге от первичных опухолей, таких как рак молочной железы, легкого и кожи (меланома), является значительной и растущей проблемой общественного здравоохранения. По оценкам, у 250000 пациентов в Соединенных Штатах в 2009 году было диагностировано наличие метастазов в мозге (Fox et al., 2011), что более чем в 10 раз выше, чем частота развития первичных опухолей мозга (Jemal et al., 2009). Прогноз для пациентов с метастазами в мозге очень неблагоприятный, и большинство пациентов живут только 4-6 месяцев после постановки диагноза. Современные схемы лечения обеспечивают крайне незначительные преимущества в выживаемости (Eichler и Loeffler, 2007).
Полное хирургическое удаление глиом почти невозможно из-за их диффузно инфильтративного характера и близости к жизненно важным структурам мозга. Системная терапия также ограничена, в силу так называемого гематоэнцефалического барьера (ГЭБ) (BBB). См., в основном, Cecchelli et al. (2007).
Этот барьер находится внутри эндотелия капилляров мозга и является объектом изучения уже более 100 лет. Действительно, тот факт, что большинство потенциальных лекарственных средств для опухолей мозга никогда не доходят до этапа клинического применения (Pardridge, 2007), связан, главным образом, с их неспособностью пересекать ГЭБ и достигать уровней, имеющих терапевтический эффект (Groothuis, 2000).
Несмотря на активные усилия в течение нескольких десятилетий, показатели излечиваемости при лечении злокачественных опухолей мозга остаются крайне низкими. Таким образом, лечение рака мозга является одной из самых больших проблем в онкологии. Более того, преобладающее мнение заключается в том, что ГЭБ является основным ограничивающим фактором при доставке лекарственного средства в опухоли мозга.
Соответственно, значительные усилия предпринимаются на глобальном уровне для обнаружения и разработки новых лекарственных средств, которые достаточно малы, чтобы пересекать ГЭБ и улучшать показатели выживаемости для пациентов с GBM. Кроме того, в стадии разработки находятся способы транспортировки лекарственных средств за ГЭБ и в микроокружение опухоли мозга.
Среди подходов, которые были изучены в попытке обойти ограничение ГЭБ, можно назвать следующие.
Гиперосмотическое нарушение ГЭБ (Kroll и Neuwelt, 1998).
Химическая модификация барьера (Black et al., 1997).
Попытки связать лекарственные средства с соединениями, имеющими переносчики через ГЭБ (Bickel et al., 2001; Zhang and Pardridge, 2007).
Прямое введение лекарственных средств в опухоли мозга и их непосредственное окружение (Hassenbusch et al., 2002; Hau et al., 2002; Reardon et al., 2002; Weber et al., 2002). Данный подход включает размещение нагруженных лекарственным средством капсул вокруг ложа удаленной опухоли, инфузию средств в полость удаленной опухоли или вокруг нее, или прямую инфузию лекарственных средств в опухолевую массу.
Конвекционная доставка или «CED» (Bobo et al., 1994; Morrison et al., 1994; Hadjipanayis et al., 2008; Hadjipanayis et al., 2010). При CED небольшой перепад гидростатического давления создается за счет шприцевого насоса для распространения инфузата непосредственно в области центральной нервной системы (ЦНС). CED является минимально инвазивной хирургической процедурой, которая с помощью градиента давления создает конвекцию жидкости в мозге, что позволяет обойти ГЭБ. Таким образом, лекарственные средства можно доставлять в мозг с минимальной токсичностью, а также к нормальным тканям и органам, обычно доступным при системной доставке.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
С учетом недостатков, которыми страдают общепринятые подходы в данной области, предложен способ системного введения терапевтически эффективного количества композиции, состоящей из множества интактных, полученных из бактерий мини-клеток, в котором каждая мини-клетка из множества заключает в себе антинеопластическое средство. К тому же, в настоящем описании предусмотрено использование такой композиции для производства лекарственного средства для лечения опухоли мозга. Множество может включать по меньшей мере примерно 108 мини-клеток, в том числе, но без ограничения, по меньшей мере примерно 1010 мини-клеток. Кроме того, описанная в настоящем документе композиция может содержать менее чем примерно 10 ЕЭ (EU) свободного эндотоксина и/или не более 1 родительской бактериальной клетки на 108 мини-клеток, например, на 1010 мини-клеток.
Антинеопластическое средство, заключающееся в мини-клетках, может представлять собой радиоактивный изотоп, например, такой как иттрий-90, технеций-99m, йод-123, йод-131, рубидий-82, таллий-201, галлий-67, фтор-18, ксенон-133 или индий-111, который может быть присоединен к белку или углеводу на поверхности мини-клеток, или он может быть присоединен к поверхности нацеленного на опухоль лиганда, связанного на поверхности мини-клеток. В данном контексте композиция может содержать, например, от примерно 30 Гр до примерно 100 Гр радиоактивности. Антинеопластическое средство может также представлять собой химиотерапевтическое лекарственное средство, при этом, например, композиция содержит его в количестве не более 1 мг. Кроме того, антинеопластическое средство может представлять собой функциональную нуклеиновую кислоту или полинуклеотид, кодирующий функциональную нуклеиновую кислоту. Таким образом, функциональная нуклеиновая кислота может ингибировать ген, который стимулирует пролиферацию опухолевых клеток, ангиогенез или устойчивость к химиотерапии, и/или который ингибирует апоптоз или арест клеточного цикла. Примерами класса функциональных нуклеиновых кислот являются молекулы рибонуклеиновой кислоты, выбранной из группы, состоящей из миРНК, микроРНК, кшРНК, длинной некодирующей РНК (lincRNA), антисмысловой РНК и рибозима.
В некоторых вариантах осуществления, в соответствии с любым из вышесказанного, каждая мини-клетка из вышеупомянутого множества может содержать лиганд, обладающий специфичностью в отношении поверхностного рецептора нефагоцитирующих клеток млекопитающих, например, антигена опухолевых клеток. Соответственно, лиганд может представлять собой, например, антитело, которое специфически узнает такой антиген опухолевых клеток.
Методологию данного описания можно использовать для лечения целого ряда опухолей мозга, например, но без ограничения, группы, состоящей из глиобластомы, астроцитарной опухоли, олигодендроглиальной опухоли, эпендимомы, краниофарингиомы, опухоли гипофиза, первичной лимфомы мозга, опухоли шишковидной железы, первичной опухоли из зародышевых клеток мозга, а также их сочетаний. Подвергающаяся лечению опухоль может быть первичной опухолью мозга или метастатической опухолью мозга.
Другие цели, особенности и преимущества станут очевидными из следующего далее подробного описания. Подробное описание и конкретные примеры приведены исключительно с иллюстративными целями, поскольку различные изменения и модификации в пределах сущности и объема конкретных вариантов осуществления станут очевидными из данного описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
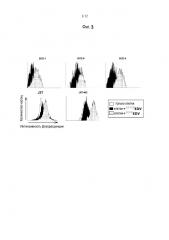
ФИГУРА 1. Количественное определение рецептора EGF на клетках опухоли мозга человека (U87-MG) и собаки, обработанных анти-EGFR мАт с последующей обработкой конъюгированными с R-фикоэритрином антителами козы против IgG мыши. Клетки анализировали с использованием FACS и сравнивали с флуоресцентными стандартами микрогранул с R-фикоэритрином. Контрольные клетки обрабатывали таким же образом, за исключением первичного антитела. Результаты количественного определения EGFR показали, что концентрация EGFR на клетку (в порядке убывания) для клеток BCD-1, U87-MG, BCD-9, BCD-8 и J3T составляла 2866854, 1465755, 930440, 774352 и 287622, соответственно. Результаты для каждой линии клеток приведены в случае контроля (кривые с темной границей) и в случае обработки анти-EGFR мАт (кривые без темной границы).
ФИГУРА 2. Приведены результаты анализа клеточной пролиферации (MTS) для определения чувствительности к доксорубицину клеток злокачественной опухоли мозга собаки и человека (U87-MG). Планки погрешностей, ± SEM.
ФИГУРА 3. Репрезентативные гистограммы анализов FACS демонстрируют эффективность связывания EGFRмини-клетокDox с клетками злокачественной опухоли мозга собаки и человека. >95% клеток в каждом случае демонстрировали значительное связывание EGFRмини-клетокDox. Клетки, обработанные неспецифически нацеленными gp120мини-клеткамиDox, не проявляли какого-либо связывания с клетками. Анти-gp120 антитело направлено против белка gp120 вирусного капсида ВИЧ, который не обнаружен ни на одной из клеток опухолей.
ФИГУРА 4. Клетки опухоли мозга человека и собаки обрабатывали EGFRмини-клеткамиDox и контрольными gp120мини-клеткамиDox в течение 3 часов. Мини-клетки, связанные с клетками опухолей, визуализировали после обработки конъюгатом антитела козы против иммуноглобулинов мыши IgG2a-AF488 (зеленая флуоресценция, показана более светлая зернистость), связывающимся с анти-ЛПС компонентом (IgG2a) биспецифического антитела, используемого для нацеливания соответствующих мини-клеток. Изображения справа или каждая из вертикальных панелей визуализированы на аутофлуоресценцию dox (красная флуоресценция, более темная зернистость) и демонстрируют, что dox находится в ядре большинства трансфицированных клеток. Изображения получали с использованием флуоресцентного микроскопа Leica. Масштабная полоска, 20 мкм.
ФИГУРА 5. Стабилизация/регрессия опухолей у семи собак с опухолями мозга на поздней стадии после лечения EGFRмини-клеткамиDox. МРТ-изображения до лечения (перед введением доз) для каждой собаки приведены в левой вертикальной колонке. В средней и правой вертикальных колонках приведены МРТ-изображения после лечения EGFRмини-клеткамиDox, и количество доз показано для каждой МРТ. Приведенные МРТ-срезы включают сагиттальные (BCD-1 и -6), аксиальные (BCD-2 до -5) и корональные (BCD-7). Объемы опухолей (размеры в см) приведены под каждым изображением МРТ, и стрелка обозначает местоположение соответствующих опухолей.
ФИГУРА 6. Определяли биохимические параметры сыворотки, после лечения, для семи собак со злокачественными опухолями мозга (BCD-1-BCD7). Горизонтальные линии на каждом графике представляют нормальный референсный диапазон у собак. Планки погрешностей, ± SEM.
ФИГУРА 7. Гематологические параметры сыворотки, определенные после лечения у семи собак со злокачественными опухолями мозга (BCD-1-BCD7). Горизонтальные линии на каждом графике представляют нормальный референсный диапазон у собак. Планки погрешностей, ± SEM.
ФИГУРА 8. Уровни TNFα, IL-6 и IL-10 в сыворотке показаны для семи собак со злокачественными опухолями мозга после лечения EGFRмини-клеткамиDox.
ФИГУРА 9. Приведены титры анти-ЛПС антител у 7 собак со злокачественными опухолями мозга (выживающих) после лечения EGFRмини-клеткамиDox.
ФИГУРА 10. Проиллюстрировано выживание (в днях) для 7 собак со злокачественными опухолями мозга (левая ось y, представлено столбиками), наряду с введенными количествами доз EGFRмини-клетокDox (левая ось y, представлено ромбами над каждым столбиком). Полосатые столбики соответствуют собакам, продолжающим жить и находящимся в стадии ремиссии. Темные сплошные столбики соответствуют собакам, у которых заболевание стабилизировалось до рецидива опухоли, возможно, вследствие развития устойчивости к dox, и эти собаки были подвергнуты эвтаназии. Светлый сплошной столбик соответствует собаке, которая находилась в стадии ремиссии, однако умерла из-за посторонней инфекции.
ФИГУРА 11. (a) Совместно регистрированные T1-взвешенные постконтрастные изображения МРТ и изображения ОФЭКТ (SPECT) показаны раздельно, (i) и (iii), и при наложении изображений (ii) в трех ортогональных плоскостях (корональной, сагиттальной и трансаксиальной). Площадь захвата и область, в которой она локализована, указаны стрелками. Захват был ниже, чем во внемозговых очагах, видимых симметрично с каждой стороны головы, но это был единственный захват, наблюдаемый в мозге.
(b) Результаты приведены для другого животного. Только трансаксиальные изображения приведены для МРТ (i) и ОФЭКТ (iii). Интенсивный захват виден в аномалии, продемонстрированной на МРТ. Изображение (ii) представляет собой совместно регистрированное воспроизведение T1-взвешенного постконтрастного изображения МРТ, ОФЭКТ и наложенных изображений. Стрелки указывают зону интенсивной локализации радиоактивно меченых мини-клеток, что соответствует части аномалии на изображении МРТ.
(c) Приведены 2D плоские изображения всего тела через 30 минут и 3 часа после инъекции. Наряду с захватом в щитовидной железе и немного в шее, ранний захват наблюдается в печени, с некоторой экскрецией в кишечник, видимой на более поздних изображениях.
ФИГУРА 12. Ксенотрансплантаты рака поджелудочной железы человека (MIA PaCa) мышам Balb/c nu/nu (n=8 на группу) вводили в/в либо со свободным гемцитабином (гемзар®), либо с нацеленными на EGFR, упакованными гемзаром мини-клетками (EGFRмини-клеткигемзар). При всех введениях мини-клеток вводили по 109 мини-клеток на дозу. Дни введения указаны ниже на оси x (треугольники). Планки погрешностей, ± SEM. Диаграмма показывает объем опухоли в указанные дни после введения.
ФИГУРА. 13. Ксенотрансплантаты рака молочной железы человека (MDA-MB-468) мышам Balb/c nu/nu (n=8 на группу) вводили в/в со свободным карбоплатином или с мини-клетками, упакованными карбоплатином, которые были либо не нацелены, либо нацелены на EGFR (EGFRмини-клеткикарбоплатин). При всех введениях мини-клеток вводили по 109 мини-клеток на дозу. Дни введения указаны ниже на оси x (треугольники). Планки погрешностей, ± SEM. Диаграмма показывает объем опухоли в указанные дни после введения.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение относится к композициям и способам лечения опухолей мозга. В этом отношении, авторы изобретения установили, что интактные, полученные из бактерий мини-клетки, упакованные одним или более антинеопластическими средствами, при системном введении быстро накапливаются в микроокружении опухоли мозга в терапевтически значимых концентрациях. Это открытие было удивительным, поскольку мини-клетки с диаметром примерно 400 нм имеют гораздо больший размер, чем 12 нм, что, согласно общепринятым представлениям, является верхним пределом размера для частиц, способных пересекать гемантоэнцефалический барьер (ГЭБ). См. Sarin et al. (2008) и Laquintana et al. (2009).
Соответственно, авторы изобретения установили, что множество различных опухолей мозга, как первичных, так и метастатических, можно лечить путем системного введения терапевтически эффективного количества композиции, состоящей из множества таких мини-клеток, когда каждая мини-клетка является переносчиком для активного средства против опухоли.
(A) Определения
Если не указано иное, все технические и научные термины, используемые в данном описании, имеют то же значение, которое им обычно придают специалисты в соответствующей области.
Для удобства, значения некоторых терминов и фраз, используемых в спецификации, примерах и прилагаемой формуле изобретения, приведены ниже. Определения другим терминам и фразам даны на протяжении всего текста спецификации.
Формы единственного числа включают указание на множественное число, если из контекста явно не следует иное.
Термины «рак», «новообразование», «опухоль», «злокачественное новообразование» и «карцинома», используемые в настоящем документе взаимозаменяемо, относятся к клеткам или тканям, которые проявляют фенотип аномального роста, характеризующийся значительной потерей контроля клеточной пролиферации. Способы и композиции по данному изобретению, в частности, применимы к злокачественным, преметастатическим, метастатическим и неметастатическим клеткам.
«Лекарственное средство» означает любое физиологически или фармакологически активное вещество, которое вызывает местный или системный эффект у животных, в частности, млекопитающих и людей.
Термины «индивидуум», «субъект», «хозяин» и «пациент», используемые в данном описании взаимозаменяемо, относятся к любому субъекту-млекопитающему, который нуждается в диагностике, лечении или терапии. Индивидуум, субъект, хозяин или пациент может быть человеком или животным, отличным от человека. Так, подходящие субъекты могут включать, но не ограничиваются ими, приматов, отличных от человека, крупный рогатый скот, лошадей, собак, кошек, морских свинок, кроликов, крыс и мышей.
Термины «лечение», «воздействие», «лечить» и тому подобные означают получение желаемого фармакологического и/или физиологического эффекта у пациента с опухолью мозга. Эффект может быть профилактическим с точки зрения полного или частичного предотвращения развития опухоли мозга или ее симптомов и/или может быть терапевтическим с точки зрения частичной или полной стабилизации или излечения опухоли мозга и/или неблагоприятного эффекта, относящегося к опухоли мозга. Лечение охватывает любое лечение опухоли мозга у млекопитающего, в частности, человека. Желаемый эффект, в частности, представляет собой реакцию опухоли, которую можно измерять по уменьшению массы опухоли или подавлению увеличения массы опухоли. В дополнение к реакции опухоли, в клинической практике в качестве желаемого эффекта лечения также можно использовать увеличение общей выживаемости, выживание без прогрессирования или время до рецидива опухоли, или уменьшение побочных эффектов.
(B) Лечение
Настоящее изобретение находит отражение и доказательства в экспериментальных данных о том, что, в соответствии с открытием авторов изобретения, полученные из бактерий и интактные мини-клетки, имеющие примерно 400 нм в диаметре, при внутривенном (в/в) введении быстро накапливаются в микроокружении опухоли мозга в терапевтически значимых концентрациях. Авторы изобретения также обнаружили, что это проникновение в опухоль мозга происходит не за счет эндоцитоза/трансцитоза эндотелия ГЭБ или любого другого механизма, с помощью которого, согласно предположениям, наночастицы проникают в микроокружение опухоли мозга. С позиции традиционных представлений, таким образом, эти открытия были довольно неожиданными.
1. Традиционные представления о предельном размере для пересечения ГЭБ
Наночастицы рассматриваются как потенциальные носители для переноса лекарственных средств за ГЭБ (Juillerat-Jeanneret, 2008). Показательной в этом отношении является стратегия доставки лекарственного средства в виде наночастиц, направленная на преодоление барьера путем связывания наночастиц с рецепторами в просвете эндотелиальных клеток, составляющих ГЭБ, с последующим эндоцитозом и трансцитозом через эндотелиальные клетки и в микроокружение опухоли мозга. Другой подход предполагает использование «эффекта усиленного проникновения и удержания», обсуждаемого ниже, для осуществления прохода частиц через крошечные промежутки между эндотелиальными клетками ГЭБ.
2. Трансцитоз наночастиц
Показано, что поли(бутил)цианоакрилатные (PBCA) наночастицы, покрытые полисорбатом 80 (Tween® 80), способны доставлять в мозг ряд лекарственных средств, которые в свободном виде не пересекают ГЭБ (Kreuter et al., 1995, 1997, 2001, 2002, 2003 и 2008; Steiniger et al., 2004).
Поскольку полисорбат 80 избирательно способствует адсорбции некоторых плазматических белков (в частности, аполипопротеинов E и B (Petri et al., 2007; Re et al., 2011)) на поверхности этих наночастиц, он позволяет связываться этим наночастицам с соответствующими рецепторами липопротеинов низкой плотности (LDLr; Xin et al., 2011), которые, как известно, избыточно экспрессируются в эндотелиальных капиллярных кровеносных сосудах, связанных с ГЭБ (Dehouck et al., 1994).
После связывания с LDLr наночастицы интернализируются эндотелиальными клетками кровеносных сосудов (Zensi et al., 2009), переносятся трансцитозом через эти клетки и затем транспортируются в микроокружение опухоли мозга.
Усилия, предпринимаемые во всем мире по разработке наночастиц для лечения опухолей мозга, фокусируются на поиске инновационных путей для обхода ГЭБ путем трансцитоза через связанные с ГЭБ эндотелиальные клетки и проникновения в микроокружение опухоли мозга. Это является серьезной проблемой в силу того, что эти частицы должны оставаться интактными в процессе трансцитозного движения внутри клеток и не разрушаться лизосомами. Последние являются внутриклеточными компартментами с высокой кислотностью, которые обычно разрушают поглощенные путем эндоцитоза материалы.
Дополнительным серьезным недостатком этого подхода является то, что LDLr не являются уникальными для ГЭБ. Они лишь избыточно экспрессированы в эндотелиальных клетках, связанных с ГЭБ. Таким образом, эти наночастицы потенциально способны проникать во многие нормальные ткани и нормальную центральную нервную систему, поскольку эти рецепторы повсеместно встречаются в эндотелиальных клетках во всей кровеносной системе. До сих пор не были найдены рецепторы, которые являются уникальными только для связанных с ГЭБ кровеносных сосудов и, следовательно, потенциальная серьезная токсичность для нормальных тканей остается проблемой.
3. Пассивное проникновение в опухоли мозга
Последние данные показали, что физиологический верхний предел размера пор в ГЭБ микроциркуляторной части сосудистого русла злокачественной глиомы составляет только примерно 12 нм (Sarin et al., 2008). Кроме того, показано, что молекулы должны быть размером <400 дальтон (Bickel, 2005; Pardridge, 2007), чтобы иметь возможность пересечь поры, обнаруженные в ГЭБ.
Ограничения, связанные с размерами, повсеместно признаются исследователями и клиницистами в данной области. Например, на основании обзора современной литературы можно сделать вывод о том, что наночастицы должны иметь размер менее 12 нм и иметь большие периоды полураспада в крови, чтобы пересекать ГЭБ микроциркуляторной части сосудистого русла злокачественной глиомы (Laquintana et al., 2009).
Разнообразные наночастицы были изучены в этом отношении, включая липосомы, полимерные наночастицы, твердые липидные наночастицы, полимерные мицеллы и дендримеры. После внутривенного введения эти частицы могут просачиваться из сосудов в ткань опухоли мозга из-за нарушенного ГЭБ сосудов опухоли мозга, но в меньшей степени также и в нормальные ткани мозга (Moghimi et al., 2005).
Это пассивное нацеливание наночастиц в опухоли мозга с нарушенным ГЭБ обычно связано с вышеупомянутым эффектом усиленного проникновения и удержания (EPR), который, как считают, играет решающую роль в доставке лекарственного средства к солидным опухолям. Например, в статье Laquintana et al. (2009) отражено современное представление о том, что липосомы, которые, как правило, имеют размер от 50 до 150 нм, остаются в пределах микроциркуляторной части сосудистого русла, в результате чего инкапсулированные химиотерапевтические лекарственные средства небольшого размера диффундируют через мембрану липосом и через поры ГЭБ злокачественных глиом. Таким образом, считается, что более крупные частицы (от 50 до 150 нм) не способны просачиваться из сосудов в ткань через ГЭБ сквозь повреждения в барьере.
Следовательно, согласно традиционным представлениям, для того, чтобы пассивно пересечь ГЭБ в результате EPR эффекта и достичь фармакологически значимых количеств в микроокружении опухоли мозга, наночастицы должны иметь размер <12 нм и макромолекулы, такие как лекарственные средства, должны иметь молекулярную массу <400 дальтон. На эти представления делается упор в обзорной статье Pardridge (2010), в которой подчеркнуто, что «самым важным фактором в разработке лекарственного средства для мозга является наличие эффективной технологии нацеливания лекарственного средства в мозге».
Это является причиной того, что большинство потенциальных лекарственных средств для центральной нервной системы (ЦНС) не пересекают гематоэнцефалический барьер (ГЭБ). Биофармацевтические препараты, которые представляют собой высокомолекулярные лекарственные средства, не пересекают ГЭБ. Таким образом, в отсутствие технологии нацеливания в мозге, рекомбинантные белки, моноклональные антитела, пептиды, малые интерферирующие РНК (миРНК) и генно-терапевтические средства не могут быть разработаны для мозга, поскольку эти лекарственные средства не пересекают ГЭБ. Что касается малых молекул, принято считать, что эти вещества пересекают ГЭБ. Однако, >98% всех малых молекул не пересекают ГЭБ (Pardridge et al., 2005). Только растворимые в липидах малые молекулы с молекулярной массой (ММ) <400 дальтон (Да) пересекают ГЭБ при посредстве липидов. Однако большинство низкомолекулярных лекарственных средств либо имеют ММ >400 Да, либо имеют высокую растворимость в воде, что препятствует свободной диффузии через ГЭБ. Вследствие этого, даже если исследования разработчиков лекарственных средств для ЦНС сфокусированы на малых молекулах, вполне вероятно, что технология нацеливания лекарственных средств через ГЭБ будет по-прежнему необходима для успешного завершения программы разработки низкомолекулярных лекарственных средств для ЦНС в случае большинства лекарственных средств.
4. Дополнительные барьеры для проникновения в опухоль мозга
Помимо ГЭБ, поступление в мозг дополнительно ограничено относительной малочисленностью отверстий и пиноцитозных пузырьков в эндотелиальных клетках мозговых капилляров, а также присутствием окружающего внеклеточного матрикса, перицитов и астроцитарных ножек (Hawkins и Davis, 2005). Кроме того, ГЭБ обычно считается неприступным для лекарственных средств и макромолекул благодаря множеству белков-транспортеров лекарственных средств, которые выводят лекарственные средства из мозга.
Например, было показано, что АТФ-зависимые транспортеры способны серьезно ограничивать проникновение в мозг лекарственных средств, даже таких, которые обладают благоприятными физико-химическими свойствами и предположительно должны пересекать ГЭБ с относительной легкостью. Большинство этих транспортеров принадлежат к двум суперсемействам, семейству АТФ-связывающих кассет (ABC) и семейству переносчиков растворенных веществ. P-гликопротеин (P-gp, ABCB1), белок устойчивости рака молочной железы (BCRP, ABCG2), и белки, связанные с множественной лекарственной устойчивостью (MRPs, ABCCs), являются важными членами семейства ABC. См. статьи Schinkel (1999), Borst et al. (2000), Sun et al. (2003), Schinkel and Jonker (2003), Kusuhara and Sugiyama (2005), Loscher and Potschka (2005) и Nicolazzo and Katneni (2009).
Соответственно, авторы настоящего изобретения нашли действительно удивительным то, что интактные, полученные из бактерий мини-клетки накапливаются в опухолях мозга, несмотря на то, что мини-клетки имеют гораздо больший размер (~400 нм), чем всеми признанный верхний предел размера (<12 нм), который должны иметь наночастицы для проникновения в опухоли мозга. Также неожиданным было то, что мини-клетки проникают в мозг пассивно, через нарушенный ГЭБ. В этом отношении, авторы изобретения обнаружили удивительный факт, что кровеносные сосуды, связанные с опухолями мозга, относятся не только к ГЭБ-типу. Установлено, что даже на ранней стадии растущая опухоль имеет множество кровеносных сосудов, в частности, в своей сердцевине. Такие кровеносные сосуды отличаются нарушением целостности; то есть, сосуды имеют большие отверстия и являются «негерметичными», в отличие от сосудов ГЭБ-типа. Вследствие этого, в нарушение традиционных представлений, частицы, такие крупные, как мини-клетки, то есть, гораздо крупнее, чем вышеописанные общепризнанные пределы размеров пор ГЭБ, тем не менее, имеют размер меньше, чем отверстия в стенках негерметичного кровеносного сосуда; таким образом, они могут пассивно вытекать через эти отверстия из сосудов в ткань и в микроокружение опухоли мозга.
Более того, авторы изобретения обнаружили, что относительно большой размер интактных, полученных из бактерий мини-клеток на самом деле является положительным, даже ключевым фактором, влияющим на то, как быстро терапевтически значимые концентрации мини-клеток достигаются в микроокружении опухоли мозга, согласно полученным данным. То есть, чем меньше частица, тем больше вероятность того, что частица будет удерживаться кровотоком в кровеносных сосудах. Напротив, мини-клетки являются частицами относительно большей массы, и они, таким образом, менее подвержены влиянию силы кровотока. Следовательно, мини-клетки, скорее всего, будут следовать по пути через кровеносные капилляры, что приводит к постоянным столкновениям с эндотелиальными стенками кровеносных капилляров. Это чисто физическое явление увеличивает вероятность того, что мини-клетки, как более крупные частицы, будут выталкиваться через отверстия в негерметичной сосудистой сети, которая, как обнаружили авторы изобретения, является отличительной чертой нарушенного ГЭБ в опухолях.
В мозге человека существует более 100 миллиардов капилляров, общая длина которых составляет около 400 миль, и тем не менее, внутриэндотелиальный объем этих капилляров составляет только примерно 1 мкл/г мозга (Pardridge, 2011). Считается, что эта очень высокая плотность кровеносных сосудов в мозге также вносит вклад в быстрое, высококонцентрированное накопление мини-клеток в опухолях мозга, согласно полученным данным.
Признавая, что диаметр просвета капилляров, связанных с ГЭБ, таким образом, может быть всего 1 мкм, авторы изобретения интуитивно понимали, что такие крупные частицы, как интактные, полученные из бактерий мини-клетки (~400 нм), по размеру будут составлять примерно половину диаметра связанных с ГЭБ кровеносных капиллярных сосудов, и вследствие этого, будут быстро просачиваться из сосудов в ткань через нарушенный ГЭБ, где размер отверстий больше, чем 400 нм. С другой стороны, поскольку отверстия в нормальной сосудистой системе организма млекопитающего не превышают примерно 100 мкм, интактные, полученные из бактерий мини-клетки, введенные системно, согласно полученным данным, будут сохраняться в общей сосудистой системе до их утилизации профессиональными фагоцитами в ретикулоэндотелиальной системе или пока они пассивно не будут просачиваться в негерметичной сосудистой системе из сосудов в ткань микроокружения опухоли мозга.
Соответственно, когда два типа наночастиц вводят в/в в равных количествах, например, наночастицы диаметром менее 12 нм и интактные, полученные из бактерий мини-клетки, можно ожидать, что концентрация циркулирующих более мелких частиц будет быстро уменьшаться, поскольку они будут просачиваться из кровеносной системы в нормальные ткани, где сосудистая система имеет размеры пор более чем 12 нм. Известно, например, что печень и желудочно-кишечная ткань имеют нормальные сосудистые отверстия размером примерно 100 нм (Wisse et al., 2008) и периферийная кожа имеет отверстия в диапазоне ~40 нм. Напротив, мини-клетки будут слишком велики, чтобы выходить из нормальной сосудистой системы; таким образом, можно ожидать, что они будут оставаться в высокой концентрации в нормальной системе кровообращения, в результате чего большее их число будет просачиваться из сосудов в микроокружение опухоли мозга, как описано выше.
Таким образом, в одном варианте осуществления настоящее изобретение относится к лечению опухоли мозга, включающему введение терапевтически эффективного количества композиции, состоящей из множества интактных, полученных из бактерий мини-клеток, несущих антинеопластическое средство. Введение композиции, содержащей мини-клетки, предпочтительно является системным, например, внутривенным или внутриартериальным.
(C) Антинеопластические средства
Как отмечалось, композиции мини-клеток по настоящему изобретению применимы для доставки антинеопластических средств к опухолям мозга. В данном контексте выражение «антинеопластическое средство» означает лекарственное средство, химическое или биологическое, которое предотвращает или подавляет рост, развитие, созревание или распространение неопластических клеток.
В контексте данного изобретения выбор антинеопластического средства для лечения конкретного пациента с опухолью мозга зависит от нескольких факторов, в соответствии с общепринятой медицинской практикой. Эти факторы включают, но не ограничиваются ими, возраст пациента, индекс по шкале Карнофски, а также то, какое лечение пациент мог получать ранее. См., в основном, Principles and Practice of Neuro-Oncology, M. Mehta (Demos Medical Publishing 2011) и Principles Of Neuro-Oncology, под редакцией D. Schiff и P. O’Neill (McGraw-Hill 2005).
В целом, стандарт медицинской помощи, применимый к конкретной злокачественной опухоли мозга, предусматривает, в первую очередь, клинический анализ, от которого будет зависеть выбор используемого активного средства. Эта концепция будет определять выбор, например, активного средства из приведенного ниже в таблице 1 списка антинеопластических средств, подходящих для лечения опухолей мозга, который опубликован Калифорнийским университетом в Лос-Анджелесе.
| Таблица 1Известные антинеопластические средства для леченияопухолей мозга | ||
| 5FC | аккутан Hoffmann-La Roche | AEE788 Novartis |
| AMG-102 | антинеопластон | AQ4N (баноксантрон) |
| авандия (росиглитазона малеат) | авастин (бевацизумаб)Genetech | BCNU |
| BiCNU кармустин | карбоплатин | CCI-779 |
| CCNU | CCNU ломустин | целекоксиб (системный) |
| хлорохин | циленгитид (EMD 121974) | цисплатин |
| CPT-11 (камптозар, иринотекан) | цитоксан | дазатиниб (BMS-354825, сприцель) |
| терапия дендритными клетками | этопозид (эпозин, этопофос, вепезид) | GDC-0449 |
| гливек (иматиниб мезилат) | глиадел пластинки | гидроксихлорохин |
| гидроксимочевина | IL-13 | IMC-3G3 |
| иммунная терапия | иресса (ZD-1839) | лапатиниб (GW572016) |
| метотрексат против рака (системный) | новокур | OSI-774 |
| PCV | прокарбазин | RAD001 Novartis (ингибитор mTOR) |
| рапамицин (рапамун, сиролимус) | RMP-7 | RTA 744 |
| симвастатин |