Депо-составы местного анестетика и способы их получения
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к пролипосомной неводной фармацевтической депо-композиции для получения депо-состава для местной анестезии; к способу получения данной композиции; набору для лечения боли, а также к пролипосомному неводному базовому депо-составу и способу лечения или облегчения боли у субъекта, нуждающегося в этом. Осуществление изобретения позволяет получить стабильную пролипосомную депо-композицию в форме прозрачного маслянистого жидкого раствора с относительно низкой вязкостью, который, благодаря низкой вязкости, можно вводить путем инъекции или инфильтрации в рану и обеспечивать, таким образом, пролонгированное локальное действие местного анестетика. 11 н. и 45 з.п. ф-лы, 12 табл., 12 пр., 4 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится в целом к депо-составу, который может быть инъецирован или инфильтрирован в необходимую область и который может обеспечить замедленное высвобождение местного обезболивающего средства. Конкретнее, настоящее изобретение относится к неводному пролипосомному депо-составу, по существу не содержащему синтетических липидов, преимущество которого заключается в том, что он образует липосомы или другие липидные везикулярные структуры in situ при контакте с физиологическими жидкостями.
УРОВЕНЬ ТЕХНИКИ
Послеоперационная боль (ПОБ), также называемая постхирургической болью, является плохо изученным синдромом, возникающим после хирургических вмешательств. ПОБ представляет собой комплексный ответ на травму тканей во время операции, которая усиливает гиперчувствительность центральной нервной системы. Это приводит к появлению боли в областях, непосредственно не затронутых хирургической процедурой. Послеоперационную боль может испытывать стационарный или амбулаторный больной. Ощущение боли может возникать после любого хирургического вмешательства, будь то легкая стоматологическая операция или операция тройного аортокоронарного шунтирования.
В настоящее время снижение ПОБ обеспечивают посредством инъекций местных анестетиков краткосрочного действия в хирургическую рану с применением системы доставки (в виде насосов) местных анестетиков в рану и путем самостоятельного перорального введения болеутоляющих средств, главным образом, на основе опиатов. Желательно продлить эффект и продолжительность действия местных анестетиков настолько, чтобы снизить потребность в послеоперационном обезболивании с применением опиатов. Послеоперационная обезболивающая терапия лекарственными средствами на основе опиатов или нестероидными противовоспалительными средствами (НПВС) может приводить к значительным послеоперационным осложнениям и может существенно ухудшить функции желудочно-кишечного тракта, дыхательную и когнитивную функции у пациента.
Применение составов местных анестетиков с пролонгированным высвобождением может улучшать самочувствие пациента и ускорять восстановление, способствовать приверженности пациента к режиму лечения, сокращать время пребывания в стационаре и больничные расходы и, таким образом, обеспечивать экономию средств для пациента и системы здравоохранения. Согласно расчетам, продажи таких местных анестетиков с пролонгированным высвобождением ежегодно только в США превышают несколько сотен миллионов долларов.
Существует реальная потребность в обеспечении различных подходов к лечению послеоперационной боли. Различные вмешательства могут осуществляться до, во время и после хирургического вмешательства. Большинство этих способов включают применение лекарственных средств, вводимых перорально, внутривенно, внутримышечно или местно (через кожу). Введение некоторых из них должно осуществляться медицинским работником, других - пациентом самостоятельно.
В настоящее время контроль послеоперационной боли осуществляют путем введения наркотических средств и обезболивающих средств сразу после операции. Эти средства вводят путем внутривенной или внутримышечной инъекции, либо пациенты принимают их перорально. Тем не менее эти лекарственные средства применяют по-разному, в то время как в некоторых больницах настаивают на установленном режиме введения лекарственных средств по графику, в других введение лекарственных средств выполняют только по мере необходимости.
В некоторых больницах считают целесообразным непрерывное, круглосуточное введение с использованием инъекционного насосного дозирующего устройства, обеспечивающего доставку лекарственного средства в вены (внутривенное, наиболее распространенный способ), под кожу (подкожное) или в пространство между твердой мозговой оболочкой и позвоночником (эпидуральное). Лечащий врач программирует устройство на размер дозы и длительность минимальных интервалов между введениями, в то время как доставку препарата регулирует пациент. Общая допустимая доза на период времени, в течение которого установлено устройство (обычно 8 часов, иногда 12 часов), запрограммирована заранее. Пациент вводит дозу нажатием кнопки, и ему рекомендовано поддерживать постоянную подачу лекарственного средства его или ее системе при усилении боли. Этот способ называется "управляемая пациентом анальгезия" (УПА).
УПА обеспечивает введение обезболивающих средств в соответствии с потребностями пациента. Однако поскольку лекарственные средства, доставляемые этими насосными устройствами, являются опиатоподобными болеутоляющими, существуют некоторые опасения относительно возможного привыкания к наркотическим препаратам.
Подходящий способ, посредством которого может быть достигнуто длительное послеоперационное обезболивание, представляет собой однократное применение депо-состава. Депо может быть оптимизировано для инъекции, инфильтрации в разрез, имплантации или местного применения. Содержащийся в депо-составе терапевтический агент включен в состав вместе с носителями, что обеспечивает постепенное высвобождение терапевтического агента в течение периода времени, составляющего от нескольких часов до нескольких дней или дольше. Основой депо-составов обычно служит биодеградируемая матрица, которая постепенно разлагается или растворяется с высвобождением терапевтического агента.
Следовательно, преимущество депо-составов заключается в том, что активные терапевтические агенты высвобождаются постепенно в течение длительных периодов времени без необходимости повторного введения дозы. Эти составы, таким образом, особенно подходят для случаев, когда соблюдение пациентом режима лечения затруднено, ненадежно или когда уровень дозировки очень важен, как, например, в случае составов на основе психотропных активных терапевтических агентов, активных терапевтических агентов с узким терапевтическим окном и активных терапевтических агентов, вводимых детям или другим пациентам, чей образ жизни несовместим с надежным соблюдением режима дозирования. Конкретные классы активных терапевтических агентов, для которых этот аспект полезен, включают контрацептивы, гормоны (включая гормональные контрацептивы и гормоны, вводимые детям, такие как гормон роста), антибиотики, агенты, препятствующие привыканию, добавки, такие как витаминные или минеральные добавки, антидепрессанты, местные анестетики, болеутоляющие лекарственные средства и противосудорожные средства.
Многие депо-составы основаны на частицах, внедренных в липосомы или микросферы для инкапсуляции терапевтического агента. Липосомные депо-составы, однако, сложны в изготовлении, чрезвычайно чувствительны к действию поверхностно-активных веществ, имеют ограниченный срок годности или требуют хранения при пониженной температуре. В связи с размером и уязвимостью этих частиц, препятствующими применению стандартных способов стерилизации, таких как фильтрация, облучение или автоклавирование, липосомные мультивезикулярные депо-составы обычно получают в асептических условиях, что делает производственный процесс трудоемким и дорогостоящим. Кроме того, липосомные депо-составы обычно обеспечивают пролонгированное высвобождение терапевтического агента в течение не более чем 12 часов. Описаны различные продукты, содержащие лекарственные средства, заключенные в микросферы в носителях на масляной основе. Например, в патенте США №6132766, авторы Sankaram и др., предложена мультивезикулярная липосомная композиция, содержащая по меньшей мере одну кислоту, отличную от галогенводородной кислоты, и по меньшей мере одно биологически активное вещество, при этом везикулы характеризуются определенным распределением по размерам, вариабельным средним размером, величиной и числом внутренних объемов и обеспечивают контролируемую скорость высвобождения биологически активного вещества из композиции. Согласно этому изобретению также предложен способ получения композиции, особенность которого заключается в добавлении кислоты, отличной от галогенводородной кислоты, обеспечивающей поддерживание и регулирование скорости высвобождения инкапсулированного биологически активного вещества из везикул на терапевтических уровнях in vivo.
В заявке США №2006/0078606, Kim и др., предложен способ получения местных анестетиков, инкапсулированных в липосомы, такие как мультивезикулярные липосомы, с высокой эффективностью инкапсулирования и медленным высвобождением in vivo. Если введение инкапсулированного анестетика осуществляют в виде однократного внутрикожного введения, длительность обезболивания и период полувыведения лекарственного средства в локальном участке инъекции увеличиваются по сравнению с инъекцией неинкапсулированного анестетика. Максимально переносимая доза инкапсулированного анестетика также значительно выше для липосомномного состава по сравнению с инъекцией неинкапсулированного анестетика.
В документе US 7547452, Atkins и др., предложены композиции на основе микрочастиц с замедленным высвобождением. Композиция на основе микрочастиц может быть приготовлена с обеспечением пролонгированного высвобождения в течение периода времени, составляющего от примерно 7 дней до примерно 200 дней. Микрочастицы могут быть приготовлены с применением биодеградируемого и биосовместимого полимера и активного агента, такого как рисперидон, 9-гидроксирисперидон и их фармацевтически приемлемые кислые соли.
Один из составов местного анестетика, применяемый для краткосрочного лечения послеоперационной боли, представляет собой инъекционную форму препарата Наропин (Naropin®) (моногидрат ропивакаина гидрохлорида). Инъекционный Наропин представляет собой стерильный изотонический раствор, содержащий энантиомер бупивакаина, хлорид натрия для обеспечения изотоничности и воду для инъекций. Для корректировки рН могут быть добавлены гидроксид натрия и/или соляная кислота. Введение инъекционного Наропина осуществляют парентерально.
Инъекционный Наропин, однако, характеризуется относительно короткой продолжительностью действия (4-6 часов). В связи с этим обычно требуются многократные повторные введения препарата, что приводит к вынужденному нахождению пациента в стационаре во время лечения или применению предварительно откалиброванного механического насоса и инфильтрации хирургической раны обезболивающим средством у перенесшего операцию пациента по мере возвращения боли. У инъекционного Наропина есть максимально допустимую дозу, поскольку он может влиять на ЦНС, и он противопоказан для внутривенного введения. Поскольку инъекционный Наропин часто применяют в комбинации с перорально принимаемыми опиатами при введении для лечения послеоперационной боли, ему присущи некоторые из недостатков, связанных с обезболивающей терапией на основе опиатов.
В патенте США №5863549, Tarantino, предложен способ получения in vivo геля на основе лецитина, который обеспечивает замедленное высвобождение биологически активного соединения, содержащегося в геле. Это изобретение также относится к способу длительного лечения человека или других млекопитающих с использованием терапевтического количества биологически активного соединения с применением геля для обеспечения пролонгированного высвобождения биологически активного соединения. Предложенные и приведенные в качестве примеров биологически активные соединения представляют собой пептиды и полипептиды.
Заявке США №2005/0287180, Chen, предложены композиции, содержащие фосфолипидный компонент (который содержит один или более фосфолипидов) и фармацевтически приемлемый жидкий носитель, при этом содержание фосфолипидного компонента находится в диапазоне от примерно 10% до примерно 90% из расчета на общую массу. Композиции могут дополнительно содержать наполнители нефосфолипидной природы, причем, количество нефосфолипидных наполнителей находится в диапазоне от примерно 5% до примерно 50% из расчета на общую массу. В некоторых вариантах реализации композиции могут быть инъекционными, нелипосомными и/или иметь форму геля или пасты. Композиции согласно изобретению могут подходить для заживления и наращивания мягких и/или твердых тканей или для замедленной местной доставки лекарственных средств. Одним из примеров составов на основе лекарственного средства является бупивакаин в фосфолипидной пасте с добавлением пропиленгликоля.
В публикации US 2012/0046220, Chen и др., предложен прозрачный депо-состав, содержащий по меньшей мере один гидрофильный водорастворимый фармацевтически активный антибактериальный агент, выбранный из группы, состоящей из ванкомицина, гентамицина, их фармацевтически приемлемых солей и их смеси, воду, фосфолипид, масло, необязательно регулятор pH и модификатор вязкости, выбранный из группы, состоящей из этанола, изопропанола и их смеси, при этом содержание воды в конечном депо-составе не превышает примерно 4 масс. % из расчета на общую массу депо-состава и pH депо-состава находится в диапазоне от примерно 3 до примерно 6.
В документе US 2012/0316108, Chen и др., предложены композиции и способы получения фосфолипидных депо-составов, которые можно инъецировать через тонкую иглу.
Дополнительные источники, содержащие описание составов на основе фосфолипидов, включают WO 89/00077, WO 02/32395, ЕР 0282405, патенты США №№4252793, 5660854, 5693337 и Wang et al., Lyophilization Of Water-In-Oil Emulsions To Prepare Phospholipid-based Anhydrous Reverse Micelles For Oral Peptide Delivery, 39 European Journal of Pharmaceutical Sciences, 373-79 (2010).
Существует потребность в длительном послеоперационном обезболивании за счет однократного введения лекарственного средства в конце хирургической процедуры. Известным депо-составам на основе фосфолипидов присущи недостатки, заключающиеся в высокой вязкости, затрудняющей их введение, и отсутствии долгосрочной стабильности при обычных температурах. Существует неудовлетворенная потребность в стабильных депо-составах местных анестетиков с улучшенной вязкостью, которая сделала бы их подлежащими доставке в требуемое место действия.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению предложен неводный пролипосомный депо-состав на основе местного анестетика, преимущество которого заключается в том, что он образует липосомы или другие липидные везикулярные структуры in situ при контакте с физиологическими жидкостями. Согласно настоящему изобретению также предложен способ получения депо-составов согласно изобретению, в соответствии с которым композицию не подвергают воздействию водной фазы ни на одной из стадий производственного процесса. Композиция не содержит воды за исключением остаточной влаги, которая может присутствовать во вспомогательных веществах, применяемых для получения композиции.
Кроме того, согласно настоящему изобретению предложен депо-состав, по существу не содержащий синтетических фосфолипидов, полученный с применением вспомогательных веществ исключительно категории GRAS (признанных в целом безопасными). Таким образом, композиции согласно изобретению обеспечивают улучшенную стабильность, увеличенную продолжительность терапевтического действия и меньшее количество нежелательных эффектов местных анестетиков.
Настоящее изобретение основано, частично, на неожиданном обнаруженном факте, что масляный раствор, являющийся носителем местного анестетика, дольше задерживается в ткани и обеспечивает улучшенные характеристики замедленного высвобождения по сравнению с гелем или гелеобразным составом. В соответствии с некоторыми вариантами реализации раствор согласно изобретению образует липосомы или мицеллы или другие типы липидных ассоциатов in vivo после попадания физиологических жидкостей организма в послеоперационную рану, благодаря чему высвобождение местных анестетиков продолжается в течение длительного периода времени. Соответственно, пролипосомный состав является стабильным и может храниться при комнатной температуре, что обуславливает преимущества в отношении транспортировки и хранения составов по сравнению с липосомными составами, требующими хранения при 2-8°C. Состав будет удерживать свой активный ингредиент и не будет демонстрировать взрывного высвобождения при контакте с поверхностно-активными веществами, соответственно, не будет высвобождать анестетик в системный кровоток, что может иметь место в случае разрыва липосом.
Согласно одному из аспектов изобретения предложен неводный фармацевтический состав, содержащий: местный анестетик, природный несинтетический фосфолипид или его фармацевтически приемлемую соль, неводный фармацевтически приемлемый носитель и сорастворитель в качестве регулятора вязкости.
В другом варианте реализации неводный фармацевтический состав состоит по существу из: местного анестетика, природного несинтетического фосфолипида или его фармацевтически приемлемой соли; неводного фармацевтически приемлемого носителя и сорастворителя. В одном из вариантов реализации неводный фармацевтический состав состоит из: местного анестетика, природного несинтетического фосфолипида или его фармацевтически приемлемой соли, неводного фармацевтически приемлемого носителя, антиоксиданта и сорастворителя в качестве регулятора вязкости.
В соответствии с некоторыми вариантами реализации композиция стабильна в течение по меньшей мере 24 месяцев при комнатной температуре. В соответствии с некоторыми вариантами реализации композиция стабильна в течение по меньшей мере 12 месяцев при комнатной температуре. В соответствии с некоторыми вариантами реализации композиция стабильна в течение по меньшей мере 6 месяцев при комнатной температуре. В соответствии с некоторыми вариантами реализации композиция стабильна в течение по меньшей мере 1 месяца при комнатной температуре.
В соответствии с некоторыми вариантами реализации композиция стабильна в течение по меньшей мере 24 месяцев при комнатной температуре. В соответствии с некоторыми вариантами реализации композиция стабильна в течение по меньшей мере 12 месяцев при комнатной температуре. В соответствии с некоторыми вариантами реализации композиция стабильна в течение по меньшей мере 6 месяцев при комнатной температуре. В соответствии с некоторыми вариантами реализации композиция стабильна в течение по меньшей мере 1 месяца при комнатной температуре.
В соответствии с некоторыми вариантами реализации сорастворитель представляет собой неароматический сорастворитель. В соответствии с некоторыми вариантами реализации неароматический сорастворитель представляет собой спирт. В некоторых вариантах реализации спирт представляет собой этанол. В некоторых вариантах реализации этанол присутствует в количестве от примерно 1% до примерно 15% по массе. В некоторых вариантах реализации этанол присутствует в количестве от примерно 2% до примерно 10% по массе. В некоторых вариантах реализации этанол присутствует в количестве от примерно 4% до примерно 6% по массе.
В некоторых вариантах реализации сорастворитель выступает в качестве регулятора вязкости, который обуславливает пригодность композиции для введения посредством инъекции. В некоторых вариантах реализации вязкость состава составляет менее 2500 сП. В некоторых вариантах реализации вязкость состава составляет менее 2000 сП. В некоторых вариантах реализации вязкость состава находится в диапазоне 1000-2500 сП. В некоторых вариантах реализации вязкость состава находится в диапазоне 1000-2000 сП.
В некоторых вариантах реализации композиция не содержит частиц размером более 100 нм. В некоторых вариантах реализации композиция не содержит частиц размером более 50 нм. В некоторых вариантах реализации композиция не содержит частиц размером более 20 нм. В некоторых вариантах реализации композиция не содержит частиц размером более 10 нм. В некоторых вариантах реализации композиция представляет собой масляный раствор, по существу не содержащий частиц. В некоторых вариантах реализации композиция представляет собой прозрачный раствор.
В некоторых вариантах реализации местный анестетик присутствует в количестве, эквивалентном от примерно 0,2% до примерно 18% по массе. В некоторых вариантах реализации местный анестетик присутствует в количестве, эквивалентном от примерно 1% до примерно 12% по массе. В других вариантах реализации местный анестетик присутствует в количестве, эквивалентном от примерно 2% до примерно 4% по массе. В некоторых вариантах реализации местный анестетик присутствует в количестве, эквивалентном от примерно 3% до примерно 6% по массе. В некоторых вариантах реализации местный анестетик представляет собой ропивакаин. В некоторых вариантах реализации ропивакаин представляет ропивакаин гидрохлорид.
В некоторых вариантах реализации экспериментальное значение гидрофобности LogP местного анестетике составляет по меньшей мере 1,5.
В некоторых вариантах реализации фосфолипид представляет собой природный фосфолипид. В некоторых вариантах реализации фосфолипид присутствует в количестве от примерно 10% до примерно 80% по массе. В некоторых вариантах реализации фосфолипид присутствует в количестве от примерно 40% до примерно 60% по массе. В некоторых вариантах реализации фосфолипид присутствует в количестве от примерно 45% до примерно 55% по массе. В некоторых вариантах реализации фосфолипид не содержит каких-либо синтетических фосфолипидов. В некоторых вариантах реализации фосфолипид не содержит 1,2-димиристоил-sn-глицеро-3-фосфоглицерина (ДМФГ) или его фармацевтически приемлемой соли. В некоторых вариантах реализации природный несинтетический фосфолипид представляет собой фосфатидилхолин (ФХ) или его фармацевтически приемлемую соль.
В некоторых вариантах реализации состав по существу не содержит наполнителей, в частности, водонерастворимых или дисперсных наполнителей. В некоторых вариантах реализации составы не содержат инертных дисперсных или взвешенных материалов, таких как микросферы.
В некоторых вариантах реализации состав по существу не содержит воды. В другом варианте реализации термин "по существу не содержит воды" в настоящем тексте относится к содержанию, составляющему менее 0,5% об./об. или масс./масс. из расчета на общий объем или общую массу состава. В других вариантах реализации термин "по существу не содержит воды" в настоящем тексте относится к содержанию, составляющему менее 0,2% об./об. или масс./масс. из расчета на общий объем или общую массу состава. В некоторых вариантах реализации композиция не содержит воды за исключением остаточной влаги, которая может присутствовать во вспомогательных веществах, применяемых для получения композиции. В некоторых вариантах реализации содержание остаточной влаги составляет менее 0,3%. В некоторых вариантах реализации содержание остаточной влаги составляет менее 0,15%.
В некоторых вариантах реализации неводный фармацевтически приемлемый носитель содержит кунжутное масло, хлопковое масло, сафлоровое масло или один или более триглицеридов. Каждый из возможных вариантов представляет собой отдельный вариант реализации изобретения. В некоторых вариантах реализации неводный фармацевтически приемлемый носитель представляет собой касторовое масло. В некоторых вариантах реализации неводный фармацевтически приемлемый носитель присутствует в количестве от примерно 20% до примерно 50% по массе. В некоторых вариантах реализации соотношение природного несинтетического фосфолипида и неводного фармацевтически приемлемого носителя находится в диапазоне от 2,2:1 до 1,2:1. В другом варианте реализации соотношение природного несинтетического фосфолипида и неводного фармацевтически приемлемого носителя находится в диапазоне от 2:1 до 1:1.
В некоторых вариантах реализации фармацевтический состав дополнительно содержит антиоксидант. В некоторых вариантах реализации антиоксидант представляет собой цистеин или его фармацевтически приемлемую соль.
Согласно другому аспекту изобретения предложен пролипосомный неводный маслянистый фармацевтический состав, содержащий: анестетик в количестве, эквивалентном от примерно 0,2% до примерно 10% по массе; от примерно 40% до примерно 60% по массе фосфатидилхолина (ФХ); от примерно 35% до примерно 55% по массе касторового масла и от примерно 2% до примерно 10% по массе этанола.
Согласно другому аспекту изобретения предложен пролипосомный неводный маслянистый фармацевтический состав, содержащий: ропивакаин в количестве, эквивалентном от примерно 0,5% до примерно 5% по массе; от примерно 40% до примерно 60% по массе фосфатидилхолина (ФХ); от примерно 35% до примерно 55% по массе касторового масла и от примерно 2% до примерно 10% по массе этанола.
Согласно другому аспекту изобретения предложен способ лечения боли, включающий введение пациенту, нуждающемуся в этом, фармацевтического состава в соответствии с любым из вышеприведенных вариантов реализации.
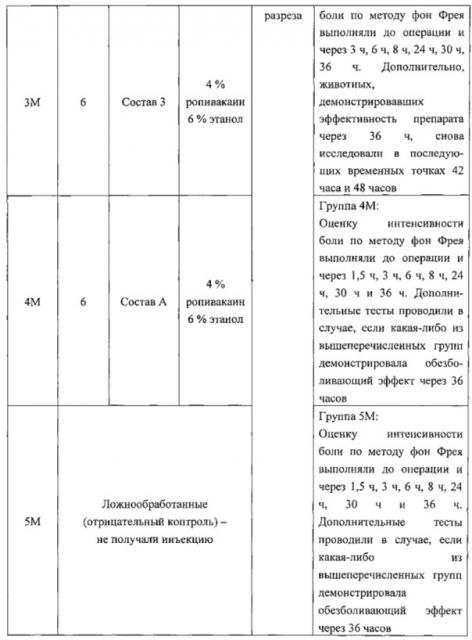
В некоторых вариантах реализации фармацевтический состав вводят в виде депо-состава. В некоторых вариантах реализации фармацевтический состав вводят в виде однократной дозы. В некоторых вариантах реализации фармацевтический состав вводят посредством инфильтрации в разрез. В некоторых вариантах реализации фармацевтический состав вводят посредством инъекции в разрез. В некоторых вариантах реализации фармацевтический состав вводят посредством инъекции в разрез с последующим зашиванием указанного разреза.
В некоторых вариантах реализации боль представляет собой послеоперационную боль.
В некоторых вариантах реализации фармацевтический состав обеспечивает облегчение боли в течение по меньшей мере примерно 24 часов. В некоторых вариантах реализации фармацевтический состав обеспечивает облегчение боли в течение периода времени, составляющего от 24 до 48 часов. В некоторых вариантах реализации фармацевтический состав обеспечивает облегчение боли в течение по меньшей мере примерно 48 часов. В некоторых вариантах реализации фармацевтический состав обеспечивает облегчение боли в течение периода времени, составляющего от 48 до 72 часов. В некоторых вариантах реализации фармацевтический состав обеспечивает облегчение боли в течение по меньшей мере примерно 72 часов.
Согласно другому аспекту изобретения предложен способ получения пролипосомного неводного маслянистого фармацевтического состава, включающий: (а) смешивание неводного фармацевтически приемлемого носителя с: (i) местным анестетиком; (ii) природным несинтетическим фосфолипидом или его фармацевтически приемлемой солью и (iii) сорастворителем с получением неводного раствора; (b) удаление сорастворителя полностью или частично из неводного раствора; (с) добавление того же самого или другого сорастворителя к неводному раствору до общего количества, составляющего от примерно 2% до примерно 12% по массе.
В соответствии с некоторыми вариантами реализации фармацевтический состав, полученный указанными способом, представляет собой прозрачный раствор, не содержащий частиц размером более 100 нм, стабильный при обычной температуре и по существу не содержащий воды.
В соответствии с некоторыми вариантами реализации фармацевтический состав, полученный указанными способом, представляет собой прозрачный раствор, не содержащий частиц размером более 50 нм, стабильный при обычной температуре и по существу не содержащий воды.
В некоторых вариантах реализации удаление сорастворителя полностью или частично из неводного раствора приводит к получению маслянистого раствора.
В соответствии с настоящим изобретением, способ не включает подвергание состава воздействию водной фазы и не включает стадии эмульгирования.
В некоторых вариантах реализации неводный фармацевтически приемлемый носитель содержит касторовое масло. В некоторых вариантах реализации способ дополнительно включает смешивание неводного фармацевтически приемлемого носителя с антиоксидантом.
В некоторых вариантах реализации сорастворитель удаляют из неводного раствора путем выпаривания и/или вакуумной сушки. В альтернативных вариантах реализации способ не предполагает применения избытка сорастворителя в качестве регулятора вязкости и, следовательно, отличается отсутствием необходимости выпаривания или вакуумной сушки.
В некоторых вариантах реализации способ дополнительно включает автоклавирование полученного состава.
Согласно другому аспекту изобретения предложен набор, содержащий: емкость, содержащую фармацевтический состав в соответствии с любым из вышеприведенных вариантов реализации, и инструкции по применению.
Согласно другому аспекту изобретения предложен предварительно наполненный шприц, содержащий фармацевтический состав в соответствии с любым из вышеприведенных вариантов реализации.
В соответствии с другим аспектом настоящего изобретения предложен пролипосомный неводный базовый состав, содержащий все вспомогательные вещества депо-состава за исключением местного анестетика, и способ получения этого состава. В некоторых вариантах реализации пролипосомный неводный базовый состав содержит: природный несинтетический фосфолипид; неводный фармацевтически приемлемый носитель и сорастворитель в качестве регулятора вязкости. В соответствии с другим вариантом реализации, базовый состав имеет высокую стабильность и может храниться в течение длительных периодов времени до добавления местного анестетика.
В соответствии с некоторыми вариантами реализации композиция стабильна в течение по меньшей мере 24 месяцев при комнатной температуре. В соответствии с некоторыми вариантами реализации композиция стабильна в течение по меньшей мере 12 месяцев при комнатной температуре. В соответствии с некоторыми вариантами реализации композиция стабильна в течение по меньшей мере 6 месяцев при комнатной температуре. В соответствии с некоторыми вариантами реализации композиция стабильна в течение по меньшей мере 1 месяца при комнатной температуре.
В некоторых вариантах реализации базовый состав по существу не содержит воды. В некоторых вариантах реализации базовый состав не содержит воды за исключением остаточной влаги, которая может присутствовать во вспомогательных веществах, применяемых для получения депо-состава. В некоторых вариантах реализации содержание остаточной влаги составляет менее 0,3%. В некоторых вариантах реализации содержание остаточной влаги составляет менее 0,15%.
В некоторых вариантах реализации вязкость базового состава находится в диапазоне 1000-2500 сП. В некоторых вариантах реализации вязкость базового состава находится в диапазоне 1000-2000 сП.
В некоторых вариантах реализации базовый состав не содержит частиц размером более 100 нм. В некоторых вариантах реализации базовый состав не содержит частиц размером более 50 нм. В некоторых вариантах реализации базовый состав не содержит частиц размером более 20 нм. В некоторых вариантах реализации базовый состав не содержит частиц размером более 10 нм. В некоторых вариантах реализации базовый состав представляет собой масляный раствор, по существу не содержащий частиц. В некоторых вариантах реализации базовый состав представляет собой прозрачный раствор.
Согласно другому аспекту изобретения предложен способ получения пролипосомного неводного базового состава, содержащего все вспомогательные вещества депо-состава за исключением местного анестетика. Указанный способ включает: (а) уравновешивание неводного фармацевтически приемлемого носителя и (b) растворение природного несинтетического фосфолипида в указанном неводном фармацевтически приемлемом носителе путем нагревания и перемешивания. В соответствии с некоторыми вариантами реализации способ дополнительно включает добавление сорастворителя на стадии (а). В альтернативном варианте способ включает добавление сорастворителя на стадии (b). Следует понимать, что указанный способ может представлять собой непрерывный процесс, во время которого добавление и обработку всех ингредиентов осуществляют одновременно.
В соответствии с некоторыми вариантами реализации базовый состав, полученный указанными способом, представляет собой прозрачный раствор, не содержащий частиц размером более 100 нм, стабильный при обычной температуре и по существу не содержащий воды. В соответствии с некоторыми вариантами реализации базовый состав, полученный указанными способом, представляет собой прозрачный раствор, не содержащий частиц размером более 50 нм, стабильный при обычной температуре и по существу не содержащий воды.
Неожиданно было обнаружено, что сочетание нагревания, перемешивания с приложением вращающего момента и большого сдвигового усилия приводит к полному растворению фосфолипида в фармацевтически приемлемом неводном носителе. Соответственно, предпочтительно отсутствует необходимость добавления избытка этанола и последующего выпаривания этанола.
В некоторых вариантах реализации антиоксидант добавляют к сорастворителю до смешивания сорастворителя с базовым составом. В альтернативном варианте антиоксидант добавляют отдельно на любой из стадий (а) или (b) указанного способа или одновременно с добавлением всех других ингредиентов.
В некоторых вариантах реализации уравновешивание неводного фармацевтически приемлемого носителя (и необязательно сорастворителя и антиоксиданта) включает нагревание до по меньшей мере примерно 50°C. В другом варианте реализации уравновешивание неводного фармацевтически приемлемого носителя (и необязательно сорастворителя и антиоксиданта) включает нагревание до по меньшей мере примерно 65°C. В другом варианте реализации уравновешивание неводного фармацевтически приемлемого носителя включает нагревание до по меньшей мере примерно 85°C.
В некоторых вариантах реализации ни одна из стадий указанного способа не включает обработки составов водной фазой или эмульгирования.
В некоторых вариантах реализации ни одна из стадий способа получения не включает применения избытка этанола. Следовательно, применение этого способа обеспечивает преимущество, заключающееся в отсутствии необходимость выпаривания этанола в присутствии местного анестетика, что помогает избежать лишних потерь местного анестетика.
Настоящее изобретение основано, частично, на неожиданно обнаруженном факте, что базовый состав представляет собой готовый для применения базовый состав, с которым местный анестетик может легко быть смешан без дополнительной обработки состава. В связи с этим, любой местный анестетик, описанный в вышеприведенных вариантах реализации, может быть добавлен к базовому составу с образованием пролипосомной неводной фармацевтической композиции. В альтернативном варианте местный анестетик растворяют перед добавлением к базовому составу.
В некоторых других вариантах реализации способ дополнительно включает автоклавирование полученного базового состава.
В соответствии с другим аспектом настоящего изобретения предложен способ получения пролипосомной неводной фармацевтической композиции, включающий: (а) уравновешивание неводного фармацевтически приемлемого носителя и (b) растворение природного несинтетического фосфолипида в указанном неводном фармацевтически приемлемом носителе путем нагревания и перемешивания. Указанный способ дополнительно включает добавление сорастворителя на стадии (а) или (b). В соответствии с некоторыми вариантами реализации местный анестетик добавляют на стадии (а) указанного способа. В соответствии с некоторыми вариантами реализации местный анестетик добавляют на стадии (b) указанного способа. В соответствии с некоторыми вариантами реализации местный анестетик добавляют на дополнительной стадии (с) указанного способа.
В соответствии с некоторыми вариантами реализации фармацевтическая композиция, полученная указанным способом, представляет собой прозрачный раствор, не содержащий частиц размером более 100 нм, стабильный при обычной температуре и по существу не содержащий воды. В соответствии с некоторыми вариантами реализации фармацевтическая композиция, полученная указанным способом, представляет собой прозрачный р